基于网络药理学和实验验证探究大黄致肝毒性作用机制*
2024-04-16王洪鑫张石宇曹陶涛
王洪鑫,张石宇,2,金 阳,曹陶涛,秦 琴,刘 文,**
(1.贵州中医药大学药学院 贵阳 550025;2.贵州中医药大学第一附属医院 贵阳 550001;3.贵州医科大学贵州省药物制剂重点实验室 贵阳 550004;4.贵州医科大学药学院 贵阳 550025)
中药大黄源于蓼科植物掌叶大黄(Rheum palmatum L.)、唐古特大黄(Rheum tanguticum Maxim.ex Balf.)或药用大黄(Rheum officinale Baill.)的干燥根及根茎。大黄具“将军”之称,始载于《神农本草经》,具有泻下攻积,清热泻火,凉血解毒,逐瘀通经,利湿退黄之功效,用于实热积滞便秘,血热吐衄,目赤咽肿,痈肿疔疮,肠痈腹痛,瘀血经闭,产后瘀阻,跌打损伤,湿热痢疾,黄疸尿赤,淋证,水肿;外用还可治烧烫伤[1]。除传统功效外,现代药理学研究表明大黄还具有广泛的抗肿瘤、抗菌抗炎与调节免疫系统等作用[2-5]。
随着大黄在临床上使用越来越广泛,使得误用和滥用情况屡见不鲜,尤其是长期或大量使用大黄导致的不良反应较为严重。随着其不良反应事件的增多,大黄越来越受到国内外的关注。一项针对187例中草药相关肝损伤(Herb induced liver injury,HILI)的前瞻性研究报道称,在导致HILI的中药汤剂及中成药组方中,大黄排在第3位[6]。有学者对香港玛丽皇后医院的45名慢性乙型肝炎患者进行入院前瞻性用药调查,发现其中7名患者的肝功能障碍是由于对大黄等肝毒性中药使用不当造成的[7]。还有研究显示,使用较小剂量的大黄可对肝损伤的大鼠起到治疗作用,且治疗效果随着剂量的增加而降低[8];若大黄使用剂量过大,则会对正常大鼠的肝脏造成损伤,且大黄肝毒性和大鼠年龄呈正相关[9]。此外,有研究表明大黄中的部分蒽醌类物质能够通过损害线粒体功能[10]、抑制谷胱甘肽合成[11]以及影响脂肪酸代谢[12]从而导致肝脏毒性。
目前,网络药理学不仅用于药物和中药活性化合物发现、整体作用机制阐释、药物组合和方剂配伍规律解析等,在预测中药毒性成分与阐明毒理机制方面也被广泛应用。孙思彤等[13]应用网络药理学及分子对接技术确定补骨脂中的补骨脂素、补骨脂异黄酮等显著毒性成分通过作用于AKT1、mTOR、SRC、Bcl-2 等主要靶点参与调节PI3K-Akt-mTOR、MAPK、VEGF 等信号通路致肝毒性作用。傅甜等[14]应用网络药理学及分子对接技术探明雷公藤肾上腺功能减退的毒理作用,可能通过雷公藤毒性化合物作用于133 个核心靶点与107 条信号通路而产生。余雪纯等[15]采用网络药理学方法和分子对接技术得到黄药子中8-表黄独素E 乙酸酯和黄独素B 与蛋白相互作用(PPI)网络中度值最高的靶点雌激素受体1(ESR1)均具有较好的结合力。曹站霞等[16]应用网络药理学和细胞实验探讨补骨脂致肝毒性机制,结果发现补骨脂主要成分可抑制MAPK1、PIK3CA、AKT1 和JAK2 的mRNA 的表达,引起肝脏的损伤。基于此,本文通过网络药理学[17-18]分析及实验验证对大黄致肝毒性的机制进行初步探讨,以期为临床安全有效使用大黄提供参考。
1 材料与方法
1.1 网络药理学分析
文中所用数据库可见表1。

表1 文中所用数据库
1.1.1 大黄潜在毒性成分预测及靶点获取
应用TCMSP 平台[19],获取大黄化学成分信息,并依据Lipinski 五原则[20],即分子量(MW)小于500,氢键供体数目(Hdonor)小于5,氢键受体数目(Hacceptor)小于10,脂水分配系数(AlogP)小于5以及口服生物利用度(Oral bioavailability,OB)≥30% 和类药性(Drug likeness,DL)≥0.18 作为指标参数进行筛选,再通过CTD 数据库检索其毒理学信息,筛选得到大黄潜在致毒成分。
应用TCMSP 平台可获取部分靶点信息,将所得信息输入UniProt数据库进行基因名称简化修正。此外,利用TCMIP 数据库也可得到部分成分对应的靶点信息。最后,基于PubChem 数据库,获取成分对应的SMILES 号,键入SwissTargetPrediction 平台[21],选择物种属性“Homo sapiens”,预测其靶点,剔除Probability<0 的靶点。将上述三个数据库得到的靶点信息去重整理,得到大黄潜在毒性成分靶点。
1.1.2 大黄致肝毒性靶点预测
以“liver injury”、“hepatotoxicity”为关键词,通过CTD 数据库、DisGeNET 数据库[22]以及GeneCards 数据库查找疾病相关基因靶点,其中CTD 数据库结果保留推理分数(Inference score)>200 的靶点,GeneCards 数据库结果保留相关系数(Relevance score)>7 的靶点。将上述3 个数据库得到的靶点信息去重整理,得到疾病相关基因靶点。将整理得到的成分靶点和肝毒性靶点导入微生信平台制作韦恩图,进行可视化处理,得到交集靶点即为大黄致肝毒性靶点。
1.1.3 蛋白质相互作用(Protein-protein interaction,PPI)网络的构建
将大黄致肝毒性靶点导入STRING 平台,限定物种为人源,设置最低互作分数为0.900,隐藏离散节点,获取靶点互作情况。利用Cytoscape 3.9.1 软件中的CytoNCA 插件进行拓扑分析,以大于介数中心性(Betweenness centrality,BC)、紧密中心性(Closeness centrality,CC)中位数和度值(Degree)均数为标准进行靶点筛选,得到核心靶点。
1.1.4 GO与KEGG富集分析分析
将大黄致肝毒性靶点导入DAVID 数据库[23],选择标识符为OFFICAL-GENE-SYMBOL,物种限定为人源,列表类型选择为基因列表,保存GO 类目下的BP、CC、MF 数据和KEGG 数据,设定阈值P<0.01,按P值排序,利用微生信平台制作对应的富集气泡图。
1.1.5 构建“成分-靶点-通路”网络
将得到的潜在致毒成分、PPI 互作得到的核心靶点与筛选出的前15 条信号通路及其相关靶点导入Cytoscape 3.9.1,构建“成分-靶点-通路”网络图。
1.2 实验验证
1.2.1 实验材料
SPF 级KM 小鼠,体质量18-22 g,购自斯贝福(北京)生物技术有限公司(许可证号:SCXK(京)2019-0010)。
大黄酸(Rhein,RH)、磺胺苯吡唑(Sulfamethazole,SFP)、1-氨基苯并三唑(1-Aminobenzotriazole,ABT)购自美国Ark 公司;利福平(Rifampicin,RFP)购自Innochem 公司;DMEM 高糖培养基、胎牛血清(FBS)、胰蛋白酶购自Gibco 公司;鼠尾胶原蛋白Ⅰ型、HEPES、EDTA、Percoll 青霉素-链霉素、0.4%台盼蓝溶液、BCA 蛋白浓度测定试剂盒、快速封闭液、一抗稀释液、SDS-PAGE 凝胶制备试剂盒购自Solarbio 公司;胶原酶Ⅳ购自美国Sigma 公司;CCK-8 购自日本同仁化学研究所;高灵敏度化学发光检测试剂盒、预染蛋白质marker 购自美国Thermo 公司;β-actin 抗体、γ-H2AX抗体、PARP-1抗体购自英国Abcam公司;一抗稀释液、苯甲基磺酰氟(PMSF)蛋白上样缓冲液、快速封闭液裂解液、PVDF 膜购自碧云天生物技术研究所。实验用水为超纯水,其他试剂均为分析纯。
Nikon 倒置显微镜、TS100 倒置显微镜(Nikon 公司),CO2 细胞培养箱、Modle680 酶标仪、超低温冰箱、Fresco17 冷冻离心机(Thermo Fisher Scientific 公司),HHS11-4 电热恒温水浴锅(上海博讯实验设备有限公司),SP-MiniPump 型蠕动泵(保定申辰泵业有限公司),低速台式离心机(上海安亭科学仪器厂),超净台(江苏苏净集团有限公司),EL204型电子天平(上海梅特勒-托利多仪器有限公司),数显立式压力蒸汽灭菌锅(上海精宏实验设备有限公司),超纯水机(四川沃特尔科技发展有限公司)。
1.2.2 实验方法
(1)小鼠原代肝细胞的分离:依照经典的Seglen门静脉两步灌注法分离小鼠原代肝细胞,在此基础上进行创新,采用Percoll单密度梯度离心法纯化肝细胞[24]。小鼠术前12 h 禁食不禁水,麻醉小鼠,用75%乙醇胸腹部消毒后固定于手术台上,上腹部开腹,将肠胃移向右侧,露出肝门静脉,插入留置针,打开泵灌注,调节流速为4 mL·min-1,当肝变黄时,切开下腔静脉,直至整个肝变黄,且所冲出的溶液澄清时关泵,换后灌流液,继续以4 mL·min-1的流速进行灌流,并反复按压下腔静脉使肝脏膨胀,最后灌至肝脏表面出现裂隙,肝脏柔软易碎,压之凹陷不易恢复时关泵,将肝脏完整取下,放在装有DMEM 的培养皿中,转移至无菌超净台。将细胞轻轻刮下,转移悬液至200 目的筛网中过滤,充分混匀后转移至15 mL 的离心管中,2000 r·min-1离心3 min,弃上清,加入35%细胞分离液,二次离心,即得小鼠原代肝细胞。向细胞沉淀中加入5 mL含1%双抗、10% FBS 的DMEM 完全培养基计数;同时将0.4%台盼蓝溶液与细胞悬液以1∶9 比例混匀(终浓度为0.04%),染色3 min,计算细胞存活率。再将细胞悬液按照一定比例稀释,以1.8×104个每孔的密度接种至0.012 mg·mL-1鼠尾胶原蛋白Ⅰ型包被的96 孔板,在37℃、5% CO2恒温培养箱中培养12 h。
(2)光学显微镜观察细胞形态:将小鼠原代肝细胞悬液以4×105的密度接种于6 孔板,在37℃和5%CO2的恒温培养箱中培养12 h,加入按照梯度稀释法配制的含有0,50,100,200 µmol·L-1RH 的培养液,培养24 h,弃去培养基,用PBS 清洗细胞,加入适量PBS,在光镜下观察细胞形态并拍照。
(3)CCK-8 细胞毒性分析实验:加入按照梯度稀释法配制的含有0、12.5、25、50、100、150、200 µmol·L-1RH 的培养基,每组5 个复孔,于细胞培养箱中分别培养6 h、12 h、24 h、48 h 后,弃去孔中原有培养基,加入含10% CCK-8的细胞培养基100 µL,在培养箱中培养2 h,酶标仪检测450 nm 波长的OD 值。重复3 次,计算各剂量组的平均值和标准差。细胞存活率(%)=[(As-Ab]/(Ac-Ab)]×100%。其中:As:实验孔(含有细胞的培养基、CCK-8、药物),Ac:对照孔(含有细胞的培养基、CCK-8、没有药物),Ab:空白孔(不含细胞和药物的培养基、CCK-8)
(4)CYP2C9 抑制实验:将小鼠原代肝细胞接种至细胞培养板中,在恒温培养箱中进行培养,约4 h 后换液,再继续培养12 h,用PBS 溶液清洗细胞表面两次,然后设置分组:空白溶剂组,ABT 200 µmol·L-1+RH(0-200 µmol·L-1)组,SFP 20 µmol·L-1+RH(0-200 µmol·L-1)组,每组5 个复孔。在给予细胞RH 前,先用对应抑制剂预处理细胞2 h,给药后培养24h。CCK-8 检测细胞存活率,具体操作同上。
(5)CYP2C9 诱导实验:将小鼠原代肝细胞接种至细胞培养板中,在恒温培养箱中进行培养,约4 h 后换液,再继续培养12 h,用PBS 溶液清洗细胞表面两次,加入RFP 20 µmol·L-1,诱导72 h,期间每24 h 进行换液,诱导结束后,加入培养基稀释的RH(0-200 µmol·L-1),每组5 个复孔,继续培养24 h。CCK-8 检测细胞存活率,具体操作同上。
(6)Western blot 检测PARP-1、γ-H2AX 蛋白表达水平:用不同浓度的RH 处理后再培养24 h,加入Ripa裂解细胞,离心取上清,采用BCA 试剂盒进行蛋白质定量。已知浓度蛋白以1∶4的比例与蛋白上样缓冲液完全混合,100℃条件下10 min使蛋白失活。冷却后进行恒压电泳(低电压80 V,20 min;高电压120 V,90 min),转膜(恒压25 V,30 min),封闭1h。于4℃下用适量一抗(γ-H2AX:1∶1000、PARP-1∶1∶1000、β-actin∶1∶5000)孵育过夜,二抗(1∶1000)室温孵育1 h,加入ECL 化学发光溶液,曝光,固定显影,扫描拍照保存。利用Quantity-one 凝胶成像分析软件对蛋白质的灰度值进行分析,结果用目标蛋白与内参蛋白灰度值之比表示。
1.3 统计学分析
采用SPSS 23.0 软件统计学分析。计量资料以平均值±标准差(±s)表示,多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 网络药理学分析结果
2.1.1 大黄潜在毒性成分预测及靶点获取
参照Lipinski 五原则、OB≥30%和DL≥0.18 为标准,结合CTD 数据库检索成分毒理学信息,筛选得到大黄潜在致毒成分为大黄酸(rhein)、芦荟大黄素(aloe-emodin)、(-)-儿茶素水合物[(-)-catechin],经过去重整理后得到对应成分靶点106个。成分基本信息见表2。

表2 大黄潜在致毒成分
2.1.2 大黄致肝毒性靶点预测
经过去重整理得到疾病相关靶点3063个,与成分靶点取交集,得到大黄致肝毒性靶点71 个。利用Venny 2.1.0 平台制作韦恩图,进行可视化处理,结果见图1。

图1 成分靶点与肝毒性靶点韦恩图
2.1.3 PPI网络的构建
为了获得潜在靶点交互作用的信息,将71个潜在靶点上传到STRING 平台,获得靶点蛋白之间的相互作用网络图,见图2。靶蛋白用节点(node)表示,节点之间用边(edge)表示,共有7个节点和570条边。将结果的TSV 文件导入Cytoscape 3.9.1 进行可视化和拓扑分析,以大于BC、CC 中位数和D 值均数为标准进行靶点筛选,得到核心靶点17个,按照度值大小排序,结果见表3。这17个核心靶点可能在大黄导致肝损伤过程中发挥着重要的作用。

图2 交集靶点PPI互作图

表3 核心靶点蛋白拓扑参数信息
2.1.4 GO与KEGG富集分析
经P<0.01 筛选后,得到233 条GO 结果,其中生物过程(Biological process,BP)162 条、细胞组成(Cellular component,CC)19 条、分子功能(Molecular function,MF)52 条,分别选取前10 条进行可视化处理,结果见图3。BP 主要涉及正向细胞凋亡调控、外源代谢过程以及雌二醇响应过程等;CC 主要涉及细胞质、细胞质基质以及线粒体等;MF 主要涉及酶结合、芳香化酶活性以及血红素结合等。经P<0.01 筛选后,得到34 条通路结果,前15 名结果见图4。其中包括化学物质致癌作用-DNA 加合物通路(Chemical carcinogenesis-DNA adducts)、P450 酶药物代谢通路(Drug metabolism-cytochrome P450)、癌症通路(Pathways in cancer)、P450 酶外源性物质代谢通路(Metabolism of xenobiotics by cytochrome P450)以及细胞凋亡通路(Apoptosis)等。考虑到癌症通路与肝毒性联系不大,将其排除,前5 通路中其余4 条都与CYP450 酶相关,结合PPI 蛋白互作得到的核心靶点结果,排名靠前的与CYP450酶相关的只有CYP2C9酶,便将其作为后续实验验证对象。此外,KEGG 结果提示大黄致肝毒性与细胞DNA损伤以及细胞凋亡密切相关,后续选择此机制进行实验验证。

图3 GO通路富集分析

图4 KEGG通路富集分析
2.1.5 构建“成分-靶点-通路”网络
“成分-靶点-通路”网络见图5,该网络中有58 个节点,129 条边。按度值对涉及到的三个潜在毒性成分进行排序,结果:rhein(RH)11.0>aloe-emodin(AE)5.0>(-)-catechin 1.0(CA)。结合文献调研与前期实验工作基础,选择RH作为后续实验验证成分。

图5 “成分-靶点-通路”网络
2.2 实验验证结果
2.2.1 RH对细胞形态的影响
通过光学显微镜观察到未经RH 处理的小鼠原代肝细胞形态呈不规则多边形,为典型的肝细胞形态,而用不同浓度的RH 处理24 h后,细胞形态会随着RH浓度的增加,逐渐出现皱缩、变圆,甚至在处理浓度为200 µmol·L-1时大部分从底壁脱落,说明RH 引起的细胞形态变化具有浓度效应关系。具体结果见图6。

图6 RH对小鼠原代肝细胞形态的影响
2.2.2 CCK-8分析细胞毒性结果
结果表明,经不同浓度的RH 处理6-48 h后,原代肝细胞活力具有显著性差异:与空白组相比,随着药物浓度的增加,细胞活力明显降低;随着药物作用时间的延长,RH 对细胞抑制作用更为明显。以上结果提示RH 的作用具有剂量与时间依赖性。具体结果见图7。

图7 不同浓度RH作用小鼠原代肝细胞不同时间后细胞活力变化
2.2.3 CYP2C9抑制实验结果
实验结果表明,抑制CYP2C9酶可以抑制RH对小鼠原代肝细胞的毒性,与对照组相比,RH对细胞活力的抑制呈剂量依赖性,而ABT和SFP可减弱这种毒性效应。当暴露于不同浓度的RH时,与无ABT和SFP的处理组相比,ABT和SFP分别使细胞活力显著增长了3.52%-32.56%和2.26%-27.52%,其中CYP450广谱抑制剂ABT抑制效果比CYP2C9专属抑制剂SFP强。具体结果见图8。

图8 RH对小鼠原代肝细胞的毒性
2.2.4 CYP2C9诱导实验结果
通过RFP 诱导CYP2C9,可增加RH 对小鼠原代肝细胞的毒性。在25-100 µmol·L-1RH 处理的情况下,与不含RFP 的孵育组相比,20 µmol·L-1RFP 的引入导致了细胞活力显著下降(下降2.01%-17.24%)。具体结果见图9。
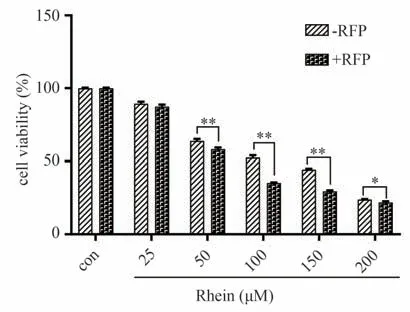
图9 RH对小鼠原代肝细胞的毒性
2.2.5 RH诱导小鼠原代肝细胞DNA损伤与凋亡
实验结果表明随RH 浓度的升高,PARP-1 和γ-H2AX 表达呈浓度依赖性,提示RH 能够诱导小鼠原代肝细胞DNA 损伤,促使细胞凋亡。具体结果见图10。

图10 γ-H2AX和PARP-1蛋白水平随RH浓度的变化
3 讨论
大黄多样的药理作用与其所含有的多样的化合物密切相关,迄今为止,已从18 种大黄属植物中分离得到约200 个具有6 种不同类型骨架的化合物,包括蒽醌类、蒽酮类、二苯乙烯类、黄酮类、酰基葡萄糖苷类和吡喃酮类,这些化合物具有广泛的药理活性,包括泻下、利尿、抗癌、保肝、抗炎以及镇痛等作用[25]。然而,近年来其毒理作用研究报道也逐渐增多。邓诺[26]通过研究发现大黄和大黄蒽醌高剂量均可下调肾脏组织的Clusterin mRNA 表达,这可能会抑制机体的抗凋亡能力和降低对肾脏的保护作用,从而使得肾脏损伤风险增大;同时大黄蒽醌高剂量可降低肾脏组织的OAT1 和OAT3 mRNA 表达,降低PAH 的清除率,这提示大黄蒽醌高剂量可能会抑制有机阴离子转运子的功能,从而导致有害的物质在肾脏中蓄积,发生肾毒性反应。王敏等[27]通过实验研究发现,生大黄的鞣质、总蒽醌及游离蒽醌含量分别为3.59%、1.96% 和1.03%,而经过炮制后的熟大黄鞣质、总蒽醌及游离蒽醌含量分别为0.33%、1.86%和1.27%,与对照组比较,生大黄呈现不同程度的肝脏变性,而相同浓度下的熟大黄给药组,仅在高浓度条件下呈现轻微的肝脏变性。这提示生大黄肝毒性可能与鞣质以及蒽醌类物质相关。
RH 作为大黄中主要的蒽醌类成分之一,具有广泛的药理作用与毒理作用。RH 可增强亚胺培南-西司他丁对金黄色葡萄球菌诱导的脓毒症小鼠的抗菌活性,其机制是通过抑制OATs 减少了亚胺培南的肾脏清除[28]。此外,经RH 预处理可改善脓毒症小鼠整体代谢状况,改善ALI,并通过调节代谢和抑制脓毒症肺损伤早期过度炎症反应,调节巨噬细胞过度活化[29]。与此同时,大黄酸的毒理作用也不应忽视。有学者研究发现长期使用大黄可导致细菌耐药、结肠结构的炎症改变、溃疡性结肠炎形成以及RH 在结肠的蓄积,而RH 蓄积可诱导细胞凋亡和自噬,这可能与结肠毒性包括溃疡性结肠炎形成有关[30]。经RH 处理的大鼠心肌细胞会出现萎缩、变圆、管壁脱落现象,同时可诱导大鼠心肌细胞S 期阻滞,抑制细胞增殖从而表现出心脏毒性[31]。
细胞色素P450 酶是以硫醇盐和血红素为活性中心,能够利用分子氧对底物进行立体和区域选择性氧化的一种氧化还原酶,其包含的主要蛋白质为含铁的血红蛋白和黄素蛋白[32]。其基本的氧化过程为,将电子从NADPH 转移到CYP 底物复合物中,底物与CYP的结合位点紧邻血红素-铁复合物。铁最初为Fe3+,通过细胞色素P450 酶从NADPH 转移一个电子,将血红素铁从三价态还原为亚铁态,同时一个氧原子被插入底物中,另一个氧原子形成H2O[33]。有研究报道,RH可通过CYP2C9 代谢活化,从而产生更强的毒性。研究表明,RH(50 µmol·L-1)通过产生活性氧(ROS)、增加细胞内Ca2+、降低线粒体膜电位和耗竭细胞内谷胱甘肽(GSH)含量,最终导致大鼠原代肝细胞凋亡,且100 nmol·L-1的环孢素A 可有效缓解这种凋亡作用[34]。而Koramagazi 等[35]通过膜联蛋白-V/PI 双染色分析和Hoechst 33258 染色发现RH 可引发原代人肝HL-7702细胞凋亡,使用钙蛋白酶抑制剂I 预处理可有效降低其对细胞凋亡诱导和JNK 激活的影响,提示RH 通过内质网应激和提高细胞内钙水平诱导HL-7702 细胞凋亡。Xu等[36]在给予RH 的大鼠尿液和胆汁中检测到1 个单羟基化代谢产物,同样地,在RH 暴露后的大鼠和人肝微粒体孵育产物中也观察到对应的代谢产物,实验发现RH 在胞浆GSTs 存在的情况下可与GSH 结合反应,且CYP 2C9 是负责RH 代谢活化的主要酶,这与本研究结论一致。
DNA 作为遗传信息的载体,其中任何位置出现损伤,都可能会引起遗传信息的突变。DNA 的损伤大致可分为单个碱基突变和结构扭曲两个大类。H2AX 组蛋白是染色体核小体组蛋白核心成员之一,当DNA 双链损伤(DSBs)时,组蛋白H2AX 的第139 位丝氨酸磷酸化形成γ-H2AX 簇集,因此对γ-H2AX 蛋白的定量可以反应DSBs的发生程度[37]。当然,生物也进化出一系列修复基因的方法,其中DNA损伤的识别主要由聚腺苷酸核糖转移酶(PARPs)家族酶来完成,同时还参与了多种细胞活动,包括DNA修复、转录、染色体结构调节、能量代谢和细胞内信息传递等。当DNA损伤激活PARP 后,PARP 可通过自身修复作用,形成DNA 损伤激发的PARP活性循环,不过PARP过渡的活化也会引起细胞能量耗尽而死亡。PARP-1 作为PARP 酶家族的最重要的成员,至少占据了细胞PARP 酶总活性的80%以上,且PARP-1参与了细胞凋亡的过程,然后在Caspases 依赖的凋亡途径中被激活,因此PARP-1在细胞凋亡中显得尤为重要。因此选择对PARP-1、γ-H2AX进行了Western blot验证。
参照《网络药理学评价方法指南》[38],结合《网络药理学评价方法指南》解读[39]两篇文章,本文收集了肝毒性疾病表型数据与大黄化学成分数据,得到疾病表型-靶点数据与药物-靶点数据,构建了疾病表型-标靶-药物网络,并对网络进行了可视化分析,功能富集分析,确定了活性成分RH,关键靶点CYP2C9 以及关键通路细胞凋亡,最后通过细胞实验进行验证,符合《网络药理学评价方法指南》的要求。然而此文也有缺点,首先是验证实验仅有细胞实验,实验证据不够充分。此外,文中TCMSP 等数据库数据来源主要是从科学文献和公开数据库中提取的。这些数据经过了严格的筛选和验证,包括验证化合物的结构、活性和药物相互作用的真实性等。因此,来源数据具有较高的准确性和查全性。然而,依赖于文献的数据仍然会受到文献本身的限制,如实验条件的不一致、样本量等问题,加之中药的复杂性和多样性,TCMSP 等数据库可能无法包含所有中药活性成分和相关的靶点信息,这可能会对结果产生一定的影响。药物与靶标之间的相互作用涉及多个层次和复杂性,网络药理学也无法完全捕捉所有相互作用的细节和动态过程,也忽视了药物在整个生物系统中的其他非特定作用和相互影响,不能全面评估药物的整体效应。本文通过网络药理学研究发现RH 导致肝毒性与CYP450 酶密切相关,文中选择排名靠前的CYP2C9作实验验证,表明其是大黄导致肝毒性的原因之一。然而实验结果表明当暴露于不同浓度的RH 时,CYP450 广谱抑制剂ABT 抑制效果比CYP2C9 专属抑制剂SFP 强,导致这一现象的原因可能是能够诱导RH 代谢活化的CYP450 酶不仅仅只有CYP2C9,可能还存在其它酶系,后续考虑对这一部分内容进行挖掘。
综上所述,本文应用网络药理学初步筛选大黄潜在致肝毒性机制,得到大黄潜在活性毒性成分RH,寻找到核心靶点17 个,综合分析之下选择CYP2C9 作为验证靶点,通过原代肝细胞实验以及Western blot实验对网络药理学预测出的通路信息进行验证。结果证明大黄中RH 能够显著抑制小鼠原代肝细胞活力,其对小鼠原代肝细胞的毒性可能是CYP2C9 对RH 代谢活化所致;RH 可激活PARP-1,使H2AX 磷酸化,诱导小鼠原代肝细胞DNA 损伤,从而导致细胞凋亡,诱导肝脏毒性。
