杞参益智方改善Aβ1-42海马区注射小鼠学习与记忆能力的效用评价与作用机制研究*
2024-04-16朱梓强陆韫青郑嘉妮仝佳祥段金廒
朱梓强,陆韫青,郑嘉妮,曹 程,陈 杨,仝佳祥,李 璇,郭 盛,2,段金廒**,朱 悦**
(1.南京中医药大学药学院,江苏省方剂研究重点实验室/江苏省方剂高技术研究重点实验室/中药资源产业化与方剂创新药物国家地方联合工程研究中心/江苏省中药资源产业化过程协同创新中心 南京 210023;2.宁夏枸杞创新中心 银川 750000)
阿尔兹海默症(Alzheimer’s disease,AD)是一种起病隐匿、呈缓慢渐进的以记忆力损害和认知障碍为主的神经系统退行性疾病,并且多发于老年人群,也是老年期痴呆中最常见的一种类型[1]。该病临床主要表现为记忆与认知障碍、视觉空间损害,并伴随有情感淡漠、注意力涣散等精神障碍[2]。据统计,2018 年中国已约有1000 多万AD 患者,预计2050 年患病人数将超过3000万[3],给社会和家庭带来巨大的负担与压力。随着我国已进入老龄化社会以及老龄人口数量的与日俱增,AD的防治已成为医学关注的热点问题。
AD 的神经病理变化主要表现为b 淀粉样蛋白(Amyloid-β peptide,Ab)在神经元细胞外异常沉积形成的老年斑,同时存在大量的神经元纤维缠结(Neurofibril tangle,NFT)[4]。研究发现AD 发病机制与Aβ 沉积导致的氧化应激和神经炎症密切相关[5]。Aβ沉积导致体内产生大量氧自由基,攻击细胞生物大分子,破坏细胞正常功能。同时Aβ 沉积激活小胶质细胞,促使细胞释放大量促炎物质如白介素1β(Interleukin-1β,IL-1β)、白介素6(Interleukin-6,IL-6)与肿瘤坏死因子α(Tumor necrosis factor α,TNF-α),导致中枢神经炎症。氧化应激与炎性应激综合作用导致海马组织神经元凋亡,影响学习与记忆能力[6]。在氧化应激通路调控中,核因子红细胞2 相关因子2(Nrf2)是在调控氧化应激过程中起着关键作用的转录因子[7]。正常情况下,Nrf2 与抗氧化应答元件(Antioxidant response elements,ARE)发生结合,调节下游靶基因血红素加氧酶1(Heme oxygenase 1,HO-1)的表达,在氧化应激条件下发挥细胞保护作用。氧化应激破坏了氧化还原平衡,抑制Nrf2/HO-1信号激活,抗氧化蛋白HO-1 表达下调,导致细胞凋亡[8]。目前AD 临床治疗一线药物主要是胆碱酯酶抑制剂如多奈哌齐以及N-甲基-D-天冬氨酸(NMDA)受体阻断剂美金刚(Memantine)等[9]。但是胆碱酯酶抑制剂对于心功能不全患者慎用或禁用。同时AD 重在预防以及干预窗口应提早到轻度认知功能障碍(Mild cognitive impairment,MCI)阶段也已经取得共识[10-11]。
中医理论认为,AD 为老年期神志疾病,病位在脑。患者常因肝肾亏虚,精亏髓枯,气虚血少,心脾两虚,导致髓海空虚,神志失养,渐成健忘甚至痴呆[12]。杞参益智方在宋代著名官修方书《圣济总录》所载经典方剂“二精丸”之枸杞子与黄精的基础上,加味人参与益智仁组成,具有滋补肝肾、益精填髓、养心安神的功效,且处方组成均为药食两用中药材,安全性高。本研究通过构建Aβ1-42海马区注射拟AD 小鼠模型,评价杞参益智方改善学习与记忆效用并初步探索作用机制,为AD防治保健产品的开发提供理论科学支持。
1 材料
1.1 动物
体质量为18-22 g 的健康SPF 级C57BL/6 小鼠,购自斯贝福生物科技有限公司,许可证号:SCXK(京)2018-0003,小鼠在实验动物中心常规饲养。本实验获得NJUCM 动物实验伦理委员会的批准(伦理批号:202207A045)。
1.2 药物
枸杞子(Lycium barbarumL.,批号:2106157)、黄精(Polygonatum sibiricumRed.,批号:237200516)、人参(Panax ginsengC.A.Mey.,批号:109200125)、益智仁(Alpinia oxyphyllaMiq.,批号:45200618)采购于亳州市紫锐药业有限公司,经段金廒教授鉴定为正品药材。
1.3 试剂
Aβ1-42(20JW09891)(上海诺优生物);多奈哌齐(GD18339)(萨恩化学技术有限公司);Marker 三色预染蛋白(180-6003)、SDS-PAGE 凝胶快速制备试剂盒(上海雅酶生物医药科技有限公司);RIPA 裂解液(碧云天生物);炎症相关ELISA 试剂盒:小鼠白介素6(IL-6)(AF2163-A)、小鼠肿瘤坏死因子α(TNF-α)(AF2132-A)、小鼠白介素1β(IL-1β)(AF2040-A)(湖南艾方生物);氧化应激相关试剂盒:小鼠超氧化物歧化酶(SOD)(A001-3-2)、还原性谷胱甘肽(GSH)(A006-2-1)、丙二醛(MDA)(A003-4-1)(南京建成)。Caspase-9(9508S)购自Cell Signaling Technology 公司;Bcl-2(sc-7382)购自Santa Cruz Biotechnology 公司;β-actin(66009-1-Ig)、Nrf-2(16396-1-AP)、HO-1(10701-1-LG) 、Caspase-3 (19677-1-AP) 、Bax(50599-2-Ig)购自Proteintech 公司;HRP Anti-rabbit IgG(BA1054)、HRP Anti-mouse IgG(BA1050)购自博士德公司。
1.4 仪器
小鼠脑立体定位仪;动物行为学影像采集系统(上海吉量);AXIO Vert A1 倒置显微镜(Zeiss 公司);旋转蒸发仪(Rotavapor R-210);多功能酶标仪(Perkin-Elmer);贝克曼离心机(南京百瑞达生物科技有限公司);凝胶成像系统(美国BIO-RAD);干式恒温金属浴(英国STUART)。
2 方法
2.1 杞参益智方提取物的制备
按照处方比例称取枸杞子50 g、黄精50 g、人参30 g、益智仁30 g,加入10 倍量水回流提取1.5 h,再加8 倍量水回流提取2 次各1 h,合并提取液,浓缩至1 g·mL-1。
2.2 构建AD动物模型及动物给药
将小鼠随机分为5 组,每组8 只,其中5 组分别为假手术组(Sham)、模型组(Model)、杞参益智方低剂量组(QSYZ-L)、杞参益智方高剂量组(QSYZ-H)、多奈哌齐(Donepezil)阳性药组。将小鼠称重,异氟烷吸入麻醉,构建Aβ1-42海马区注射诱导小鼠痴呆模型,实验方案参考文献[13],模型构建成功后小鼠正常饲养1周,之后进行给药30 天,阳性药给予多奈哌齐(2 mg·kg-1·d-1),其余组别每日灌胃生理盐水(0.9% NaCl),杞参益智方提取物给药剂量根据处方生药量进行折算。其中低剂量组给药剂量(1.335 g·kg-1·d-1)按处方人用日常服用剂量折算确定,高剂量组给药剂量(2.67 g·kg-1·d-1)按处方人用日常服用剂量的2倍折算确定。
2.3 行为学检测
通过Y 迷宫和Morris 水迷宫实验进行行为学评价,具体实验方法按照课题组已发表的内容[13]。
2.4 海马区脑片HE染色
解剖受试动物获取全脑组织,参照课题组已发表实验方法进行实验[14]。
2.5 TUNEL染色法检测海马区细胞凋亡
将“2.4”项下所制得的石蜡切片脱蜡,根据TUNEL 试剂盒检测步骤进行检测,并用倒置显微镜进行拍照,检测模型动物海马区的凋亡水平。
2.6 氧化因子水平检测
称取相关海马组织,按照试剂盒说明书检测小鼠海马组织中MDA、SOD、GSH的含量。
2.7 炎性因子水平检测
称取海马组织,加PBS离心取上清,照ELISA试剂盒检测说明书检测IL-6、IL-1β、TNF-α的含量。
2.8 Nrf2、HO-1及凋亡蛋白表达检测
称取相关海马组织,加入RIPA 裂解液提取蛋白并测定蛋白浓度,98℃使蛋白变性,时间15 min。按照课题组已发表实验方法进行实验[14]。
2.9 统计学方法
采用SPSS 19.0统计学软件进行统计分析,数据结果以均值±标准差(±s)表示,多组间比较采用单因素方差分析(One-way ANOVA),以P<0.05 为差异有统计学意义。
3 结果
3.1 杞参益智方对Aβ1-42海马区注射小鼠学习与记忆行为的影响
采用水迷宫实验考察杞参益智方对Aβ1-42海马区注射诱导痴呆模型小鼠学习与记忆行为的改善作用,结果如图1 所示。与假手术组小鼠相比,模型组小鼠穿越平台次数显著减少(P<0.05)、上台前路程、潜伏期显著增加(P<0.05),表明Aβ1-42海马区注射导致小鼠学习与记忆能力损伤。杞参益智方水提物低剂量组和高剂量组均显著减少模型小鼠潜伏期和上台前路程(P<0.05),穿越平台次数也显著增加(P<0.05),且高剂量组作用趋势更为显著。Y 迷宫实验结果如图2所示,与假手术组小鼠相比,模型小鼠的新臂探索时间和次数显著减少(P<0.05)。杞参益智方低剂量组和高剂量组均能显著增加模型小鼠新臂探索时间和次数(P<0.05),低剂量组上调作用趋势略强于高剂量组。表明杞参益智方具有改善痴呆模型小鼠记忆能力与学习的效用。
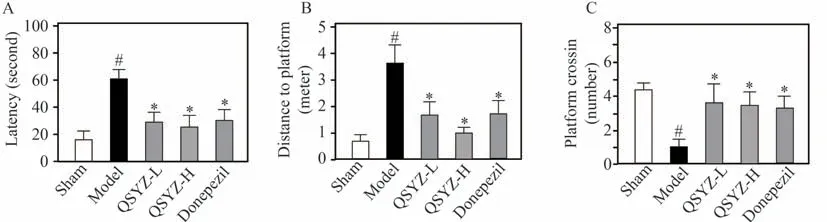
图1 杞参益智方对痴呆模型小鼠水迷宫行为学的影响(n=7)

图2 杞参益智方对痴呆模型小鼠Y迷宫行为学的影响(n=7)
3.2 杞参益智方对Aβ1-42海马区注射小鼠海马组织的影响
行为学测试结束后,处死受试动物并解剖获取脑组织。海马组织HE 染色结果如图3 所示。假手术组小鼠海马区齿状回形态完整,未观察到明显结构异常,神经细胞排列紧密,细胞核清晰,无明显的组织空泡化病变。模型组小鼠海马区细胞排列较为松散,细胞间间隙增大,空泡化明显、细胞数量明显减少。杞参益智方可显著逆转上述趋势,改善模型小鼠海马损伤状态,其中高剂量组改善趋势更为明显。

图3 杞参益智方对痴呆模型小鼠海马区脑片HE染色的影响(n=3)
3.3 杞参益智方对Aβ1-42海马区注射小鼠海马区细胞凋亡的影响
结果如图4 所示,模型组小鼠较假手术组小鼠海马区细胞凋亡数量显著增多。杞参益智方低、高剂量组给药后相较于模型组小鼠海马区细胞凋亡数量显著降低,提示杞参益智方可以抑制海马区细胞凋亡。杞参益智方低剂量组与高剂量组作用趋势相似,未见显著差异。

图4 杞参益智方对痴呆模型小鼠海马区细胞凋亡的影响(n=3)
3.4 杞参益智方对Aβ1-42海马区注射小鼠海马组织氧化应激因子水平的影响
结果如图5 所示,模型组小鼠较假手术组小鼠MDA 表达显著升高、SOD 和GSH 水平显著降低(P<0.05),表明模型小鼠脑内氧化应激加剧。杞参益智方低剂量组和高剂量组均能够显著升高SOD 和GSH 水平,显著降低MDA的表达(P<0.05)。杞参益智方低剂量组改善SOD 和MDA 作用趋势较高剂量组更为显著,高剂量组上调GSH 作用趋势更为显著。上述结果表明杞参益智方能够降低氧化产物的生成,提高抗氧化关键因子的表达,减缓氧化应激。

图5 杞参益智方对痴呆模型小鼠海马氧化因子表达的影响(n=5)
3.5 杞参益智方对Aβ1-42海马区注射小鼠海马炎性因子水平的影响
检测受试动物海马组织中炎性因子表达,如图6所示。模型组小鼠较假手术组小鼠海马中IL-6、TNF-α和IL-1β 水平显著上升,杞参益智方能够显著逆转上述趋势,且杞参益智方高剂量组下调作用趋势更为显著,表明杞参益智方能够减缓海马炎性损伤。
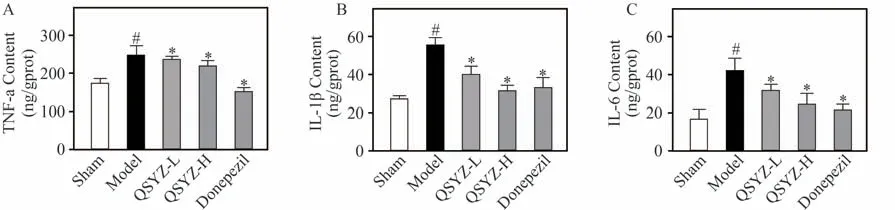
图6 杞参益智方对痴呆模型小鼠海马组织炎性因子表达的影响(n=5)
3.6 杞参益智方对Aβ1-42海马区注射小鼠海马组织Nrf2、HO-1蛋白表达的影响
解剖受试动物,检测痴呆模型小鼠海马组织中Nrf2、HO-1 蛋白表达,结果如图7 所示。与假手术组相比,模型组小鼠海马中抗氧化蛋白Nrf2 和HO-1 的表达显著下调(P<0.05)。与模型组小鼠相比,杞参益智方高剂量组能够显著增加模型动物海马抗氧化蛋白的表达(P<0.05),发挥抗氧化作用。
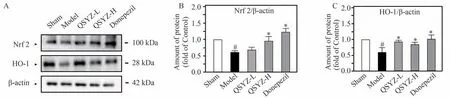
图7 杞参益智方对痴呆模型小鼠海马组织Nrf2和HO-1蛋白表达水平的影响(n=5)
3.7 杞参益智方对Aβ1-42海马区注射小鼠海马组织凋亡蛋白表达的影响
结果如图8 所示,模型组较假手术组小鼠海马抗凋亡蛋白Bcl-2 蛋白表达水平显著降低(P<0.05),凋亡蛋白Caspase-3、Caspase-9 和Bax 蛋白表达显著升高(P<0.05)。杞参益智方低剂量和高剂量均能够显著抑制凋亡蛋白Caspase-3、Caspase-9 和Bax 的表达,升高Bcl-2 蛋白表达水平(P<0.05),表明杞参益智方能够显著抑制海马细胞凋亡。
4 讨论
AD 发病机制复杂,所提出的致病因素包括Aβ 淀粉样蛋白沉积[15]、氧化应激[16]、中枢神经炎性损伤[17]、Tau 蛋白异常磷酸化[18]以及“脑-肠”轴失调加剧中枢炎性损伤[19]等。其中Aβ淀粉样蛋白沉积在AD发病机制中占据极为重要的地位[20]。首先,Aβ 淀粉样蛋白沉积,激活小胶质细胞释放大量炎症因子[21-22],加剧Aβ寡聚物和原纤维聚集形成具有神经毒性的淀粉样蛋白沉积,引发突触损伤、小胶质细胞过度活化、中枢神经炎症以及Tau 蛋白磷酸化等神经系统改变[23-24]。大脑相比于人体其他组织的耗氧量更高,而Aβ 沉积介导了中枢神经蛋白质氧化、糖氧化和脂质过氧化等氧化应激全过程,导致AD 患者及MCI 患者脑内氧化应激水平加剧[25-26]。AD 病理状态下,ROS 急剧增加,抗氧化酶SOD 和GSH 活性显著降低,氧化产物MDA 急剧增加,导致细胞线粒体能量转化停止与通透性增加,加剧神经变性[27-28]。海马是脑内学习与记忆功能调控的关键脑区,本研究基于AD 的上述病理机制,采用Aβ 蛋白海马区注射构建了拟AD 小鼠模型。实验研究表明,杞参益智方能够上调动物海马组织中SOD和GSH 活性,降低MDA 的表达。Nrf2 是细胞抗氧化防御系统的关键蛋白,对神经元氧化损伤的保护起着至关重要的作用。正常情况下,Nrf2 能够增强抗氧化酶的表达,调节下游靶基因HO-1的表达,发挥抗氧化作用,而氧化应激下氧化还原平衡被破坏,Nrf2/HO-1信号通路被抑制,抗氧化因子和抗氧化酶表达下降,氧化剂表达升高,加剧炎症反应,导致细胞凋亡[29]。本研究发现杞参益智方能够上调Nrf2 与HO-1 表达,显著改善模型小鼠海马区氧化应激,表现出显著的抗氧化效用。同时,杞参益智方还可抑制炎性因子的表达,减缓炎性应激。在氧化应激与炎性应激缓解的基础上最终改善了模型动物海马区细胞凋亡,增强了模型动物学习与记忆能力,体现了中药复方多成分、多靶点、多通路的治疗优势。
中药复方在防治AD 有丰富的经验。现代研究发现人参养荣汤能够改善痴呆模型小鼠学习与记忆能力,调节乙酰胆碱酯酶活力,减轻海马的损伤[30]。复方地黄能够增强痴呆大鼠学习记忆能力,促进大鼠海马神经营养因子的表达[31]。复方田七益智颗粒能够改善痴呆模型动物胆碱能神经元损伤,从而改善其学习与记忆能力[32]。与这些复方相比,杞参益智方具有显著的改善海马区氧化应激与炎性应激的作用,并可显著抑制海马区细胞凋亡。杞参益智方在中医“助气固精,保镇丹田”的经典方剂“二精丸”基础上加味而成。“二精丸”中黄精与枸杞子均为中医添精填髓、滋补肝肾之要药,与中医理论中AD“肾精亏虚、髓海失养”的基本病机高度吻合。但肾精需得元气资助,方能化生气血濡养脏腑。人参大补元气,不仅使气血生化有源,还可推动气血上荣于脑。黄精与枸杞子较为滋腻,年老之人本就脾肾功能渐衰,久服有碍脾之嫌,故辅以益智仁温肾以助肾阳,暖脾以滋脾运,又取其芳香之气,补而不滞。四药相合,使肾精得充,气血可化,神志可复。并且该方四味药均为药食同源的药材,安全性好,是有利于防治AD的长期用药。
杞参益智方中四味药及其活性成分均有改善痴呆模型动物学习与记忆能力的现代报道。枸杞多糖可以改善APP/PS1小鼠的认知功能,减少淀粉样病变,促进海马神经发生,并改善小鼠受损的突触的可塑性[33]。黄精中活性成分薯蓣皂苷元能够显著改善痴呆大鼠的空间学习记忆能力,对Aβ 引起的认知功能障碍具有显著的保护作用,同时薯蓣皂苷元调节了模型大鼠氧化应激水平、降低了神经炎症和乙酰胆碱酯酶水平,保护神经元免受损伤[34]。人参皂苷Re 能够改善Klotho 基因缺陷小鼠认知障碍,调节模型小鼠体内氧化应激水平,降低活性氧的表达,通过上调Nrf2/GPX-1/ERK/CREB 信号通路,改善模型小鼠神经损伤[35]。益智仁不同极性提取物能够调节痴呆动物胆碱能系统,改善其学习与记忆能力[36]。因此杞参益智方改善拟AD 模型小鼠学习与记忆能力可能是方中各成分共同作用的结果。
本研究通过构建Aβ1-42海马区注射诱导AD 小鼠模型,评价了杞参益智方改善模型动物学习与记忆能力的效用并进行了初步的作用机制探讨。后续将继续探索杞参益智方改善AD 模型动物学习与记忆能力的功效物质基础,并对其作用机制与效用机制进行深入研究,以期为杞参益智方防治AD 产品的开发提供更多的现代科学依据。
