枸杞叶改善D-半乳糖致亚急性衰老小鼠学习与记忆能力的效应部位与作用机制研究*
2024-04-16仝佳祥朱梓强宿树兰康宏杰段金廒
仝佳祥,陈 杨,李 璇,朱梓强,宿树兰,郭 盛,康宏杰,段金廒,朱 悦**
(1.南京中医药大学药学院,江苏省方剂研究重点实验室/江苏省方剂高技术研究重点实验室/中药资源产业化与方剂创新药物国家地方联合工程研究中心/江苏省中药资源产业化过程协同创新中心 南京 210023;2.宁夏枸杞创新中心 银川 750000)
枸杞叶为茄科枸杞属植物宁夏枸杞(Lycium barbarumL.)与枸杞(L.chinenseMill.)的嫩茎叶,其药用记载始见于南朝宋《名医别录》“冬采根,春、夏采叶,秋采茎实”[1]。唐·孙思邈《备急千金要方》将其功效概括为“补虚羸,益精髓”[2]。五代《药性论》记载“子叶同说,味甘平。补益精,诸不足”,认为其功效与枸杞子类似[3],《日华子本草》进一步描述其具有“除烦益志”“壮心气”功效[4]。现代《中药大词典》及《中华本草》将其功效总结为“补虚益精,清热明目”[5-6]。
现代研究表明,枸杞叶富含黄酮类[7]、酚酸类[8]、多糖类及生物碱类成分[9-10],其活性成分种类与枸杞子相似,而黄酮类成分含量甚至超过枸杞子[11]。同时研究发现枸杞叶具有抗氧化[12]、抗疲劳[13],调节血糖血脂[14-15]、神经保护[16]、抗肿瘤等生物活性[17],是具有高度开发利用价值的药食两用资源。为了深入挖掘其资源利用价值,基于其“补虚益精”的传统功效,构建D-半乳糖致亚急性衰老小鼠模型,评价枸杞叶对衰老模型小鼠学习与记忆能力的影响并探索效应部位与作用机制,为枸杞叶资源化利用与相关产品开发提供现代科学依据。
1 材料
1.1 动物
本实验使用SPF 级,体质量为25-30 g 的雄性ICR小鼠,由上海斯莱克实验动物有限公司提供,许可证号SCXK(沪)2022-0004。本实验获得南京中医药大学动物实验伦理委员会批准(202211A006)。
1.2 药物
枸杞叶(Lycium barbarumleaves,批号:2208153)采购自宁夏明德中药饮片有限公司,经过段金廒教授鉴定为合格药材。
1.3 试剂
多奈哌齐(E120086)购自萨恩化学技术有限公司;凝胶制备试剂盒(PG112)购自上海雅酶生物医药科技有限公司;蛋白酶抑制剂(Cocktail,HY-K0011)购自MCE 公司;小鼠肿瘤坏死因子α(TNF-α)ELISA 试剂盒(AF2132-A)、小鼠γ 干扰素(IFN-γ)ELISA 试剂盒(AF2182-A)、小鼠白介素10(IL-10)ELISA 试剂盒(AF2176-A)、小鼠白介素1β(IL-1β)ELISA 试剂盒(AF2040-A)、小鼠脑源性神经营养因子(BDNF)ELISA 试剂盒(AF2204-A)、小鼠神经生长因子(NGF)ELISA 试剂盒(AF2147-A)、小鼠胶质细胞源神经营养因子(GDNF)ELISA 试剂盒(AF2110-A)购自湖南艾方生物科技有限公司;还原性谷胱甘肽(GSH)检测试剂盒(A006-2-1)、丙二醛(MDA)检测试剂盒(A003-1-2)、小鼠超氧化物歧化酶(SOD)检测试剂盒(A001-3-2)购自南京建成生物工程研究所;TUNEL 凋亡检测试剂盒(A112-01)购自南京诺唯赞生物科技公司;抗体Caspase-9(Mouse mAb 9508S)、Nrf2(Rabbit mAb 12721S)购自Cell Signaling Technology(CST)公司;抗体Caspase-3(66470-2-lg)、HO-1(10701-1-AP)、β-actin(66009-1-lg)购自武汉三鹰生物技术公司;二抗HRP Conjugated AffiniPure Goat Anti-rabbit IgG (H+L)(BA1054)、HRP Conjugated AffiniPure Goat Antimouse IgG (H+L)(BA1050)购自BOSTER公司。
1.4 实验仪器
动物行为学分析系统(上海欣软信息科技有限公司);微孔板恒温振荡器(ST60-4,Thermo 公司);高速冷冻离心机(D1524R,大龙兴创实验仪器公司);多功能酶标仪(Enspire,Perkin-Elmer 公司);凝胶成像系统(ChemiDocTMXRS+Imaging System,Bio-Rad 公司);干式恒温金属浴(SBH130D,STUART 公司);荧光倒置显微镜(AXIO Vert.A1,Zeiss公司)。
2 方法
2.1 枸杞叶提取部位的制备
取枸杞叶500 g,加入10 倍量水,进行两次回流提取,微沸计时提取2 h,将两次提取后的滤液合并后过滤浓缩,然后将浓缩液放入冻干机,得到枸杞叶水提部位(ST);按上述操作及图1 样品制备流程图依次制备枸杞叶75%乙醇提取部位(CT)、80%醇沉上清部位(SQ)及80%醇沉沉淀部位(CD),经计算求得枸杞叶水提部位(ST)得率为31.23%、枸杞叶75%乙醇提取部位(CT)得率为21.71%、80%醇沉上清部位(SQ)得率为17.68%、80%醇沉沉淀部位(CD)得率为15.75%。

图1 枸杞叶不同溶剂提取部位制备流程图
图2 各组小鼠Y迷宫运动轨迹图
2.2 D-半乳糖致亚急性衰老小鼠模型构建、分组及给药
将100 只雄性ICR 小鼠随机设置为空白组、模型组、枸杞叶水提物低剂量组(ST-L)、枸杞叶水提物高剂量组(ST-H)、枸杞叶75%醇提物低剂量组(CT-L)、枸杞叶75%醇提物高剂量组(CT-H)、枸杞叶水提80%醇沉上清低剂量组(SQ-L)、枸杞叶水提80%醇沉上清高剂量组(SQ-H)、枸杞叶水提80%醇沉沉淀低剂量组(CD-L)、枸杞叶水提80%醇沉沉淀高剂量组(CD-H)以及阳性药组多奈哌齐(Donepezil),除空白组10 只外,其余每组9 只。除空白组外,其余组通过颈背部皮下注射D-半乳糖(500 mg·kg-1·d-1)8 周建立亚急性衰老小鼠模型。D-半乳糖(500 mg·kg-1·d-1)通过0.9%生理盐水配制浓度为50 mg·mL-1,给药体积为10 ml·kg-1,造模8 周动物出现学习与记忆损伤后进行灌胃给药。枸杞叶根据《宁夏中药材标准》中人用每日生药量15 g,通过人与小鼠体表面积换算系数得到小鼠给药剂量,其中低剂量组剂量(2.25 g·kg-1)根据枸杞叶人用日常剂量设置、高剂量组剂量(4.5 g·kg-1)根据枸杞叶人用日常剂量的2 倍设置。提取物用0.9%生理盐水配制,给药浓度分别为0.255 g·mL-1、0.45 g·mL-1,给药体积为10 ml·kg-1。枸杞叶不同溶剂提取部位给药剂量均按照得率折算为相应生药量。阳性药组(Donepezil)通过0.9%生理盐水配制给药浓度为0.2 mg·mL-1,给药体积为10 ml·kg-1。动物分组及给药情况见表1。给药周期为四周,之后进行行为学测试并解剖,每组取3 只进行心脏灌注,取全脑固定,剩余小鼠分离海马组织,进行后续生化指标检测。

表1 动物实验给药剂量
2.3 行为学测试
Y 迷宫(Y-maze)实验:将Y 迷宫三个臂随机设置为新异臂、起始臂和其他臂。训练期将新异臂用隔板阻挡,小鼠由起始臂放入,自由探索起始臂和其他臂5 min。间隔1 h 后打开新异臂的挡板,小鼠由起始臂放入,在三个臂中自由探索5 min,采用VisuTrack 软件分析小鼠进入新异臂的次数和时间。每只小鼠在测试前用75%酒精擦拭实验装置以消除气味影响。
新物体识别(Novel object recognition,NOR)实验:测试分三个阶段进行。第一阶段为适应期,小鼠在实验装置内自由探索10 min;第二阶段为熟悉期,在实验装置对称角落位置放入两个完全相同的物体,将小鼠背朝物体并从距物体等距离处放入实验装置,小鼠自由探索5 min后取出小鼠,间隔1 h后进行下一阶段实验;第三阶段为测试期,将两个相同物体中的一个物体替换为一个形状、颜色、材质都不同的新物体,同样将小鼠背朝物体并从距物体等距离处放入实验装置内自由探索5 min,采用VisuTrack软件分析小鼠在此期间对新物体和旧物体的探索时间及探索次数[18]。每只小鼠在测试前用75%酒精擦拭实验装置以消除气味影响。
2.4 脑组织海马区HE及尼氏(Nissl)染色
行为学测试后,每组取3只小鼠麻醉,以PBS 溶液进行心脏灌注,断头取脑,将脑组织置于4%多聚甲醛中固定24 h,石蜡包埋、切片、二甲苯脱蜡、乙醇梯度脱水,然后进行HE以及Nissl染色,在显微镜下对海马组织进行病理观察并拍照,采用Image J软件统计单位面积下尼氏体染色阳性细胞数。
2.5 神经营养类因子及炎症因子含量测定
行为学测试后,取6只小鼠解剖取海马组织,液氮速冻后称取一定重量的小鼠海马组织,加入10倍量的PBS,低温研磨制备10%组织匀浆,3000 r·min-1,离心10 min,取10%匀浆上清液待测。按照湖南艾方生物ELISA 试剂盒说明书,测定小鼠海马组织中神经营养类因子BDNF、NGF、GDNF 水平及炎症因子TNF-α、IL-1β、IFN-γ、IL-10水平。
2.6 氧化应激因子的测定
行为学测试后,取每组6只小鼠解剖取海马组织,液氮速冻后称取一定重量的小鼠海马组织,按照重量加入10 倍体积PBS 缓冲液,低温研磨制备组织匀浆,3000 r·min-1,离心10 min 后取上清液。按照试剂盒说明书,测定小鼠海马组织中氧化因子SOD 的活力以及MDA和GSH的含量。
2.7 Western blot 法检测小鼠海马组织Nrf2、HO-1 蛋白表达
称取受试小鼠海马组织,并将其加入10倍体积含有蛋白酶抑制剂Cocktail 的RIPA 蛋白裂解液中。之后,使用BCA 法来测定提取得到的组织总蛋白的浓度并制备蛋白样品。采用10%蛋白凝胶试剂盒制备电泳凝胶,120 V 电泳2 h。转膜条件:Nrf2,300 mA 120 min;β-Actin、HO-1,300 mA 60 min。5%脱脂牛奶封闭2 h,加入相应一抗:Nrf2 Rabbit mAb(1∶2000)、HO-1 Rabbit PolyAb(1∶4000)、β-actin Mouse mAb(1∶10000),置于4℃冰箱过夜孵育后取出。TBST 洗膜3次,每次10 min。加入相应二抗室温孵育1 h,HRP Conjugated AffiniPure Goat Anti-mouse IgG(H+L)(1∶10000),HRP Conjugated AffiniPure Goat Anti-rabbit IgG(H+L)(1∶10000)。TBST 洗膜后,通过ECL 化学发光液在凝胶成像系统中显影成像,使用Image J软件对成像条带进行定量分析。
2.8 TUNEL 法及Western blot 法分别检测小鼠脑组织海马区细胞凋亡及小鼠海马组织Caspase-3、Caspase-9蛋白表达
依据行为学检测结果,选择行为学改善较为明显的枸杞叶不同溶剂提取部位高剂量组小鼠脑组织石蜡切片,用二甲苯脱蜡,梯度乙醇脱水,按照TUNEL试剂盒说明书进行染色,封片后置于荧光显微镜下观察并拍照;按照“2.7”项下的方法检测凋亡蛋白Caspase-3、Caspase-9 表达,转膜条件:Caspase-3、Caspase-9,300 mA 60 min,一抗:Caspase-9 Mouse mAb(1:1000)、Caspase-3 Rabbit mAb(1:2000)。
2.9 统计学分析
分别通过SPSS 20.0和GraphPad Prism 9统计软件对数据进行统计学分析和作图,数据结果以均数± 标准差(±s)表示,组间统计学分析采用单因素方差分析。
3 结果
3.1 枸杞叶不同溶剂提取部位改善D-半乳糖致亚急性衰老小鼠学习与记忆能力的效用评价
小鼠给以枸杞叶提取部位四周后,采用Y 迷宫实验及新物体识别实验评价小鼠学习与记忆能力(见图2)。分析行为学测试结果发现,Y迷宫实验中,模型组小鼠对Y 迷宫中新异臂的探索次数和探索时间较空白组显著降低(P<0.01);与模型组相比,枸杞叶水提部位、75%醇提部位以及80%醇沉上清部位均能显著上调小鼠对新异臂的探索次数及探索时间(P<0.01)(见图3)。在新物体识别实验中,模型组小鼠对新物体的时间分辨率与次数分辨率较空白组显著降低(P<0.01);枸杞叶各溶剂提取部位均能够逆转小鼠对新事物分辨率降低的趋势(见图4)。上述两种行为学测试结果综合表明,枸杞叶水提部位以及水提80%醇沉上清部位可显著改善亚急性衰老模型小鼠的学习与记忆能力,其作用趋势与阳性药多奈哌齐一致。

图3 枸杞叶不同溶剂提取部位对D-半乳糖致亚急性衰老模型小鼠Y迷宫行为学的影响(n=9)

图4 枸杞叶不同溶剂提取部位对D-半乳糖致亚急性衰老模型小鼠新物体识别行为学的影响(n=9)
3.2 枸杞叶不同溶剂提取部位对小鼠海马区组织病理变化的影响
为了考察枸杞叶不同溶剂提取部位对模型小鼠脑组织海马区组织病理变化的影响,对小鼠脑组织海马区进行苏木素-伊红(HE)以及Nissl染色。如图5所示,在HE 组织切片中,空白组细胞排列整齐均匀,核仁清晰。与空白组相比,模型组小鼠海马去神经元细胞排列较为松散,核固缩现象十分明显,核仁模糊;与模型组相比,枸杞叶水提部位、75%醇提部位以及水提80%醇沉上清部位神经元排列较为整齐,核固缩现象得到明显改善,其中以水提部位高剂量组以及水提80%醇沉上清部位低、高剂量组改善作用最为显著。

图5 枸杞叶不同溶剂提取部位对D-半乳糖致亚急性衰老模型小鼠海马区组织HE染色的影响(n=3)
如图6 所示,在Nissl 染色组织切片中,空白组小鼠海马区神经元胞质内可见明显深蓝色斑块状尼氏体。与空白组相比,模型组小鼠海马区尼氏体阳性细胞数目显著减少(P<0.01);与模型组相比,枸杞叶水提部位、75%醇提部位和水提80%醇沉上清部位的高剂量组均可显著增加小鼠海马区尼氏体数目(P<0.05,P<0.01),作用趋势与阳性药多奈哌齐一致,其中以水提部位高剂量组效用最为显著。

图6 枸杞叶不同溶剂提取部位对D-半乳糖致亚急性衰老模型小鼠海马区组织尼氏体染色的影响(n=3)
3.3 枸杞叶不同溶剂提取部位对小鼠海马组织神经营养类因子及炎性因子表达的影响
为了考察枸杞叶不同溶剂提取部位对模型动物海马神经营养类因子及炎性因子表达的影响,检测海马组织中神经营养类因子BDNF、NGF 与GDNF 及炎症因子TNF-α、IL-1β、IFN-γ、IL-10 的表达。其中神经营养类因子表达结果如图7 显示,模型小鼠海马组织中BDNF、NGF、GDNF 含量较空白组显著降低(P<0.01);枸杞叶不同溶剂提取部位高剂量组均能明显上调小鼠海马组织中神经营养因子表达(P<0.05),作用趋势与阳性药多奈哌齐一致,其中水提部位以及水提80%醇沉上清部位高剂量组表现出较强的作用趋势;炎症因子表达结果如图8显示,与空白组相比,模型组小鼠海马组织中促炎细胞因子TNF-α、IL-1β、IFN-γ表达显著升高(P<0.01),抗炎细胞因子IL-10 表达显著减少(P<0.01);枸杞叶的水提部位、75%醇提部位以及水提80%醇沉上清部位的高剂量组均可显著降低模型动物海马中促炎因子TNF-α、IL-1β、IFN-γ 表达(P<0.01),并且显著增加抗炎细胞因子IL-10 的表达(P<0.01)。作用趋势与阳性药多奈哌齐一致,水提部位高剂量组表现出较强的作用趋势。

图7 枸杞叶不同溶剂提取部位对D-半乳糖致亚急性衰老模型小鼠海马组织神经营养类因子表达的影响(n=6)
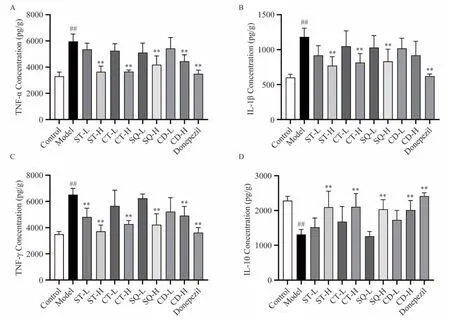
图8 枸杞叶不同溶剂提取部位对D-半乳糖致亚急性衰老模型小鼠海马组织炎症因子水平的影响(n=6)
3.4 枸杞叶不同溶剂提取部位对小鼠海马组织氧化应激因子的影响
为了考察枸杞叶不同溶剂提取部位对模型小鼠海马氧化应激的影响,检测氧化应激因子在小鼠海马组织的活力或表达。结果如图9 所示,模型组小鼠海马组织中抗氧化物酶SOD 的活力和GSH 的含量较空白组显著降低(P<0.01),脂质过氧化物MDA的含量显著升高(P<0.01);与模型组相比,枸杞叶水提部位显著增强模型小鼠海马组织中SOD 活力及GSH 的表达(P<0.01),下调MDA 的表达(P<0.01),枸杞叶水提部位高剂量组作用趋势最强。

图9 枸杞叶不同溶剂提取部位对D-半乳糖致亚急性衰老模型小鼠海马组织氧化因子水平的影响(n=6)
3.5 枸杞叶不同溶剂提取部位对小鼠海马组织抗氧化蛋白Nrf2、HO-1表达的影响
采用Western blot 法检测小鼠海马区抗氧化蛋白Nrf2 和HO-1 的表达水平。结果如图10 显示,模型组小鼠海马组织中抗氧化通路蛋白Nrf2和HO-1蛋白表达水平较对照组显著降低,枸杞叶水提部位高剂量组Nrf2 和HO-1 的蛋白表达水平较模型组显著增加(P<0.01),作用趋势最强。

图10 枸杞叶不同溶剂提取部位对D-半乳糖致亚急性衰老模型小鼠海马组织Nrf2和HO-1蛋白表达水平的影响(n=6)
3.6 枸杞叶不同溶剂提取部位对小鼠脑组织海马区细胞凋亡及凋亡蛋白Caspase-3、Caspase-9 表达的影响
依据行为学检测结果,选择行为学改善较为明显的枸杞叶不同溶剂提取部位高剂量组石蜡切片,通过TUNEL 法检测小鼠脑组织海马区细胞凋亡情况,染色结果如图11A 所示,对照组脑组织海马区未见明显阳性细胞,与对照组相比,模型组小鼠脑组织海马区凋亡阳性细胞数目显著增多(P<0.01),表明模型小鼠脑组织海马区存在明显凋亡;与模型组相比,枸杞叶水提部位、75%醇提部位以及水提80%醇沉上清部位的高剂量组脑组织海马区阳性细胞数目显著减少(P<0.01),表明给药后细胞凋亡程度明显改善;采用Western blot 法检测小鼠海马区凋亡通路蛋白Caspase-3 和Caspase-9 的表达水平,结果如图11B 显示,模型组小鼠海马组织中凋亡蛋白Caspase-3 和Caspase-9 蛋白表达水平较对照组显著升高,枸杞叶75%醇提低剂量组和水提80%醇沉上清部位高剂量组可显著抑制Caspase-3 和Caspase-9 蛋白表达水平(P<0.05,P<0.01),作用趋势最强。

图11 枸杞叶不同溶剂提取部位对D-半乳糖致亚急性衰老模型小鼠海马区凋亡的影响
4 讨论
衰老是指机体器官功能随着时间推移产生功能减退的生理过程。大脑功能衰退是机体衰老最显著的症状之一,表现为学习与记忆能力呈下降趋势,甚至发展为老年痴呆症等神经退行性疾病,给国家、社会和家庭带来了沉重的负担。机体氧化应激和炎性应激水平的上升是机体衰老最为显著的指标与关键病理机制[19]。机体在衰老过程中会产生大量自由基,如果大量的自由基不能被及时清除,最终会导致自由基失衡从而引发氧化应激,其产生的活性氧(Reactive oxygen species,ROS)不仅会对神经元造成严重损伤,还可通过激活炎症信号通路产生多种促炎细胞因子来引发神经炎症加剧氧化应激,导致恶性循环。在中枢神经系统中,氧化应激和炎性应激会导致中枢神经系统中与学习记忆功能密切相关的海马组织损伤,从而产生认知障碍[21-22],故抑制海马神经元的氧化与炎性应激对于预防老年期痴呆症的发生或延缓疾病进程,防止衰老过程中的认知能力下降至关重要[23-24]。因此,预防氧化应激诱导的神经元凋亡可能是治疗年龄相关的神经退行性疾病的潜在治疗策略。本研究采用D-半乳糖小鼠皮下注射构建亚急性衰老动物模型。D-半乳糖过量摄入可产生过量ROS 以及抗氧化酶活性降低,导致机体氧化应激加剧而加速衰老进程,是公认并常用的亚急性衰老动物模型[25-27]。本研究中发现,小鼠颈背部长期、大剂量皮下注射D-半乳糖后学习与记忆能力下降,并出现了行动迟缓与毛发稀疏等衰老特征,较好地模拟了人体的衰老。同时,D-半乳糖致亚急性衰老模型小鼠产生显著氧化应激、炎症应激损伤和细胞凋亡,表现为学习记忆能力下降、损伤小鼠海马区神经元、神经营养因子BDNF、NGF、GDNF 表达下调、促炎细胞因子TNF-α、IL-1β、IFN-γ 表达升高、抗炎细胞因子IL-10 表达减少、同时其氧化应激因子抗氧化物酶SOD 的活力和GSH 的含量显著降低、脂质过氧化物MDA 的含量显著升高,抗氧化通路Nrf2/HO-1 蛋白表达显著降低,在细胞凋亡方面,表现为Caspase-3、Caspase-9蛋白表达水平显著升高。
中医理论认为年龄增长,肾精亏虚是导致衰老的根本原因。同时“肾通髓海”,肾藏精生髓而充于脑。肾精充足,髓海充盈,则脑健神明,耳聪目明,反应灵活,记忆力强;反之,肾精亏虚,髓海失养,则易出现心烦、健忘等神志异常症状。因此补虚益精为中医抗衰老并防治老年期痴呆的治本之法。枸杞叶在历代多种本草典籍中均记载其具有“补虚益精”功效[28]。现代研究也证实了枸杞叶的神经活性。韩怀钦等[29]研究发现宁夏无果枸杞叶水提物能够促进海马区神经细胞增殖,减少神经细胞凋亡。王长江等[30]研究发现枸杞叶总黄酮可通过提高机体氧化应激水平、促进BDNF表达及减少细胞凋亡从而发挥抗抑郁作用,徐龙飞[31]研究发现枸杞叶总黄酮具有改善染铅小鼠学习记忆损伤的效果,其机制可能与下调脑组织中Bcl-2 蛋白表达有关。
本研究基于D-半乳糖所致亚急性衰老小鼠模型,系统考察了枸杞叶改善模型动物学习与记忆能力的效用部位。研究发现,枸杞叶的水提部位以及水提80%醇沉上清部位对模型动物的学习与记忆能力均有显著提高作用,并可以改善模型小鼠海马神经元活力增加尼氏体数目,对小鼠海马区神经元损伤具有保护作用,其中以水提部位和80%醇沉上清部位高剂量组在改善模型动物的学习与记忆能力,增强海马神经元活力方面效用最为明显;在上调神经营养因子表达方面,同样也是水提部位以及水提80%醇沉上清部位作用最为显著;在中枢神经炎症调控方面,以枸杞叶水提部位高剂量组抑制促炎因子表达与提升抗炎因子表达效果最为显著;在调控氧化应激方面,枸杞叶水提物高剂量组提高抗氧化物酶活力、降低脂质过氧化物含量,促进抗氧化蛋白表达方面效用最为明显;在细胞凋亡方面,枸杞叶75%醇提低剂量组和水提80%醇沉上清部位高剂量组可显著抑制凋亡通路蛋白Caspase-3 和Caspase-9 表达,减少模型小鼠脑组织海马区细胞凋亡。综上分析认为,枸杞叶总水提部位与水提80%醇沉上清部位具有较强的改善衰老模型小鼠学习与记忆能力的作用,并改善相关生化指标。据文献报道,枸杞叶中富含黄酮及酚酸类成分、多糖类成分、生物碱类等多种化学成分[32],其中黄酮与多酚类成分含量高于枸杞果实,并具有清除自由基、抗氧化、抗炎及神经保护作用等生物活性,被认为是枸杞叶中的主要活性物质。枸杞叶所含黄酮与酚酸类成分主要为芦丁、槲皮素-3-O-芸香糖苷-7-O-葡萄糖苷、绿原酸、新绿原酸以及咖啡酸等。研究表明绿原酸对脑组织氧化损伤具有保护作用,还可通过抗细胞凋亡以及抗β-淀粉样蛋白生成,发挥神经保护作用[33];诸多体内外实验证明,芦丁可通过抗氧化、抗炎以及抗凋亡发挥其神经保护作用[34];咖啡酸可通过抑制氧化应激、神经炎症、上调神经营养因子BDNF表达等改善Aβ 诱导的AD 小鼠模型学习与记忆功能障碍[35]。课题组前期研究表明,枸杞叶水提物、75%醇提物与水提80%醇沉沉淀上清部位中均含有上述类型成分,而水提80%醇沉淀部位中并不含有黄酮与酚酸成分。所以水提80%醇沉淀部位改善模型动物学习与记忆能力显著弱于其余三种部位。在后续实验研究中,将进一步采用活性跟踪分离等手段,探索揭示行为学测试中改善模型动物学习与记忆能力作用趋势最显著的枸杞叶80%醇沉上清部位中的活性成分,进一步解析其药效物质基础,以期为这一药食两用中药材的临床应用提供更多的现代科学依据,同时助力于枸杞资源的综合利用与大健康产品开发。
