发酵鲢鱼鱼糜香肠加工工艺优化及品质分析
2024-04-16袁志宁霍栓张容李璐郑捷
袁志宁 霍栓 张容 李璐 郑捷


摘要:以混合菌种(清酒乳杆菌、木糖葡萄球菌)作为发酵剂,以感官评分和pH为指标,采用正交实验优化發酵鲢鱼鱼糜香肠的加工工艺,并对产品进行指标测定。结果表明,当发酵剂接种量为3%,在 30 ℃下发酵18 h 时,所得产品香味浓郁,组织紧密,色泽均匀,口感良好,无异味。与未发酵香肠对比,在此条件下制得的发酵香肠的pH显著降低,氨基酸态氮含量升高,产品的色泽和质地得到明显改善,风味物质增加,尤其是芳香化合物和醇类化合物。该研究为发酵鱼糜制品的深入研究提供了一定的理论基础,为工业化生产提供了参考。
关键词:发酵;鲢鱼鱼糜;发酵香肠;风味
中图分类号:TS201.1 文献标志码:A 文章编号:1000-9973(2024)02-0157-08
Optimization of Processing Technology and Quality Analysis of Fermented Silver Carp Surimi Sausage
Abstract: Using mixed strains (Lactobacillus sake and Staphylococcus xylosus) as the fermentation agents, with sensory score and pH as the indexes, the processing technology of fermented silver carp surimi sausage is optimized by orthogonal experiment, and the indexes of product are determined. The results show that when the inoculation amount of fermentation agents is 3% and the product is fermented at 30 ℃ for 18 h, the obtained product has strong flavor, compact tissue, uniform color, good taste and no peculiar smell. Compared with unfermented sausage, the pH of fermented sausage prepared under these conditions significantly decreases, the content of amino acid nitrogen increases, the color and texture of the product are significantly improved, and the flavor substances increase, especially the aromatic compounds and alcohol compounds. This study has provided a theoretical basis for the further research on fermented surimi products and references for the industrial production.
Key words: fermentation; silver carp surimi; fermented sausage; flavor
我国淡水鱼销量占水产品总销量的50%以上,但目前主要以鲜食为主,少量被加工制成干制品、罐头、腌腊制品等。我国对淡水鱼深加工程度不足,综合利用能力有待提高。原料供应量大和生产加工技术落后之间的矛盾导致我国淡水鱼领域发展缓慢,并存在产品价值低、资源浪费等现象[1-2]。因此,加强我国淡水鱼类的深加工程度,开发出一种既营养又便捷的产品是一种可行策略。
发酵食物历史悠久,因其口感独特、营养价值高、耐储存的特点深受消费者的青睐[3]。近年来,发酵产品获得广泛关注,国外研究者发现,在肉中加入益生菌可以有效地降低葡萄球菌、假单胞菌等杂菌的数量,减少生物胺等有害物质的含量[4]。并且发酵过程中碳水化合物和脂肪会分解成有机酸类、醇类、酮类等风味物质,使产品具有独特的发酵香味[5]。目前利用微生物技术加工鱼糜制品的研究较少,开发一种新型鱼糜制品有助于推动淡水鱼资源的利用以及增加产品种类。
本研究以鲢鱼鱼糜为原料,接种商业发酵剂(清酒乳杆菌、木糖葡萄球菌),以pH和感官评分为评价指标,经单因素实验和正交实验确定最优发酵工艺,在此基础上分别检测未发酵香肠和发酵香肠的营养指标、理化指标和质构指标,并进行风味分析,为研制具有独特风味、高营养、高品质的发酵淡水鱼糜香肠提供了理论基础。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
冷冻鲢鱼鱼糜(AAA级):湖北洪湖市井力水产食品有限公司;白醋、曲酒:天津金元宝滨海农产品交易市场;姜汁:跃龙食品旗舰店;食盐:中国盐业股份有限公司;马铃薯淀粉、食品级大豆分离蛋白:河南万邦化工科技有限公司;塑料肠衣:北京德茂科贸有限公司;商业发酵剂(清酒乳杆菌、木糖葡萄球菌,比例为1∶1):北京汉森生物科技有限公司。
1.1.2 仪器与设备
JYL-C022 斩拌机 九阳股份有限公司;FE28 pH计 厦门和谱仪器有限公司;HH-S6数显恒温水浴锅 金坛市白塔新宝仪器厂;K9840 凯氏定氮仪 济南海能仪器股份有限公司;MLS-3751L-PC立式压力蒸汽灭菌锅 浙江新丰医疗器械有限公司;SHP-160DA 生化培养箱 天津津立仪器设备科技发展有限公司;FA2204B分析天平 上海佑科仪器仪表有限公司;YG268 色差仪 美国三恩时公司;TA.XT Plus质构仪 英国Stable Micro Systems公司;MicroMR 低场核磁共振仪 苏州纽迈分析仪器股份有限公司;QP-2010 GC-MS 联用仪 日本Shimadzu 公司。
1.2 实验方法
1.2.1 工艺流程
冷冻鱼糜→冷藏解凍→斩拌→接种→搅拌→灌肠→发酵→蒸煮→成品。
1.2.2 操作步骤
1.2.2.1 解冻
将冷冻鱼糜从冰柜(-20 ℃)中取出,放在冰箱4 ℃恒温冷藏室内自然解冻24 h。
1.2.2.2 斩拌
将解冻好的鱼糜切成1 cm×1 cm×1 cm的均匀肉块,放入斩拌机先进行空斩2 min,放入2%食盐后进行盐斩3 min,最后和其他辅料混合后进行混合斩3 min。
1.2.2.3 接种发酵剂
将发酵剂活化后的菌悬液在无菌操作台上均匀接种于混合肉糜中,使混合鲢鱼肉糜中发酵剂初始数量约在107 CFU/g。
1.2.2.4 灌肠
用灌肠器将混合好的鱼糜灌制成肠,保持适度的松紧度,保证香肠的外观美感。灌好后用棉线扎成等长度的肠体,每根肠重量约为30 g左右。为防止杂菌污染,使用的器具都需经过高温灭菌。
1.2.2.5 发酵
将灌好的鲢鱼鱼糜香肠放入生化培养箱中,在30 ℃下发酵18 h,待发酵结束后,将其放入水浴锅中蒸煮熟化,擦拭表面水分进行真空包装,冷藏备用。
1.2.3 发酵温度对发酵香肠的影响
向解冻好的鱼糜中加入辅料,发酵剂接种量为3%,分别置于20,25,30,35,40 ℃的生化培养箱中对鱼糜香肠进行发酵,发酵18 h后蒸煮熟化,测定成品的pH,并进行感官评价。
1.2.4 接种量对发酵香肠的影响
向解冻好的鱼糜中加入辅料,分别接种1%、2%、3%、4%、5%(按肉的质量计),置于30 ℃的生化培养箱中对香肠进行发酵,发酵18 h后蒸煮熟化,测定成品的pH,并进行感官评价。
1.2.5 发酵时间对发酵香肠的影响
向解冻好的鱼糜中加入辅料,发酵剂接种量为3%,置于30 ℃的生化培养箱中对香肠进行发酵,分别发酵6,12,18,24,30 h,发酵结束后蒸煮熟化,测定成品的pH,并进行感官评价。
1.2.6 发酵工艺正交优化
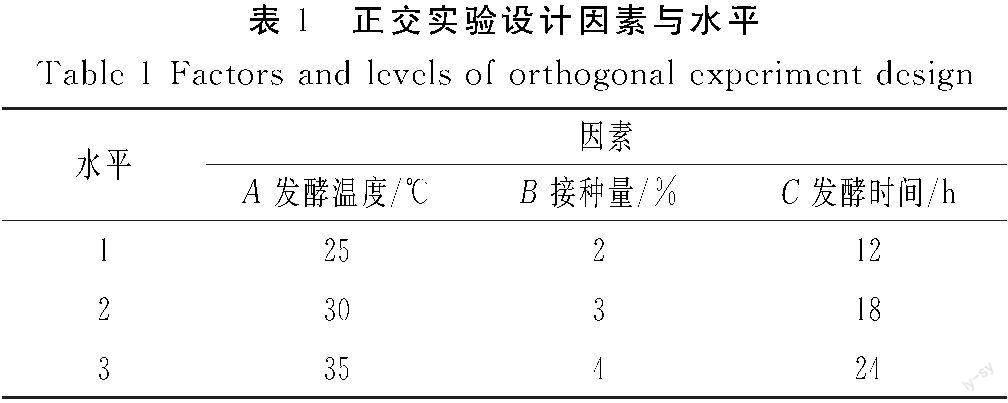
基于单因素实验结果,选取发酵温度、接种量、发酵时间3个因素进行研究,确定上述3个关键因素的水平范围,以感官评分为指标,对3个因素设计L9(33)正交实验,正交实验设计因素与水平见表1。
1.2.7 营养指标的测定
参照GB 5009.237-2016[6]对样品的pH值进行测定;参照GB 5009.3-2016[7]对样品的水分含量进行测定;参照GB 5009.4-2016[8]对样品的灰分含量进行测定;参照GB 5009.5-2016[9]对样品的蛋白质含量进行测定;参照GB 5009.6-2016[10]对样品的脂肪含量进行测定。
实验组:在最优发酵条件下蒸煮得到的发酵香肠。
对照组:不经发酵直接蒸煮得到的蒸煮香肠。
1.2.8 质构的测定
参照Trindade等[11]的方法并稍作修改,将制备好的样品切成直径为20 mm、高为20 mm的圆柱体,于室温下静置平衡30 min后置于物性分析平台上,选择质构分析仪(TPA)进行测定。
1.2.9 色差的测定
参照张根生等[12]的方法,利用校准的色差仪对样品进行测定。
1.2.10 氨基酸态氮的测定
参照许惠雅等[13]的方法,对样品中氨基酸态氮含量进行测定。
1.2.11 水分分布的测定
参照王博等[14]的方法,对样品中水分分布进行测定。
1.2.12 电子鼻测定
参考Vidigal等[15]的方法并稍作修改,将不同的香肠样品搅碎,每个样品称取2.0 g装入10 mL顶空瓶中,将盖子盖好并拧紧密封。在室温条件下放置30 min,使样品中的风味成分能够充分挥发达到平衡状态。样品测定时,将电子鼻的进样针和补气针同时插入顶空瓶中。测定参数设置:清洗时间90 s,测定时间120 s,进气速度400 mL/min。
PEN3电子鼻各传感器所代表的物质见表2。
1.2.13 挥发性风味物质的测定
采用GC-MS气质联用仪对两组样品中的挥发性风味成分进行检测。
1.2.13.1 GC-MS测定方法
参照Cai等[16]的方法,准确称量2.0 g成品香肠装入15 mL顶空瓶中,盖好盖子并拧紧密封,样品测定前,先对萃取头进行清洗,清洗结束后将其放入60 ℃水浴锅中,将进样针插入顶空瓶中,将萃取头拔下,对瓶中的气味进行吸附,吸附时间为30 min,结束后拔回萃取头,插入GC-MS仪器中,在250 ℃下解吸15 min。
1.2.13.2 GC-MS气质联用仪反应条件
色谱条件:Rtx-5MS色谱柱(30 m×0.25 mm×0.25 μm),程序升温:色谱柱初始温度设置为40 ℃并保持3 min,然后以4 ℃/min的速度升温到150 ℃,再以8 ℃/min的速度升温到250 ℃,保持6 min。载气为99.999%纯度的氦气,流量为1 mL/min,分流比为5∶1。
质谱条件:离子源为EI源;离子源温度为220 ℃,电子能量为70 eV,质量扫描范围为43~500 amu。
1.2.14 感官评价
由20名具有食品专业知识的人员(男、女各10名)组成感官品评小组,对成品按照风味、色泽、组织状态、口感依次进行打分,满分10分。制定的发酵香肠感官评价标准见表3。
1.2.15 统计与分析
使用Excel软件计算实验数据平均值,运用IBM SPSS Statistics 26.0软件进行数据统计分析及显著性分析,显著性水平为0.05,采用Origin 2018软件作图。
2 结果与分析
2.1 单因素实验
2.1.1 发酵温度对发酵香肠的影响
由图1可知,在不同发酵温度下pH呈逐渐下降的趋势,说明发酵剂在此发酵温度范围内能很好地进行代谢活动,但发酵温度为20 ℃和40 ℃时,感官评分较低,说明当发酵温度较低时,发酵剂生长和代谢活性较弱,发酵不充分,产品风味较差,随着温度升高,产品风味有所改善,但温度过高会导致香肠酸味强烈[17]。综合考虑,选取发酵温度25~35 ℃进行正交实验。
2.1.2 接种量对发酵香肠的影响
由图2可知,随着接种量的增加,感官评分先升高后降低,当接种量为1%时,产品中微生物含量较少,导致发酵不充分,pH不能降到理想范围(pH<5.3),香肠发酵风味较淡,产品安全性不能得到保障[18]。发酵剂接种量越大,pH值下降幅度越大,这是因为乳酸菌开始大量繁殖且成为优势菌,分解香肠中的碳水化合物,产生有机酸,从而导致pH出现不同程度的下降。当接种量为5%时,香肠品质劣化,出现酸味过高的现象,影响口感。综合考虑,选取接种量2%~4%进行正交实验。
2.1.3 发酵时间对发酵香肠的影响
由图3可知,随着发酵时间的增加,pH呈下降趋势,18~30 h内pH的变化变缓,导致这一现象的原因可能是鱼糜中的营养物质逐渐被消耗,导致发酵菌种的代谢速率变慢[19]。发酵时间在18 h时感官评分最高,为8.8,此时pH为5.16,其风味大大改善,发酵鱼糜香肠的切片性也有提高,发酵时间为30 h时感官评分最低,发酵时间过长,发酵鱼糜香肠出现过大孔洞,并有强烈酸味,色泽较差。综合考虑,选取发酵时间12~24 h进行正交实验。
2.2 正交实验结果
由表4可知,A2B2C2为发酵工艺的最优组合,由极差分析结果可知,3个因素对品质变化的影响由高到低为B>C>A,即接种量>发酵时间>发酵温度,可知发酵温度、接种量和发酵时间均对发酵鲢鱼鱼糜香肠的感官品质有显著的影响(P<0.05),最终得到的最优发酵工艺为发酵温度30 ℃、接种量3%、发酵时间18 h。对最优发酵工艺进行验证实验(见表5),得到的感官评分为9.2,所得的成品肠切面完整,肠体饱满,坚实有弹性。不同批次香肠品质的稳定性良好,均高于正交方案组中的感官评分。
2.3 产品指标的测定
2.3.1 产品营养指标的测定
由表6可知,除脂肪含量较低外,发酵鱼肉香肠符合国标GB/T 20712-2006中的特级要求。
2.3.2 产品理化指标的测定
由表7可知,实验组由于添加了发酵剂,微生物分解碳水化合物产生乳酸与醋酸等有机酸,导致pH下降。但蒸煮熟化过程中也会生成部分溶于水的非蛋白氮与含氮类挥发性物质,使pH略微上升[20],最终产品的pH值为5.18。发酵18 h产品的L*值和b*值有所提升,白度达到50.15,明显大于对照组。胡永金[21]研究发现,鱼糜香肠的白度提升有助于人们提高对其的喜爱程度。鱼肉中的蛋白质会因为酸碱度的变化而失去原有的构象,形成胶状组织[22]。蛋白质具有吸水特性,因此当pH下降导致蛋白质凝胶化时,其中一部分水分会被锁定在凝胶网络结构中,水分也会散布在肉品的表面,导致L*值增加。氨基酸态氮含量表示产品中以氨基酸形式存在的氮元素,可作为产品蛋白质水解程度的指标。与对照组相比,实验组有更高的氨基酸态氮含量。原因可能是微生物生长繁殖并成为发酵过程中的优势菌,分泌的蛋白水解酶加速了蛋白质水解,从而使蛋白质发生降解产生多肽、游离氨基酸等物質。
2.3.3 产品质构指标的测定
由表8可知,在混合发酵剂发酵后,鲢鱼鱼糜香肠的硬度和咀嚼性都明显提高,尤其是在硬度方面,由原来的1 674 g提高到2 692 g。质构结果表明添加菌种会有效改善发酵香肠的质构特性,尤其是对硬度、咀嚼度的影响较大,有助于香肠被切成薄片,其原因可能是在酸性环境下蛋白质发生变性,酸诱导凝胶使硬度和咀嚼性上升[23]。本实验研制的发酵鱼肉香肠与市售的鱼肉香肠对比,发酵鱼肉香肠的指标更接近于市售香肠,表明发酵鱼肉香肠的口感可接受程度较高。
2.3.4 水分分布的测定
在低场核磁共振图中,T21代表和大分子紧密相连的结合水,其横向弛豫时间定义为小于10 ms;T22代表蛋白质内部的不易流动水,其横向弛豫时间介于10~100 ms之间;T23代表肌纤维外的自由水,其横向弛豫时间大于100 ms。
由图5可知,发酵鲢鱼鱼糜香肠的T22的弛豫时间逐渐向左偏移,说明水的移动性下降。导致这一现象的原因可能是发酵过程中鱼糜香肠逐渐形成凝胶网络结构,将水分锁在凝胶的网络结构中,凝胶的锁水能力随着凝胶强度的增大而增强。另外,T23的峰值呈上升趋势,这表明肌原纤维蛋白中部分不易流动水的活动增强,可能会向T22流动,或者转化为自由水后迁移至鱼糜香肠表面,这与王博等[14]的研究结果相符。
2.4 产品风味分析
2.4.1 电子鼻测定
电子鼻分析可以灵敏地检测不同样品香气成分的细微变化和差异。PCA图能够反映样本间的区别,包括PC1(主轴1)和PC2(主轴2),图中的圈表示每个样品,点表示每个样品的取样点;雷达图显示了不同传感器对不同气体的敏感响应值,由此鉴别风味物质的种类,图中每个坐标轴代表各个传感器所对应的一类物质,坐标轴上的点表示样品中检测到的风味物质的相对强度值[24]。对照组和实验组的电子鼻PCA分析和雷达图分析见图6。
由图6中a可知,第一主成分PC1和第二主成分PC2的贡献率分别为99.73%和0.17%,二者总贡献率(99.9%)在90%以上,对照组和实验组的分析数据点分别分布在各自的区域内,彼此之间没有重叠,说明对照组和实验组之间挥发性气味有明显差异性,主成分能够准确地反映两者的风味特征。
由图6中b可知,对照组和实验组雷达图的外形轮廓不同,说明发酵后的实验组和对照组的风味物质之间具有差异性。R1、R3、R7、R8这4个传感器的响应值较高,表明这些传感器对E-nose的检测结果起着重要作用,样品间的风味物质差异主要体现在这4个传感器上,香肠中的芳香成分、硫化物及醇类、萜烯类化合物有所增加;R2、R4、R5、R6、R9、R10这6个传感器的响应值随着发酵时间的增加变化不是很明显,说明这些传感器对发酵样品产生的风味物质不敏感[25]。从传感器信号响应的强弱可以初步判断样品间芳香成分、硫化物及醇类、萜烯类化合物存在差异。结合感官评价,发酵鱼糜香肠的风味物质增加,风味更加浓郁。
2.4.2 GC-MS测定
利用GC-MS技术从发酵组与对照组中共检测出46种挥发性风味物质,包括醇类11种、醛类8种、酯类9种、烃类6种、酮类5种、酸类4种、其他类3种共7类。两种香肠中各挥发性风味物质相对含量见表9,香肠发酵前后各挥发性成分的相对含量变化见表10,这些物质主要来源于香肠制作过程中添加的香料以及香肠发酵过程中发生的碳水化合物的代谢、蛋白质的分解和脂肪的水解与氧化。对照组中的挥发性成分主要为酯类>醛类>醇类>烃类>酮类>其他类,而发酵组的挥发性成分主要为酯类>醇类>醛类>烃类>酸类>酮类>其他类。其中,发酵组香肠挥发性物质种类较对照组多14种,表明利用复合发酵剂进行发酵香肠制作可以豐富香肠的风味。
2.4.2.1 醛类物质变化分析
醛类化合物多为脂肪氧化产物,通常具有青草味、糖果味、坚果味、干酪味和脂香味,其中己醛、壬醛、庚醛等常在水产制品中检测出,由表9和表10可知,经过脱腥处理制作的蒸煮鱼肉香肠挥发性成分中仍能检测出相对含量较高的己醛、壬醛,与对照组相比,实验组中的醛类化合物明显下降,表明接种发酵可以有效降低腥味物质,抑制产品氧化。此外,苯甲醛(杏仁味)对其风味也起很重要的作用[26]。
2.4.2.2 醇类物质变化分析
醇类物质对发酵香肠的风味有着非常重要的贡献作用,由表9和表10可知,在本实验中共检测到11种醇类物质,其中乙醇含量最高,可能是曲酒中含有一定量的乙醇。芳樟醇、4-萜烯醇、桉叶油醇、α-松油醇等阈值较低的醇类物质大多来源于发酵香肠中添加的辅料。Iglesias等[27]研究发现,1-辛烯-3-醇呈现出淡淡的蘑菇气味,并常在水产制品中检出,经过添加复合发酵剂发酵后,其相对含量降至0.52%。
2.4.2.3 酯类物质变化分析
酯类是微生物代谢产生的醇和酸经过酯化反应形成的一类化合物,主要源于发酵或脂质代谢。酯类物质是鱼肉香气的主要成分,主要表现为果香味的酯是由短链脂肪酸生成的,油脂味的酯是由长链脂肪酸生成的。
发酵过程中乙醇和短链酸结合,促进了乙酯类风味化合物的产生,乙酯类物质能够赋予鱼肉奶油香味和果香味,构成了发酵鲢鱼鱼糜香肠独特风味形成的重要成分。己酸乙酯具有香蕉和菠萝的味道,而辛酸乙酯具有白兰地酒香[28]。加入曲酒蒸煮鱼肉香肠中酯类含量也相对较高。
2.4.2.4 酮类物质变化分析
酮类化合物具有独特的花果香味。发酵鲢鱼鱼糜香肠中酮类物质的种类和含量都很低,其中2,5-辛二酮和鱼体腥味成分的产生直接相关[29],3,5-辛二酮表现为奶香味,2,5-辛二酮在实验组中未检测到,3,5-辛二酮含量有所上升。Wang等[29]在发酵酸鱼实验中也发现发酵能使酮类物质减少。
2.4.2.5 烃类物质变化分析
检测出的烃类挥发性风味成分共有5种。发酵后的烃类化合物变化不大。烃类化合物在鱼露中主要是由脂肪酸烷氧自由基的均裂产生的,对鱼露的风味有贡献的是烷基苯和支链烷基。在本研究中检测到了一定含量烷烃,但由于烷烃的阈值较高,预测这些物质对产品整体风味的贡献不会太大。
2.4.2.6 酸类及其他物质变化分析
酸类物质是发酵香肠中具有代表性的风味物质之一,并在酯类的形成中起重要作用。对照组中未检测出任何酸味物质,然而经过发酵的香肠中检测出4种酸味化合物,它们的阈值很低,发酵香肠中常常会发现这些物质。碳水化合物的分解和氨基酸的代谢是产生这些物质的主要原因。Stahnke[30]证实了木糖葡萄球菌可以利用缬氨酸、亮氨酸和异亮氨酸产酸,Larrouture等[31]也分析了乳酸菌和葡萄球菌均有能力通过亮氨酸产酸。
其他类物质中检出2-正戊基呋喃、莰烯和蒎烯,相对含量为0.65%。2-正戊基呋喃(豆香、酯香)是典型的美拉德反应产物。有研究表明[32],萜类物质具有抗氧化和抑菌特性,可以有效地抑制发酵香肠生产过程中脂肪的氧化和微生物的生长,从而确保产品的质量和安全。因此,在发酵香肠配方中添加香辛料可以为其提供独特的风味和口感。
3 结论
以pH和感官评分为指标,通过单因素实验和正交实验优化发酵工艺,得出最佳发酵工艺为发酵温度30 ℃、接种量3%、发酵时间18 h。与蒸煮鱼糜香肠相比,发酵鱼糜香肠口味酸爽,白度、硬度和咀嚼度提升,氨基酸态氮含量升高。利用电子鼻分别对发酵鲢鱼鱼糜香肠和蒸煮鱼糜香肠的挥发性成分进行分析,电子鼻能有效识别发酵鲢鱼鱼糜香肠和蒸煮鱼糜香肠,两个样品之间芳香成分、硫化物及醇类、萜烯类化合物存在差异,发酵鱼糜香肠的风味物质增加,风味更加浓郁。对新型发酵鲢鱼鱼糜香肠的研制进行了研究,技术成果可为发酵水产品加工提供参考价值,加快工业化进程,提升低值水产加工的附加值,具有巨大的经济效益。
参考文献:
[1]密更,李婷婷,仪淑敏,等.人工接种乳酸菌发酵鱼糜的研究进展[J].中国食品学报,2019,19(5):302-312.
[2]ZANG J, XU Y, XIA W, et al. Quality, functionality, and microbiology of fermented fish: a review[J].Critical Reviews in Food Science and Nutrition,2020,60(7):1228-1242.
[3]HUA Q, GAO P, XU Y, et al.Effect of commercial starter cultures on the quality characteristics of fermented fish-chili paste[J].LWT-Food Science and Technology,2020,122:109016.
[4]XU Y, ZANG J, REGENSTEIN J M, et al. Technological roles of microorganisms in fish fermentation: a review[J].Critical Reviews in Food Science and Nutrition,2021,61(6):1000-1012.
[5]WANG Q, LI X, XUE B, et al. Low-salt fermentation improves flavor and quality of sour meat: microbiology and metabolomics[J].LWT-Food Science and Technology,2022,171:114157.
[6]國家卫生和计划生育委员会.食品安全国家标准 食品pH值的测定:GB 5009.237-2016[S].北京:中国标准出版社,2016.
[7]国家卫生和计划生育委员会.食品安全国家标准 食品中水分的测定:GB 5009.3-2016[S].北京:中国标准出版社,2016.
[8]国家卫生和计划生育委员会.食品安全国家标准 食品中灰分的测定:GB 5009.4-2016[S].北京:中国标准出版社,2016.
[9]国家食品药品监督管理总局,国家卫生和计划生育委员会.食品安全国家标准 食品中蛋白质的测定:GB 5009.5-2016[S].北京:中国标准出版社,2016.
[10]国家食品药品监督管理总局,国家卫生和计划生育委员会.食品安全国家标准 食品中脂肪的测定:GB 5009.6-2016[S].北京:中国标准出版社,2016.
[11]TRINDADE M A, KING J L, LICEAGA A M. Production and evaluation of mexican-style chorizo sausage using invasive silver carp (Hypophthalmichthys molitrix) meat[J].Journal of Aquatic Food Product Technology,2019,28(5):531-540.
[12]张根生,赵金娜,刘燕静,等.复配决明胶配比优化及对肉糜肠品质影响[J].中国食品添加剂,2023,34(4):14-22.
[13]许惠雅,张强,王逸鑫,等.不同乳酸菌对发酵草鱼品质的影响[J].水产学报,2022,46(2):289-297.
[14]王博,章智华,王浩,等.镜鲤鱼鱼糜肠发酵过程中品质特性及凝胶特性的变化[J].食品工业科技,2017,38(24):89-94.
[15]VIDIGAL I G, SIQUEIRA A F, MELO M P, et al. Applications of an electronic nose in the prediction of oxidative stability of stored biodiesel derived from soybean and waste cooking oil[J].Fuel,2021,284:119024.
[16]CAI J, ZHU Y, MA R, et al. Effects of roasting level on physicochemical, sensory, and volatile profiles of soybeans using electronic nose and HS-SPME-GC-MS[J].Food Chemistry,2021,340:127880.
[17]李雪倩,赵嘉楠,武思佳,等.乳酸菌发酵人参香肠理化特性及其工艺优化[J].农产品加工,2021(16):26-32.
[18]CRUXEN C E D S, BRAUN C L K, FAGUNDES M B, et al. Development of fermented sausage produced with mutton and native starter cultures[J].LWT-Food Science and Technology,2018,95:23-31.
[19]韦诚,常荣,段珍珍,等.发酵时长对酸肉物理特性及食用安全性的影响[J].食品与发酵工业,2019,45(8):86-92.
[20]杨逸然.短时发酵蒸煮香肠品质变化分析研究[D].天津:天津科技大学,2021.
[21]胡永金.淡水鱼糜发酵及其凝胶形成机理研究[D].无锡:江南大学,2007.
[22]GU Z, LIU S, DUAN Z, et al. Effect of citric acid on physicochemical properties and protein structure of low-salt restructured tilapia (Oreochromis mossambicus) meat products[J].Journal of the Science of Food and Agriculture,2021,101(4):1636-1645.
[23]尹忞強,焦宇知,黄露怡,等.腐生葡萄球菌和植物乳杆菌复配对发酵香肠品质和风味的影响研究[J].中国调味品,2022,47(11):38-43.
[24]庞一扬,余远江,袁桃静,等.腌鱼腌制过程中挥发性成分的变化分析[J].现代食品科技,2020,36(8):281-289.
[25]刘洒洒.臭鳜鱼自然及接菌发酵过程中微生物菌落演化与品质变化规律研究[D].大连:大连工业大学,2018.
[26]刘旭坤.霉鱼加工过程中蛋白质变化对品质影响[D].南昌:江西科技师范大学,2022.
[27]IGLESIAS J, MEDINA I, BIANCHI F, et al. Study of the volatile compounds useful for the characterisation of fresh and frozen-thawed cultured gilthead sea bream fish by solid-phase microextraction gas chromatography-mass spectrometry[J].Food Chemistry,2009,115(4):1473-1478.
[28]蔡瑞康,吴佳佳,朱建龙,等.大黄鱼糟制过程中风味物质及风味活性物质分析[J].中国食品学报,2017,17(2):264-273.
[29]WANG Z, XU Z, SUN L, et al. Dynamics of microbial communities, texture and flavor in Suanzuoyu during fermentation[J].Food Chemistry,2020,332:127364.
[30]STAHNKE L H. Dried sausages fermented with Staphylococcus xylosus at different temperatures and with different ingredient levels-Part II.Volatile components[J].Meat Science,1995,41(2):193-209.
[31]LARROUTURE C, ARDAILLON V, PEPIN M, et al. Ability of meat starter cultures to catabolize leucine and evaluation of the degradation products by using an HPLC method[J].Food Microbiology,2000,17(5):563-570.
[32]石乐乐.不同乳酸菌对发酵香肠品质的影响[D].呼和浩特:内蒙古农业大学,2022.
