孤立性心房颤动致病基因TBX20新突变的发现及功能研究
2024-04-15张道良李宁姜伟峰吴绍辉仇兴标杨奕清
张道良 李宁 姜伟峰 吴绍辉 仇兴标 杨奕清
心房颤动(房颤)在一般人群中的发病率高达2%,可诱发智力下降甚至痴呆、血栓栓塞性脑卒中、急性肾损伤或慢性肾病、急性心肌梗死、心力衰竭、室性心律失常等并发症,甚至心源性死亡[1]。临床遗传研究表明,遗传缺陷是部分房颤的重要分子病因[2]。目前,除了已发现的140多个房颤相关遗传位点外,还发现60多个房颤相关基因,包括编码心脏离子通道、缝隙连接通道、心脏结构蛋白和转录因子蛋白的基因[1-2]。近年来研究发现,心脏转录因子TBX20可以转录激活调节多个房颤致病基因的表达,包括GJA5、NPPA、GJC1和KCNH2基因等[1-2]。本研究将TBX20基因作为房颤的候选致病基因进行研究。
1 对象与方法
1.1 研究对象
选取2015年3月至2017年12月就诊于上海交通大学医学院附属胸科医院的182例汉族孤立性房颤患者作为病例组,其中男性102例,女性80例,年龄32~56岁,平均年龄(53±6)岁。选取236名汉族无房颤健康体检者作为对照组,其中男性131名,女性105名,年龄35~57岁,平均年龄(53±7)岁。2组入选者均经过个人史及家族史回顾、仔细体检、标准心电图检查和心脏超声检查。孤立性房颤的诊断根据国际通用的房颤患者管理指南[3]。病例组中35例(约19%)有房颤家族史,对照组中均无房颤家族史。2组入选对象均无明确的可诱发房颤的环境因素。本研究遵守医学伦理学规范,并经过上海交通大学医学院附属胸科医院伦理委员会的核准。经研究对象知情同意后,收集其临床信息和外周静脉血标本,常规纯化、-20℃冰箱保存其基因组DNA。
1.2 方法
1.2.1 人TBX20基因的体外扩增 使用聚合酶链反应(PCR)仪(美国Bio-Rad公司)扩增人TBX20基因的编码区和剪接位点序列,引物序列见参考文献[4]。以每个入选对象的基因组DNA作模板,应用AccuPrimeTMTaq高保真DNA聚合酶试剂盒(美国Invitrogen公司)及化学合成的上述人TBX20基因的扩增引物,在PCR仪(美国Bio-Rad公司)上对人TBX20基因各片段进行体外扩增。PCR混合液的总体积为50 μL,其中包括10×AccuPrimeTMPCR BufferⅡ(内含dGTP、dATP、dTTP和dCTP各2 mmol/L)5.0 μL、正、反向引物(10 μmol/L)各1.0 μL、AccuPrimeTMTaq 高保真 DNA聚合酶(5 U/μL)0.2 μL、基因组DNA(40 μg/L)2.0 μL、高压灭菌蒸馏水40.8 μL。PCR的温度循环条件设置为:94 ℃预变性20 s,随即进入温度循环36次,每次包括94 ℃变性20 s、62 ℃退火30 s和68 ℃ 延伸1 min,终末68 ℃延伸8 min。PCR产物经1.4%琼脂糖凝胶电泳(80V、45 min)分离后,切胶回收并用GeneJET凝胶DNA回收试剂盒(美国Thermo Scientific公司)进行纯化。
1.2.2 人TBX20基因的PCR测序分析 以上述纯化的PCR产物为模板,使用1条人TBX20基因扩增引物(正向或反向)和 BigDye Terminator v3.1 循环测序试剂盒(美国Applied Biosystems 公司)在PCR仪(美国Bio-Rad公司)上进行测序PCR。测序PCR混合液的体积定为20 μL,其中预混合液 Premix 8.0 μL、正向或反向引物(2 μmol/L)2.0 μL、人TBX20基因片段DNA(30 μg/L)2.0 μL、高压灭菌蒸馏水8.0 μL。测序PCR的条件如文献[5]所述:共30次循环,每1次循环包括95 ℃变性(20 s)、50 ℃退火(15 s)及60 ℃延伸(l min)。测序PCR产物使用BigDye XTerminator 纯化试剂盒(美国Applied Biosystems 公司)进行纯化。纯化后的测序PCR产物在遗传分析仪(美国Applied Biosystems公司)上进行凝胶电泳测序。将测出的人TBX20基因序列与核苷酸数据库(https://www.ncbi.nlm.nih.gov/Nucleotide)中的人TBX20基因序列(登陆号:NM_001077653.2)进行比对分析以发现人TBX20基因突变。如识别出人TBX20基因突变,则PCR测序分析236名对照者的TBX20基因,并且在线检索单核苷酸多态性(SNP)数据库(https://www.ncbi.nlm.nih.gov/snp)和gnomAD数据库(http://gnomad-sg.org/)以明确所发现的人TBX20基因突变的新颖性。
1.2.3 构建人TBX20基因的真核细胞表达质粒 野生型人TBX20基因的真核细胞表达质粒TBX20-pcDNA3.1的构建见参考文献[4]。以野生型人TBX20基因的真核细胞表达质粒TBX20-pcDNA3.1作模板,应用定位诱变试剂盒(美国Invitrogen公司)和1对互补引物(长度为31个碱基、突变点在中心),通过PCR生成Lys236*-突变型TBX20-pcDNA3.1。用DNA酶DpnⅠ(美国Thermo Fisher Scientific公司)切除野生型TBX20-pcDNA3.1模板,并通过测序证实获得Lys236*-突变型TBX20-pcDNA3.1。人KCNH2基因启动子驱动萤火虫荧光素酶表达的KCNH2-luc质粒的构建见参考文献[1]。
1.2.4 人TBX20基因突变体的功能研究 将HeLa细胞接种于24孔细胞培养板,置于细胞培养箱常规培养。借助Lipofectamine 3000(美国Invitrogen公司)将多种表达质粒共转染入HeLa细胞,转染方法见参考文献[1]。每次转染实验用100 ng的空pcDNA3.1质粒(–)或100 ng的野生型人TBX20-pcDNA3.1表达质粒(WT)或100 ng的Lys236*-突变型人TBX20表达质粒(Lys236*)或50 ng的空质粒+50 ng 的WT或50 ng的空质粒+50 ng的Lys236*,同时共转染1.0 μg的人KCNH2-luc和40 ng的pRL-TK 质粒(美国Promega公司)。使用内对照海肾荧光素酶表达质粒pRL-TK平衡每次转染的效率。HeLa细胞转染质粒后48 h进行收集并裂解。借助荧光定量分析仪(瑞士Tecan 公司),应用双荧光素酶(双报告基因)分析试剂盒(美国Promega 公司)分析HeLa细胞裂解液中2种荧光素酶的活性,以萤火虫荧光素酶活性与海肾荧光素酶活性的比值表示靶基因KCNH2启动子的转录活性。
1.3 统计学分析
连续变量参数如研究对象的年龄、靶基因人KCNH2启动子的转录活性等以均数±标准差表示;分类变量参数如研究对象的性别、种族等用数字或百分比表示。2组连续变量参数的比较用Student’st检验(非配对);2组分类参数的比较用Fisher’s精确检验。双侧检验值P<0.05表示差异有统计学意义。
2 结果
2.1 发现人TBX20基因新突变
本研究通过对182例孤立性房颤患者的TBX20基因进行测序分析,在1例51岁的男性散发性孤立性房颤患者中发现了1个TBX20基因杂合无义突变,即NM_001077653.2:c.706A>T;p.(Lys236*)突变。该TBX20基因突变在其他181例孤立性房颤患者和236名无房颤对照者中均未检测出,在SNP或gnomAD数据库中也尚未报道,表明该TBX20基因突变是新发现的突变。该例散发性孤立性房颤患者的TBX20基因c.706A>T杂合突变和1名无房颤对照者的纯合野生型对照DNA序列见图1。
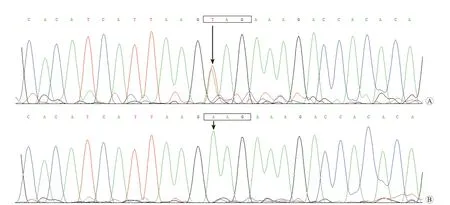
图1 人TBX20基因c.706A>T杂合突变及纯合野生型对照DNA序列
2.2 Lys236*-突变型人TBX20对靶基因KCNH2的转录激活作用丧失
在转染了多种基因表达质粒的HeLa细胞中,100 ng的TBX20和等量(100 ng)的Lys236*对人靶基因KCNH2启动子的转录激活效应分别约为36倍(36.13±2.20)和2倍(2.29±0.67),2组之间的转录激活效应差异有统计学意义(t=25.48,P<0.01);而在同时转染50 ng的TBX20和等量(50 ng)的Lys236*时,所产生的转录激活效应约为18倍(17.71±1.91),显著低于100 ng的TBX20对人靶基因KCNH2启动子的转录激活效应,2组之间差异有统计学意义(t=10.94,P<0.01)。
3 讨论
本研究在1例男性散发性孤立性房颤患者中发现了1种新的TBX20基因杂合无义突变,即NM_001077653.2:c.706A>T;p.(Lys236*)突变。该TBX20基因突变在236名无房颤对照者中未检测出,在SNP或gnomAD数据库中也尚未报道。基于双报告基因定量分析表明Lys236*-突变型TBX20对靶基因KCNH2启动子的转录激活作用丧失,而KCNH2基因变异已被证实可导致多种类型的心律失常,包括房颤、短QT综合征和长QT综合征[6-10]。因此,TBX20基因突变极有可能是该例孤立性房颤患者的分子病因。
人TBX20基因定位于7号染色体7p15-7p14区域,编码1种由447个氨基酸组成的含有T-box的转录因子,属于T-box家族的5号成员[1]。研究发现,TBX20大量表达于胚胎发育期的心脏,且在出生后及成年人的心脏中持续大量表达,对心血管正常发育和适应性重构具有关键调控作用[11]。实验证实,TBX20可以单独调节或与其转录合作伙伴如TBX5、NKX2.5、GATA5或GATA4一起协同调节具有重要作用的心血管相关靶基因如GJA5、NPPA、GJC1和KCNH2的表达,从而影响心血管发育和重构[1,12-14]。此外,已发现GJA5、NPPA、GJC1、KCNH2、TBX5、NKX2.5、GATA5和GATA4基因突变均可诱发房颤[1]。本研究在孤立性房颤患者中发现的TBX20基因功能丧失性突变,表明人TBX20基因单倍型不足是房颤发生的分子病理机制之一。
TBX20基因功能障碍诱发房颤可部分归因于心脏结构和电生理异常。既往研究证实,TBX20基因在胎心发育、内稳态、成年心脏功能和病理生理适应,以及心脏电生理尤其是心脏传导系统功能等方面具有重要作用[11]。心脏传导系统发育不良或稳态失衡可致传导系统功能障碍,从而触发心律失常甚至猝死[1,11,15]。在成年小鼠,特异性敲除心肌Tbx20基因可导致心脏扩大、收缩功能丧失、心脏传导速度降低和严重心律失常[16-17]。此外,已有研究表明TBX20可以选择性地调节KCNH2基因的表达[1,12]。KCNH2基因编码Kv 11.1(hERG),形成快速激活延迟整流K+通道α亚单位(辅助性β亚单位为KCNE2基因编码),而快速激活延迟整流K+通道所产生的心肌动作电位3期复极电流是心肌复极的主要电流之一[17]。Caballero等[12]发现,TBX20基因功能丧失可降低hERG的表达,减少心肌内向整流K+电流,导致心肌动作电位时程延长。经典心脏电生理理论认为,触发和折返是房颤的主要电生理机制,而触发活动可由心肌动作电位时程延长所致的早期后除极所引发[18],因此,TBX20基因功能障碍诱发房颤可能主要与触发活动增加有关。
值得注意的是,既往有报道TBX20基因突变可导致多种不同类型的心血管疾病,包括先天性心脏病如法洛四联症、室间隔缺损、房间隔缺损、房室共同通道、主动脉缩窄、动脉导管未闭、右室双流出道、异常肺静脉连接、心脏瓣膜畸形及扩张性心肌病[1,19]。本研究提示TBX20基因功能丧失性突变可诱发散发性孤立性房颤,从而扩大了TBX20基因突变的表型谱。
总之,本研究识别出1种新的TBX20基因功能丧失性突变,该突变可诱发房颤,为部分房颤的精准防治提供了新的分子靶标。
