高迁移率族蛋白1通过调控自噬因子P62调节心肌细胞纤维化
2024-04-15聂雅琴乌日娜金慧张广平李永明智利薛仕煊娜日格乐
聂雅琴 乌日娜 金慧 张广平 李永明 智利 薛仕煊 娜日格乐
心肌纤维化是多种心脏疾病、进展的重要环节,心肌细胞代谢异常、心肌肥厚、冠状动脉硬化等因素均可导致心脏受损,引起心肌纤维化,造成心脏功能障碍,甚至威胁生命。心肌纤维化主要表现为心肌中胶原纤维过度沉积,胶原浓度和体积分数显著升高,胶原类型不均衡及排列紊乱[1]。心肌纤维化参与各种心血管疾病的发生、进展过程,如充血性心力衰竭、高血压性心脏病、心肌梗死、扩张型心肌病等。此外,在代谢性疾病中也可见到不同程度的心肌纤维化[2]。研究表明,自噬与心肌纤维化密切相关。自噬是溶酶体降解蛋白质的高度保守过程,对机体的生存、分化、发育和稳态至关重要[3]。高迁移率族蛋白1(HMGB1)为高度保守的核蛋白,广泛分布于哺乳动物细胞中且含量丰富,平均10~15个核小体中含有1个HMGB1分子[4]。HMGB1可促进促炎症因子产生,参与细胞增殖、分化、侵袭和自噬等过程[5]。本研究探讨HMGB1通过调控自噬对心肌纤维化产生作用,以期为心肌纤维化的预防及临床诊治提供新方法。
1 材料与方法
1.1 实验材料
人心肌细胞AC16购于同派生物科技股份有限公司细胞库。α-平滑肌肌动蛋白(α-SMA)抗体、Ⅰ型胶原蛋白(CollagenⅠ)抗体购于英国Abcam公司。HMGB1、微管相关蛋白1轻链3(LC3)-Ⅱ/LC3-Ⅰ、P62抗体、磷酸肌醇-3-激酶3(PIK3C3)抗体购于美国Sigma公司。哺乳动物雷帕霉素靶蛋白(mTOR)、磷酸化mTOR(p-mTOR)抗体购于美国Cell Signaling Technology公司。
1.2 细胞培养
AC16细胞使用含10%胎牛血清、100 U/mL青霉素、100 U/mL链霉素的DMEM培养基(完全培养液)培养,置于37 ℃、5%CO2恒温培养箱中,湿度为70%~80%。取生长良好的对数生长期细胞用于实验。
1.3 免疫荧光染色检测AC16细胞α-SMA的表达水平
将AC16细胞接种于12孔板上,待细胞贴壁后,加入不同浓度的HMGB1(0、4、20、100 μg/L),继续培养6 h。每孔加入4%多聚甲醛室温固定10 min后,加入0.5% Triton X-100室温静置10 min。3%牛血清蛋白封闭1 h后,加入α-SMA一抗(稀释比例1︰100),4 ℃孵育过夜,加入山羊抗兔IgG二抗(稀释比例1︰200),避光室温孵育1 h。4’6-二脒基-2-苯基吲哚(DAPI)封片后置于激光共聚焦显微镜下观察并拍照。
1.4 Western blot法检测AC16细胞自噬信号通路蛋白及纤维化因子表达水平
取AC16细胞,RIPA裂解液提取蛋白,BCA法测定蛋白浓度。取蛋白进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳,PVDF转膜,加入LC3、P62、α-SMA、CollagenⅠ、p-mTOR、mTOR一抗,4 ℃孵育过夜,加入羊抗兔IgG二抗,室温孵育2 h。ECL显影,采用Gel-Pro3.0软件分析蛋白的相对表达水平。
1.5 免疫共沉淀法检测P62与α-SMA的作用关系
将细胞培养皿中的培养基丢弃,加入Co-IP裂解液,4 ℃、10 000×g离心30 min,取上清液。按说明书进行操作,将变性后的Input和IP液进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳,采用免疫共沉淀法检测P62与α-SMA之间是否存在相互作用。
1.6 统计学分析
应用SPSS 20.0软件进行统计学分析,计量资料以均数±标准差表示。多组间比较采用单因素方差分析,组间两两比较采用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1 各组AC16细胞中CollagenⅠ和α-SMA的表达水平比较
Western blot检测显示,用不同浓度的HMGB1刺激AC16细胞,AC16细胞中CollagenⅠ与α-SMA的蛋白表达水平呈浓度依赖性升高。组间两两比较显示,各组间CollagenⅠ与α-SMA的蛋白表达水平的差异均有统计学意义(P均<0.01)。见表1、图1。
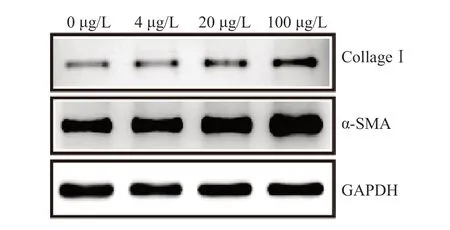
图1 不同浓度HMGB1作用于AC16细胞后CollageⅠ和α-SMA蛋白表达情况
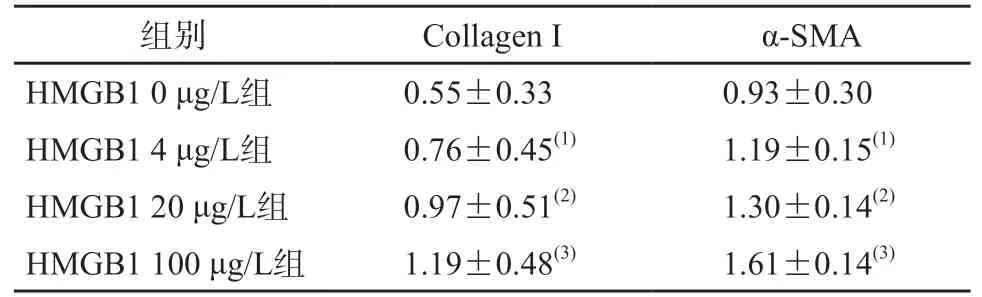
表1 不同浓度HMGB1作用于AC16细胞后Collagen Ⅰ和α-SMA的蛋白表达水平比较
免疫荧光染色显示,HMGB1(100 μg/L)作用于AC16细胞后,α-SMA的表达水平升高。见图2。

图2 免疫荧光染色检测100 μg/L HMGB1作用于AC16细胞后α-SMA的蛋白表达情况
2.2 各组AC16细胞中自噬相关蛋白的表达水平比较
Western blot检测显示,用不同浓度的HMGB1刺激AC16细胞,AC16细胞p-mTOR与mTOR的比值(p-mTOR/mTOR),PIK3C3、不可溶性P62的蛋白表达水平,LC3-Ⅱ与LC3-Ⅰ的比值(LC3-Ⅱ/LC3-Ⅰ)呈浓度依赖性升高,可溶性P62的蛋白表达水平呈浓度依赖性降低。组间两两比较显示,各组间p-mTOR/mTOR,PIK3C3、不可溶性P62的蛋白表达水平,LC3Ⅱ/LC3Ⅰ的差异均有统计学意义(P均<0.01)。见表2、图3。

图3 不同浓度HMGB1作用于AC16细胞后自噬相关蛋白的表达情况
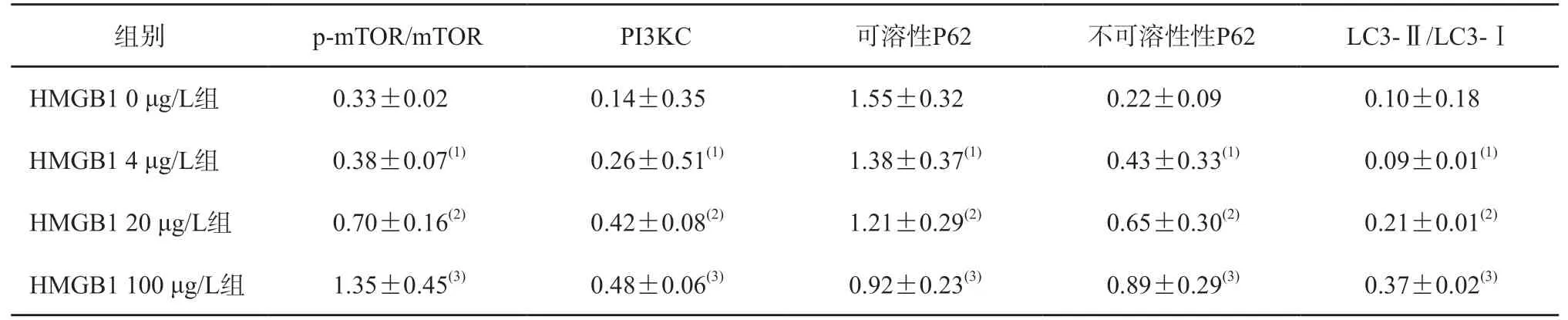
表2 不同浓度HMGB1作用于AC16细胞后自噬相关蛋白的表达水平比较
2.3 P62与α-SMA的关系
免疫共沉淀实验显示,P62与α-SMA存在相互作用。见图4。

图4 AC16细胞中p62与α-SMA的相互作用
3 讨论
心肌纤维化是以细胞外基质(ECM)成纤维细胞异常增殖,胶原过度沉积及异常分布为特征的病理现象。急性心肌缺血及慢性心脏疾病均可导致心脏压力负荷增加,进而促进心肌纤维化的进展[6]。心脏成纤维细胞(CFB)在心肌纤维化中起重要作用。当机体处于稳态时,CFB通过调节ECM的产生维持心脏结构的完整性。在病理条件下,CFB激活、增殖,并分泌过量的ECM蛋白,导致心肌纤维化,引起心律失常、心脏室壁运动减低及心脏重构[7-8]。延缓心肌纤维化有助于改善心血管疾病的预后[9-11],但目前尚无有效预防及治疗方案。
HMGB1为高度保守的核蛋白,在感染或无菌炎症时可从细胞中释放。研究显示,心肌纤维细胞在高糖高脂(HGHL)干预后,HMGB1的表达水平显著增加,提示HMGB1参与HGHL促心脏纤维化过程[12]。张妍等[13]研究发现,阻断HMGB1可减轻大鼠心肌梗死导致的纤维化。在急性血吸虫病导致的肝纤维化中,抑制HMGB1可显著降低肝纤维化水平[14]。上述研究提示,抑制HMGB1可能是治疗组织纤维化的有效途径。为了明确HMGB1对心肌纤维化的作用,我们前期研究用不同浓度HMGB1作用于小鼠原代心肌成纤维细胞,发现HMGB1导致的CollagenⅠ和α-SMA表达水平升高呈浓度依赖性[15]。基于此结果,本研究用不同浓度的外源性HMGB1作用于AC16细胞,结果提示随着外源性HMGB1浓度的增加,AC16细胞中心肌纤维化标志蛋白CollagenⅠ和α-SMA表达水平逐渐升高。
有研究发现,改变自噬水平可以改善心肌纤维化[16]。自噬见于多种心血管疾病,如心肌慢性缺血、心肌纤维化、心脏重构等。自噬可抑制细胞凋亡,减轻组织损伤[17],但过度自噬则导致细胞死亡。因此,只有当自噬活性保持在最佳平衡水平时,才可以保持正常的心血管功能[18]。P62为致癌蛋白,定位于细胞核,当细胞发生自噬时,细胞质中的P62与泛素化蛋白结合,随后与自噬小体内膜上的LC3-Ⅱ蛋白结合形成复合物,并在自噬溶酶体中降解[19]。当自噬受到抑制时,P62的表达水平会明显增加[20],所以P62蛋白是自噬发生的重要标志蛋白。在自噬发生时,胞浆型LC3即LC3-Ⅰ会酶解掉一小段多肽,转变为膜型LC3即LC3-Ⅱ,因此,LC3-Ⅱ/LC3-Ⅰ可反映自噬水平的高低。为了评估自噬在AC16细胞纤维化中的作用,本研究检测AC16细胞中自噬标志性蛋白的表达水平,结果显示LC3-Ⅱ/LC3-Ⅰ增大,提示自噬被激活,LC3-Ⅱ的增加可能是由于自噬溶酶体降解过程受阻。同时,p-mTOR/mTOR、PIK3C3的表达水平显著增加,提示自噬受抑制;可溶性P62的表达水平降低,不可溶性P62的表达水平升高,无论LC3是否发生由Ⅰ型向Ⅱ型的转化,均代表自噬流受到抑制。以上实验结果表明,在高浓度HMGB1作用下,即使AC16细胞中存在更多的LC3-Ⅱ,细胞内的自噬流依然受到抑制。
HMGB1可在不同生理条件下从细胞中释放,参与调节心肌细胞自噬及心肌纤维化[21-22]。Du等[23]研究发现阿霉素可通过促进HMGB1表达,使心肌细胞自噬和凋亡增加,引起心脏损伤。Hu等[24]发现,心肌细胞在缺氧/复氧时,会出现自噬活性的改变,这可能与HMGB1的释放有关。本课题组前期通过免疫荧光共定位和免疫共沉淀实验发现,在HMGB1的作用下,小鼠原代心肌成纤维细胞内α-SMA与P62之间存在相互作用。本研究通过免疫共沉淀实验验证,AC16细胞中内源性的P62与α-SMA之间存在相互作用,可能导致α-SMA在细胞内堆积,并引起自噬流受阻。
本研究证实,外源性HMGB1可抑制AC16细胞中的自噬流,诱导AC16细胞纤维化。抑制HMGB1对心肌细胞的作用,有望成为预防与治疗心肌纤维化的新方法。
