超声引导微波消融治疗腹壁子宫内膜异位症
2024-04-15刘玉江徐瑞芳钱林学
刘玉江,徐瑞芳,钱林学
首都医科大学附属北京友谊医院超声科,北京 100050;*通信作者 徐瑞芳 drsophiaxu@outlook.com
腹壁子宫内膜异位症(abdominal wall endometriosis,AWE)是子宫内膜腺体和间质出现于腹壁的一种最常见的盆腔外子宫内膜异位症[1-2]。大多数AWE与既往子宫手术史相关,如剖宫产、子宫切除术和羊水穿刺等[3]。近年来随着剖宫产人群的不断增加,AWE发病率也明显上升。AWE是一种良性病变,但大多数患者会出现腹壁肿块伴有周期性腹痛或逐渐加剧的月经痛,影响患者的健康和生活质量[4]。因此,对AWE进行准确诊断和有效治疗非常重要。目前对AWE大多采用手术切除和药物治疗,但外科手术切除创伤较大,可能会需要复杂的腹壁修复、皮瓣移植或补片植入[5],造成进一步创伤,且术后易复发,而药物治疗成功率低。因此,临床上迫切需要一种高效的治疗方法消除AWE病变。超声引导下微波消融(microwave ablation,MWA)作为微创技术在全身多部位肿瘤的精准治疗中取得了显著疗效[6-8]。本研究拟采用MWA治疗AWE,并评估其安全性和有效性,为AWE的治疗提供更多选择。
1 资料与方法
1.1 研究对象 回顾性纳入2014年8月—2023年6月在北京友谊医院超声科接受MWA治疗的17例AWE患者共19个病灶,年龄26~42岁,平均(32.6±5.8)岁,所有患者术前均行超声引导下粗针穿刺活检,病理证实为AWE。纳入标准:①育龄期女性,有剖宫产史;②剖宫产瘢痕周围伴有周期性疼痛,月经期加重;③超声显示剖宫产瘢痕周围有病灶结节;④超声引导下穿刺活检及HE染色显示AWE中存在子宫内膜腺体或间质[9-10];⑤超声可于切口附近探及病灶且病灶未突破腹膜。排除标准:①身体状况较差,不能耐受手术;②严重凝血功能障碍或不能停用抗凝药物;③妊娠期或哺乳期女性;④严重心、肝、肾功能不全不能耐受手术或不能配合手术。术前记录患者的年龄、剖宫产次数、剖宫产类型、距离上次剖宫产的时间间隔,以及患者主观症状、周期性或持续性疼痛、触痛和皮肤隆起症状。本研究经本院医学伦理委员会批准(2022-P2-339-01),患者均签署知情同意书。
1.2 仪器 超声仪器采用日立Ascendus 和迈瑞Resona R9彩色多普勒超声诊断仪,使用L12-5型高频线阵探头(日立)和L9-3高频线阵探头(迈瑞)。治疗前后使用超声造影(CEUS)评估病灶范围和血液灌注情况,判断消融是否彻底,使用声诺维(SonoVue)造影剂(Bracco公司)。微波消融仪采用南京亿高微波消融治疗仪器,内置水冷循环系统,工作频率2 450 MHz,消融功率10~50 W。术前使用18G全自动活检枪(巴德公司)进行活检。
1.3 治疗方法 术前长期服用抗凝药物的患者需停药1周,治疗后继续停药3 d。在行MWA前对病灶进行常规超声与CEUS。记录待消融病灶的大小、位置、形状、深度、回声、边界和血流情况。病灶测量包括病灶最大径(d1)和垂直最大径切面的两径线大小(d2,d3),并计算病灶的初始体积。病灶体积计算方式:V=π/6×d1×d2×d3。
MWA过程中患者取仰卧位,腹部完全暴露。消毒铺巾后,使用1%利多卡因行局部浸润麻醉。消融过程中,保持病灶与皮肤及肌肉等重要组织的安全距离,以保护重要组织免受热损伤。为了防止皮肤及深部肌层组织灼伤,消融前需在病灶与危险部位之间注入2%利多卡因(5 ml)和0.9%生理盐水(25 ml)的混合液,以形成液体隔离区。消融所用功率为10~50 W,超声引导消融针刺入病灶内,在结节内部用较高功率(30~50 W)提高消融效率,靠近危险部位则使用较低功率(10~20 W)以降低热损伤风险,消融范围包括病灶及病灶周边0.5~1.0 cm的正常组织以完整消除病灶并降低复发风险。对于实性为主病灶,可直接进行MWA;对于混合性或囊性为主病灶,需在消融前抽出病灶内液体。在超声引导和实时动态监视下,将微波针精准插入目标病灶内开始治疗,随着微波能量的释放,病灶内出现气化强回声。通过多点移动消融,使气化高回声区完全覆盖整个AWE病灶,彩色多普勒显示病灶内无血流信号,可暂时中止消融,随后进行CEUS检查,评估病灶是否消融彻底,必要时补充消融。在整个手术过程中密切监测患者生命体征,记录MWA持续时间、功率以及与治疗相关的不良事件,如疼痛、发热、治疗区域感染以及实际或潜在的损伤等。
所有患者在接受MWA治疗后1周内需报告术后不适或不良反应,并在患者在消融后3、6、12个月返回门诊接受常规超声、彩色多普勒超声和CEUS检查。检查病灶的大小、回声和血流情况,并计算病灶体积,根据病灶体积缩小率(volume reduction rate,VRR)评估治疗效果。VRR(%)=[(治疗前体积-随访体积)/治疗前体积]×100%。记录患者术前和术后的疼痛评分,采用视觉模拟评分量表(visual analogue scale,VAS)[11-12]评价疼痛程度,由轻到重为0~10分,分值越高表示疼痛越严重。
1.4 统计学分析 采用SPSS 25.0软件。符合正态分布的计量资料用±s表示,采用配对样本t检验比较;非正态分布的计量资料采用Wilcoxon秩和检验。计数资料以例数表示。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 17例AWE患者共19个病灶中,15例单发,2例均有2个病灶。病灶最大径1.6~4.2 cm。所有患者均有一次剖宫产史,剖宫产切口类型为横切。剖宫产与首次出现AWE症状的时间间隔为14~46个月,平均(4.56±16.72)个月。
2.2 消融术后超声特征 17例AWE患者超声检查显示在腹壁内可见低回声病灶(回声低于周围脂肪组织),其中16个病灶呈实性,3个病灶呈囊实性。超声检查显示19个病灶中12个局限于皮下脂肪组织,2个病灶位于肌肉层,5个病灶同时侵犯脂肪层和肌层。消融术前CEUS显示所有病灶均有轻微灌注,呈均匀或不均匀低增强。消融术后即刻行CEUS显示结节内无造影剂填充,表现为黑洞征,提示结节的血液灌注消失,消融治疗成功(图1A、B)。
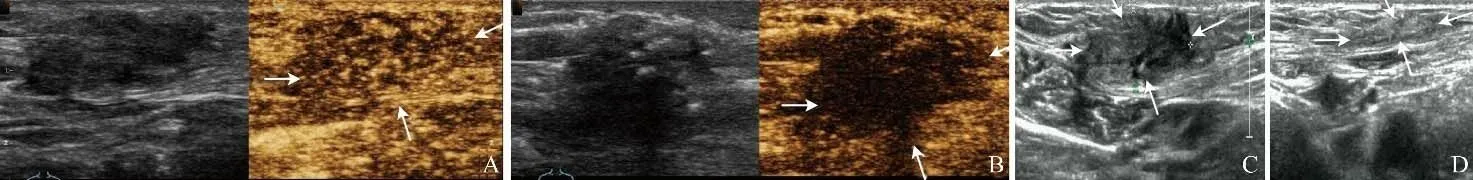
图1 女,36岁,MWA治疗前后超声声像图。A.术前CEUS示病灶呈均匀低增强(箭);B.术后病灶内无造影剂填充,提示消融完全(箭);C.术前病灶大小为2.32 cm×1.82 cm×1.04 cm(箭);D.术后12个月随访时病灶缩小为1.06 cm×0.86 cm×0.34 cm(箭),VRR 92.94%,腹壁结构基本恢复正常
2.3 治疗效果 17位患者19个病灶在接受治疗后病灶体积不断缩小,术前平均体积为(7.46±5.82)ml,术后3、6、12个月的平均体积[(4.32±2.76)ml、(2.47±1.68)ml、(1.72±1.16)ml]与术前相比差异均有统计学意义(t=0.423、0.198、0.556,P=0.005、0.001、0.002),平均VRR 分别为(46.18±24.36)%、(61.43±18.72)%、(74.25±13.26)%。超声检查发现部分患者被AWE病灶破坏的腹壁结构基本恢复正常(图1C、D)。随访期间对原病灶区域行CEUS检查显示病灶范围明显缩小,内部无造影剂填充,提示病灶出现凝固性坏死,并且体积减小。
患者治疗前VAS评分为(5.26±2.63)分,治疗后3、6、12个月随访时VAS评分[(2.23±1.05)分、(1.56±0.82)分、(0.62±0.33)分]与术前相比,差异有统计学意义(t=0.500、0.310、0.210,P=0.002、0.004、0.005)。术后3个月开始,患者腹部周期性疼痛症状均明显减轻甚至消失。在术后12个月随访中,所有患者均未出现疼痛复发。
2.4 术后并发症 术后1周内3例患者出现轻度皮肤热痛,间断冰敷后缓解。1例患者治疗区域出现皮肤烫伤且伴有感染,与患者过度肥胖、进针点位于皮肤褶皱处及消毒不彻底有关,经过多次彻底消毒换药和口服抗生素治疗后1个月基本恢复正常。所有患者未出现其他严重并发症。
3 讨论
AWE是一种常见的妇科疾病,其特征是在腹部切口瘢痕组织中出现子宫内膜渗透,常继发于腹腔镜切口、疝修补和剖宫产手术[13-15]。目前临床上治疗AWE的方法主要包括药物治疗[7-9]、外科手术切除[5,9-10]和各种微创技术。随着人们对微创技术的认可,越来越多的医师尝试使用高强度聚焦超声消融[15-16]、影像引导的冷冻消融[17-18]和热消融技术等[19-21]治疗各类实性肿瘤。本研究结果显示MWA治疗AWE安全有效。
3.1 AWE热消融疗效 本研究使用超声引导经皮MWA治疗AWE,17例患者(19个病灶)在治疗后病灶体积随时间延长呈进行性缩小,术后随访时病灶体积与术前相比均有显著差异,1年后最终VRR可达74%以上。杜琳瑶等[22]报道使用超声引导下射频消融治疗11例AWE患者,术后12个月所有结节最终完全消失,VRR可达100%。王凯等[23]对28例AWE患者(36个结节)行MWA治疗,术后随访6个月,VRR可达82%。本研究与既往研究结果均显示热消融治疗AWE疗效显著,但VRR略低于既往研究,可能与本研究纳入病灶体积明显大于上述研究有关,本研究病灶术前平均体积为7.46 ml,而上述研究术前平均体积分别为2.86 ml及3.01 ml,本研究病灶长期VRR尚待进一步随访观察。本研究与既往研究[22-23]结果一致,所有患者随访期间均未出现复发,但随访时间较短,MWA的长期疗效有待进一步观察。
本研究所有患者的腹壁周期性腹痛最终均得到明显减轻甚至消失,治疗后随访期间VAS评分较治疗前均显著降低,大部分患者术后3个月起腹部周期性疼痛症状得到明显改善。杜琳瑶等[22]研究显示术后3个月开始患者疼痛VAS评分明显降低。王凯等[23]研究显示术后6个月腹壁疼痛症状明显缓解、VAS评分明显下降,治疗总有效率为100%。本研究结果与上述研究基本一致,证实MWA治疗AWE疗效明确,具有较好的应用价值。
3.2 AWE热消融治疗的安全性 本研究中仅3例患者术后出现轻微皮肤热痛,间断冰敷后缓解,1例患者出现皮肤烫伤继发感染。杜琳瑶等[22]根据国际介入放射学会(society of Interventional Radiology,SIR)分级标准对术后并发症进行分级,仅1例术后出现皮肤热痛、轻微水肿,为SIR B级,未予处理,1 d后即自行恢复。王凯等[23]研究显示所有患者均未出现严重并发症,术后47%的患者出现术区疼痛,冰敷后1 d内即可缓解。本研究中出现1例皮肤烫伤患者,为相对严重并发症,术后分析其原因与患者过度肥胖、病灶范围大、且进针点位于皮肤褶皱处术后护理不到位有关,经对症治疗1个月后基本恢复正常。上述研究均证实热消融治疗AWE安全性较好,并发症少,未出现肠瘘等严重并发症。
3.3 AWE热消融治疗技术要点 对AWE进行热消融治疗的技术关键在于充分消融的同时尽量避免损伤周围正常组织。本研究注重使用超声实时动态引导和水隔离技术保护相邻的皮肤、肌肉和腹腔内肠道结构。消融过程中在超声引导下对病灶浅方和深方分别注射充分的液体隔离带,并要求隔离带厚度持续≥1 cm。另外在消融时可降低功率,使用10~20 W低功率进行消融,也可以有效保护皮肤和肠管。对于体积大、范围广的病灶,可采用分次消融的方法以降低热消融后病灶脂肪液化坏死和炎症的发生率[22]。
3.4 本研究的局限性 热消融治疗AWE存在一定的局限性,对于AWE病灶范围过大甚至突破腹膜及腹壁皮肤不完整的患者,不适合行热消融治疗,应选择外科手术干预。此外,本研究是单中心回顾性研究,纳入受试者数量较少,随访时间较短,且未进行对照研究。未来还需开展多中心、前瞻性随机对照研究,纳入更多患者并延长随访时间验证这项技术的安全性和有效性。
总之,MWA治疗AWE安全有效、创伤小、可重复性好、并发症少,能够显著改善患者的临床症状,避免不必要的外科手术,值得在临床推广。
