治疗前18F-FDG PET/CT 影像组学特征在弥漫大B 细胞淋巴瘤预后评估中的增益作用
2024-04-15孟晓琳潘越崔景景孙树伟周晖王瑞民
孟晓琳,潘越,崔景景,孙树伟,周晖,王瑞民*
1.解放军总医院第一医学中心核医学科,北京 100853;2.联影智能医疗科技有限公司,北京 100094;*通信作者 王瑞民wrm@yeah.net
弥漫性大B 细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是非霍奇金淋巴瘤中最常见的类型,约占30%~40%[1]。其中50%~60%的患者通过基于利妥昔单抗的治疗方案R-CHOP得到有效缓解,但部分患者仍会发展为难治/复发类型,预后差[2-3]。因此,及早准确识别此类患者并制订个体化治疗方案是提高预后生存的关键。国际预后指数(international prognostic index,IPI)是目前应用最广泛的预后预测评分[4],但仍有不良预后无法准确识别。为弥补这一局限性,临床上将18F-FDG PET/CT作为预后评估和治疗的常规工具[2]。PET/CT的常用代谢参数,如标准化摄取值、肿瘤代谢体积(metabolic tumour volume,MTV)、总糖酵解量(total lesion glycolysis,TLG)等,在多种疾病的诊疗过程中具有应用价值[5-7],但在反映肿瘤异质性方面的能力有限。人工智能飞速发展衍生出的影像组学技术可以从定量医学成像中提取反映肿瘤异质性的潜在特征,并提供一种有效的方法对患者进行风险分层和辅助制订治疗决策[8],有望弥补临床指标及PET/CT常用代谢参数的不足。
随着多种新型药物的问世,通过影像资料对患者重新进行危险分层并精准治疗的研究层出不穷,本课题组既往通过传统临床、影像资料建立模型[9],为了更好地改善DLBCL患者预后,本研究拟探讨DLBCL患者治疗前18F-FDG PET/CT影像组学特征对无进展生存期(progression free survival,PFS)及总生存期(overall survival,OS)的预测价值,并分析影像组学特征、代谢参数和临床因素构建联合模型的增益效能。
1 资料与方法
1.1 研究对象 回顾性分析2016年1月—2018年12月解放军总医院第一医学中心135例DLBCL患者治疗前的18F-FDG PET/CT资料。男66例,女69例,年龄14~89岁,平均(55.0±15.4)岁。纳入标准:经病理证实为DLBCL;经一线化疗方案R-CHOP(利妥昔单抗+环磷酰胺+长春地辛+多柔比星+泼尼龙)治疗;治疗前行18F-FDG PET/CT。排除标准:临床或影像学数据集不完整;合并或既往有其他癌症类型;不能配合临床随访。
收集患者性别、年龄、病理Hans分型、美国东部肿瘤协作组(eastern cooperative oncology group,ECOG)评分[9]、乳酸脱氢酶、结外病变个数、B症状(在排除其他原因后,患者体温≥38℃且持续3 d以上、盗汗、6个月内体重降低>10%)、Ann Arbor分期[10]、IPI评分[4]等临床资料。本研究经本院医学研究伦理审查委员会批准(〔2007〕临审第029号),受试者均知情同意。
采用电话和(或)门诊随访,每6个月1次,直到患者死亡或研究截至2023年6月。PFS定义为首次治疗至第一次复发、进展、任何原因死亡或最后一次随访的时间。OS定义为首次治疗至任何原因死亡或最后一次随访的时间。
1.2 PET/CT 使用GE Discovery 710 和Siemens Biograph 64 TruePoint PET/CT。患者空腹4~6 h,静脉注射18F-FDG 4.44~5.55 MBq/kg后采集图像。扫描范围为颅顶至大腿根部,PET发射扫描均为2 min/床位。CT图像扫描参数:管电压120 kV,管电流100 mA,螺距1 mm。图像经迭代法重建后获得冠状位、矢状位和横断面图像(图1)。

图1 男,64岁,ⅣB期DLBCL,18F-FDG PET/CT显像
1.3 影像组学流程及方法 使用uAI Research Portal软件(上海联影智能医疗科技有限公司)。先使用标准化摄取值阈值分割工具半自动生成PET图像的感兴趣区(ROI),再由2名分别有8年(医师1)和5年(医师2)工作经验的核医学科医师进行手动调整,尽可能标注患者所有淋巴瘤病灶作为ROI。使用该软件组学模块提取影像组学特征,同时测量并计算每例患者PET图像的MTV、TLG。将135例患者以8∶2随机分为训练集108例与测试集27例,再将训练集以8∶2分为训练集86例和验证集22例进行模型构建,使用测试集进行模型的独立测试。使用Z分数归一化方法对识别出的特征进行标准化,标准化后的数据符合正态分布。用单因素COX回归及最小绝对收缩选择算子回归算法进行特征筛选。将筛选出的特征乘以相应加权系数后,求和计算影像组学评分(Radscore)。
1.4 模型构建 利用Radscore建立影像组学模型。将临床指标及传统代谢参数(年龄、乳酸脱氢酶、B症状、ECOG、Ann Arbor分期、结外病变个数、MTV、TLG)纳入单因素及多因素COX回归分析,得到预测DLBCL预后的独立因子并构建传统模型。结合临床指标、传统代谢参数及Radscore建立联合模型。为量化模型的判别性能,使用来自训练集的公式和cut-off值在验证集及测试集中分别进行内部及外部测试。
1.5 统计学分析 采用R 4.3、SPSS 26.0软件。训练组、验证组及测试组的临床信息差异采用χ2检验。采用单因素、多因素Cox回归分析确定OS和PFS的独立预测因素。通过受试者工作特征(ROC)曲线确定Radscore判断终点事件发生的cut-off值,并通过曲线下面积(AUC)评价其区分度。用Kaplan-Meier法行生存分析,基于Log-rank检验判断两组的生存率差异。计算C-index、绘制时间依赖的ROC曲线、决策曲线(DCA)验证预测模型的效能。通过Delong检验比较不同模型C-index的差异。基于最佳模型绘制列线图及校准曲线观察预测结果与实际情况的符合程度。P<0.05为差异有统计学意义。
2 结果
2.1 临床资料 训练集、验证集及测试集患者基线资料差异均无统计学意义(P>0.05),见表1。随访后59例患者疾病复发或进展,40例患者在中位随访时间(70个月)后死亡,发生进展和死亡的比例分别为43.7%(59/135)和40.0%(54/135)。
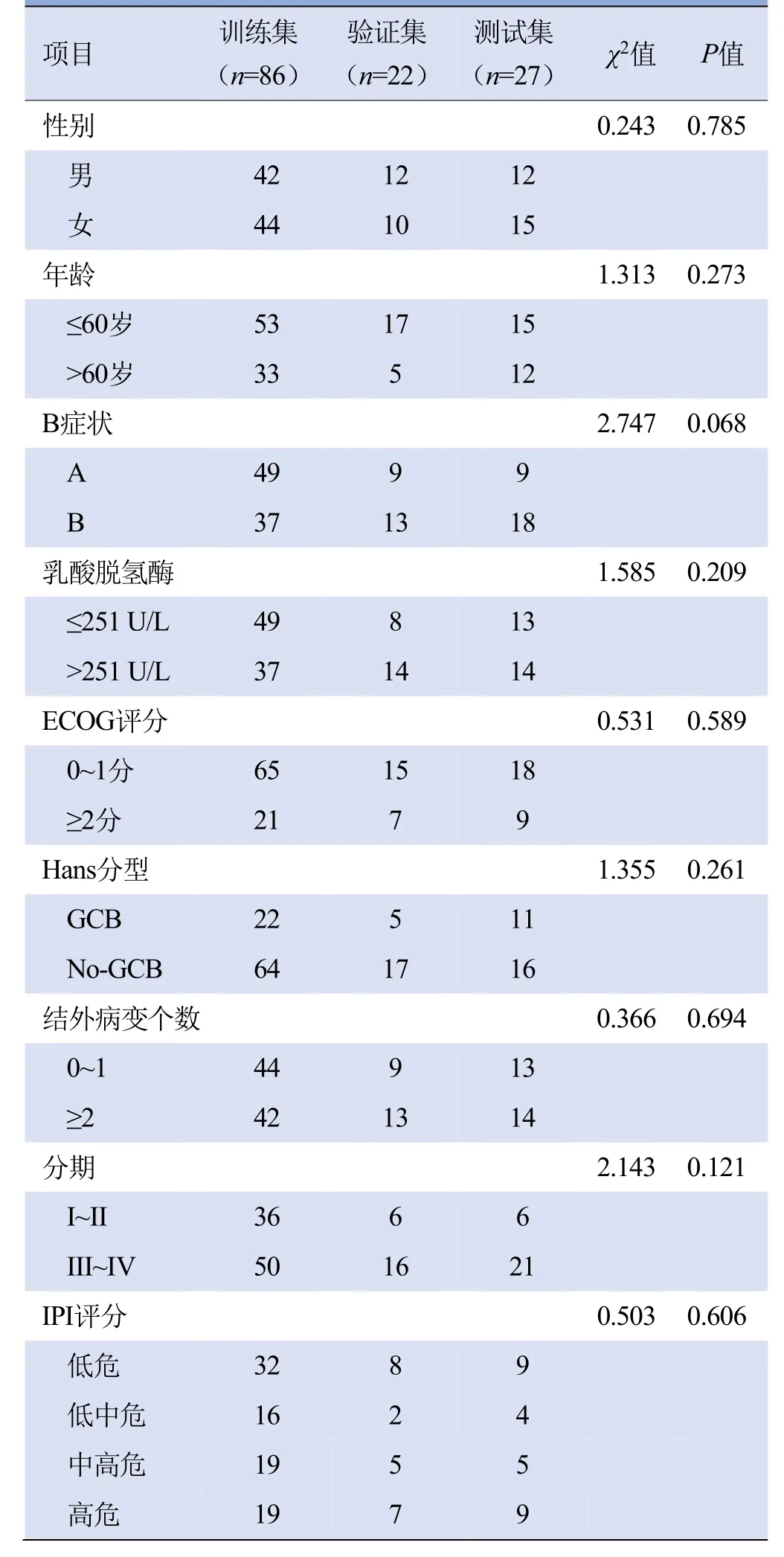
表1 训练集、验证集、测试集患者临床资料比较(例)
2.2 影像组学特征提取、筛选及Radscore构建 对患者的PET图像进行影像组学特征提取,获得2 264种特征,最后筛选出与OS相关的10个影像组学特征及与PFS相关的6个影像组学特征。分别计算Radscore,即特征和系数乘积之和。
ROC曲线分析显示OS和PFS的Radscore在训练集的cut-off值均为-0.119,敏感度分别为0.886、0.806;特异度分别为0.843、0.800;AUC分别为0.919、0.873;且测试集、验证集的AUC均在0.75以上。按上述cut-off值分组,结果显示高、低风险组患者死亡(进展)情况差异有统计学意义(P<0.05),见图2、3。

图3 DLBCL患者OS不同Radscore的生存曲线。A:训练集;B:验证集;C:测试集
2.3 单变量和多因素分析 单因素分析显示,传统预后因素中年龄、B症状、乳酸脱氢酶、ECOG评分、结外病变个数、分期、IPI评分、MTV、TLG与PFS和OS相关。将以上预后因素纳入多因素分析中,得出IPI评分、TLG与DLBCL预后独立相关,见表2、3。
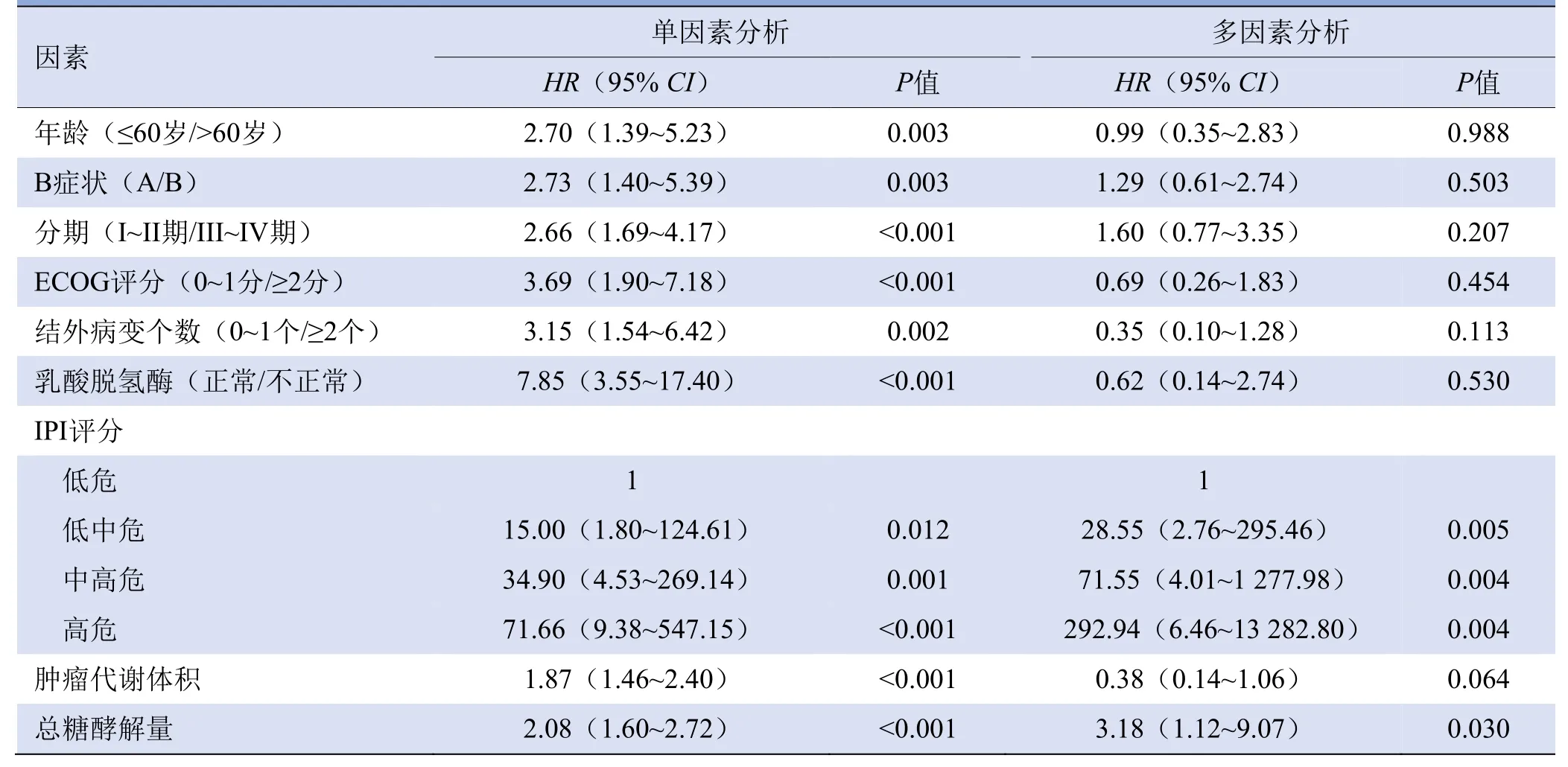
表2 DLBCL患者PFS的单因素及多因素COX回归分析

表3 DLBCL患者OS的单因素及多因素COX回归分析
2.4 预测模型构建及评估 将多因素分析中的独立预测因子(IPI评分、TLG)构建传统因素模型,Radsocre构建Radscore模型,结合前2个模型中所有因素构建联合模型。
对于PFS和OS,在训练集中,联合模型的C-index值分别为0.847、0.869,与传统模型(0.818、0.833)和Radscore模型(0.802、0.848)相比差异无统计学意义,见表4、图4。各模型预测1、3、5年PFS的C-index分别为:传统模型:0.87、0.91、0.91;Radscore模型:0.86、0.87、0.88;联合模型:0.90、0.93、0.94,其中Radscore模型与联合模型(P=0.160、0.032、0.043)、传统模型和联合模型(P=0.212、0.036、0.034)预测3、5年PFS的C-index差异有统计学意义(Z=0. 962 1~2.133 3)。各模型预测1、3、5年OS的C-index分别为:传统模型:0.82、0.88、0.90;Radscore模型:0.85、0.88、0.90;联合模型:0.87、0.91、0.94,其中Radscore模型与联合模型(P=0.578、0.040、0.027)预测3、5年OS的C-index差异有统计学意义,传统模型和联合模型(P=0.024、0.037、0.025)预测3个时段OS的C-index差异有统计学意义(Z=2.050 6~2.253 9)。DCA分析显示,在对PFS和OS的预测中,联合模型的净收益均最大,见图5。
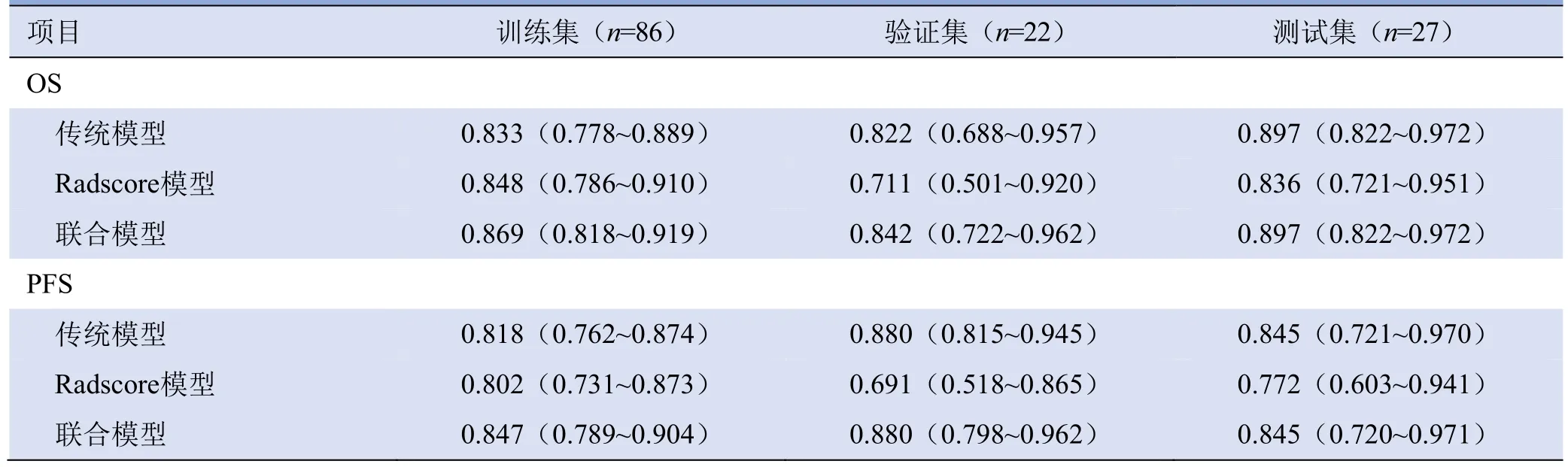
表4 训练集、验证集、测试集C-index(95% CI)结果
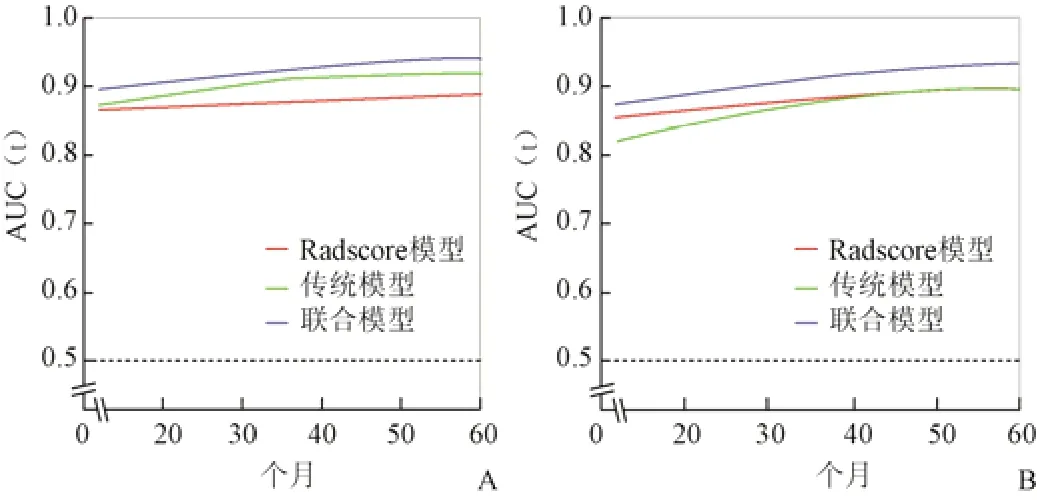
图4 AUC对比3种模型的预测效能。A:PFS;B:OS

图5 3种模型的决策曲线分析。A:PFS;B:OS
2.5 预测列线图的建立与验证 根据联合模型构建列线图(图6),校准曲线见图7。该列线图对PFS和OS的实际观测值与真实值一致性良好。

图6 联合模型预测DLBCL患者预后列线图。A:PFS;B:OS

图7 校准曲线验证列线图的效能。A:PFS;B:OS
3 讨论
3.1 传统指标对DLBCL预后的预测 IPI是结合系列的临床参数(年龄、分期、结外病变数量、ECOG、乳酸脱氢酶)而建立的评分系统,是应用最广泛的DLBCL预后评分系统[11]。多项研究证明IPI是预后的独立预测指标[12],与本研究结果一致。影像评估研究中,MTV和TLG等基于PET传统定量参数,反映肿瘤的代谢负荷,可作为DLBCL的预后生物标志物提供额外的重要信息[13-15]。既往研究表明MTV、TLG是预后的独立预测因素[16-17],本研究也证明TLG是独立预后因素,而未得出MTV是独立预后因素,可能是勾画ROI的方式不同所致。
3.2 Radscore有效预测DLBCL患者预后 随着影像组学的发展,从医学图像中提取的影像组学特征能够在肿瘤细胞和遗传水平提供关于肿瘤异质性的额外信息[18]。PET图像影像组学对DLBCL预后的预测价值目前已有一定数量的研究。Aide等[19]评估132例DLBCL患者预处理PET影像组学特征预测预后的能力,发现长区域高灰度强调是2年无事件生存的唯一独立预测因子(HR=2.84),AUC=0.76。Lue等[20]从171例DLBCL患者中提取80个基于PET的放射组学特征,发现灰度游走矩阵与PFS(HR15.7)和OS(HR8.64)独立相关。上述研究仅针对某一影像组学特征与DLBCL患者预后生存的关系进行分析,最新研究显示,利用Radscore对DLBCL患者进行预后预测能够得到更好的结果[21-22]。因此,本研究选取多个影像组学特征构建Radscore并勾画DLBCL患者绝大多数病灶。经ROC曲线评估Radscore具有较好的区分度。基于ROC曲线得出的cut-off值对训练组进行危险分层,Kaplan-Meier曲线显示高、低危组生存情况有显著差异。因此,本研究构建的Radscore有望成为改善DLBCL患者预后的有力指标。
3.3 模型构建与列线图的绘制 本研究不仅包括大多数研究训练集训练模型及验证集调整参数的模型建立过程[20,23],还增加了测试集进行外部测试,且测试结果较好,验证了模型的准确度。本研究构建的3组模型中,联合模型对3、5年PFS及OS的预测性能均优于传统模型、Radscore模型,再次肯定了Radscore的增益作用。DCA结果也显示联合模型临床净收益最大。本研究结果表明联合模型更适合预测个体生存,显示了影像组学特征对DLBCL预后预测的增益作用。基于联合模型绘制列线图,其中包括IPI评分、TLG、Radscore 3个指标,每个指标的赋值均对应顶部的分值,3个指标相加的总分值对应底部预测1、3、5年的生存或进展情况。利用校准曲线验证列线图对预测值与实际值的一致性,结果表明对3、5年生存或进展情况的预测效果较好,而对1年的预测效果差,这可能是数据量较少所致。
3.4 本研究的局限性 由于为回顾性分析,存在选择偏倚;在单中心数据的基础上建立模型并进行验证,缺乏外部模型验证,未来需在多中心研究中进一步探索;DLBCL分子生物、基因学研究进展对于预后评估及潜在发现新的治疗靶点至关重要,如双、三打击淋巴瘤等预后不良类型的影像组学评估[24],有待进一步研究[25]。总之,本研究系统分析了影像组学特征构建的Radscore模型预测DLBCL患者生存结果的效能,结合Radscore的联合模型为DLBCL患者预后评估起到增益作用。其中基于联合模型绘制的列线图有望成为一种简单、方便的评估方法,可以应用到临床实践中,有助于患者个体化治疗方案的制订。
