一株耐盐高效脱氮微生物的筛选和鉴定
2024-04-15伏春燕阎佩佩张亨商延高庆涛李霞刘雪兰
伏春燕 阎佩佩 张亨 商延 高庆涛 李霞 刘雪兰

摘 要:随着养殖污水排放量的增加,降低养殖污水中氮素水平,防止水体富營养化,已经成为当今水环境污染防治的热点问题。为了筛选出具有耐盐高效脱氮作用的微生物,通过选择性培养基结合极限稀释法以及平板划线法,从6个不同样本中筛选到了7株耐盐脱氮微生物,通过对这些微生物脱氮效率的复筛,得到一株脱氮效果最好的菌株(A1),通过表观分类鉴定、生理生化鉴定及测序分析相结合获得可靠的鉴定结果。经鉴定,菌株A1与盐单胞菌属(Halomonas)相似度最高,在30 g/L盐浓度条件下氨氮去除率达到38.33%。通过对菌株进行相关性质及影响因素的研究,确定了菌种脱氮的最适温度为25 ℃,最适pH为5。
关键词:氨氮;脱氮微生物;耐盐;盐单胞菌属
近年来,随着城市化进程的迅速发展,以及工业、农业等活动的加快,水体中的氮素污染现象日益严重,危及到人类及牲畜的饮水问题,其中养殖污水又是氮素污染的主要原因之一[1]。畜禽养殖污水中的大量含氮(尤其氨氮)、磷、有机物等污染物,尤其是污水中氮素的去除,若不经过合理处理,其进入水体将引起水体富营养化,必将对水体生态环境造成极大破坏[2-5]。因此,水中氮素的去除已成为当今水环境污染防治的热点问题。养殖污水成分复杂,存在许多有机盐、无机盐、抗生素、尿素、大分子营养物质等,此种复杂条件对生物脱氮提出了更高的要求[6-11]。因此,针对养殖污水中高盐的特点,对6个样品进行耐盐脱氮菌的筛选,旨在筛选出在高盐条件下仍具有较高脱氮能力的微生物,为脱氮微生物的菌落筛选及生存条件研究等方面提供理论基础。
1 材料与方法
1.1 材料
1.1.1 样品来源 A样品来自东营盐碱农田土壤,已经过预处理,菌样足够;B样品来自山东省农业科学院长期运行的人工湿地基质;C样品来自济南污水处理厂的活性污泥;D样品取自水田(水稻田)土壤;E样品为旱地(棉花地)土壤;F样品为河流底泥。
1.1.2 培养基 (1)富集培养基:牛肉膏3 g/L,蛋白胨10 g/L,NaCl 30 g/L,pH 7.0~7.2,121 ℃灭菌30 min。
(2)分离培养基:葡萄糖 5 g/L,(NH4)2SO4 0.5 g/L,K2HPO4 1.0g/L,MgSO4·7H2O 0.3 g/L,NaCl 30 g/L,CaCl2·H2O 0.03 g/L,FeSO4·7H2O 0.03 g/L,pH 7.2~7.4。加入20%的琼脂制成固体培养基,用于菌种的分离纯化。其中以(NH4)2SO4作为氮的来源[12]。
(3)种子培养基(液):LB培养基:LB粉25 g/L、NaCl 30 g/L、pH 7.2 斜面培养基加2%琼脂[13]。
(4)好氧反硝化培养基(DM):葡萄糖5 g,KNO3 0.5 g,NaNO2 0.5 g,KH2PO4 1 g,MgSO4 0.2 g,微量盐溶液2 mL,蒸馏水1 L,pH 7.2,固体培养基加2%的琼脂[14-15]。
(5)微量盐溶液:乙二胺四乙酸50 g,ZnSO4 2.2 g,CaCl2 5.5 g,CuSO4·5H2O 1.57 g,MnCl2·4H2O 5.56 g,FeSO4·7H2O 5 g,CoCl2·6H2O 1.61 g,蒸馏水1 L,pH 7.0~7.2[16]。
(6)脱NH4+-N发酵培养基(液):葡萄糖 5 g/L,(NH4)2SO4 0.7g/L,NaCl 30 g/L,FeSO4·7SO4
0.05 g/L,K2HPO4 0.5 g/L,MgSO4·7H2O 0.25 g/L,pH 7.2~7.4[17-18]。
1.2 试验方法
1.2.1 细菌的筛选分离 (1)耐盐脱氮微生物的筛选:取样品各2 g,分别接入无菌水中,于30 ℃ 180 rpm条件下振荡培养3 h,静置,取细菌悬液5 mL转入100 mL富集培养基中,在相同条件下培养48 h,得到富集菌液;制备一系列该培养液的稀释液(10-1、10-2、10-3、10-4、10-5、10-6),取100 ?L涂布在倒置的分离培养基中,于30 ℃下恒温培养48 h,每天观察记录菌体长势。挑取菌落形态各异的菌株,进行划线分离;经多次划线分离后,得到纯菌株。
(2)好氧反硝化筛选:将纯化出的菌株通过划线方式接入好氧反硝化培养基,筛选出具有好氧反硝化能力的菌株[19]。
(3)高效耐盐脱氮微生物筛选:将纯化后的各菌株分别接入富集培养基活化1 d,再取5 mL接入100 mL分离培养基中,于30 ℃ 180 rpm条件下摇床培养48 h,分别于24 、48 h取样通过纳氏比色法测定培养基中 NH4+-N的浓度,计算总脱氮率和氨氮降解率。每个菌种设三组。根据总脱氮率和氨氮降解率,挑选脱氮效果好且生长速度快的菌株进行下一步试验。
1.2.2 菌株保藏 选择转化率最高的菌株,作为目的菌株,接种于LB斜面培养基上,4 ℃冰箱保藏。
1.2.3 耐盐高效脱氮微生物适宜培养条件研究 (1)温度对菌株的影响:取保存的菌种以5%(V/V)的接种量接种至NH4+-N发酵培养基中,分别置于20 、25 、30 、35 ℃ 和40 ℃,150 rpm摇床震荡培养1 d,检测样品氨氮含量和菌液光密度[20]。
(2)pH对菌株的影响:分别配制pH值为4.0、5.0、6.0、7.0和8.0的脱NH4+-N发酵培养基,取保存的菌种按5%(V/V)的接种量接种于上述培养基中,30 ℃、150 rpm摇床震荡培养,1 d后检测样品氨氮含量和菌液光密度[21]。
(3)盐度对菌株的影响:取保存的菌种,按5%(V/V)的接种量分别接种至盐度值为5、10、20和30的脱NH4+-N发酵培养基中,30 ℃、150 rpm摇床震荡培养,1 d后检测样品氨氮含量和菌液光密度[22]。
1.2.4 耐盐高效脱氮微生物鉴定 包括菌株形态观察、革兰氏染色、16S rRNA测序和分析、生理生化鉴定等。16S rRNA委托山东力戈科技公司进行,序列同源性分析在NCBI采用blast软件检索,参考序列取自Genbank数据库。生理生化鉴定包括甘油试验、葡萄糖糖发酵试验、H2S试验、硝酸盐还原试验、靛基质试验、MR-VP试验、明胶液化试验[16]。
2 结果与分析
2.1 耐盐脱氮微生物的筛选结果及其菌落特征分析
对6个样品进行富集培养、梯度稀释(10-1~10-6)后涂布在倒置的分离培养基平板上,并反复分离纯化,得到单菌株,进行菌落形态观察,见图1。
2.2 反硝化的筛选结果
接入反硝化培养基的七种菌均无菌落长出,证明七种菌均无好氧反硝化作用。
2.3 耐盐高效脱氮微生物筛选结果
通过纳氏比色法测定接有各菌种的培养基中不同时间的吸光度值如表2,计算各菌种48 h脱氮率如表3。菌株A1具有较高的脱氮效率,其氨氮降解率达到38.33%,明显高出其他菌种,可作为目标菌种,进行下一步实验。
2.4 适宜培养条件研究结果
2.4.1 温度条件 通过测定,A1在25 ℃条件下脱氮能力最强(图2),氨氮降解率为33.2%,在30 ℃时菌体细胞密度最大(图3)。
2.4.2 pH条件 通过测定,A1在pH为5条件下脱氮能力最强(图4),氨氮降解率为39.7%;在pH为8时OD600最高,与其他几个梯度颜色差异较为明显,考虑到培养基颜色对吸光度值的影响,此处认为pH为6~7时菌体细胞密度最大(图5)。
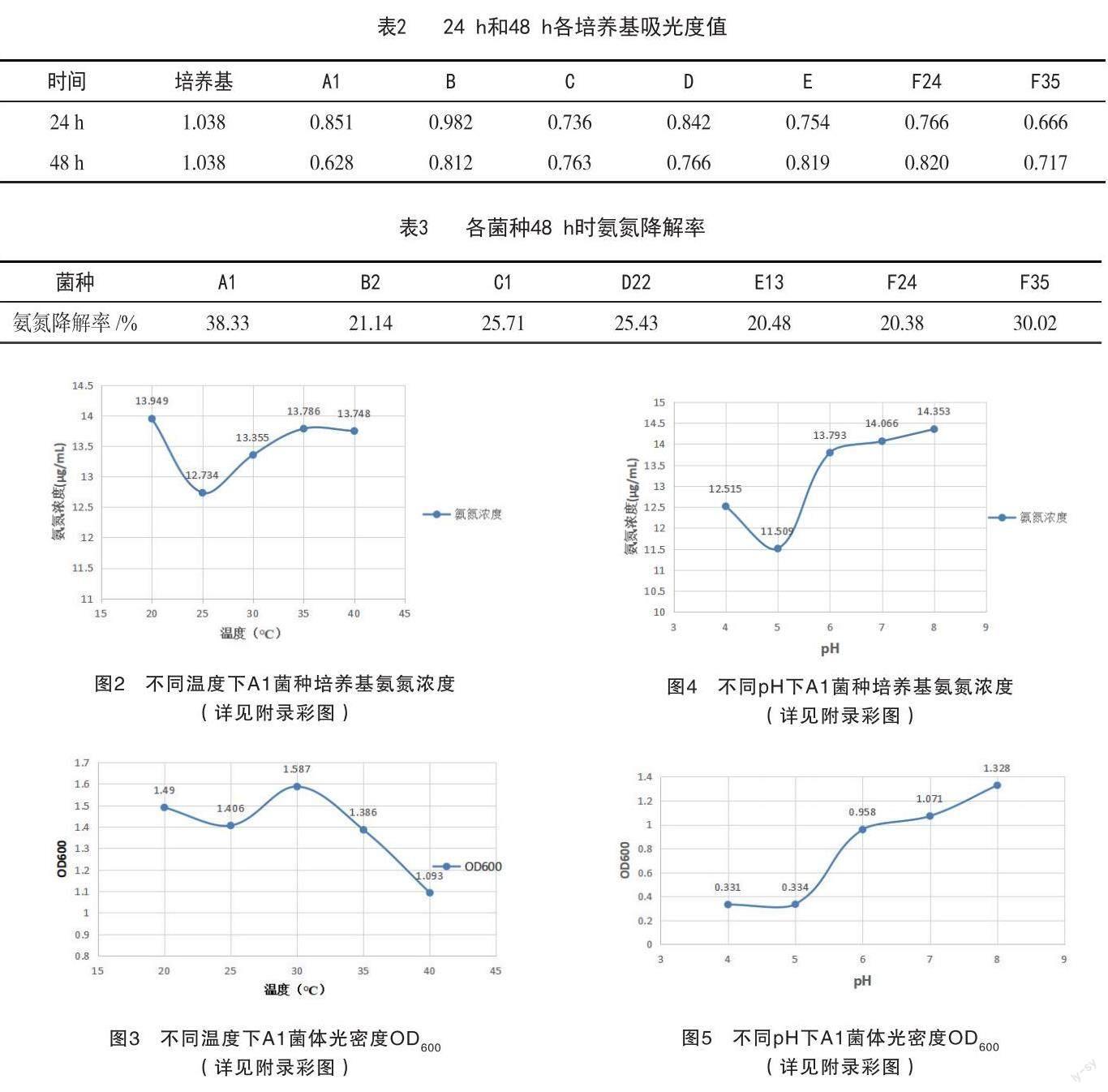
2.4.3 盐度条件 随着盐度的升高,菌体脱氮能力逐渐降低,在盐度为5、10、20、30时,氨氮去除率分别为50.44%、47.5%、46.31%、40.32%,显示A1在盐度为30的情况下仍具有较好的脱氮能力(图6)。
据图7可知,盐度在10~20的条件下,菌液细胞密度变化不明显;盐度为20时,菌液细胞密度达到最高值,故可得出A1菌体生长的最适盐度为10~20。
2.5 分子生物学鉴定结果
A1菌株的16S rRNA扩增片段测序结果为591 bp,将测序结果与Genbank上已登录的基因序列作比对,发现与盐单胞菌属(Halomonas)同源性最高,为97.71%。利用MEGA6软件,将分离菌株与部分参考菌株基于16S rRNA序列构建系统发育树,确定其进化地位。
2.6 生理生化鉴定结果
分离菌株A1的生理生化鉴定结果见表4。根据菌株A1的染色结果见(图8)及生理生化测定(表4)结果,A1菌为革兰氏阳性的杆菌,运动型,硝酸盐还原试验阳性,葡萄糖发酵阴性,明胶液化试验阴性。
3 结论
本研究从东营盐碱土地中筛选出一株具有耐盐高效脱氮的革兰氏阳性杆菌菌株A1,属盐单胞菌属,脱氮最适温度为25 ℃、最适pH为5、最适盐度为30,对于去除畜禽污水中氮素、水环境污染防治具有重要的应用价值。
参考文献:
[1] 邓斌,郑佳佳,傅罗琴,等.一株高效硝化菌的鉴定及其特性[J].环境工程学报,2013,7(9):3635-3641.
[2] 刘平,陈芳艳,谢永福,等.一株脱氨除臭菌的筛选鉴定及其脱氮性能研究[J].中国畜牧兽医,2013,40(5):40-43.
[3] 杨垒.高效异养硝化细菌的脱氮特性及其处理高氨氮废水研究[D].西安:西安建筑科技大学,2016:41-68.
[4] 贾燕,江栋,周伟坚,等.高效脱硫脱氨氮菌株的分离、鉴定及特性研究[J].中国给水排水,2009,25(23):114-116.
[5] 杨新萍.污水处理中脱氮功能微生物特性及固定化应用研究[D].南京:南京农业大学,2009:31-70.
[6] 刘健楠.废水处理系统中脱氮菌株的分离、筛选与鉴别研究[D].北京:北京工商大学,2010:1-68.
[7] 陈亮,刘锋,肖润林,等.人工湿地氮去除关键功能微生物生态学研究进展[J].生态学报,2017,37(18):6265-6274.
[8] 陳银燕.异养同步硝化好氧反硝化细菌的脱氮性能研究[D].杭州:浙江农林大学,2019:1-50.
[9] 陈相林.人工湿地对水产养殖废水中氮磷的去除效能分析[J].江西水产科技,2020(2):37-38.
[10] 王宇娜,国晓春,卢少勇,等.人工湿地对低污染水中氮去除的研究进展:效果、机制和影响因素[J].农业资源与环境学报,2021,38(5):722-734.
[11] 苏俊峰,王继华,马放,等.好氧反硝化细菌的筛选鉴定及处理硝酸盐废水的研究[J].环境科学,2007(10):2332-2335.
[12] 陈苏兰.猪场污水中脱氮微生物的分离与鉴定的研究[D].武汉:华中农业大学,2007:3-25.
[13] 宋慧赟,王莹,陈虎,等.盐度对新型生物脱氮技术影响的研究进展[J].化工进展,2021,40(4):2298-2307.
[14] 芮傳芳.脱氮微生物的筛选及其脱氮性能研究[D].合肥:安徽大学,2011:4-14.
[15] 邱晓帆. 脱氮微生物筛选及脱氮条件优化研究[D].无锡:江南大学,2012:1-37.
[16] 李慧,李宇飞,孟子育,等.螭霖鱼肠道微生物多样性分析[J].水产养殖,2020,41(8):1-21.
[17] 吴占东.极地微生物中脱氮菌筛选与脱氮性能的研究[D].青岛:青岛大学,2017:1-18.
[18] 赵燕.耐冷氨氮降解菌的分离、鉴定及其在废水处理中的应用研究[D].兰州:兰州交通大学,2013:3-15.
[19] 袁建华,赵天涛,彭绪亚.极端条件下异养硝化-好氧反硝化菌脱氮的研究进展[J].生物工程学报,2019,35(6):942-955.
[20] AVGU?TIN J A,BERTOK D ?,AVGU?TIN G.Isolation and characterization of a novel violacein-like pigment producing psychrotrophic bacterial species Janthinobacterium svalbardensis sp. nov[J].Antonie van leeuwenhoek,2013,103(4):763-769.
[21] LU H,DENG T,CAI Z,et al.Janthinobacterium violaceinigrum sp. nov., Janthinobacterium aquaticum sp. nov. and Janthinobacterium rivuli sp. nov., isolated from a subtropical stream in China[J].International journal of systematic and evolutionary microbiology,2020,70(4):2719-2725.
[22] BARICZ A,TEBAN A,CHIRIAC C M,et al.Investigating the potential use of an antarctic variant of janthinobacterium lividum for tackling antimicrobial resistance in a one health approach[J].Scientific reports, 2018,8(1):1-12.
