鹅细小病毒强毒株的分离鉴定与遗传进化分析
2024-04-15王志强黄宇翔邹跃张红杨昊天董佳强杨坤
王志强 黄宇翔 邹跃 张红 杨昊天 董佳强 杨坤

摘 要:为了了解齐齐哈尔地区鹅细小病毒(GPV)现地强毒株的流行及抗原变异情况,试验从齐齐哈尔龙江县某养殖场采集疑似小鹅瘟病死雏鹅的肝脾病料进行病毒分离培养,对获得的疑似尿囊液进行PCR检测、血凝性检测、动物回归试验及VP3基因序列分析。结果表明,分离到的病毒株能使12日龄鹅胚在144 h内死亡;血凝性检测未检测出血凝价;动物回归试验,可复制该病,致使5日龄雏鹅在96~144 h内全部死亡;VP3基因PCR扩增条带大约为1 600 bp,与目的条带大小相符;对其进行序列分析,判定该分离株为鹅细小病毒毒株,与我室之前分离鉴定的鹅细小病毒HH10强毒株核苷酸同源性为98.17%,与标准B株核苷酸同源性为97.13%。说明鹅细小病毒基因保守。
关键词:鹅细小病毒;现地株分离鉴定;动物回归试验;遗传进化分析
鹅细小病毒(Goose parvovirus, GPV)易感谱很窄,在自然感染条件下,只感染雏鹅和雏番鸭。感染雏鹅引发的疫病,我们通常称为小鹅瘟,流行范围很广,世界各地均有发生该病的报道。小鹅瘟是一种极烈性传染病,对20日龄以内的雏鹅,不仅传染速度快,病死率高,而且越小日龄感染率和病死率越高,甚至可达100%[1]。该病毒感染后可引起雏鹅多器官炎症,如急性肠炎、肝炎、肾炎等[2]。特征性病变是小肠中下段比正常肠管粗2~3倍,肠道内形成灰白色或淡黃色栓状凝固物。被感染的雏鹅表现出精神沉郁、食欲不振、严重下痢、呼吸困难、角弓反张等症状[3]。本病的发生率和死亡率与年龄有很大的相关性,1周龄以内雏鹅感染死亡率达到100%,2~3周龄的雏鹅发病率虽然很高、但死亡率可能低于10%,而4~5周龄雏鹅感染后,造成的损失可能不大,但如果饲养管理不善,继发其他细菌、真菌或病毒感染,可使最终死亡率大幅上升[4]。
2022年5月,龙江县某养殖场7日龄雏鹅暴发疑似小鹅瘟疫情,损失非常严重。本研究在该养殖场采集疑似鹅细小病毒感染的病料,用鹅胚分离出疑似鹅细小病毒,并通过PCR试验进行实验室确诊,同时扩增出分离毒株的VP3基因,进行遗传进化分析,为齐齐哈尔地区鹅细小病毒现地强毒株的流行及抗原变异情况提供科学依据。
1 材料与方法
1.1 病料
病死雏鹅肝脏、脾脏等组织,均采自黑龙江省龙江县某养鹅场。
1.2 毒株与试验动物
HH10株为本实验室于2010年自黑河市病例中分离鉴定的鹅细小病毒现地强毒株;FY89、YAN98株为本实验室分离致弱的鹅细小病毒株;12日龄鹅胚与1日龄雏鹅均为鹅细小病毒非免疫本地鹅蛋孵化,其鹅细小病毒琼扩(AGP)抗体阴性。
1.3 主要试剂
2×GoTaq? Green Master Mix,购自Promega公司;磁珠法病毒DNA/RNA提取试剂盒,购自天根生化科技(北京)有限公司;DAN凝胶回收试剂盒、pMDTM19-T载体克隆试剂盒、质粒DNA小量纯化试剂盒,均购自宝日医生物技术(北京)有限公司。
1.4 病毒的分离培养
采集龙江县某养殖场疑似暴发鹅细小病毒病死亡雏鹅的肝、脾组织,用研钵研磨,按每克病料加入1 mL生理盐水的比例稀释;反复冻融3次后,14 000 r/min离心10 min,取上清液,经0.22 μm滤膜过滤除菌后,取0. 2 mL接种于12日龄鹅胚,置于孵化器中继续孵化,收取24 h后死亡鹅胚的尿囊液。连传2代,收取第二代尿囊液,暂命名为LJ22株,-20 ℃保存备用。
1.5 病毒PCR鉴定
以Zadori等[5]发表的鹅细小病毒B株核苷酸序列作为参照,应用引物设计软件oligo6设计出一对鹅细小病毒VP3基因引物,由上海生工工程有限公司合成,引物序列见表1。以F2代及阴性对照的尿囊液DNA为模板,以设计合成的引物作为扩增VP3基因的引物,利用PCR法鉴定病毒。PCR反应体系为50 μL,反应条件为:首先95 ℃预变性5 min;其次95 ℃变性1 min,56 ℃退火50 s,72 ℃延伸2 min,共进行30个循环;最后72 ℃延伸10 min。用1%琼脂糖凝胶电泳检测,观察并记录结果。
1.7 血凝特性鉴定
按照文献[6]方法,采用血凝试验(HA)测定现地株LJ22的血凝性。
1.8 动物回归试验
将10只1日龄体内检测无鹅细小病毒抗体的雏鹅,随机平均分成两组,一组为攻毒组,一组为空白对照组。5日龄时对攻毒组进行强毒感染,所用强毒为现地株LJ22,攻毒方式为颈部皮下注射,攻毒剂量为0.2 mL/羽,空白对照组与攻毒组攻毒方式和攻毒剂量相同,只是将现地株LJ22强毒换成无菌生理盐水。隔离饲养,每天观察雏鹅的发病及死亡情况。
2 结果与分析
2.1 病毒分离及PCR检测结果
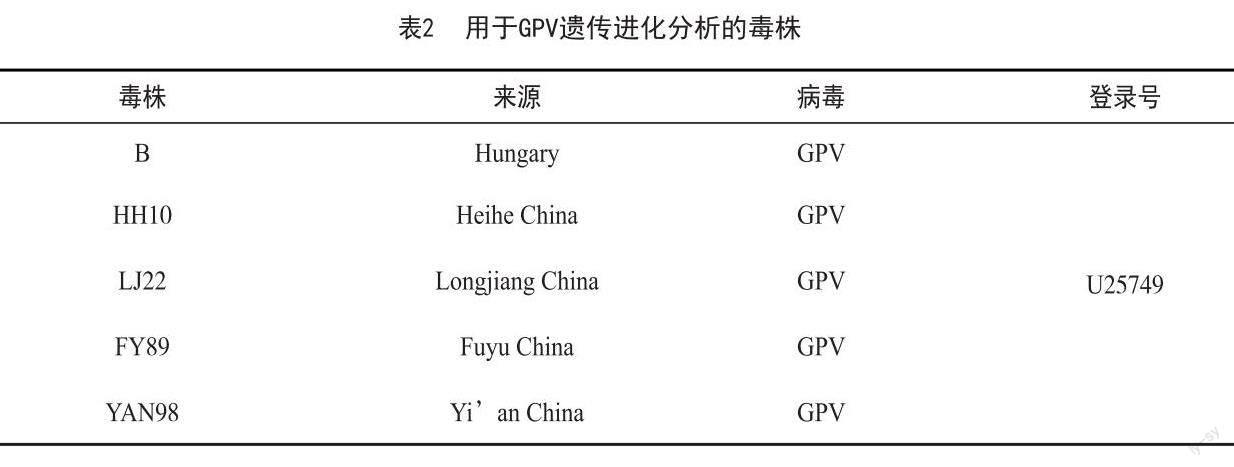
将保存备用的病料接种鹅胚并传代,结果显示:第一代鹅胚接种后144 h出现死亡,共接种5枚鹅胚,死亡2枚。第二代鹅胚接种后120 h出现死亡,共接种10枚鹅胚,至144 h全部死亡。死亡鹅胚胚体出血明显,尿囊膜水肿增厚。以F2代病毒尿囊液中的DNA为模板,进行PCR扩增,结果显示,扩增得到大小约为1 600 bp的目的片段,与预期片段大小相符。结果表明分离病毒为鹅细小病毒。结果见图1。
2.2 血凝试验结果
采用微量法测定现地株LJ22株的血凝性,结果显示,该分离株不能凝集公鸡红细胞,符合鹅细小病毒没有血凝性的特点。
2.3 动物回归试验结果
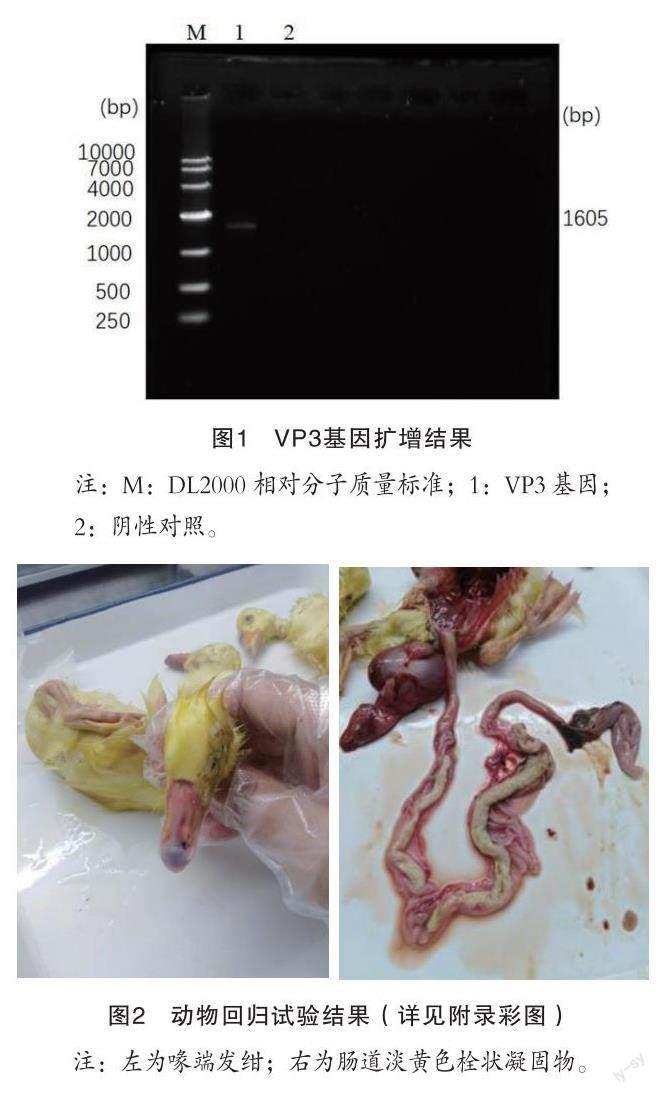
攻毒组雏鹅发病率和死亡率均为100%(5/5),对照组雏鹅未见发病。死亡雏鹅喙发绀,剖检见鹅细小病毒典型症状,即肠道内形成淡黄色栓状凝固物。结果见图2。
2.4 遗传进化分析结果
测定LJ22株的VP3结构基因序列各碱基随机分布于整个序列,无缺失和插入,少数发生替换。使用DNAMAN软件,对LJ22株与强毒株B株和HH10株、弱毒株FY89、YAN98株一起繪制遗传进化树(图3),结果显示LJ22株与强毒株HH10株亲缘关系较近,核苷酸同源性为98.17%;与B株稍远,为97.13%。与弱毒株YAN98的核苷酸同源性为95.85%,弱毒株FY89为95.66%。
3 讨论
近几年来在现地服务过程中发现,虽然养殖场对小鹅瘟防控工作都十分重视,但依然有小鹅瘟疫情散在发生,造成很大的经济损失。所以小鹅瘟虽然在1956年就由我国学者方定一教授分离并命名[2],但直到今天,防控形势依然不容乐观。
鹅细小病毒基因组结构相对简单,只有两个主要的开放阅读框架,位于左侧的开放阅读框编码两种非结构蛋白,NS1和NS2,位于右侧的开放阅读框编码三种结构蛋白,VP1、VP2和VP3[7-9]。鹅细小病毒结构蛋白与病毒的毒力及致病性有关,其中VP3蛋白暴露于病毒粒子表面,约占病毒衣壳蛋白总含量的80%,是主要抗原蛋白,能诱导机体产生保护性抗体来中和病毒,因此,VP3基因在鹅细小病毒研究中具有重要意义[10-13]。
本研究分离到的LJ22现地强毒株与HH10强毒株核苷酸同源性为98.17%,表明鹅细小病毒基因变异相对较少。至今鹅细小病毒只有一个血清型,它们的基因在漫长的历史演化过程中严格保守,不随时间和地域的不同而发生大的改变[2, 14],本结果进一步说明鹅细小病毒基因组的这个特点。由于鹅细小病毒结构蛋白VP基因没有非结构蛋白NS基因保守,相对来讲是鹅细小病毒基因组中核苷酸序列最容易出现突变的区域,因此推测LJ22现地强毒株整个基因组变异不大。细小病毒是所有病毒中基因组最小的病毒之一,鹅细小病毒全基因组只有5 000多个核苷酸,为了更加经济有效的利用,有些核苷酸甚至同时编码三个蛋白,它们之间不仅相互作用,而且受到彼此制约,鹅细小病毒本身又是DNA病毒,基因组比较稳定,因此不易发生变异[15-18]。由于鹅细小病毒基因组非常小,基因组中的每一个核苷酸都被充分利用,任何重要的核苷酸变化,导致氨基酸发生改变,进而导致编码的蛋白质发生任何变化,都有可能改变病毒的属性,从而危及到病毒自身的存亡,这是病毒在其进化过程中所不能允许的[14]。
4 结论
本研究成功分离鉴定出1株鹅细小病毒现地强毒株LJ22株,并针对其VP3基因进行了序列分析,结果显示VP3基因仅有个别核苷酸发生改变,虽然鹅细小病毒也在有效免疫的选择压力下,但其基因组趋于保守,并未引起强毒株基因组变异,虽未变异,但防控形势依然不容乐观。本研究为鹅细小病毒病的流行病学调查提供了一定的参考依据,并为进一步制定鹅细小病毒病的防控方法奠定了基础。
参考文献:
[1] 蔡宝祥.家畜传染病学[M].第四版.北京:中国农业出版社,2001: 334-336.
[2] 殷震,刘景华.动物病毒学[M].第二版.北京:科学出版社,1997: 1165-1168.
[3] 陈理盾,李新正,靳双星.禽病彩色图谱[M].沈阳:辽宁科学技术出版社, 2009: 100-102.
[4] 王志强.一例鹅细小病毒感染的诊治[J].畜牧兽医科技信息,2016: 116-117.
[5] Z Zadori, R Stefancsik, T Rauch, et al. Analysis of the complete nucleotide sequences of goose and Muscovy duck parvoviruses indicates common ancestral origin with adeno-associated virus 2[J]. Virology, 1995, 212: 562-573.
[6] 吴敏秋,周建强.兽医实验室诊断手册[M].南京:江苏科学技术出版社, 2009: 404-405.
[7] 王志强,李洪彬,杨旭东,等. 鹅细小病毒VP3基因在昆虫杆状病毒表达系统中的表达[J].中国畜牧兽医, 2014, 41 (9): 52-55.
[8] 邱娜,刘明,白小飞,等. 鹅细小病毒鹅胚成纤维细胞适应病毒株的培育及序列分析[J]. 中国预防兽医学报, 2014, 36 (11): 898-900.
[9] 王志强,刘力威,李洪彬,等.鹅细小病毒细胞适应株结构基因序列分析[J].中国兽医杂志, 2016, 52 (09): 40-42.
[10] 朱海侠,万春和,黄瑜.鹅细小病毒基因组结构特征研究进展[J]. 中国动物传染病学报, 2011, 19 (1): 82-86.
[11] HUO XR,CHEN YM, ZHU JG, et al. Evolution, genetic recombination, and phylogeography of goose parvovirus[J].Comp Immunol Microbiol Infect Dis, 2023,102: 102079.
[12] 张晓战,邢忠玉,陈梦云,等. 河南地区青年鹅源细小病毒分离鉴定和全基因组序列分析[J]. 中国兽医学报, 2023, 43(09): 1837-1844.
[13] 王志强,刘力威,杨旭东,等.鹅细小病毒VP1-VP3非重叠区基因的克隆与序列分析[J].中国家禽, 2011, 33 (19): 28-30.
[14] 余兵,王永坤,刘宝荣, 等. 鹅细小病毒主要免疫原性蛋白基因的克隆与序列分析[J].病毒学报, 2002, 18 (3): 259-263.
[15] 江丹丹,林峰强,程晓霞,等.小鹅瘟病毒的分离鉴定及遗传变异分析[J].中国兽医杂志. 2021, 57(09): 27-31.
[16] HAKAN Isidan, TURHAN Turan, MUSTAFA Ozan Atasoy, et al Molecular analysis of goose parvovirus field strains from a Derzsy's disease outbreak reveals local European-associated variants[J]. Arch Virol, 2021, 166(7): 1931-1942.
[17] 李阁锦,郭维军,曹祁峰,等.鹅细小病毒辽宁分离株全基因测序与遗传演化分析[J].现代畜牧兽医, 2021(04): 39-43.
[18] 李亚非,潘金金,陈洪益,等. 江苏省盐城市3株白羽肉鸭鹅细小病毒的分离鉴定及其VP3基因遗传进化分析[J].中国动物检疫, 2018, 35 (8): 85-88.
