miR-26b-3p 靶向CREB1 调控神经胶质瘤细胞的增殖、迁移及侵袭
2024-04-13黄秋虎王子珍陈政纲
黄秋虎,周 建,王子珍,杨 堃,陈政纲
海南医学院第一附属医院神经外科,海南 海口570102
胶质瘤是颅内最常见的原发恶性肿瘤,一般由于其具有高度侵袭性和手术难以全切,因此预后极其不佳,多数患者中位生存期仅12~15月[1]。近年来,胶质瘤的基础与临床研究虽然取得了重大突破,新的治疗手段层出不穷,但有效的干预措施依然很少,严重影响胶质瘤患者的预后[2,3]。从其发生发展的分子机制入手,寻找可干预的致病基因以及药物治疗靶点,具有重要临床价值和社会意义。研究表明,微小RNA(miRNAs)与胶质瘤的恶性发生、发展密切相关[4,5]。miRNA前体产生的两条miRNA单链(3p和5p链)都具有生物学功能[6-8]。从miR-26b前体的3'端臂加工而来的miR-26b-3p可通过多种机制调节细胞侵袭和增殖[9,10]。我们前期研究表明,miR-26b表达随着胶质瘤级别的增加逐渐降低[11]。然而,miR-26b-3p 在胶质瘤中的作用以及靶点目前仍不完全清楚,需要进一步探索。环磷酸腺苷效应元件结合蛋白1(CREB1)是调节基因转录、细胞发育与生存的核转录因子,主要通过cAMP依赖的细胞信号转导途径调控基因的表达[12]。研究表明,CREB1在细胞生长、增殖、凋亡等的过程中发挥重要作用[13,14]。有研究表明CREB1的表达随着胶质瘤级别增加而增加[15],但其在胶质瘤中的作用机制尚不明确。我们利用生物信息学软件预测发现,miR-26b-3p在CREB1 mRNA的3'UTR区有多个潜在的靶点,预示miR-26b-3p 可能调控CREB1蛋白表达水平,参与胶质瘤的生物学进展,但相关研究未见报道。本研究旨在阐明miR-26b-3p靶向调控CREB1在胶质瘤中的作用机制,以及miR-26b-3p对胶质瘤增殖、迁移和侵袭能力的影响,现报道如下。
1 材料和方法
1.1 临床标本采集及处理
收集2016年6月~2021年6月在我院收治的75例星形细胞瘤患者的病理标本,其中男40例,女35例,年龄为41~73(49.23±3.67)岁。所有患者术前均未行放疗、化疗,其中,星型细胞瘤Ⅰ级5例、Ⅱ级25例、Ⅲ级25例、Ⅳ级20例。肿瘤组织离体后分为2块,一块迅速置入RNA长效保存液中,另一块使用焦碳酸二乙酯处理过的冷磷酸缓冲液冲洗,并去除血渍,迅速投入液氮中保存。所有临床样本收集均取得海南医学院第一附属医院伦理委员会批准(2022-L-146)及患者知情同意。
1.2 细胞株及主要试剂
人脑胶质瘤细胞U251(上海生命科学研究院),Lipofectamine®2000转染试剂盒(Invitrogen),二甲基亚砜(DMSO,Sigma),胎牛血清,DMEM 培养基(Life Technologies),miR-26b-3p PCR引物、抑制序列、阴性对照(NC)序列均由Invitrogen公司合成,BCA蛋白检测试剂盒(碧云天),CREB1抗体(CST),Trizol试剂盒(Life Technologies),SYBR Premix Ex TaqTM(Takara),PCR仪(Thermo),蛋白凝胶成像仪(Bio-Rad),流式细胞仪(Beckman)。
1.3 方法
1.3.1 细胞分组 从液氮中取出人脑胶质瘤细胞系U251接种于培养基培养内,然后进行传代培养,当细胞培养至第3 代时用于后续实验。通过转染试剂盒将NC、miR-26b-3p mimic及miR-26b-3p inhibitor片段,参照Lipofectamine®2000 说明书转染胶质瘤细胞U251,转染24 h后在荧光显微镜下观察荧光结果确认转染效率。
1.3.2 CCK-8实验 在离心管中配置好已经稳定转染的适量细胞悬液,然后将细胞悬液均匀滴加到96孔板中,每组设置3个复孔,然后将96孔板放于37 ℃细胞孵育箱中培养。24 h后取出96孔板,置于倒置显微镜中观察细胞贴壁及生长情况。在避光条件下于每孔中加入10 μL的CCK-8溶液,然后置入细胞孵育箱中,分别于12、24、48、72 h重复上述的步骤,加入CCK-8溶液后用酶标仪检测细胞在450 nm处的吸光度。
1.3.3 伤口愈合实验 用无血清培养基将U251细胞接种至6 孔板中,各组细胞以50 nmol/L 的浓度转染细胞。24 h后用在标记线处进行划痕,并在划痕0、24、48、72 h后观察划痕中细胞的覆盖情况,即细胞的迁移能力,并用Image J软件测定两处的直线距离,重复测量3次,取其均数。
1.3.4 Transwell实验 各组细胞以50 nmol/L的浓度转染U251细胞24 h,然后将U251细胞使用无血清培养基重悬,并在铺有基底膜基质胶的Transwell 上室中接种。在下室中加入含10%FBS的胎牛血清培养液,培养24 h后,保留室内下层细胞,并用棉签清理未迁移的细胞,加入4%的多聚甲醛固定10 min,结晶紫染液染色15 min,在倒置显微镜下随机挑选5个视野进行计数,实验重复3次,取其均数作为这个小室的侵袭细胞数。
1.3.5 双荧光素酶报告基因检测 利用TargetScan、JASPAR等网站对miR-26b-3p调控CREB1的靶位点进行预测。在萤光素酶报告载体中构建了一个包含野生型(WT)或突变型(MUT)CREB1 3'UTR假定结合位点的3'UTR序列,然后构建相应的质粒。取对数生长期的U251 细胞接种于96 孔板中,按照Lipofectamine®2000的操作指南与设计的载体和miR-26b-3p mimic/NC mimic片段进行共转染,然后继续培养48 h后,检测海参荧光素酶的发光强度与萤火虫荧光素酶发光强度。
1.3.6 细胞凋亡检测 转染后的各组细胞继续培养48 h,制备单细胞悬浮液,调整细胞密度为5×104/mL接种;加入预冷PBS漂洗,然后离心,保留下层细胞,用70%乙醇固定30 min;PBS漂洗,然后加入AnnexinV-FITC、PI(1∶2)进行重悬,避光孵育60 min(4 ℃),采用流式细胞仪检测各组细胞凋亡率。
1.3.7 RT-qPCR检测 各组细胞培养后加入细胞裂解液进行裂解,按照RNA 提取试剂盒说明书提取细胞总RNA,采用反转录试剂盒将RNA反转录为cDNA,miR-26b-3p 引物为:F:5':GGCCTGTTCTCCATTACTTG G3',R:5'-CGCTTCACGAATTTGCGTGTCAT-3'。U6引物:F:5'-ATGCACAGTCTATAGATTT-3',R:5'-GCT ATACGAACGTGCATCC-3';CREB1 mRNA引物为:F:5-TGCCACATTAGCCCAGGTATC-3',R:5-GGACTT GAACTGTCTGCCCA-3';GAPDH 引物为:F:5'-GTG AAGGTCGGAGTCAACGG-3',R:5'-CCCGTTCTCA GCCATGTAGT-3';反应体系为20 μL: SYBR Premix 10 μL,H20 8 μL,cDNA 1 μL,上下游引物0.5 μL。反应程序:95 ℃预变性5 min,95 ℃变性15 s、60 ℃退火20 s,72 ℃3 min,共40个循环,72 ℃延伸10 min。以GADPH作为内参基因,根据2-ΔΔCT算法进行计算CREB1 mRNA表达量;以U6作为内参基因计算miR-26b-3p mRNA表达量。
1.3.8 Western blotting 转染后各组细胞培养48 h,加入蛋白裂解液反应30 min,离心后收集上清液,按照细胞总蛋白提取试剂盒说明书提取细胞总蛋白,采用BCA法测定所提取蛋白的浓度。然后配制分离胶及浓缩胶,上样、电泳,加入CREB1,4 ℃孵育过夜,TBST漂洗后加入二抗,于室温下孵育2 h;TBST漂洗后ECL显色,置于凝胶成像仪中显像。
1.4 统计学分析
采用SPSS29.0建立数据库进行统计分析。符合正态分布且方差齐的计量资料以均数±标准差表示,两组均数的比较采用Student'st检验,以P<0.05为差异有统计学意义。
2 结果
2.1 不同级别胶质瘤中miR-26b-3p和CREB1的表达
RT-qPCR结果显示,miR-26b-3p mRNA表达水平随着胶质瘤级别的增加而逐渐下降(P<0.05,图1C);CREB1的mRNA及蛋白表达水平随着胶质瘤级别的增加而逐渐增加(P<0.05,图1A、B、D)。

图1 不同级别胶质瘤中miR-26b-3p及CREB1的表达情况Fig.1 Expression of miR-26b-3p and CREB1 in gliomas of different pathological grades.A,B:Western blotting of expression of CREB1 in different stages of glioma. C, D: RT-qPCR of miR-26b-3p in different stages of glioma.*P<0.05 vs WHO I group.
2.2 miR-26b-3p mimic 转染后miR-26b-3p 和CREB1 mRNA的表达
miR-26b-3p mimic转染人胶质瘤细胞U251 48 h后,miR-26b-3p mimic组miR-26b-3p mRNA的表达水平提高(P<0.001,图2A);miR-26b-3p mimic组CREB1 mRNA的表达水平降低(P<0.001,图2B)。

图2 转染miR-26b-3p mimic后miR-26b-3p和CREB1 mRNA的表达情况Fig.2 mRNA expression of miR-26b-3p(A)and CREB1(B)detected by RT-qPCR in U251 cells transfected with miR-26b-3p mimic.***P<0.001 vs NC group.
2.3 miR-26b-3p靶向调控CREB1
利用TargetScan、JASPAR等网站进行生物信息学预测显示CREB1的3′UTR 区域上存在与miR-26b-3p匹配的核苷酸序列(图3A)。双荧光素酶报告基因检测结果表明,过表达miR-26b-3p mimic 可显著抑制CREB1 WT的相对荧光素酶活性(P<0.01),而CREB1 MUT的相对荧光素酶活性无明显变化(P>0.05,图3B)。RT-qPCR 和Western blotting 检测结果显示,过表达miR-26b-3p的U251细胞中CREB1 mRNA及蛋白表达水平均比NC组细胞降低(P<0.01,图3C~E)。
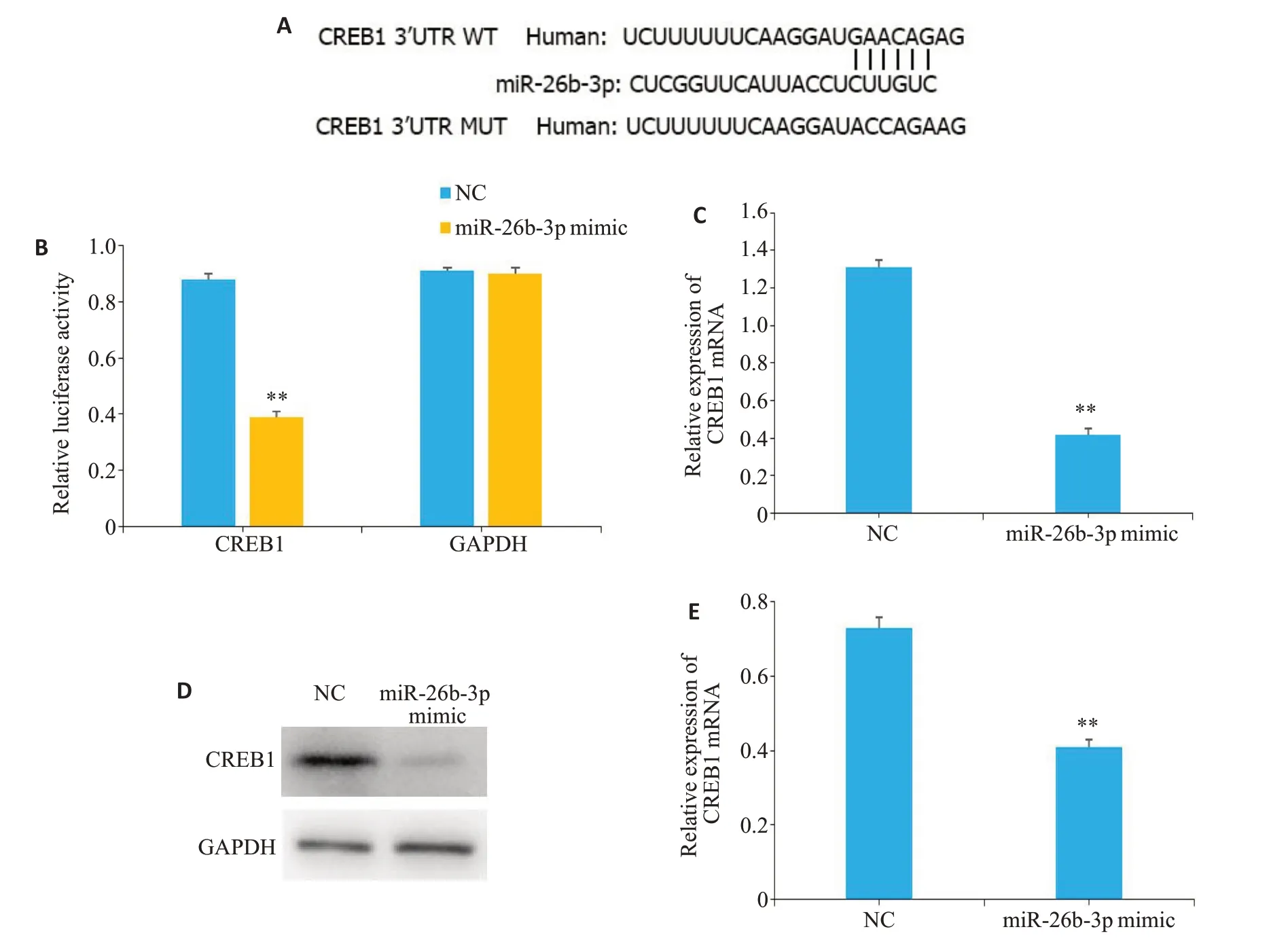
图3 双荧光素酶报告基因验证CREB1作为miR-26b-3p的靶基因Fig.3 Dual luciferase reporter gene experiment confirms that CREB1 is the target gene of miR-26b-3p.A:Bioinformatics prediction of the binding site in CREB1 for miR-26b-3p.B:Luciferase reporter assay confirms that miR-26b-3p is capable of binding to CREB-WT but not to CREB1-MUT in U251 cells.C:RT-qPCR of CREB1 mRNA in U251 cells transfected with miR-26b-3p mimic. D: Western blotting of CREB1 expression in U251 cells transfected with miR-26b-3p mimic; E: Quantification of Western blotting results.**P<0.01 vs NC group.
2.4 miR-26b-3p靶向调控CREB1对胶质瘤细胞增殖的影响
在U251 细胞中转染了miR-26b-3p mimic、miR-26b-3p inhibitor及NC片段。CCK-8结果显示,过表达miR-26b-3p mimic可抑制U251细胞的增殖作用,miR-26b-3p inhibitor 可促进U251 细胞的增殖(P<0.05,图4A);Western blotting结果显示miR-26b-3p mimic可抑制CREB1的表达,miR-26b-3p inhibitor可促进CREB1的表达(P<0.05,图4B、C)。
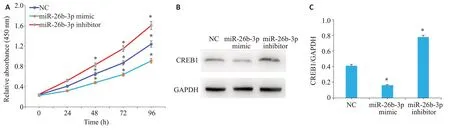
图4 miR-26b-3p靶向调控CREB1对胶质瘤细胞增殖能力的影响Fig.4 MiR-26b-3p targets CREB1 to regulate U251 cell proliferation.A:Viability of cells measured by MTT assay.B,C:Western blotting of CREB1 expression in U251 cells transfected with NC,miR-26b-3p mimic and miR-26b-3p inhibitor.*P<0.05 vs NC group.
2.5 miR-26b-3p靶向调控CREB1对胶质瘤细胞凋亡的影响
流式细胞术的研究结果显示,转染miR-26b-3p mimic 的U251 细胞凋亡率增加,转染miR-26b-3p inhibitor的U251细胞凋亡率下降(P<0.05,图5)

图5 流式细胞术检测各组胶质瘤细胞凋亡率Fig.5 MiR-26b-3p targets CREB1 to regulate apoptosis of U251 cells.A:U251 cells stained with FITC-Annexin V-PI and analyzed by flow cytometry.B:Quantitative analysis of apoptosis in U251 cells transduced with miR-26b-3p.*P<0.05 vs NC group.
2.6 miR-26b-3p靶向调控CREB1对胶质瘤细胞迁移及侵袭的影响
划痕愈合实验结果显示,与NC组相比,转染miR-26b-3p mimic的U251细胞在24、48、72 h时,胶质瘤细胞迁移率均降低,转染miR-26b-3p inhibitor的U251细胞在24、48、72 h时,胶质瘤细胞迁移率均增加(P<0.05,图6A、B)。
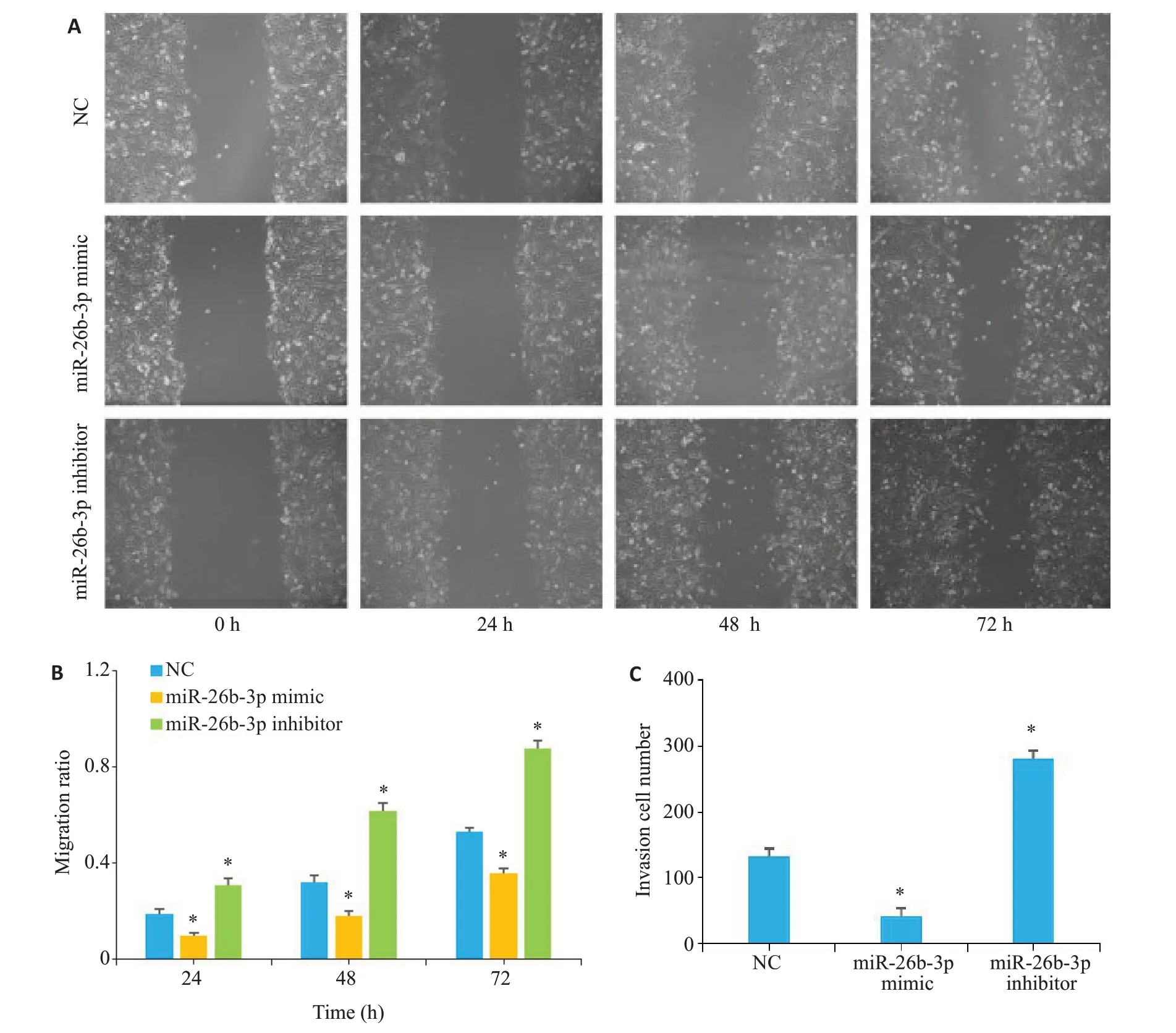
图6 miR-26b-3p对U251细胞迁移和侵袭能力的影响Fig.6 Effect of miR-26b-3p expression level on migration and invasion of U251 cells.A:Scratch wound healing assay of U251 cells in different groups.B:Quantitation of wound migration ratio at different time points.C:Quantitation of the number of invading cells.*P<0.05 vs NC group.
Transwell实验结果显示,与NC组相比,转染miR-26b-3p mimic后通过基质胶的胶质瘤细胞减少,转染miR-26b-3p inhibitor后通过基质胶的胶质瘤细胞增多,差异有统计学意义(P<0.05,图6C)。
3 讨论
胶质瘤是中枢神经系统中最常见的恶性肿瘤之一,由于其呈浸润性生长,手术难以全切,且对放、化疗敏感性差,术后复发率高,多数患者中位数生存率低,这与胶质瘤细胞增殖、侵袭和迁移等恶性生物学行为密切有关[16]。miRNAs是一类由约20个核苷酸组成的小型非编码RNA分子,参与高等真核细胞内多种生物作用的调控。研究表明,miRNAs与肿瘤的发病机制密切相关,包括细胞增殖、迁移和侵袭等。miRNAs的异常表达是由多种癌症类型的基因改变所致,并通过靶基因表达的失调在肿瘤的发生和发展中发挥作用。我们前期研究表明miR-26b 在胶质瘤中低表达,可通过下调COX-2表达抑制神经胶质瘤的增殖、侵袭和迁移[11],表明miR-26b 在恶性胶质瘤的发生和发展中发挥抑癌作用。miR-26b-3p作为抑癌基因或致癌基因,在胆管癌、食管癌、乳腺癌、结肠癌、喉癌等多种恶性肿瘤中均有表达[17-20],并且对肿瘤恶性进展发挥重要作用。研究表明,miR-26b-3p在神经胶质瘤中表达明显上调,可通过靶向调控TRA2B、ANTXR1调节胶质瘤增殖、迁移[10,21]。然而,其关键作用靶点及具体作用机制尚不完全清楚,仍需进一步研究。
为进一步验证miR-26b-3p在胶质瘤的表达水平,本研究检测了不同级别胶质瘤中miR-26b-3p的表达水平,其结果显示miR-26b-3p在胶质瘤中低表达,并且随着胶质瘤级别的增加其表达水平逐渐下降,表明miR-26b-3p在恶性胶质瘤中发挥抑癌基因的作用,可阻止胶质瘤细胞增殖、迁移和侵袭能力,这与既往研究[14,21]结果相似。
CREB1是肿瘤细胞增殖和迁移过程的一个关键核转录因子[12,22]。研究表明,CREB1在乳腺癌、肝细胞癌、前列腺癌、肾癌等多种肿瘤的发生发展中发挥重要作用,促进肿瘤细胞的增殖和迁移[14,23-25]。有学者发现抑制CREB1的表达可有效减少胰腺癌细胞的迁移和增殖[26]。也有研究表明,CREB1在高级别胶质瘤组织中的表达上调,而下调CREB1表达可以抑制胶质瘤细胞的增殖和侵袭能力[15],但CREB1在神经胶质瘤进展中的作用仍不清楚。基于此,本研究进一步探索CREB1在胶质瘤中的作用,临床数据和体外实验结果表明,CREB1的表达随着胶质瘤级别增高而增加,且CREB1的表达与胶质瘤病理分级密切相关,表明CREB1在恶性胶质瘤进展中充当致癌基因,并且可能与神经胶质瘤恶性肿瘤的严重程度相关。miRNAs 可通过靶向CREB1基因的表达而在多种肿瘤中发挥抑癌基因的作用[27],miR-27b-3p的表达水平与乳腺癌组织中CREB1水平负相关[28]。miR-200b靶向调控CREB1抑制胶质瘤的生长[29]。miR-138 通过靶向CREB1 抑制AKT/mTOR信号通路,调节神经胶质瘤细胞的增殖、凋亡和侵袭[30]。基于此,本研究通过TargetScan、Jaspar等数据库分析了miR-26b-3p潜在的下游转录调控因子,发现CREB1可能是miR-26b-3p的潜在靶基因。为探索胶质瘤细胞中miR-26b-3和CERB1之间的作用及相关机制,利用双荧光素酶报告基因检测方法,我们证实了CREB1是miR-26b-3p的新靶基因。运用RNA 干扰技术,过表达miR-26b-3p可显著抑制CERB1的表达,表明胶质瘤中CREB1蛋白的表达受miR-26b-3p的负调控。进一步通过流式细胞仪对胶质瘤细胞的凋亡情况进行检测发现,下调胶质瘤细胞中miR-26b-3p 表达,胶质瘤细胞的凋亡率显著提高,而且其迁移及侵袭能力明显下降,表明miR-26b-3p 可通过调节CREB1作为神经胶质瘤抑制因子,影响胶质瘤细胞的增殖、迁移和侵袭等恶性生物学行为。
但本研究尚存在一定的局限:在恶性胶质瘤中,miR-26b-3p及CREB1的上下游可能存在其他的调控机制尚需进一步研究;能否找到其他的作用靶点、能否在恶性胶质瘤的诊治中发生重要作用,还需进一步探索。
综上所述,本研究首次在恶性胶质瘤细胞中研究miR-26b-3p 和CREB1 的相互作用及相关机制,发现miR-26b-3p可靶向负调控CREB1表达抑制胶质瘤细胞的增殖、侵袭、迁移能力,促进胶质瘤细胞的凋亡,从而参与胶质瘤的发生、发展。因此,miR-26b-3p/CREB1可作为胶质瘤诊断或治疗的新靶点。
