青蒿琥酯对氟化钠所致骨细胞MLO-Y4凋亡和线粒体自噬的影响
2024-04-13王子晗莘裕辰楼凯沈方敏王钰婷鲍欣怡章璐彬张云
王子晗,莘裕辰,楼凯,沈方敏,王钰婷,鲍欣怡,章璐彬,张云
(绍兴文理学院医学院,浙江绍兴 312000)
氟是自然界中广泛分布的元素之一,适量的氟化物有益于人和动物的生长。但氟摄入过量可损害肾、肝、心脏、生殖系统、神经系统、肠道系统和内分泌系统[1]。临床研究表明,过量氟能破坏骨组织,诱发氟斑牙和氟骨症等代谢性骨病[2-6]。目前有关氟骨症的研究主要集中在氟对成骨细胞和破骨细胞活动及功能的调控[4-6]。低浓度氟化钠(NaF)1 μmol·L-1可促进成骨细胞的异常增殖和分化,导致骨转换障碍和成骨异常[4];高浓度NaF 0.5 mol·L-1明显抑制成骨细胞活性,并诱导成骨细胞凋亡[6]、骨基质钙化和胶原合成异常,最终造成骨硬化、韧带钙化和骨量严重减少。此外,过量摄入氟还会促进破骨细胞形成和骨丢失[7],增加绝经期妇女患骨质疏松的风险。
骨细胞由成骨细胞分化而来,其数量占骨组织细胞的90%~95%。骨细胞能合成和分泌硬骨素和牙本质基质蛋白1 和成纤维细胞生长因子23 等分子,调控位于骨表面的成骨细胞和破骨细胞的活动而调节骨生长和骨重建[7]。因此,骨细胞是调节骨代谢的主要细胞,可作为防治骨代谢异常疾病的一种新的靶细胞。以往研究[8]和我们前期数据[9]表明,氟过量可抑制骨细胞MLO-Y4 活性,诱导骨细胞凋亡及线粒体自噬。最近,Yang 等[10]研究报道,氟骨症大鼠股骨中骨细胞活性明显降低,并发生显著凋亡。以上研究提示,骨细胞参与调控氟骨病的发生和发展。目前临床上治疗氟骨症主要有阿司匹林、吲哚美辛等非甾体抗炎药物,这些药物虽然有一定的治疗效果,但也存在诸多不良反应,不宜长期服用。
青蒿琥酯(artesunate,Art)源于植物黄花蒿,是一种倍半萜结构的抗疟药青蒿素的衍生物。青蒿素具有特异的抗疟作用,临床上广泛应用于治疗疟疾[11]。另有研究显示,Art还具有抗氧化、抗肿瘤、抗炎及免疫调节作用[12-14]。此外,Art能促进成骨细胞增殖、上调Runt 相关转录因子,骨钙素和骨桥蛋白等成骨细胞分化相关蛋白的表达,增加新骨形成[15]。同时,Art 还能抑制破骨细胞的形成,减弱破骨细胞活性而阻止骨吸收[16]。但是,Art 对NaF 所致骨细胞损伤是否具有改善作用目前尚不清楚。本研究建立NaF 诱导骨细胞MLO-Y4 损伤模型,研究Art 对NaF 所致骨细胞损伤的改善作用,并探讨其分子调控机制,以期为治疗氟骨病提供新方法和新靶点。
1 材料与方法
1.1 细胞、试剂和仪器
小鼠骨细胞MLO-Y4 由美国密苏里大学口腔学院Bonewald 教授馈赠;青蒿琥酯(批号:B20992,纯度>98%)购于上海源叶生物技术有限公司;α-MEM 培养基(批号:8123251)、胎牛血清(批号:2238253)和小牛血清(批号:2212423)购自美国Gibco 公司;MTT(批号:ST316)、calcein-AM探针(批号:C2013)、乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒(批号:C0016)、丙二醛(malondialdehyde,MDA)试剂盒(批号:S0131S)、超氧化物歧化酶(superoxide dismutase,SOD)活性试剂盒(批号:S0101S)、ATP 检测试剂盒(批号:S0026)、Hoechst33342(批号:C1011)、活性氧荧光探针DCFH-DA(批号:S0033S)、线粒体膜电位荧光探针JC-1(批号:C2003S)、溶酶体荧光探针Lyso-Tracker(批号:C1046)和RIPA 裂解液(批号:P0013B)购于上海碧云天生物试剂有限公司;线粒体荧光探针MitoTrackerTMGreen(批号:M7514)购自美国Invitrogen Molecular Probes公司;Annexin-V/PI 凋亡检测试剂盒(批号:A10642)购于上海联科生物科技有限公司;兔抗小鼠微管相关蛋白轻链3(microtubule-associated protein 1 light chain 3,LC-3)单克隆抗体(批号:43566S)、鼠抗小鼠Tom20 单克隆抗体(批号:42406S)、兔抗小鼠P62单克隆抗体(批号:23214S)、兔抗小鼠E3泛素连接酶蛋白(Parkin)单克隆抗体(批号:42406S)和兔抗小鼠β 肌动蛋白单克隆抗体(批号:3700S)购于美国Cell Signaling Technology 公司;兔抗假定激酶1(PTEN induced putative kinase 1,PINK1)单克隆抗体(批号:A7131)、辣根过氧化物酶标记的山羊抗兔或抗小鼠IgG 抗体(二抗)购自爱博泰克武汉生物科技有限公司;超敏ECL 化学发光液(批号:1810212)购于上海勤翔科学仪器有限公司。
AB104S 电子分析天平,德国Sartorius 公司;细胞培养箱,美国Thermo Scientific 公司;5430R 台式高速冷冻离心机,美国Eppendorf 公司;VersaMax全波长酶标仪美国MD 公司;CytoFLEX S 流式细胞仪,美国Beckman 公司;DMIL 荧光显微镜,德国Leica 公司;LSM900 激光共焦显微镜,德国Carl Zeiss 公司;小型蛋白垂直电泳转印系统,美国Bio-Rad 公司;凝胶成像分析系统,上海勤翔科学仪器有限公司。
1.2 骨细胞MLO-Y4培养
第39代小鼠骨细胞MLO-Y4加入含有2.5%胎牛血清和2.5%小牛血清的α-MEM 培养基中,置于37 ℃,5% CO2及饱和湿度下常规培养,24 h 后换新的培养基。当细胞85%铺满培养瓶底时加入0.125%胰蛋白酶/0.01% EDTA 消化传代,取对数生长期细胞进行后续实验。
1.3 细胞分组
MLO-Y4 细胞接种于24 孔培养板中常规培养24 h,细胞分为细胞对照组、NaF 2 mmol·L-1(与细胞孵育12 或48 h)组及NaF+Art 0.25,0.50 和1.00 μmol·L-1组(Art预孵育2 h 后,加NaF 2 mmol·L-1继续孵育12或48 h)。
1.4 MTT法检测MLO-Y4细胞存活率
取1.3 分组处理48 h 细胞,每孔加入20 μL MTT(5 g·L-1),继续孵育4 h,弃上清液后加入200 μL DMSO 避光震荡5 min。应用酶标仪检测各孔细胞的吸光度值(A570nm)。细胞存活率(%)=(药物组A570nm-空白对照组A570nm)/(细胞对照组A570nm-空白对照组A570nm)×100%。每组6 复孔,实验至少重复3次。
1.5 calcein-AM染色检测MLO-Y4细胞活性
calcein-AM 是一种低毒性、易透过细胞膜的活细胞荧光染料。calcein-AM 进入到细胞质后会被水解为calcein并发出强绿色荧光。有研究表明,应用calcein-AM 染色检测细胞活性的结果与金标准15Cr-释放法的结果具有一致性[17]。取1.3分组处理48 h 细胞,去除上清液经PBS 清洗后加入calcein-AM(5 μmol·L-1)室温、避光孵育30 min,PBS 清洗后置于DMIL 荧光显微镜下观察MLO-Y4 细胞,以绿色荧光强度表示细胞活性。
1.6 化学比色法检测MLO-Y4 细胞上清液中LDH水平
取1.3 分组处理48 h 细胞,收集各组细胞上清液,应用LDH 试剂盒检测上清液中LDH 的水平。每组设4复孔,实验至少重复3次。
1.7 MLO-Y4 细胞内ROS 水平检测
1.7.1 化学荧光染色法
按照1.3 分组处理12 h 细胞,去除上清液后各组细胞分别加入DCFH-DA(10 μmol·L-1)室温、避光孵育30 min,PBS清洗2次后置于DMIL荧光显微镜下ROS水平,绿色荧光强度表示ROS水平。
1.7.2 流式细胞术
按照1.3分组处理12 h,去除上清液后收集各组细胞。PBS清洗后分别加入DCFH-DA(10 μmol·L-1)室温、避光孵育30 min,PBS 清洗2 次后,流式细胞仪定量检测MLO-Y4 细胞内ROS 水平。每组4 复孔,实验至少重复3次。
1.8 化学比色法检测MLO-Y4 细胞中MDA 含量和SOD活性
取1.3 分组处理48 h 细胞,按照试剂盒说明书测定MLO-Y4 细胞中MDA 含量和SOD 活性变化。每组5复孔,实验至少重复3次。
1.9 Hoechst33342染色观察MLO-Y4细胞核形态
取1.3 分组处理48 h 细胞,去除上清液后各组细胞分别加入Hoechst33342(5 mg·L-1)室温、避光孵育30 min,PBS 清洗后置于DMIL 荧光显微镜下观察MLO-Y4细胞核的形态变化。
1.10 流式细胞术检测MLO-Y4细胞凋亡率
取1.3 分组处理48 h 细胞,收集细胞经300×g离心10 min。去除上清液后经PBS 清洗2次,加入5 μL Annexin V-FITC 和5 μL 碘化丙啶,室温、避光孵育15 min。PBS 清洗后再加入PBS 200 μL 重悬细胞,应用流式细胞仪检测MLO-Y4 细胞凋亡率(%)。每组4复孔,实验至少重复3次。
1.11 MLO-Y4 细胞线粒体膜电位(mitochondrial membrane potential,MMP)水平检测
1.11.1 荧光染色法观察MLO-Y4细胞MMP水平
取1.3 分组处理48 h 细胞,去除上清液后各组细胞分别加入JC-1(10 μmol·L-1)室温、避光孵育30 min,PBS 清洗2 次后分别应用DMIL 荧光显微镜进行观察。其中,MMP 较高时,JC-1 在线粒体中形成聚合物,产生红色荧光;MMP 较低时,JC-1 为单体,产生绿色荧光。以红色和绿荧光强度变化反映MLO-Y4细胞MMP水平的改变。
1.11.2 流式细胞术
取1.3 分组处理48 h 细胞,收集细胞经300×g离心10 min。去除培养基经PBS 清洗2 次后加入JC-1(10 μmol·L-1)室温、避光孵育30 min,PBS 清洗后再加入PBS 200 μL 重悬细胞,应用流式细胞仪定量检测MLO-Y4 细胞中红色荧光强度来定量MMP。每组3复孔,实验至少重复3次。
1.12 Mito-Tracker 染色观察MLO-Y4 细胞中线粒体形态变化
取1.3 分组处理48 h 细胞,去除上清液后各组细胞分别与Mito-Tracker Red(1 μmol·L-1)室温、避光共孵育30 min,PBS 清洗2 次后置于DMIL 荧光显微镜下观察细胞观察线粒体形态改变。
1.13 荧光素酶法检测MLO-Y4细胞内ATP含量
取1.3 分组处理48 h 细胞,按ATP 检测试剂盒说明书测定细胞内ATP 含量。采用BCA 蛋白浓度测定试剂盒测定细胞总蛋白量,以每mg 蛋白样品中ATP 含量进行统计分析。每组3 复孔,实验至少重复3次。
1.14 Western 印迹法检测MLO-Y4 细胞中线粒体自噬相关蛋白表达水平
1.15 Lyso-Tracker观察自噬泡的形成
取1.3 分组处理48 h 细胞,去除上清液后各组细胞分别与Lyso-Tracker(50 nmol·L-1)室温、避光共孵育30 min,PBS 清洗2 次后置于DMIL 荧光显微镜观察细胞观察自噬泡的形成。
1.16 免疫荧光染色观察LC-3 在MLO-Y4 细胞线粒体中表达
取1.3 分组处理细胞48 h,去除上清液后各组细胞经4%多聚甲醛固定30 min,0.1%Triton X-100破膜5 min,10%胎牛血清封闭2 h,加入兔抗小鼠LC-3(1∶200)和小鼠抗小鼠Tom20(1∶300)抗体置于4 ℃孵育过夜。PBS 清洗后加入FITC 或Cy3 标记的二抗(稀释比),室温、避光孵育2 h。PBS 清洗后置于LSM900 激光共焦显微镜下观察LC-3 和Tom20 的荧光共定位情况,以此来反映LC-3 在线粒体中的表达。
1.17 统计学分析
实验结果数据采用x±s表示,用SPSS 16.0 软件进行统计学分析。多组间比较釆用单因素方差分析(one-way ANOVA),组间两两比较用LSD 检验。P<0.05为差异有统计学意义。
2 结果
2.1 Art对NaF诱导MLO-Y4 细胞存活率的影响
MTT检测结果(图1)显示,与细胞对照组比较,NaF 组MLO-Y4 细胞存活率显著降低(P<0.01);与NaF 组比较,NaF+Art 0.25,0.50 和1.00 μmol·L-1组细胞存活率呈浓度依赖性显著升高(r=0.9825,P<0.01)。
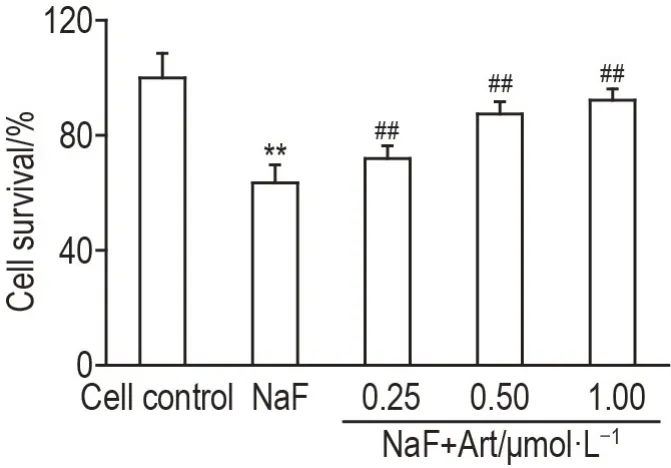
Fig.1 Effect of artesunate(Art)on cell survival in NaF-treated MLO-Y4 cells by MTT. MLO-Y4 cells were pretreated with Art(0.25,0.50 and 1.00 μmol·L-1)for 2 h,and then incubated with NaF(2 mmol·L-1)for 48 h. x±s,n=6. **P<0.01,compared with cell control group;##P<0.01,compared with NaF group.
2.2 Art对NaF诱导MLO-Y4细胞活性的影响
calcein-AM 染色结果(图2)显示,与细胞对照组比较,NaF 组MLO-Y4 细胞calcein 绿色荧光强度明显下降,表明NaF 对MLO-Y4 细胞活性有明显的抑制作用;与NaF 组比较,NaF+Art 0.25,0.50 和1.00 μmol·L-1组MLO-Y4 细胞calcein 绿色荧光强度显著增加,提示Art 可减弱NaF 诱导MLO-Y4 细胞活性的降低。
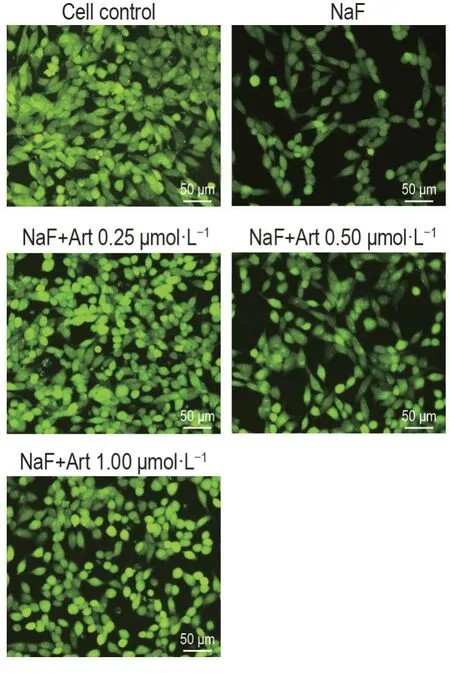
Fig.2 Effect of Art on cell viability in NaF-treated MLO-Y4 cells by calcein-AM staining. See Fig.1 for the cell treatment.
2.3 Art 对NaF 诱导MLO-Y4 细胞上清液中LDH含量的影响
LDH 检测结果(表1)显示,与细胞对照组比较,NaF 组MLO-Y4 细胞上清液中LDH 含量明显增加(P<0.01);与NaF 组比较,NaF+Art 0.25,0.50 和1.00 μmol·L-1组上清液中LDH 含量呈浓度依赖性地减少(r=0.9769,P<0.01)。

Tab.1 Effect of Art on supernatant lactate dehydrogenase(LDH)content in NaF-treated MLO-Y4 cells
2.4 Art 对NaF 诱导MLO-Y4 细胞内ROS 水平的影响
DCFH-DA 染色和流式结果(图3)所示,与细胞对照组相比,NaF 组MLO-Y4 细胞中DCFH-DA 绿色荧光强度显著升高(P<0.01),表明NaF处理可显著增加MLO-Y4细胞内ROS水平。与NaF 组比较,NaF+Art 0.25,0.50 和1.00 μmol·L-1组MLO-Y4细胞中DCFH-DA 绿色荧光强度显著降低(P<0.01)。
由于学生思维的活跃性,实际教学过程中往往会产生学生思维与教师预期结果大相径庭的情况。对教师来说,应当鼓励这些创新性思维,而并非根据自身预期结果去进行一味的否定,有的时候顺从学生的思维开展教学,往往能够取得意想不到的教学效果。
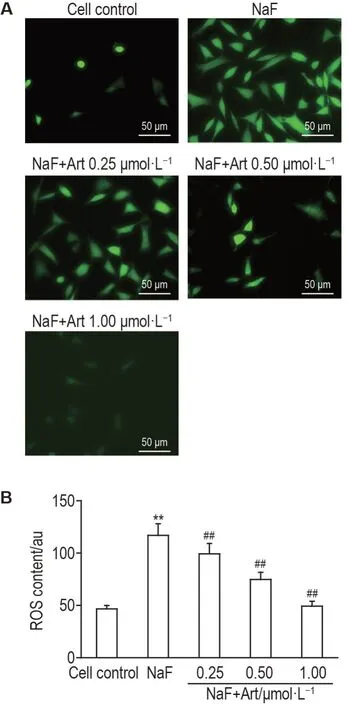
Fig.3 Effect of Art on level of intracellular ROS in NaF-treated MLO-Y4 cells by DCFH-DA staining using a fluorescence microscope (A) and flow cytometry (B).MLO-Y4 cells were pretreated with Art(0.25,0.50,1.00 μmol·L-1)for 2 h,and then incubated with NaF(2 mmol·L-1). B was the semi-quantitative result of A. x±s,n=4. **P<0.01,compared with cell control group;##P<0.01,compared with NaF group。
2.5 Art 对NaF 诱导MLO-Y4 细胞内MDA 含量和SOD活性的影响
表2 显示,与细胞对照组比较,NaF 组MLO-Y4细胞内MDA 含量显著增加,SOD 活性明显减少(P<0.01)。与NaF 组比较,NaF+Art 0.25,0.50 和1.00 μmol·L-1组MLO-Y4 细胞内MDA 含量显著减少,SOD活性明显增加(P<0.05,P<0.01)。
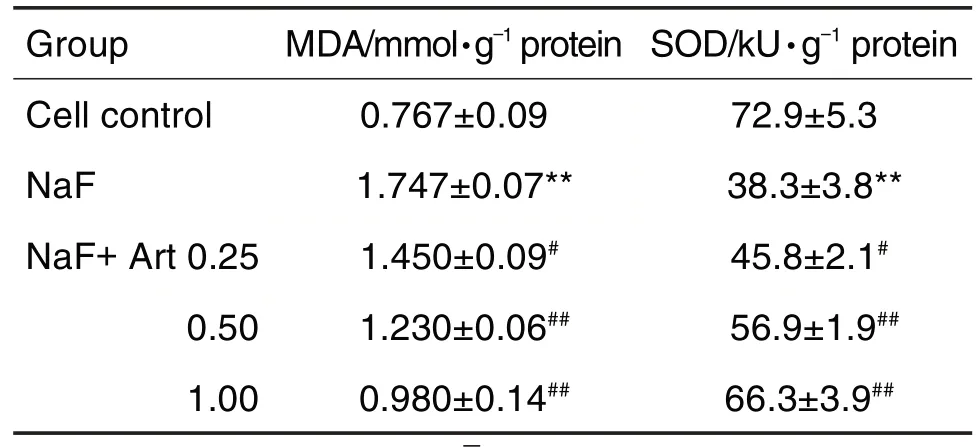
Tab.2 Effect of Art on malondialdehyde(MDA)content and superoxide dismutase(SOD)activity induced by NaF in MLO-Y4 cells.
2.6 Art 对NaF诱导MLO-Y4细胞核改变的影响
Hoechst33342 染色结果(图4)显示,细胞对照组MLO-Y4 细胞发出均匀的蓝色荧光,细胞核形态呈圆形或椭圆形,大小均一,无明显形态学改变;NaF 组MLO-Y4 细胞出现核皱缩和核碎裂等凋亡样特征,NaF+Art 0.25,0.50 和1.00 μmol·L-1组MLO-Y4细胞核皱缩和核破碎减少。
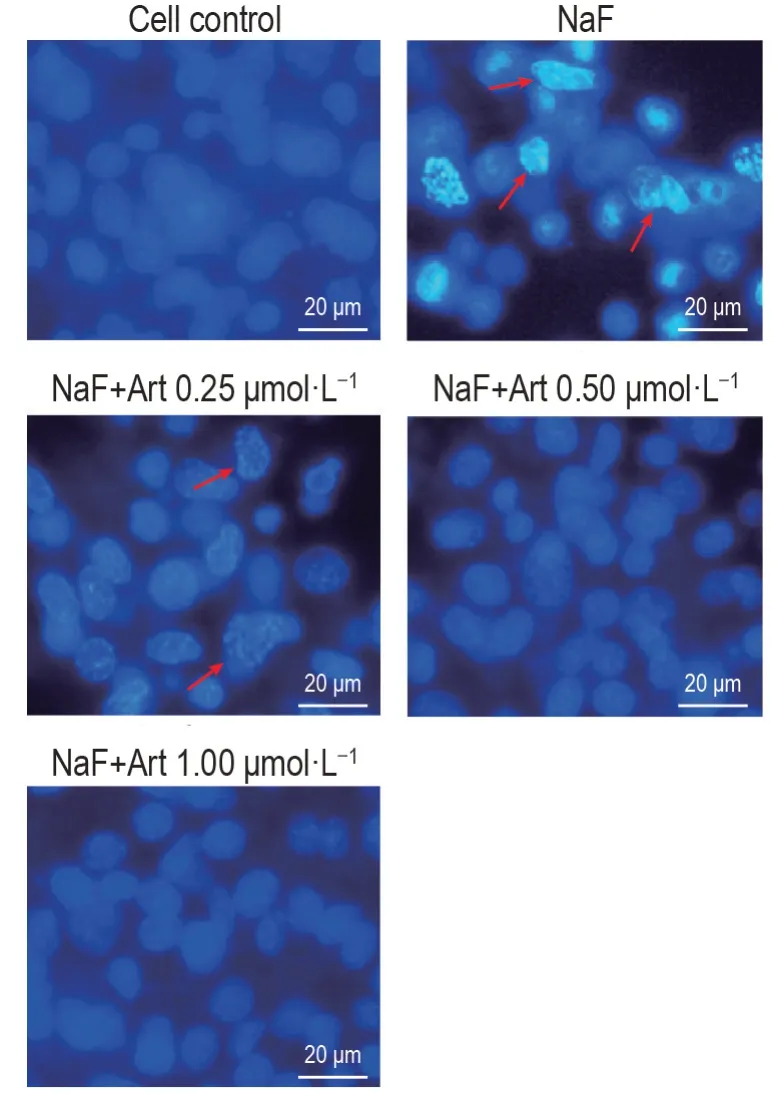
Fig.4 Effect of Art on nuclear morphology in NaFtreated MLO-Y4 cells. See Fig.1 for the cell treatment. Arrows show nuclear fragmentation.
2.7 Art 对NaF诱导MLO-Y4细胞凋亡的影响
图5显示,与细胞对照组比较,NaF组MLO-Y4细胞凋亡率显著升高(P<0.01);与NaF 组比较,NaF+Art 0.50 和1.00 μmol·L-1组MLO-Y4细胞凋亡率显著减少(P<0.05,P<0.01)。

Fig.5 Effect of Art on cell apoptosis in NaF-treated MLO-Y4 cells using flow cytometry. See Fig.1 for the cell treatment. B was the semi-quantitative result of A. x±s,n=3. **P<0.01,compared with cell control group;#P<0.05,##P<0.01,compared with NaF group.
2.8 Art对NaF诱导MLO-Y4细胞MMP水平的影响
JC-1染色结果(图6)显示,与细胞对照组相比,NaF 组MLO-Y4 细胞中绿色荧光强度显著上升,红色荧光强度明显下降(P<0.01),表明NaF可显著降低MLO-Y4 细胞MMP 水平;与NaF 组比较,NaF+Art 0.25,0.50 和1.00 μmol·L-1组MLO-Y4 细胞绿色荧光强度下降(P<0.01)。
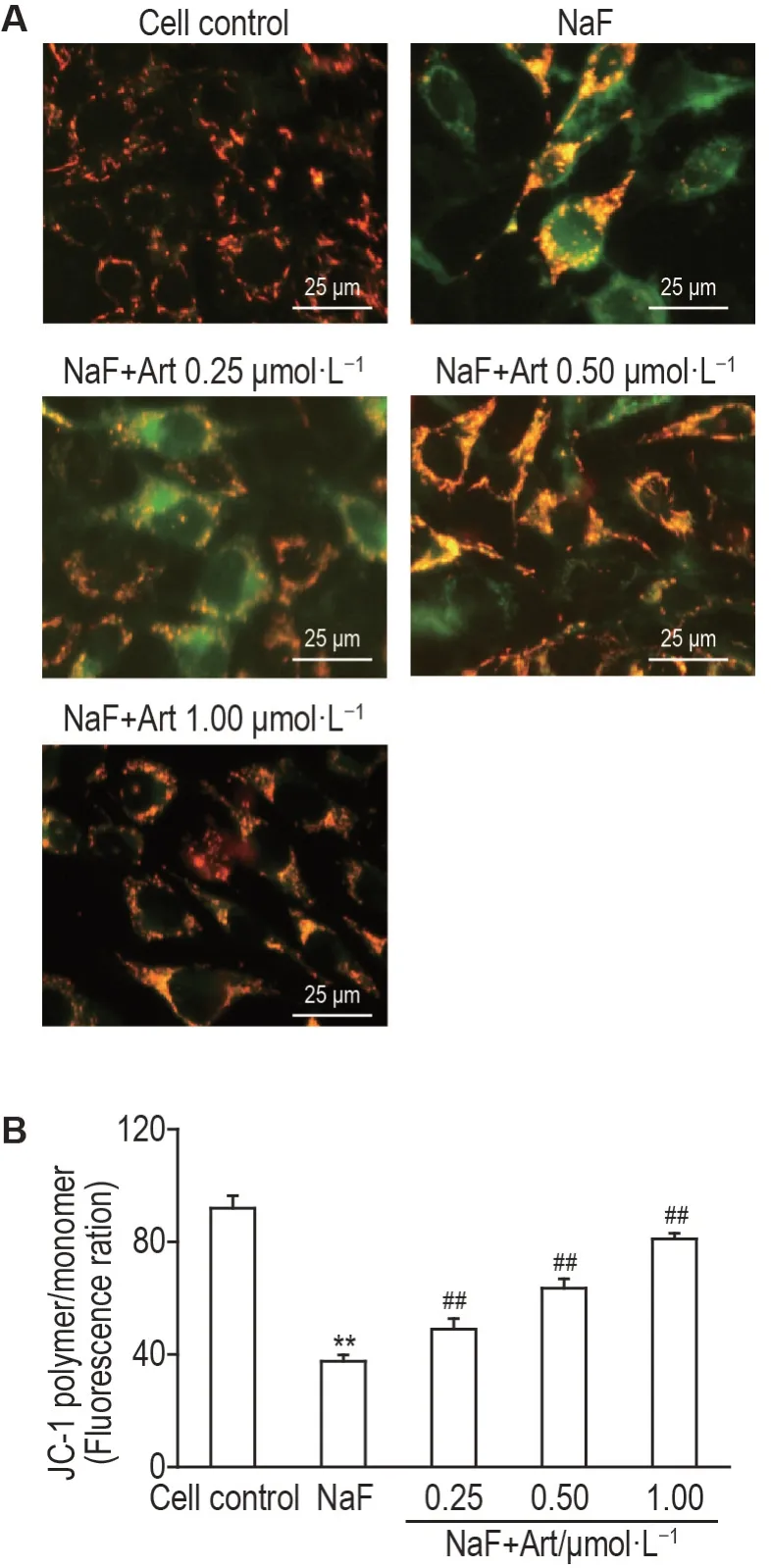
Fig.6 Effect of Art on mitochondrial membrane potential(MMP) level in NaF-treated MLO-Y4 cells by JC-1 staining using fluorescence microscope(A)and flow cytometry(B). See Fig.1 for the cell treatment. x±s,n=3. **P<0.01,compared with cell control group;##P<0.01,compared with NaF group.
2.9 Art 对NaF 诱导MLO-Y4 细胞内ATP 水平的影响
表3 显示,与细胞对照组比较,NaF 组MLO-Y4细胞内ATP 含量明显减少(P<0.01);与NaF 组比较,NaF+Art 0.25,0.50和1.00 μmol·L-1组MLO-Y4细胞内ATP含量明显增加(P<0.05,P<0.01)。

Tab.3 Effect of Art on ATP content in NaF-treated MLO-Y4 cells
2.10 Art 对NaF 诱导MLO-Y4 细胞线粒体形态的影响
Mito-Tracker 染色结果(图7)显示,NaF 组MLO-Y4 细胞线粒体明显被破坏,从相互交联的网状转换为短棒状或颗粒状;NaF+Art 0.25,0.50 和1.00 μmol·L-1组线粒体破坏明显被抑制。
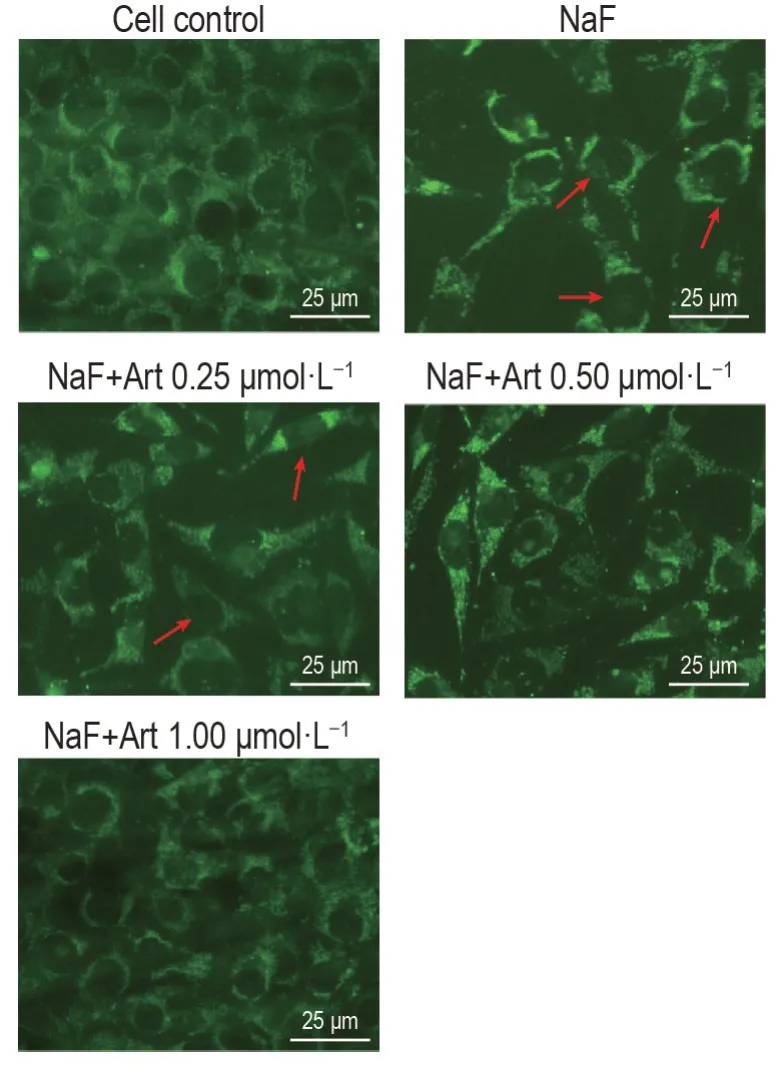
Fig.7 Effect of Art on mitochondrial morphology in NaF-treated MLO-Y4 cells. See Fig.1 for the cell treatment.Arrows show mitochondrial rupture.
2.11 Art 对NaF 诱导MLO-Y4 细胞线粒体自噬相关蛋白的影响
Western 印迹实验结果(图8)显示,与细胞对照组比较,NaF 组MLO-Y4 细胞中线粒体自噬相关蛋白PINK1 和Parkin 表达显著上调,LC-3Ⅰ向LC-3Ⅱ转换明显,LC-3Ⅱ/LC-3Ⅰ值升高,而P62表达明显下调(P<0.01),表明NaF 可诱导MLO-Y4细胞发生线粒体自噬。与NaF 组比较,NaF+Art 0.25,0.50 和1.00 μmol·L-1组MLO-Y4 细胞中PINK1 和Parkin 表达明显著减少,P62 表达显著增加,LC-3Ⅱ/LC-3Ⅰ值显著减少(P<0.05,P<0.01)。
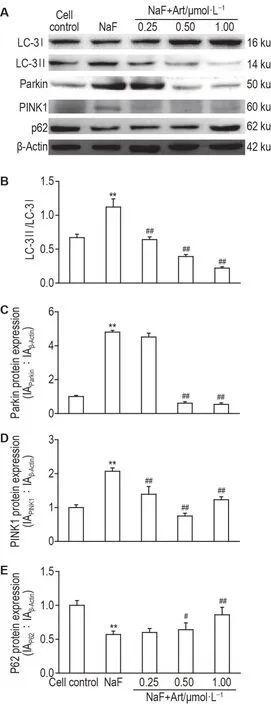
Fig.8 Effect of Art on expression levels of mitophagyrelated proteins in NaF-treated MLO-Y4 cells by Western blotting. See Fig.1 for the cell treatment. B-E were the semiquantitative results of A. IA:integrated absorbance. x±s,n=3.**P<0.01,compared with cell control group;#P<0.05,##P<0.01,compared with NaF group.
2.12 Art 对NaF 诱导MLO-Y4 细胞中自噬泡形成的影响
Lyso-Tracker 染色结果(图9)显示,与细胞对照组比较,NaF 组溶酶体呈高亮点红色的MLO-Y4细胞数目显著增加,表明NaF 可促进MLO-Y4 细胞自噬泡的形成;与NaF 组比较,NaF+Art 0.25,0.50和1.00 μmol·L-1组溶酶体呈高亮点红色的MLO-Y4细胞数目明显减少,提示Art 能抑制NaF 诱导MLO-Y4 细胞中自噬泡的形成,进而抑制自噬和线粒体自噬。

Fig.9 Effect of Art on formation of autophagic vacuoles in NaF-treated MLO-Y4 cells by Lyso-Tracker staining. See Fig.1 for the cell treatment.Arrows show the accumulation of autophagic vacuoles.
2.13 Art 对NaF 诱导MLO-Y4 细胞中LC-3 在线粒体中聚集的影响
免疫荧光染色结果(图10)显示,与细胞对照组比较,NaF 组MLO-Y4 细胞中损伤线粒体中LC-3(绿色荧光)表达增加;与NaF 组比较,NaF+Art 1.00 μmol·L-1组MLO-Y4 细胞中线粒体中的LC-3表达明显减少,表明Art 可抑制LC-3 在线粒体中聚集。

Fig.10 Effect of Art on co-localization of microtubule-associated protein 1 light chain 3(LC-3)with Tom20 in NaF-treated MLO-Y4 cells by immunofluorescence staining. See Fig.1 for the cell treatment. Arrows show increased expression of LC-3 in mitochondria.
3 讨论
本研究结果表明,Art 可显著抑制NaF 诱导的MLO-Y4细胞氧化损伤,表现为MLO-Y4 细胞存活率和细胞活性显著增加,ROS 和MDA 含量降低,SOD 活性明显增加,其机制可能是Art 结构中的酚羟基在体内被氧化释放H+,竞争性与MLO-Y4 细胞中自由基及氧化产物结合,保护脂质不被氧化,阻断自由基链式反应,从而减弱NaF 所致MLO-Y4 细胞损伤。因此,Art可通过抑制ROS 的产生,减轻氧化应激反应从而发挥对损伤MLO-Y4 细胞的保护作用。
研究结果表明,过量ROS可诱导线粒体膜通透性改变、破坏呼吸链和MMP 崩解[18-19]。后者常被视为细胞凋亡的早期事件之一[20]。另有报道,多种病理刺激可促进细胞内ROS 的产生,引起MMP 下降及ATP 合成减少,并促进凋亡蛋白Bax 易位进入线粒体、细胞色素C 从线粒体释放到细胞质中,启动胱天蛋白酶级联凋亡反应,最后通过激活胱天蛋白酶3/9 等来执行细胞凋亡[18,21-22]。而抑制MMP水平和ATP 合成的下降能减少NaF 所致MLO-Y4细胞凋亡。本研究发现,Art能显著阻止MLO-Y4细胞中MMP 和ATP 水平的降低,减轻线粒体破坏并减少细胞凋亡,表明Art 可通过调节线粒体功能而阻止NaF诱导MLO-Y4细胞凋亡。
线粒体自噬是近年来在自噬领域的一个新的研究热点。线粒体自噬是通过自噬途径将多余或受损线粒体的线粒体清除,在维持细胞内线粒体数量和维持线粒体正常功能等方面发挥重要的作用。有研究发现,当线粒体损伤或MMP 下降时,PINK1稳定在损伤线粒体外膜上并维持其激酶活性,同时招募原本处于抑制状态的Parkin 并使其磷酸化,活化后的Parkin 催化线粒体蛋白泛素化,并介导其与选择性自噬受体结合,最后与LC3 连接形成线粒体自噬[22]。病理条件下线粒体自噬水平增加会破坏骨代谢平衡[18,21-24],是骨质疏松症和关节炎等疾病的重要诱因之一。2014 年Yang 等[25]应用去势大鼠骨质疏松模型研究表明,骨细胞自噬水平增加可诱导破骨细胞生成和骨丢失。此外,Yuan 等[26]发现,PINK1 介导的线粒体自噬参与调控糖皮质激素诱导MLO-Y4细胞合成cathepsin K,后者可促进破骨细胞的形成和骨吸收。本研究结果表明,NaF 明显上调线粒体自噬相关蛋白PINK1 和Parkin 等表达,促进LC-3Ⅰ向LC-3Ⅱ转换,增加线粒体中LC-3的表达,下调自噬底物p62的表达,并增加自噬泡的生成。以上研究结果提示,NaF 可诱导MLO-Y4 细胞线粒体自噬,增加自噬和线粒体自噬水平,与我们前期研究结果一致[9]。Art 可显著减弱NaF 诱导MLO-Y4 细胞线粒体自噬,下调PINK1 和Parkin 表达,阻止LC-3Ⅰ向LC-3Ⅱ转换,同时减少LC-3 在损伤线粒体中的表达。由此推测,Art 可通过调控PINK1/Parkin 信号通路来减少线粒体自噬水平,从而阻止NaF所致MLO-Y4细胞损伤。
综上所述,Art可通过抑制细胞凋亡和线粒体自噬而发挥对NaF 所致MLO-Y4 细胞氧化损伤的改善作用。但本研究缺乏Art 对体内骨细胞活动影响的相关研究数据,后续我们将通过动物实验进一步探讨Art对NaF诱导的骨细胞损伤的改善作用。
