低氧诱导内皮-间充质转化致肺血管重构及药物干预研究进展
2024-04-13王洪麦夏晴晴盖祥云王金宇赵悦孚
王洪麦,夏晴晴,盖祥云,王金宇,赵悦孚
(青海民族大学药学院,青海西宁 810007)
肺动脉高压(pulmonary hypertension,PH)的肺血管异常收缩和血管重构,导致右心衰竭,甚至患者死亡[1]。根据病因可将PH 分为5种类型:动脉性PH(pulmonary arterial hypertension,PAH)、左心疾病所致PH、肺部疾病和(或)低氧所致PH、慢性血栓栓塞性PH 和(或)其他肺动脉阻塞性病变所致PH 及不明原因所致PH[2]。目前治疗药物包括内皮素受体拮抗剂、磷酸二酯酶5 抑制剂和前列环素类似物等[3]。然而这些药物的治疗主要针对前列环素、一氧化氮和内皮素等信号通路,抑制血管异常收缩,改善血管的舒张特性和患者心肺功能,对于肺血管重构的影响有限[4]。因此,急需寻求更有效的方法来解决肺血管重构问题。
血管内皮细胞(vascular endothelial cell,VEC)在调节血管稳态中发挥重要作用,通过释放多种生长因子和血管活性介质,调节肺血管的生理特性,影响血管收缩性和细胞生长[5]。内皮细胞暴露于病理性刺激(包括低氧和促炎因子在内的多种因素)下可发生动态表型转化,低氧可促使内皮细胞向间充质样表型转化,这一过程称为内皮-间充质转化(endothelial-to-mesenchymal transition,EndMT)[6]。
EndMT在多种心血管疾病中发挥重要作用,如心肌梗死、肺纤维化、动脉粥样硬化和PH 等[7]。以往研究肺血管重构机制重点关注内皮的作用,近年来EndMT 因其在PH 肺血管重构中的潜在作用受到越来越多的关注[8-9]。本综述旨在阐明低氧通过转化生长因子β/骨形态发生蛋白(transforming growth factor-β/bone morphogenetic protein,TGF-β/BMP)、Notch 和Wnt/β 联蛋白信号通路诱导EndMT 参与肺血管重构的机制,以期为研发治疗PH 药物提供新策略。
1 低氧诱导EndMT
低氧是导致EndMT 发展的重要因素。低氧时,内皮细胞经历向间充质表型的转变,并且间充质转化的程度会随低氧刺激持续时间变化;EndMT过程中,内皮特异性基因的抑制和间充质标志性基因的激活是由锌指蛋白SNAI1(zinc finger protein-SNAI1,Snai1)和锌指蛋白SNAI2(zinc finger protein SNAI2,Slug)及扭曲相关蛋白(twist-related protein,Twist)等转录因子调控[6,10-11]。EndMT主要是VEC发生表型变化,同时内皮细胞功能发生显著变化[12-13]。EndMT 过程破坏内皮的完整性,导致肺VEC 增殖和迁移能力增加,并且可能在将缓慢增殖的肺VEC 转化为高度增殖的细胞类型(如肌成纤维细胞)过程中发挥重要作用[14]。
EndMT 过程导致血管平滑肌细胞和成纤维细胞数量异常增多,并且此过程会导致细胞-细胞黏附的丧失,使得内皮细胞向血管内层移动和血管周围环境迁移,低氧可显著增强内皮细胞的迁移能力[15]。低氧诱导间充质标志物和EndMT 相关转录因子(如Snail 和Twist)上调,且Snail 是EndMT 过程的主调节因子[16]。EndMT 过程中,内皮细胞失去其特异性标志物如CD31和VEC-钙黏蛋白,并逐渐表达间充质特异性标志物如α 平滑肌肌动蛋白(alpha smooth-muscle actin,α-SMA)、钙调蛋白、成纤维细胞特异性蛋白1 和波形蛋白[17]。Yu 等[18]研究芍药苷(paeoniflorin)对Sugen5416 和低氧诱导的PAH 大鼠的影响,发现PAH 大鼠肺中内皮标志物下调,间充质标志物显著上调,而芍药苷处理后抑制肺中的EndMT,改善肺血管重构。此外,BMPⅡ型受体(BMP receptor 2,BMPR2)参与芍药苷抑制低氧诱导的EndMT,用小干扰RNA(small interfering RNA,siRNA)下调BMPR2 的表达,减弱芍药苷对低氧诱导的EndMT 的抑制作用。因此,抑制EndMT过程可能成为研究和治疗PH 的新方向。
2 低氧诱导EndMT参与肺血管重构
肺血管重构最重要的特征是细胞增殖、迁移和细胞外基质沉积导致的血管内膜、中膜和外膜的增厚,涉及VEC、平滑肌细胞和成纤维细胞等多种细胞类型[19]。EndMT 过程可引起平滑肌样细胞异常增殖,大量的细胞外基质蛋白表达,导致血管中膜增厚,进而引起血管重构。低氧条件下,肺VEC 通过EndMT 过程转化为平滑肌样细胞,这些平滑肌样细胞不仅导致血管的异常收缩,而且具有促增殖、迁移和产生细胞外基质,导致PH 肺血管重构的能力[12,20]。在低氧等因素刺激下,成纤维细胞过度产生细胞外基质,可导致组织硬化,影响血管功能;在PH 中,肺VEC 通过EndMT 过程向成纤维细胞表型转化,促进细胞外基质产生和胶原沉积,进而导致肺血管重构[21-22]。Wang 等[23]报道,丹参酚酸B 镁(magnesium lithospermate B)可抑制肺血管中低氧诱导的EndMT,改善肺血管重构,进而延缓PH的发展。
PH 中肺血管重构的确切机制尚不清楚,但越来越多的证据表明,VEC 功能障碍是导致肺血管重构的重要因素;VEC 功能障碍导致内皮中多种细胞信号通路激活,进而引起VEC、肺血管平滑肌细胞和成纤维细胞异常增殖,最终导致肺血管重构[24]。EndMT是PH中VEC 功能障碍的诱因之一,低氧刺激引起的血管内皮损伤可诱导VEC 通过EndMT过程转化为间充质样细胞,从而导致内皮功能障碍[5,25-26]。EndMT是炎症和内皮功能障碍之间复杂作用的关键环节。低氧条件下,炎症介质白细胞介素1β能持续激活VEC,并通过EndMT过程将其转化为间充质样细胞,导致正常内皮功能改变;此外,低氧可导致炎症反应和EndMT 的发生,炎症可导致肺组织氧气供需失衡,形成局部低氧微环境,进一步加重体内低氧程度,协同促进EndMT 的发展,导致肺血管重构[25,27]。Huang 等[28]研究阿司匹林对低氧诱导的PH 的影响,发现阿司匹林可抑制低氧诱导的EndMT,保护VEC,进一步改善肺血管重构。Cai等[29]研究发现,低氧诱导的PH小鼠肺动脉内皮细胞中过氧化物酶增殖物激活受体γ共激活物1α(peroxisome proliferator-activated receptor-γ coactivator-1α,PGC-1α)表达降低,而内皮特异性过表达PGC-1α 抑制肺动脉内皮细胞的EndMT,PGC-1α 过表达可通过抑制肺动脉内皮细胞的EndMT,恢复内皮功能,改善肺血管重构,缓解PH发展。丝氨酸/苏氨酸蛋白激酶(serine/threonine protein kinase 1,Akt1)对内皮屏障的完整性至关重要。Sabbineni 等[30]研究Akt1 介导的β 联蛋白信号通路在EndMT 和病理性肺血管重构中的作用,发现抑制Akt1 可导致EndMT,并加剧肺血管重构,使用β 联蛋白抑制剂ICG-001 可对EndMT 和肺血管重构进行靶向治疗。因此,可以将PGC-1α 和β联蛋白作为治疗PH肺血管重构的潜在靶点。
3 低氧诱导EndMT的相关信号通路
低氧诱导EndMT参与肺血管重构不是一个单独的过程,而是与多种信号通路相互作用,如TGF-β[14]、Akt/糖原合成酶激酶3β[31](glycogen synthase kinase-3β,GSK-3β)、Wnt[32]、Jagged/Notch[33]和NF-κB[34]等,这些信号转导通路调控低氧诱导End-MT 的具体机制尚不清楚,目前研究主要集中在低氧条件下信号通路中相关介质所发生的变化。本文重点讨论参与EndMT过程的TGF-β/BMP,Notch和Wnt信号通路及相关介质。
3.1 TGF-β/BMP信号通路
BMPR2 通路的异常和TGF-β/Smad 信号通路的激活是肺血管重构的驱动因素[35]。BMP是TGF-β超家族配体之一,BMP 与其受体结合触发受体调节Smad1/5/8磷酸化,磷酸化的Smad1/5/8与Smad4形成异寡聚复合物,该复合物转位到细胞核与其他转录因子结合,启动BMP/Smad信号转导[36]。低氧显著降低人肺动脉内皮细胞中BMPR2 的表达;抑制Smad1/5 的磷酸化水平,导致BMPR2 信号功能转导异常,从而引起肺动脉高压中EndMT 的发生(图1)[18]。Yuan等[37]发现,丹参(Salvia miltiorrhizaBge.)中的活性成分丹酚酸A 可提高Smad1/5 的磷酸化水平,激活BMPR2/Smad 通路,抑制低氧诱导的人肺动脉内皮细胞中EndMT。
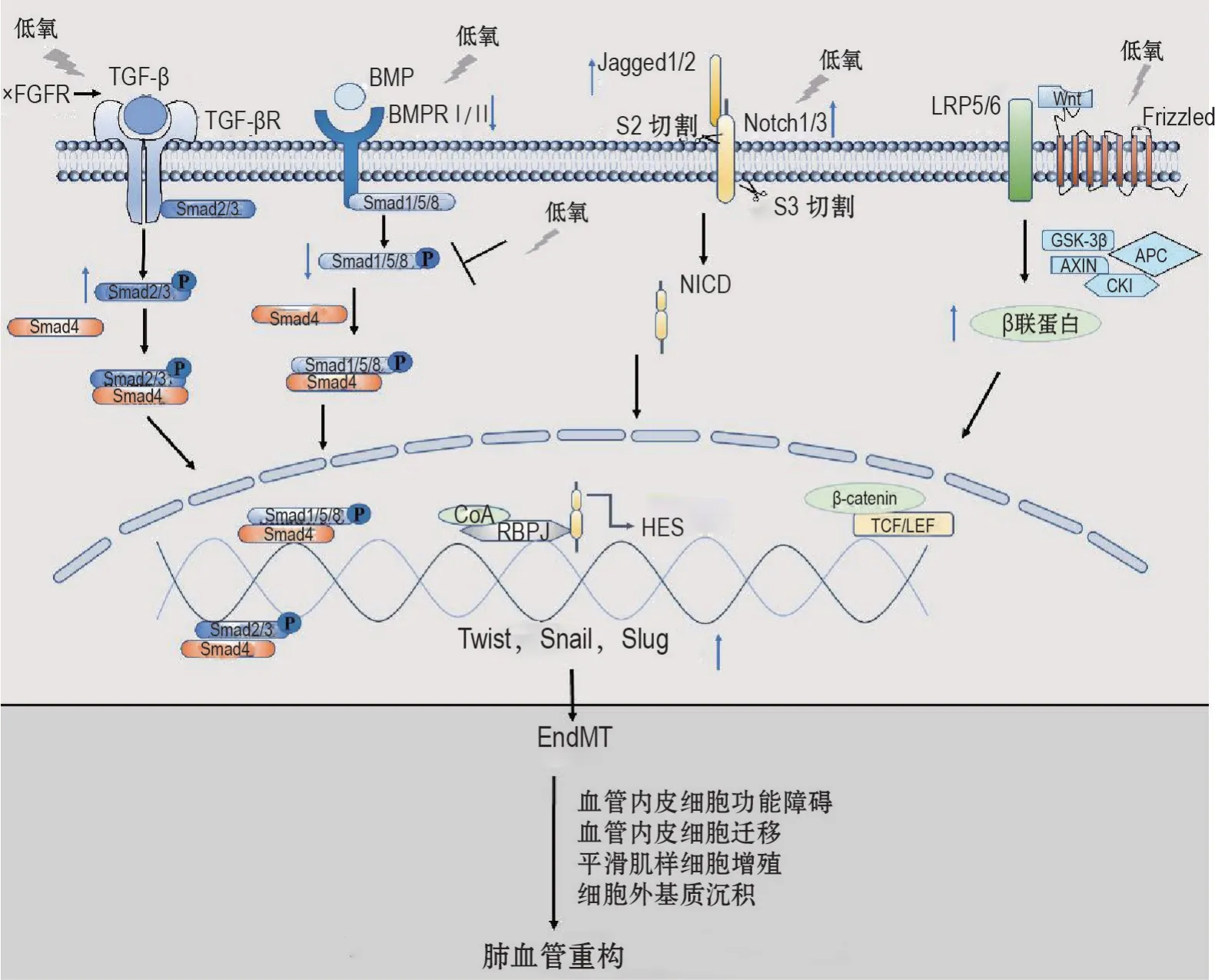
图1 低氧条件下诱导内皮-间充质转化(EndMT)的转化生长因子β(TGF-β)/Smad、骨形态发生蛋白(BMP)、Wnt/β 联蛋白(catenin)和Notch 信号通路. P:磷酸化;×:缺乏;BMPR:骨形态发生蛋白受体;FGFR:成纤维细胞生长因子受体;CoA:共激活剂;RBPJ:重组信号结合蛋白J;HES:发状分裂相关增强子;Frizzled:跨膜受体卷曲蛋白;LRP5/6:低密度脂蛋白受体相关蛋白5/6;GSK-3β:糖原合成酶激酶-3β;APC:腺瘤性激素蛋白;AXIN :轴蛋白;CK1:酪蛋白激酶1;TCF:T 细胞特异性转录因子;LEF:淋巴增强结合因子;↑:诱导,促进或增加;↓:降低;⊥:抑制.
低氧通过诱导TGF-β 信号通路加剧EndMT,TGF-β通路的下游介质Smad在PH发病机制中发挥关键作用;低氧促进TGF-β 诱导的磷酸化Smad2/3在细胞核中积累,导致Twist,Snail和Slug转录因子过表达,进一步导致EndMT发展(图1)。研究发现,内皮细胞中成纤维细胞生长因子受体功能下调,可促进低氧诱导的PH中EndMT过程,并增强TGF-β/Smad2/3 信号,而内皮细胞中成纤维细胞生长因子受体信号的激活可抑制EndMT 过程[38-40]。Tang等[27]报道,人参皂苷Rg1 可通过增加富半胱氨酸蛋白61 表达,抑制TGF-β 信号通路激活,进而抑制低氧诱导EndMT 的发生,改善肺血管重构。TGF-β超家族包括TGF-β1,TGF-β2和TGF-β3,3 种亚型均能诱导EndMT,但TGF-β2是最有效的诱导剂[16];TGF-β 信号通路参与低氧诱导的EndMT 过程,TGF-β2表达显著增加,且Smad2 和Smad3 磷酸化水平均升高[41],表明抑制TGF-β2诱导的EndMT 可能有利于改善PH 肺血管重构。Twist1通过TGF-β/Smad 通路调控低氧诱导的EndMT,过表达的Twist1可上调TGF-β2表达和Smad2磷酸化水平,诱导EndMT 发生;用SB525334(Smad2 磷酸化抑制剂)处理人肺动脉内皮细胞时,Smad2 的磷酸化水平降低,VEC-钙黏蛋白表达上调,α-SMA 的表达下调,抑制Twist1 过表达诱导的EndMT[42]。内皮细胞特异性Twist1缺陷小鼠可免受慢性低氧对PH 和肺血管重构的影响[43]。因此,对Twist1 表达的调节可能是改善肺血管重构的有效策略之一。
调节TGF-β/BMP 信号通路可能是一种潜在治疗PH的方法,目前认为激活BMPR2 或抑制TGF-β/Smad 信号通路可改善肺血管重构。但是由于BMP/Smad 和TGF-β/Smad2/3 信号途径均需要Smad4 才能发挥正常的功能,因此需要深入了解Smad4 在TGF-β/BMP 信号通路中的作用[44]。此外,BMP 信号通路在实验诱导的PH 中的作用可能与人类疾病中观察到的不同,甚至可能在模型之间也会有所不同,这也限制了药物的开发[45]。研究表明,上调或下调的微RNA(microRNA,miRNA)通过靶向血管细胞BMPR2 的表达抑制BMP 信号,但miRNA治疗PH 的潜力相对有限,靶向BMP 信号的miRNA 抑制剂或miRNA 模拟物在临床研究中仍然具有挑战性。miRNA 应用于临床的前提是其可靶向与疾病相关的组织细胞,由于肺部的复杂性,还需进一步研究miRNA 进入肺血管内皮细胞的特异性、安全性、效率和稳定递送。外源性BMPR2 基因传递可恢复BMPR2 信号,但需进一步改进载体技术才能转化到临床治疗肺血管疾病。不同的治疗方法取决于患者的特殊遗传背景,为了更有效治疗,还必须考虑导致疾病的其他遗传和环境因素[46]。
3.2 Notch信号通路
Notch 信号通路在低氧诱导EndMT 中具有重要意义,Notch 通路的异常与PH 相关。低氧条件下,内皮细胞中Notch2 表达受到抑制,而内皮细胞中其他Notch 受体家族成员Notch1、Notch4 和平滑肌细胞中Notch3 表达均上调[47-49]。Sahoo 等[47]发现,低氧刺激下人肺动脉内皮细胞中Notch2 mRNA 和蛋白表达均下调,且抑制Notch2 导致内皮细胞增殖和迁移能力增加,肺血管内皮细胞迁移能力增加是EndMT 的重要特征,且肺血管重构涉及血管内皮细胞和平滑肌细胞的增殖,迁移等过程[14,19]。Qiao 等[48]发现,Notch 信号通路在肺血管重构中具有重要作用,低氧诱导的PH 大鼠肺组织中Notch1、Notch3和Notch4mRNA 水平均升高,并且Notch1 和Notch 3 促进内皮细胞向平滑肌样细胞转化,Notch 1和Notch 4诱导内皮细胞的增殖和迁移增加,血管内皮稳态失衡;用γ-分泌酶抑制剂(2S)-N-〔N-(3,5-二氟苯乙酰基)-L-丙氨酰〕-2-苯基甘氨酸叔丁酯{N-〔N-(3,5-difluorophenacetyl)-L-alanyl〕-Sphenylglycine t-butyl ester,DAPT}处理低氧条件下的大鼠离体血管条,发现PH 血管壁厚度下降,且DAPT抑制Notch通路可抑制PH大鼠血管平滑肌细胞增殖和表型转化,最终改善肺血管重构。
生理条件下,Notch1 信号通路处于静息状态,但在低氧等应激情况下,Notch1 信号通路短暂激活。Notch 受体(Notch1,2,3 和4)与配体(如Jagged-1 和Jagged-2 蛋白)相互作用触发γ-分泌酶,介导跨膜Notch 受体裂解并释放Notch 胞内结构域(notch intracellular domain,NICD),NICD 转位至细胞核,与重组信号结合蛋白J 或其他转录因子相互作用,启动Notch靶基因转录,激活下游靶基因发状分裂相关增强子(hairy and enhancer of split,HES)(图1)[50-51]。Wang 等[13]发现,低氧可激活Notch3 信号通路,并诱导Notch3,Jagged-1和HES1 高表达,促进肺动脉内皮细胞向间充质细胞转化,用Notch 信号抑制剂DAPT 和敲低Jagged-1 均可抑制低氧诱导的EndMT,导致细胞活力和迁移能力显著降低,表明Notch3 在低氧诱导EndMT参与肺血管重构中具有重要作用。
上述研究表明,Notch 信号通路在低氧诱导EndMT 致肺血管重构中可能发挥关键作用。然而Notch 通路较复杂,不同细胞上表达的Notch 受体和配体相互作用,可反向激活Notch信号通路;同一细胞上表达的受体和配体相互作用,可激活或顺式抑制Notch 信号通路;Notch 信号通路的激活或抑制取决于配体;此外该通路激活或抑制可能受到受体和配体结合的亲和力以及它们相对量的影响,详细机制还需进一步研究。Notch 靶向治疗研究未能达到预期,可能是由于非特异性Notch 抑制剂亲和力低或者其会引起机体毒副反应等[52-53]。开发针对特定Notch 蛋白的高选择性抑制剂和影响Notch配体-受体相互作用的药物可能是理想的PH 治疗方法。
3.3 Wnt信号通路
Wnt 信号通路大致分为2 大类:经典Wnt/β 联蛋白通路和非经典的Wnt 信号通路,两者均参与PH的发生发展。经典Wnt/β-联蛋白信号通路异常调控在肺血管重构过程中发挥重要作用;Wnt缺失情况下,GSK-3β磷酸化β联蛋白,并与轴蛋白、腺瘤性激素蛋白和酪蛋白激酶1(casein kinase 1,CK1)结合降解β 联蛋白,从而抑制Wnt 信号转导。有研究报道,PAH 患者和低氧诱导的PH 模型肺组织中β联蛋白的表达水平显著升高,β 联蛋白积累并易位到细胞核,在核中与T细胞特异性转录因子/淋巴增强结合因子相互作用以调节EndMT 调控基因Twist,Snail和Slug等的表达(图1)[54-58]。研究报道,Wnt5a 表达上调可能拮抗Wnt/β 联蛋白信号通路[59],Zhang 等[60-61]发现,Wnt5a/BMP 信号通路可能是PH 肺血管重构的潜在机制,野百合碱(monocrotaline,MCT)诱导的PH 大鼠肺组织Wnt5a 和Wnt11 表达水平显著降低,而β 联蛋白表达水平显著升高。且低氧条件培养的肺动脉内皮细胞中Wnt5a和Wnt11表达显著降低,β联蛋白表达增加;更重要的是,在MCT 诱导的PH 大鼠和低氧条件培养的肺动脉内皮细胞中CD31 和VEC-钙黏蛋白表达显著降低,α-SMA 表达显著升高;此外,与低氧条件培养的肺动脉平滑肌细胞相比,低氧条件培养的肺动脉内皮细胞中沉默Wnt5a基因,BMPR2 表达和Smad1/5/8磷酸化水平显著降低,TGF-β1表达和Smad2/3 磷酸化水平显著增加。帕纳替尼(ponatinib)是一种酪氨酸激酶抑制剂。Kang 等[62]发现,帕纳替尼可抑制人肺微血管内皮细胞中TGF-β1诱导的EndMT,且帕纳替尼可通过抑制低氧诱导的人肺动脉平滑肌细胞中Wnt/β联蛋白信号通路和改善肺血管重构,延缓PH 发展。研究报道,Wnt/β 联蛋白信号通路抑制剂和激动剂包括LRP5/6 抑制剂、散乱蛋白抑制剂、CK1 激动剂和靶向β 联蛋白/TCF转录复合体的抑制剂(如4-硫脲基-苯磺酰胺衍生物LF3)等[63],但仅有少部分在PH模型中进行了测试,如LF3。Lei等[64]发现,LF3 可通过抑制平滑肌细胞的迁移和增殖改善PH,表明LF3 可能对肺血管重构有潜在的治疗作用。但Wnt 激活剂和抑制剂之间存在相互作用,可能导致不良事件发生,因此药物的安全性方面也值得进一步研究。考虑到Wnt信号通路的复杂性、信号组分的大量存在及其与其他信号通路(如Notch和BMP信号)的串扰程度,目前很难找到疾病中特异性靶向Wnt 信号通路的安全有效的药物[65-66]。
4 结语
PH 是一种破坏性血管疾病,其特征是肺血管异常收缩和血管重构,导致肺动脉压力升高、右心室肥厚,最终导致右心室功能衰竭,甚至患者死亡。肺血管重构包括VEC 功能障碍、肺动脉平滑肌细胞过度增殖、细胞外基质沉积和炎症等。目前,许多针对PH的药物研究倾向于扩张血管,提高患者生存率,临床上尚无有效改善PH肺血管重构的药物。如前所述,许多体外和体内研究均表明EndMT通过多种信号通路参与肺血管重构,促进PH 的发展,因此抑制EndMT 可能是改善PH 的有效策略。但PH 病理机制复杂,还需深入研究肺血管重构中TGF-β,Wnt 和Jagged/Notch 信号通路之间及它们与其他信号通路的相互调节作用,从而发现更多药物靶点和有效的疾病防治策略。同时研究表明,一些天然产物在PH 实验模型中疗效确切,但缺乏有效的临床实践,不能准确指导临床治疗,对具开发潜力的天然产物,如芍药苷、丹酚酸A 和人参皂苷Rg1 等进行更深入研究有望研发出安全、有效的PH 临床治疗药物。
