急性脑损伤并发ARDS患者中乳酸水平与EIT中背侧通气分布关联性的临床研究
2024-04-13王缓,郑欣,钟鸣
王 缓, 郑 欣, 钟 鸣
急性脑损伤(acute brain injury,ABI)包括创伤性脑损伤(traumatic brain injury,TBI)、脑出血(intracerebral hemorrhage,ICH)、蛛网膜下腔出血(subarachnoid hemorrhage,SAH)以及急性缺血性中风(acute ischemic stroke,AIS)等,是一组常见且发病率高的疾病[1]。ABI不仅致死率极高,而且幸存者常常伴随着广泛的神经功能障碍[2]。这些疾病严重影响临床预后,也大大降低了患者后期生活质量。并且,ABI不仅限于对脑部的严重影响,也可能引发颅外器官和系统的功能障碍。既往研究表明,在所有潜在的靶器官和系统中,肺部是脑损伤后最容易受到损害的部位[3]。高达30%的ABI患者会发生肺损伤及急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)[4]。ARDS是一种严重的肺实质炎症反应,涉及弥漫性肺泡损失和肺毛细血管通透性增加,导致肺泡液体渗出及气体交换障碍,从而发生低氧血症和肺生理异常。在脑损伤患者中,特别是颅脑外伤后,ARDS被认为是死亡率增加的关键因素之一,能使患者住院死亡的风险增加3倍[5]。对这些患者而言,准确监测和有效管理其呼吸状况至关重要,却也颇具挑战[6]。电阻抗断层成像(electrical impedance tomography,EIT)技术是近年来逐渐兴起的一种肺部通气监测新技术。作为一种无创的功能性成像方法,EIT能够实时反映肺部通气分布的不均匀性,对于ARDS患者的评估与管理具有重要价值。同样基于阻抗变化,高渗盐水增强EIT肺灌注成像可以用于肺血流生理的监测和量化通气血流匹配情况。乳酸作为代谢产物,在组织缺氧和全身性炎症反应中通常会上升,是评估组织代谢状态的重要生化指标。特别是在脑损伤后,由于脑组织对氧气的高需求,乳酸水平的监测显得尤为重要。尽管乳酸浓度及EIT背侧通气感兴趣区域(region of interest,ROI)在临床上已被单独应用于病情监测和评估,但两者间的关联性尚未被充分研究。现有文献对脑损伤后ARDS患者中这两项指标的联合应用和相关性探讨不足。本研究旨在探索ABI并发ARDS患者乳酸水平与EIT背侧通气ROI之和的相关性以揭示肺部通气不均和全身代谢状态之间的联系,为临床提供更为精准的评估和管理参数。
1 对象与方法
1.1研究对象 收集2020年5月至2021年12月复旦大学附属中山医院重症医学科收治的脑损伤并发ARDS患者的临床资料。纳入标准:(1)年龄>18岁。(2)患者因脑损伤术后入ICU。(3)接受EIT通气监测。(4)符合ARDS的诊断标准[7],包括急性发作,动脉血氧分压(partial pressure of oxygen in arterial blood,PaO2)/吸氧浓度(inspiratory fraction of oxygen,FiO2)≤300 mmHg,机械通气呼气末正压(positive end expiratory pressure,PEEP)≥5 cmH2O,胸部X射线检查显示双侧浸润,无心力衰竭。排除标准:(1)EIT监测禁忌证,如起搏器、烧伤或限制电极放置的伤口。(2)血流动力学不稳定,即收缩压(systolic blood pressure,SBP)<75 mmHg或平均动脉压(mean arterial pressure,MAP)<60 mmHg(尽管使用血管加压药)和(或)心率<55次/min。(3)患者的临床数据或EIT通气图像数据缺失。本研究获复旦大学附属中山医院医学伦理委员会批准[批号:B2019-230(2)R],符合赫尔辛基宣言。
1.2研究方案 (1)收集患者基线特征信息:性别、年龄、入ICU时的急性生理学和慢性健康评估Ⅱ(Acute Physiology and Chronic Health Evaluation,APACHE Ⅱ)评分、氧合指数(ratio of arterial oxygen partial pressure to fractional inspired oxygen,P/F ratio)、住院时间等。(2)收集患者EIT时的动脉血气指标和炎症相关指标数据。(3)收集患者EIT肺通气评估数据及同时段部分患者肺血流监测数据,然后获取其可视化床旁通气血流匹配度分析数据。将包含16个等距电极的EIT专用带放置在第4或第5肋间的胸部周围,并连接到EIT机器(PulmoVista 500;Dräger Medical GmbH,Lübeck,Germany)[8]。EIT信号以50 Hz的帧速率记录。在EIT数据基线记录5 min后,进行持续20 s的吸气末屏气。屏气开始2 s后,通过中心静脉导管注射10 mL 5% NaCl溶液。在2 s内推注的NaCl溶液通过肺循环,并且产生一条遵循典型首过效应动力学的阻抗稀释曲线。EIT通气成像是通过对5个连续呼吸周期的平均值进行离线跟踪分析获得。将EIT图像人为划分成4个平行区域或4个象限,即ROI1、ROI2、ROI3、ROI4。在本研究中,将患者肺通气EIT图像分为4个平行区域,测量各个区域中通气像素的百分比。在EIT肺通气水平比较时,采用分层法获得各ROI数值(区域通气测量值)。基于水平层,腹侧和背侧区域分别定义为从胸骨到脊椎沿轴线的上部和下部,即腹侧区域为ROI1+ROI2,背侧区域为ROI3+ROI4[9]。通过调整ROI的位置和尺寸,可定制肺部图像的区域量化。各ROI覆盖的区域由相应的区域阻抗波形显示。与全局阻抗波形相比,区域阻抗波形显示特定ROI内阻抗变化的总和,并可对肺部不同区域内的阻抗变化进行比较,即比较肺的区域通气分布情况。根据入组患者的背侧通气ROI之和(ROI3+ROI4),以中位数为界,可将患者分为背侧通气低水平组(n=6)和背侧通气高水平组(n=6)。根据动脉血二氧化碳分压(partial pressure of carbon dioxide in arterial blood,PaCO2)水平,以中位数为分界点分为PaCO2低通气组和PaCO2高通气组。
1.3研究终点 (1)探究ABI并发ARDS患者中EIT时血气指标P/F ratio、PaCO2、动脉血乳酸与EIT背侧通气ROI之和(ROI3+ROI4)的相关性。(2)探究ABI并发ARDS患者通气血流匹配的情况。将患者肺通气和肺灌注EIT图像按“左上、左下、右上、右下”分为4个象限区域(依次为ROI1、ROI2、ROI3、ROI4),进行以下测量:①死腔通气-EIT%,对应于通气但未灌注的像素除以通气和(或)灌注的像素总数。②分流-EIT%,对应于灌注但不通气的像素除以分类为通气和(或)灌注的像素总数。③通气血流匹配水平,对应于同时通气和灌注的像素除以通气和(或)灌注的像素总数。根据既往研究[10],通气血流匹配水平<60%提示通气血流匹配显著失调。
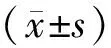
2 结果
2.1患者特征 共纳入12例患者,其中男6例,女6例,中位年龄64(42,81)岁,入ICU时中位APACHE Ⅱ评分为19(6,31)分,住ICU中位时间为12(7,39)d,住院中位时间为24(12,60)d,出院死亡9例,见表1。患者EIT时P/F ratio为(150±53)mmHg,各动脉血气指标见表2,炎症相关指标见表3。
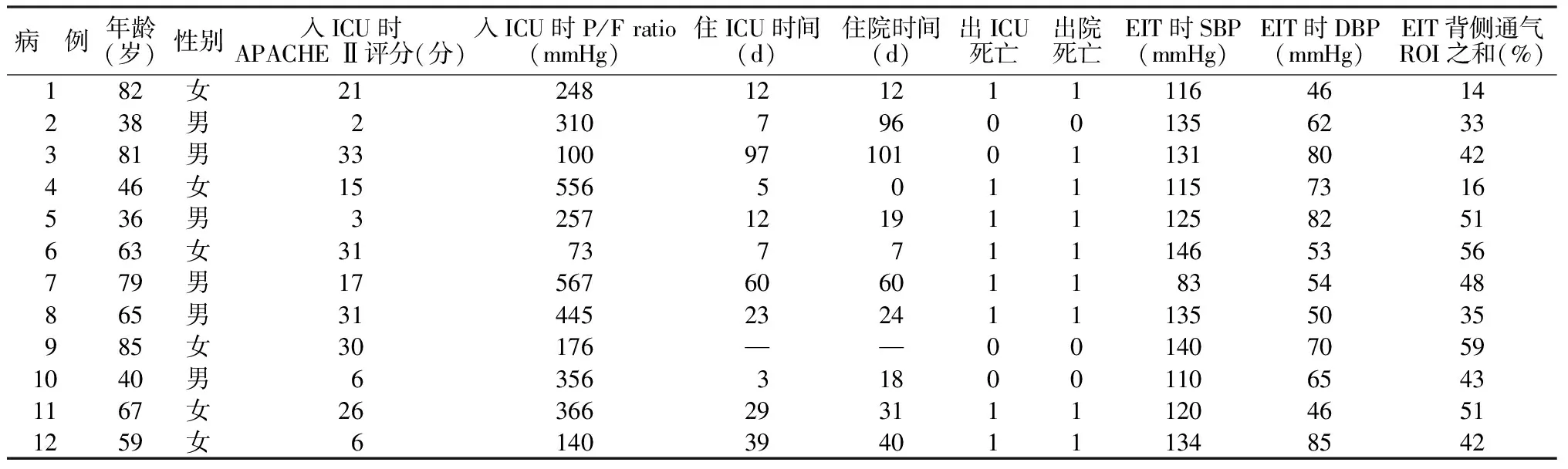
表1 12例ABI并发ARDS患者基线特征和EIT时SBP、DBP及EIT背侧通气ROI之和
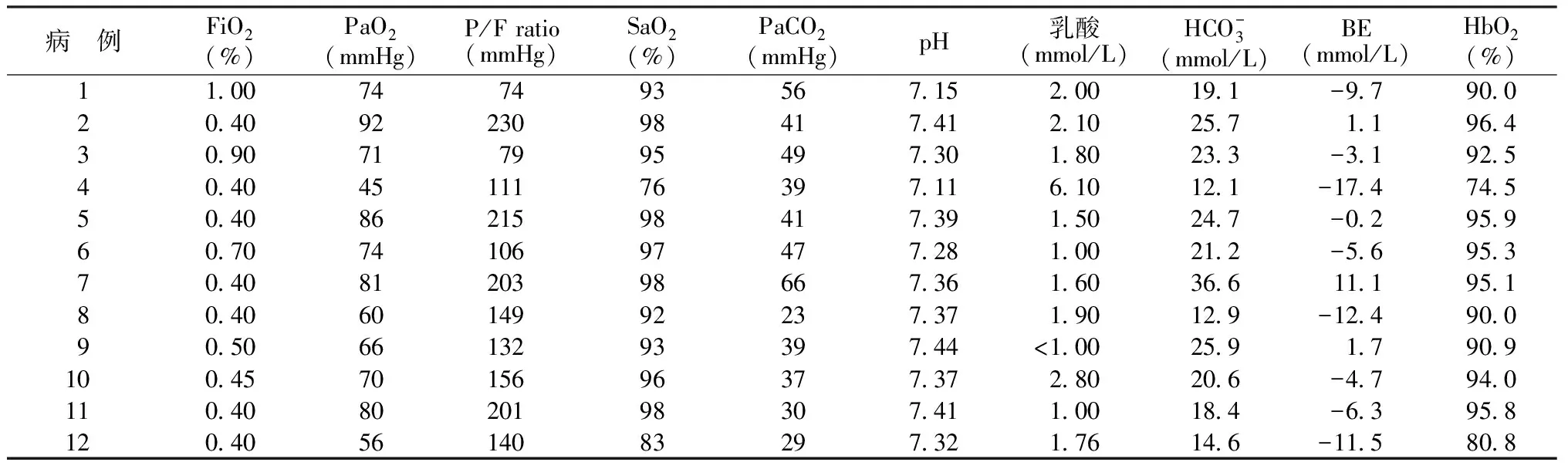
表2 12例ABI并发ARDS患者EIT时的动脉血气指标
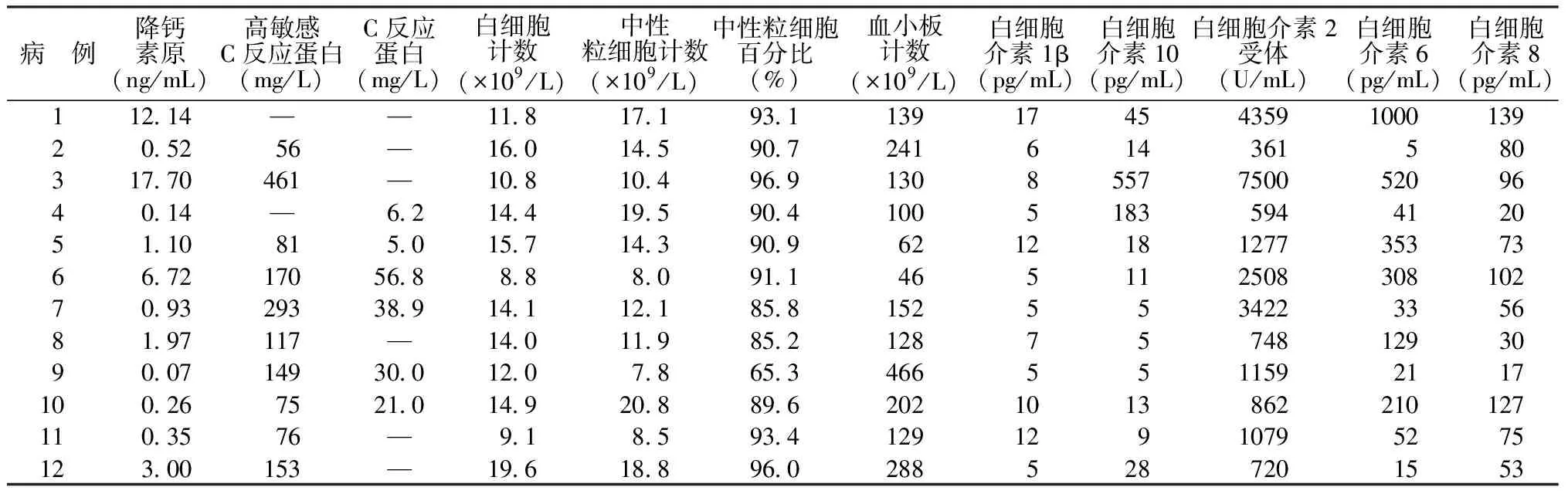
表3 12例ABI并发ARDS患者EIT时的炎症相关指标
2.2EIT监测下ABI并发ARDS患者背侧通气ROI之和与动脉血乳酸水平、PaCO2、P/F ratio的相关性分析结果 EIT监测时患者动脉血乳酸水平与EIT肺通气成像中背侧通气ROI之和(ROI3+ROI4)呈负相关(r=-0.700,P=0.011)。PaCO2水平、P/F ratio与背侧通气ROI之和(ROI3+ROI4)无明显相关性(P>0.05),见图1。
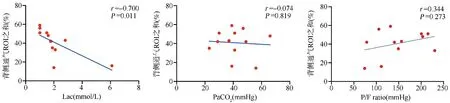
图1 EIT监测下ABI并发ARDS患者背侧通气ROI之和与动脉血乳酸水平、PaCO2、P/F ratio的相关性分析结果图
2.3背侧通气低水平组和背侧通气高水平组动脉血气指标及炎症相关指标比较 本研究中纳入EIT分析患者的平均背侧通气ROI之和(ROI3+ROI4)的中位数为43%(34%,51%)。背侧通气低水平组和背侧通气高水平组动脉血气指标及炎症相关指标比较差异均无统计学意义(P>0.05),见图2。
图2 背侧通气低水平组和背侧通气高水平组动脉血气指标及炎症相关指标比较结果图
2.4PaCO2低通气组和PaCO2高通气组动脉血气指标及炎症相关指标比较 PaCO2低通气组和PaCO2高通气组的动脉血气指标及炎症相关指标比较差异无统计学意义(P>0.05),见图3。
图3 PaCO2低通气组和PaCO2高通气组动脉血气指标及炎症相关指标比较结果图
2.5EIT监测下ABI并发ARDS患者通气血流匹配情况 根据本研究可获取的5例患者(病例1~5)肺通气及灌注成像数据分析,患者的平均死腔通气-EIT%为(45±18)%,分流-EIT%中位数为2%(0.1%,16%),平均通气血流匹配水平为(49±11)%(<60%),存在通气血流匹配显著失调。EIT测量的1例患者(病例2)的肺通气和肺灌注见图4。
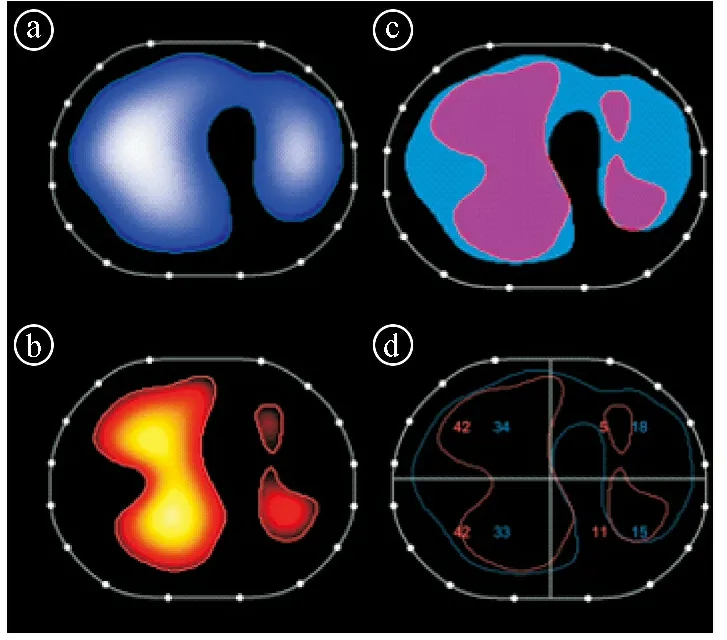
ⓐ代表性的通气(蓝色图谱)分布图像;ⓑ代表性的灌注(红色图谱)分布图像;ⓒ通过整合通气和灌注图谱获得的代表性图谱:粉色区域指同时被通气和灌注的匹配单元,而红色区域仅表示被灌注的单元,蓝色区域仅表示被通气的单元;ⓓ4个水平ROI中通气(蓝色数字)和灌注(红色数字)分布百分比的代表性图谱
3 讨论
3.1本研究发现,ABI并发ARDS患者中乳酸水平与EIT监测到的背侧通气ROI之和之间有明显相关性。在ARDS的治疗中,呼吸管理是至关重要的,而乳酸水平的变化可能反映了患者通气效率的改变。这项发现提供了一种新的生理标志物,有助于在EIT的辅助下调整通气策略,以优化患者的氧合和通气效果。此外,这一结果也提示我们,乳酸水平可能是评估ARDS患者肺部通气分布状态的一个有价值的间接指标,尤其是在ARDS常见的背侧通气不均的患者中。血乳酸浓度已经广泛用作危重患者组织灌注改变的标志物[11],连续的乳酸浓度监测结果可能比单个值更有参考价值。EIT床旁的连续实时监测或许能与乳酸水平变化呈一定相关性,但有待更多研究验证。
3.2本研究中床旁EIT可视化分析可见,ABI并发ARDS患者通气血流匹配存在显著失调,与既往研究[12]相符。这种失调可能导致气体交换效率降低,从而加剧了患者的低氧血症。EIT对于揭示ARDS患者通气血流匹配失调具有重要意义。这一发现强调了EIT在ARDS患者呼吸管理中的潜在应用价值,特别是在监测和调整通气策略以优化气体交换方面。然而,需要注意的是,尽管EIT提供了通气分布的重要视角,但其数据解释需结合患者的临床表现和其他监测结果进行综合判断。
3.3脑损伤并发ARDS的患者预后更差,死亡率更高,其中的相关机制也一直存在争议。在病理生理方面,脑损伤会引起呼吸系统力学的改变,包括肺部弹性和气道阻力,并导致全身和肺部炎症,以及肺静水压和通透性增加。颅内高压会增加肺通气不良区域的血管外肺水量,并可能直接加剧肺部炎症[13]。值得注意的是,脑损伤炎症介质引起的全身炎症状态本身就会使患者更容易发生机械通气相关性肺损伤及呼吸机相关性肺炎(ventilator associated pneumonia,VAP)[3]。在临床因素方面,除意识改变、误吸或微误吸是高危因素以外,脑损伤患者相关的吞咽障碍也会增加肺炎的发生风险。在分子机制方面,一方面脑损伤后引起的免疫抑制和脑-肺相互作用可能导致全身性炎症、肺部损伤以及感染[14-16];另一方面脑损伤后ARDS的发生可能是由神经源性肺水肿(neurogenic pulmonary edema,NPE)引起,后者与交感神经-肾上腺素系统的激活有关[17]。其中儿茶酚胺风暴“爆炸伤”理论是目前NPE病理生理机制解释中最为广泛接受的[18-19]。基于以上机制,ABI患者易发生ALI/ARDS。研究表明,乳酸是细胞缺氧的标志物。因此,通过动脉血乳酸与背侧肺通气及肺血流异常的相关性,有助于早期诊断ABI患者是否发生ARDS,并且通过EIT背侧通气连续反映患者乳酸水平,深化对ARDS发病机制的理解。
3.4本研究为单中心回顾性研究,受纳入患者样本量限制,关于EIT监测背侧通气水平与动脉血气指标及炎症水平的关联性还需要进一步验证。期待不仅在ABI并发ARDS的患者中,而且在更多类型的ARDS患者中进行临床研究,以进一步提高对这一疾病的综合治疗。
综上所述,在ABI并发ARDS的患者中,由于接受脑损伤和肺损伤的“双重打击”[20],这类患者的呼吸和整体管理更具挑战性。EIT监测的背侧通气ROI之和与患者动脉血乳酸水平具有明显的相关性,由此通过EIT通气监测不仅能实时反映患者肺通气血流变化,而且与患者全身代谢状态也有一定相关性。EIT监测有利于评估此类患者的通气血流匹配水平,对其进行个体化呼吸治疗。未来,期待更多样本量和多中心的临床研究能对相关结论和生理学表现进一步验证与深入探讨。
