蒙医三种基本体质人群肠道菌群结构差异研究
2024-04-11阿如热苏如那于红珍付明海
阿如热,苏如那,于红珍,白 丽,付明海
(1.国家药监局中药(蒙药)质量控制重点实验室,内蒙古 通辽 028000;2.内蒙古民族大学蒙医药学院,内蒙古 通辽 028043;3.海南医学院药学院,海南 海口 571199;4.中央民族大学药学院,北京 100081)
蒙医学是一门古老而具有丰富理论体系和实践经验的优秀传统医学,也是蒙古民族长期在医疗实践中与疾病斗争的经验总结。体质是由先天遗传和后天获得所形成的,是指在先天禀赋和后天获得的基础上所形成的生理功能和心理状态。人的体态、相貌、胖瘦、胃火、消化功能、智慧、举止、性格等各有差异,因此各有特性[1-3]。体质特性取决于父母先天特性、环境影响以及体内赫依、希拉、巴达干所含的比例。蒙医理论认为,将人体体质分为赫依型、希拉型、巴达干型、赫依希拉混合型、赫依巴达干混合型、希拉巴达干混合型、聚合型(赫依、希拉、巴达干三根聚合)等七种类型,其中尤以聚合型体质最佳。体质特性与父母的体质特性遗传密切相关,并且与胚胎发育过程中母亲的饮食生活条件有着紧密联系[4-5],即以赫依、希拉、巴达干三者的哪个为主,其秉性特征表现就可突出体现于人体上,例如,赫依型体质特性者主要表现为体态瘦小、肤色青灰、胃火不平、多言、行动轻盈,嗜好甘、酸、咸、辛味和热性饮食;希拉型体质特性者表现为体态中等、肤色及毛发微黄、胃火锐、耐寒、消化功能强、反应敏锐、多汗等,嗜好甘、苦、涩味及凉性饮食;巴达干型体质特性者表现为体态高大、身体肥胖、胃火钝、耐热、嗜睡、行动缓慢、性情温柔等,嗜好辛、酸、咸味和糙性饮食;赫依希拉混合型、赫依巴达干混合型及希拉巴达干混合型体质特性者可体现两种体质的秉性特征;聚合型体质特性者可体现三根均衡的秉性特征[1,6]。
前期研究发现,蒙医三种基本体质对健康人群血常规和血液流变个别指标影响较大,且不同体质人群中胃动素和胃泌素水平存在较大差异[7],使赫依、希拉、巴达干三种基本体质人员在形态结构、性格特点及生理机能等方面都表现出显著个体差异,成为辨别体质类型的重要指标。笔者通过对蒙医三种体质人群的尿常规、身体质量指数(BMI)、肠道菌群结构差异等的分析,进一步为蒙医体质科学判定及蒙医临床个体化用药提供科学依据;探讨肠道菌群与蒙医体质的相关性,为蒙医体质现代研究提供参考。
1 资料与方法
1.1 一般资料
选取内蒙古民族大学蒙医药学院2018—2021届18~25岁蒙古族本科生志愿者进行体质判定。纳入标准:神智正常、无病史、行为配合、自愿受试并在研究开始前均签署知情同意书的受试者;排除标准:去掉混合体质者,年龄小于18岁或者是大于25岁的受试者,填写问卷项目不完整、有疾病的受试者(如:有遗传病、先天性疾病、传染病、肥胖者等),未在知情同意书上签字的受试者,女生处于经期者。本研究内容已通过《内蒙古民族大学附属医院医学伦理委员会》伦理审查评议,伦理批件号为:NM-LL-2021-06-15-1。
1.2 体质判定
1.2.1 判定方法
根据《额氏蒙医体质分类与判定评分表》,围绕蒙医学基础理论[3]对于赫依、希拉、巴达干三种基本体质特征描述分别设问卷内容。给每一位自愿受试者发放问卷表,填写问卷内容及姓名、性别、年龄、民族、健康状况或病史、联系方式等基本信息,对填写表格的学生诚信度做判断。学生完成问卷打分后,初步筛选出赫依、希拉、巴达干及聚合型体质志愿者。最后,由蒙医临床专家结合打分结果经“望”“问”“触”三诊方法最终确定受试者。
1.2.2 判定标准
依据《额氏蒙医体质分类与判定评分表》对受试者进行体质判定。判定评分表中,赫依、希拉、巴达干偏盛体质者各有18个选项,总共有54个选项(表1)。54个选项中每人必选18个选项,每项记1分,3组分别计算总得分以及百分比。每2个体质者相差小于33.33%的看作为聚合型体质者,最高值和其余2型的相差均高于33.33%的视为单一体质者,余视为混合型体质者。

表1 额氏蒙医体质特性判定表Tab.1 Evaluation table of E’s Mongolian medicine physical constitution characteristics
1.3 样本的测定
1.3.1 尿样采集
受试者采集样本前1天不吃高脂类食品,不饮酒,不过度劳累,采集前空腹,不解小便,女生在经期不做尿常规。采用一次性专用塑料尿杯接中段尿液30~50 mL,迅速送往通辽市科尔沁区健安医院体检中心,使用自动尿液分析仪BT-200进行尿常规检测分析。
1.3.2 粪便样品采集
受试者在采样前1个月禁止服用胃肠动力类药品、各类抗生素和微生态调节剂等引起肠道内微生态环境改变的药品或食品。受试者于门诊采集新鲜自然排出的粪便约3 g,装入10 mL 大便采集管中,置于-80 ℃储存、备用。
1.3.3 实验仪器
电子天平(赛多利斯科学仪器有限公司),冷冻离心机(Multifuge X1R.Thermo Scientific),NovaSeq 6000测序仪(USA ILLumina),Qubit2.0 DNA 蛋白定量仪(赛默飞世尔科技有限公司),Agilent 5400 全自动毛细管电泳仪。
1.3.4 16S rRNA测序
采用试剂盒提取样本中DNA后,在1∶100琼脂糖凝胶上检测DNA含量和纯度。根据浓度,用无菌敷料水稀释DNA。使用特异性条形码引物(341F-806R 为F:CCTAYGGGRBGCASCAG,R:GGACTACNNGGGTATCTAAT)扩增16S V3+V4区。
PCR反应使用0.2 μL正向和反向引物以及约10 ng的模板DNA高保真PCR预混液(New England Biolabs)。循环过程包括在98 ℃初始变性1 min,然后再在98 ℃变性30 s,在50 ℃退火30 s以及在72 ℃延伸30 s的30个循环。将等容积的缓冲液(包含SYB绿色染料)和PCR产物以等比例混匀,并在2∶100琼脂糖的凝胶材料上通过电泳以完成测定。然后,用德国Qiagen凝胶材料提取检测试剂盒(德国Qiagen)纯化混合物的PCR产品,再使用美国Illumina公司的TruSeq DNA PCR-Free Library Preparation Kit建库检测试剂盒完成文库的建设,对建好的文库实行Qubit定量和文库测试,合格后使用NovaSeq 6000上机测试。
对检测后所得的原始数据(Raw Data)进行拼接、筛选,获得修饰统计数据(Clean Data)。再进行OTUs(Operational taxonomic units)聚集和生物类型解析,依据OTUs聚集结果,对各个OTU的代表顺序做生物标注,得出相应的种类统计信息和基于种类的丰度分布。同时,对OTUs 采用丰度、Alpha 多样性统计、Venn图等分析,以获得样本内生物富集度和均匀度统计信息。分别在各个类别水平(以门、属为主)上,统计各样本的信息种群组成。依据OTU及其聚类的分析结果和分类学相关信息,在各水平上开展对菌群构成的统计分析,包括主成分分析(principal component analysis,PCA)及群落组成分析等。
1.4 统计分析
使用GraphPad Prism 8.0.2进行数据统计分析。各分析指标数据以平均值±标准差(xˉ±s)表示。方差分析方法用于多组间比较,P<0.05视为具有统计学意义。
2 结果
2.1 三种基本体质人群生理指标分析
本研究共调查了283人,平均年龄为21岁,发放问卷回收率为100%,其中,赫依体质者24人(8%),希拉体质者57人(20%),巴达干体质者13人(5%),聚合型体质者42人(15%),剩余147人(52%)为混合型体质者。从各体质人群中随机抽取12人分配到各个不同体质组中,男女各半。
各受试者其尿液pH均在5.5~7.5正常范围内,组间无显著差异。尿蛋白(PRO)、尿糖(GLU)、胆红素(BI)、维生素C及尿酮(KET)均为阴性。赫依组、希拉组、巴达干组、聚合型组等各组间比较无显著性差异(表2)。
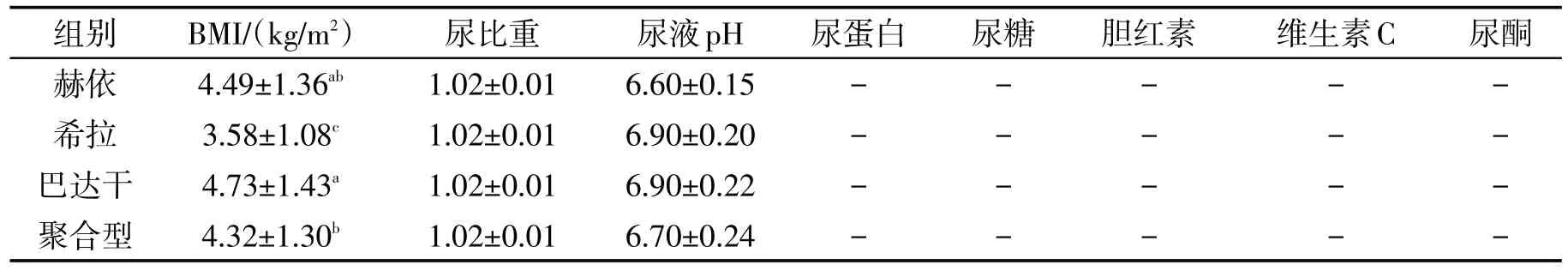
表2 各组BMI及尿常规指标比较Tab.2 Comparison of BMI and urine routine indexes in each group
根据各体质受试者身高(m)与体质量(kg),按BMI=体质量(kg)/身高2(m2)公式计算其BMI。表2结果显示,巴达干组与希拉组和聚合型组比较,BMI值显著增高(P<0.05);赫依组BMI值显著高于希拉组(P<0.05)。
2.2 肠道菌群物种进化树分析
通过多序列比对获得top100属的代表顺序,绘制进化树,发现肠道内细菌的进化途径分支主要集中在厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)、变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)、疣微菌门(Verrucomicrobiota)、广古菌门(Euryarchaeota)、脱硫菌门(Desulfobacterota)、梭杆菌门(Fusobacteriota)等8种菌门,其中厚壁菌门(Firmicutes)物种相对丰度最高,其次是拟杆菌门(Bacteroidota)和变形菌门(Proteobacteria)(图1)。
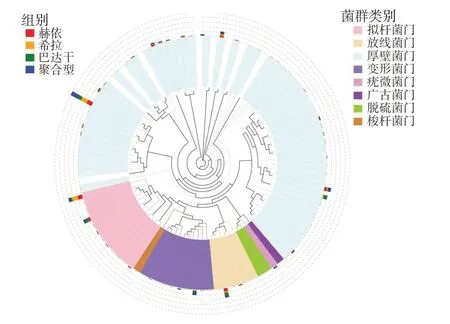
图1 各体质组肠道菌群物种系统发育图Fig.1 Gut microflora phylogenetic map of different physical constitution groups
2.3 Alpha多样性分析
Alpha多样性反映个体菌群的生物多样性。肠道菌群生物多样性主要以ACE、Chao1、Observed-species、PD-whole-tree、Simpson和Shannon指数等来反映。如图2所示,Observed-species、ACE和Chao1指数在赫依、希拉、巴达干三种单型体质组显著高于聚合型组(P<0.05)。PD-whole-tree指数中,赫依和希拉组显著高于聚合型组(P<0.05)。Shannon 和Simpson 指数在4组间比较无显著差异。以上结果提示,赫依组、希拉组、巴达干组与聚合型组相比,肠道菌群群落丰度发生了显著变化。
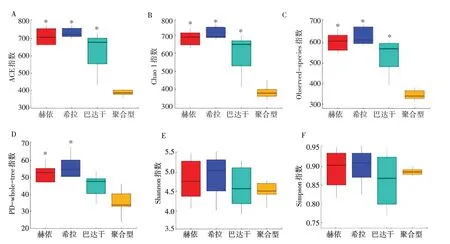
图2 Alpha多样性指数图Fig.2 Index charts of Alpha diversity
2.4 OTU数及Beta多样性分析
肠道菌群分析结果共获得2 583 203 条原始reads,平均长度为414 bp。经质控过滤后,平均每个样本得到80 045个有效数据。经聚类分析,共鉴定出2 536个OTU,获得了40门、286科、465属的微生物群落信息。维恩图显示,在2 536个OTU的总丰度中,4组重叠共有OTU 386个。赫依、希拉、巴达干3组与聚合型组之间单独重叠OTU 数依次为178、133、18(图3A)。该结果说明,三种基本体质组与聚合型组OTU相似度依次为赫依组>希拉组>巴达干组。
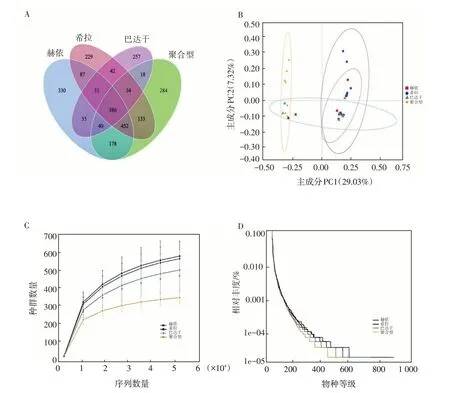
图3 OTU(A)及Beta多样性(B~D)分析图Fig.3 Analysis charts of OTU(A)and Beta diversity(B-D)
Beta多样性反映生物复杂性的差别程度,利用该指数得到的分析图中距离越大表示样本间的差异越大。PCoA分析技术用于研究样品群体构成的相似之处或不同,每个点代表一个样品,点和点之间的相距越大表示样品间菌群构成差异性越大。4组PCoA分布出现明显分离(图3B),其中,聚合型组与其他3组相比分离度最大,说明其菌群构成与三种基本体质组差异较大。此外,随着样品测序量的增加,稀薄曲线达到平台,趋于饱和,物种数量不再线性或快速增加,表明测序数据量合理(图3C)。4组斜率的秩丰度呈现一致的趋势,说明测序深度足以反映群落的微生物多样性(图3D)。
2.5 各组菌落结构分析
各组受试者10种门水平肠道菌落中,厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidota)的相对丰度最高,约占75%;而在属水平肠道菌落中,粪杆菌属(Faecalibacterium)、拟杆菌属(Bacteroides)、普氏菌属(Prevotella)、双歧杆菌属(Bifidobacterium)4种菌属占比最高,约占50%(图4)。

图4 门和属水平群落分析图Fig.4 Analysis charts of gut microflora at phylum and genus level
不同体质组间特征菌落存在显著差异(图5)。在门水平上,赫依组拟杆菌门(Bacteroidota)显著高于聚合型组(P<0.05),而变形菌门(Proteobacteria)在巴达干组显著高于赫依组(P<0.05)。在属水平上,赫依组与巴达干组相比,巨单胞菌属(Megamonas)和埃希氏菌-志贺氏菌属(Escherichia-Shigella)在2 组间存在显著差异(P<0.05);希拉组与巴达干组相比,普氏菌属(Prevotella)和拟杆菌属(Bacteroides)在2组间具有显著差异(P<0.05);拟杆菌属(Bacteroides)在希拉组中表达显著高于聚合型组(P<0.01);粪杆菌属(Faecalibacterium)在巴达干组表达显著低于聚合型组(P<0.05)。

图5 各组间特征菌落差异Fig.5 Differences of characteristic microflora among groups
2.6 功能预测
在Level2水平上,赫依组、希拉组、巴达干组和聚合型组等4组中丰度排序靠前的特征功能信息包括药物抵抗(Drug resistance)、脂肪代谢(Lipid metabolism)、碳水化合物代谢(Carbohydrate metabolism)、氨基酸代谢(Amino acid metabolism)、免疫系统(Immune system)等,说明不同体质人群在营养代谢、药物耐受和免疫功能方面存在较大差异(图6)。
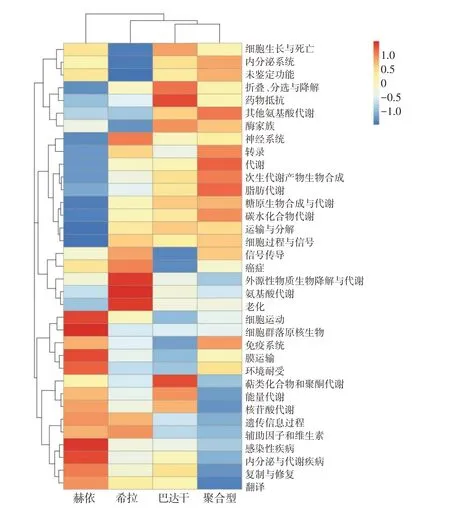
图6 各组间特征Tax4Fun功能预测Fig.6 Tax4Fun functional prediction among different groups
3 讨论
体质是人体生理和心理与生俱来的特性[8]。蒙医理论将人的体质分为七种,其中,赫依、希拉、巴达干为主的单一体质称为三种基本体质。赫依体质人群嗜甘、酸、咸、辛食物之品,根据胃火不均特点,宜食易消化饮食;希拉体质人群嗜甘、苦、涩食物之品,根据胃火旺盛特点,应少服用具有土源、重效的饮食;巴达干体质人群嗜辛、酸、咸食物之品,根据腹坚特点,宜食温热性轻的易消化食物[9-10]。因此,笔者选择蒙古族年轻人群(18~25岁)为受试者,结合《额氏蒙医体质分类与判定评分表》和蒙医三诊方法判定受试者基本体质,对其肠道菌群结构差异进行了分析,为蒙医基本体质判定和临床个体化用药提供科学依据。
肠道菌群被称为调控人体的“第二基因组”,在人类预防和治疗疾病中的作用逐渐被重视[11]。本研究中Alpha 多样性和Beta多样性分析结果表明,三种基本体质及聚合型体质人群之间菌群结构存在显著差异,其中,赫依组拟杆菌门(Bacteroidota)显著高于聚合型组,其与代谢性疾病呈负相关,它也是肠道菌群中的主要菌群,有促进肠道黏膜血管的形成、维持肠道生态平衡的作用[12]。从拟杆菌门的变化来看,各体质组相对丰度按高低排序依次为赫依组>希拉组>巴达干组>聚合型组。可见各体质组因个体差异所导致拟杆菌门的丰度不同。Alpha多样性指数结果显示,巴达干组的丰度和多样性降低,与以往文献报道的长期高脂饮食能降低肠道菌群物种的丰富性以及多样性相一致[13-14]。变形菌(Proteobacteria)外膜有脂多糖,使人体内脂肪沉积增加,致使人肥胖[15]。因此,巴达干体质人群体重和BMI值显著高于其余组,可能与变形菌表达较高相关。同样,巨单胞菌属(Megamonas)、埃希氏菌-志贺氏菌属(Escherichia-Shigella)、普氏菌属(Prevotella)与碳水、氨基酸以及脂肪代谢密切相关,并与体重和BMI呈正相关[16-18]。粪杆菌属(Faecalibacterium)是有益菌,与免疫功能密切相关,对人体健康起到重要作用[19]。此外,功能预测结果提示,不同体质人群肠道菌群结构的差异化导致了对药物的耐受和抵抗机制不同[20],进一步表明对不同体质患者实施个体化用药的重要性和科学性。
4 结论
笔者从蒙医学角度对三种基本体质人群肠道菌群进行了分析,发现不同体质人群肠道菌群结构存在显著差异,且与调节多种营养物质代谢、免疫功能和药物耐受等重要生理功能密切相关。该发现为蒙医体质科学判定和临床个体化用药提供科学依据。
