猪轮状病毒G1P[7]株分离鉴定及多克隆抗体制备
2024-04-11李素芬汤学超周金柱王丹丹朱雪蛟陶然李运川郭容利张雪寒李彬
李素芬,汤学超,周金柱,王丹丹,朱雪蛟,陶然,李运川,郭容利,张雪寒*,李彬*
(1. 南京农业大学动物医学院,江苏 南京 210095;2. 江苏省农业科学院兽医研究所,江苏 南京 210014)
轮状病毒(rotavirus,RV)感染与多种哺乳动物和鸟类的肠炎和腹泻有关[1]。RV是非囊膜二十面体病毒颗粒,包含11段双链 RNA基因组[1]。病毒粒子由3层病毒结构蛋白组成,VP2构成核心,VP6构成内层,VP7和VP4构成外壳,外壳包含血清型/基因型特异性表位。根据VP6蛋白的抗原性可将RV分类为12个血清群(A~L)[2-3],A、B、C、E和H群RV已经被证实可感染猪,其中感染人和动物最常见的为A群轮状病毒(RVA)。
猪轮状病毒A群(PoRVA)感染仔猪呈世界流行,各国猪场中 PoRVA 的阳性率呈明显走高趋势,报道最高感染率可达70%以上,引起世界各国重视[4-5],常与猪流行性腹泻病毒(PEDV)等其他腹泻病原混合感染,给世界养猪业造成严重的经济损失[6-7]。2种外衣壳蛋白(VP7和VP4)刺激中和抗体的产生,形成了RVA菌株G(糖蛋白)和P(蛋白酶敏感)双基因分型系统的基础。这种双基因分型系统通常用于RVA分类,并由轮状病毒分类工作组不断更新。根据这一分类体系,全球已描述了42种G和58种P基因型[8-9]。G/P双基因组合的多样性是免疫保护的重要决定因素,与疫苗研制高度相关[8,10]。因此,持续监测流行的RVA毒株对于了解区域流行病学信息和更新新型疫苗毒株非常重要。
小鼠EDIM毒株和猿猴SA-11毒株是能够在细胞培养中繁殖的第一批RV毒株[11-12]。牛和人源RV分别于1971年和1980年在细胞培养中首次分离出来[13-14]。本研究旨在从临床发病猪样品中分离PoRV,对分离毒株的VP4和VP7基因进行序列和遗传进化分析,为疫苗研制储备生物学材料,并且制备该分离毒株的多克隆抗体,为PoRV致病机制研究提供可靠的工具。
1 材料与方法
1.1 病料来源
从江苏省南京市附近某猪场采集腹泻猪粪便,将3份粪便与1×MEM(含双抗,其中青霉素浓度为 200 U/mL,链霉素终浓度为200 mg/mL),按1∶3进行均质化,反复冻融2次,低温12 000 r/min离心5 min,取上清液先后使用0.45 μm和0.22 μm滤器过滤,其中吸取部分用于 RNA 提取和RT -PCR检测,剩余部分用于病毒分离。
1.2 主要试剂、细胞和动物
RNA提取试剂盒(Fast Pure Cell/Tissue Total RNA Isolation Kit V2),HiScript Ⅲ 1st Strand cDNA Synthesis Kit(+gDNA wiper)和2×GreenTaqMix 预混液购自南京诺唯赞生物科技股份有限公司。MA104细胞由江苏省农业科学院兽医所保存。MEM和胰酶购自上海源培生物科技股份有限公司;四季青胎牛血清购自浙江天杭生物科技股份有限公司;PoRVA 的VP6单克隆抗体由本实验室制备[15];His-sumo-VP4*P7(26~231 aa)重组蛋白由本实验室制备,是将VP4基因完整阅读框的78~693位核苷酸序列克隆到pCold-sumo质粒,大肠杆菌表达纯化所得,浓度为2 mg/mL;FITC-羊抗小鼠二抗、FITC-羊抗兔二抗和HRP-羊抗兔二抗购自武汉博士德生物科技有限公司。新西兰大白兔2只,体重3 kg/只,采购自金陵种兔场。
1.3 引物设计与合成
本研究使用引物主要用于检测PEDV、传染性胃肠炎(TGEV)、猪德尔塔冠状病毒(PDCoV)、RV、伪狂犬病毒(PRV)和牛病毒性腹泻病毒(BVDV),委托南京金斯瑞生物科技有限公司合成,如表1。
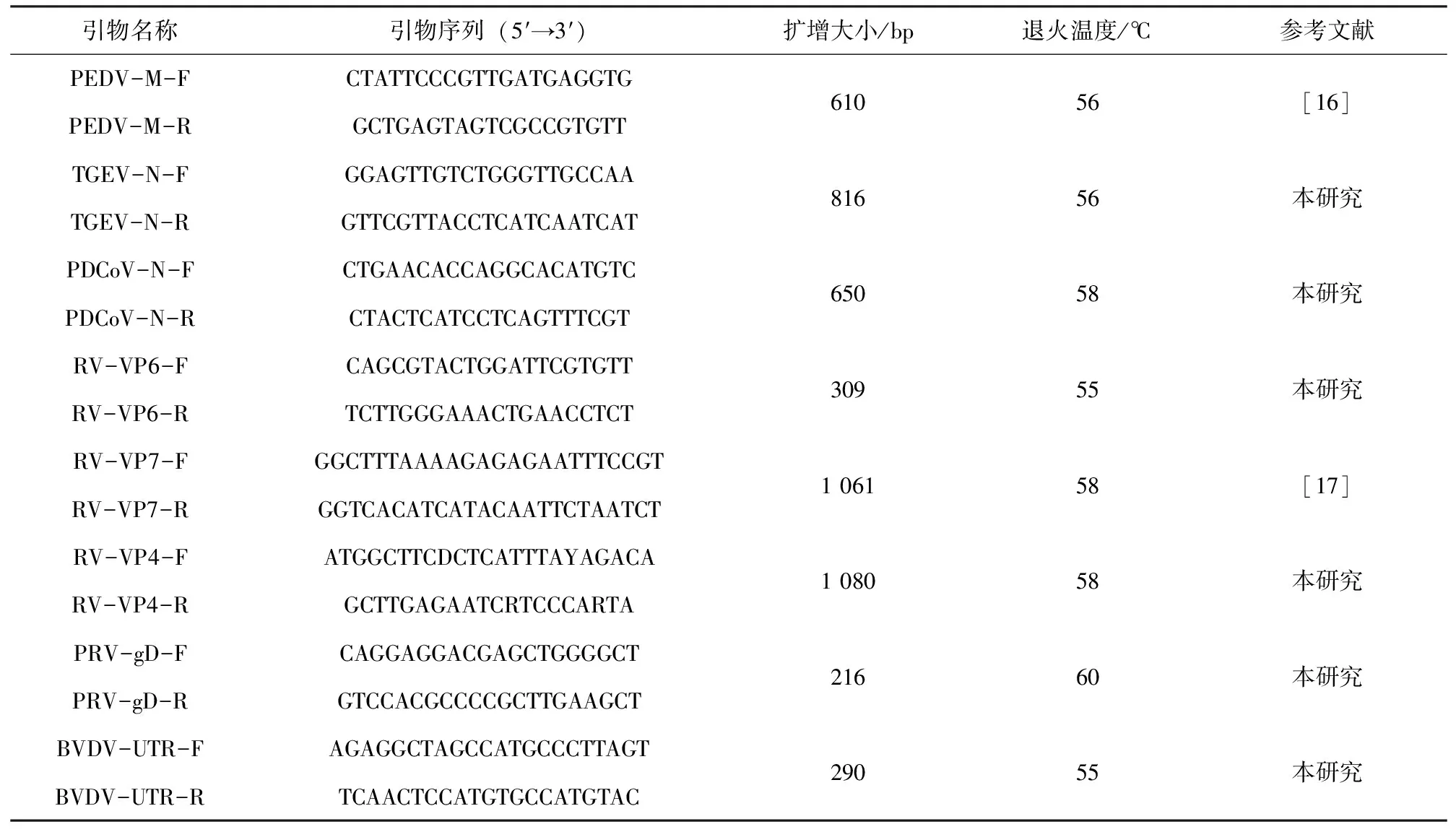
表1 引物信息
1.4 病原的RT-PCR检测
吸取1.1中处理的上清液样品100 μL,参照核酸提取试剂盒说明书提取总RNA和DNA。按照反转录试剂盒HiScript Ⅲ 1st Strand cDNA Synthesis Kit(+gDNA wiper)说明书进行反转录获得cDNA。利用2×GreenTaqMix和6种腹泻相关病毒(PEDV、TGEV、PDCoV、RV、PRV和BVDV)的检测引物进行检测。PEDV和TGEV:95 ℃预变性3 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃延伸10 min。PDCoV:95 ℃预变性3 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃延伸10 min。PRV:95 ℃预变性3 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃延伸10 min。BVDV和RV-VP6:95 ℃预变性3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃延伸10 min。
1.5 病毒分离和传代
将长满单层的MA104细胞进行消化和传代,铺1块6孔板,待细胞长满单层后接毒。首先将1.1中过滤处理上清液预处理,加入终浓度为10 μg/mL胰酶,置于37 ℃激活30 min后备用。先用1×PBS洗涤6孔板单层细胞,将前述预处理过上清液加入至6孔板中,于5% CO2培养箱中使病毒与细胞孵育1 h。之后取出6孔板,弃掉上清液,并用1×PBS洗涤2次,加入无血清、胰酶终浓度为2 μg/mL的MEM维持液,连续观察细胞病变(CPE)不少于3 d,待细胞有80% CPE时收获病毒液,反复冻融2次,收获病毒。相同的方法连续传代。
1.6 间接免疫荧光(IFA)鉴定
将MA104细胞铺于96孔板中,按照1.5方法进行病毒感染,病毒感染后24 h左右即将出现细胞病变时,弃掉上清液,用预冷的1×PBS洗涤细胞3次后加入200 μL预冷的冰乙醇,4 ℃固定30 min;再PBS洗涤3次后加入5%脱脂奶粉封闭1 h;弃掉封闭液,PBS洗涤3次之后向孔中加入50 μL稀释的PoRV VP6蛋白单克隆抗体(1∶2 500),37 ℃孵育1 h;弃掉一抗,用PBS洗涤3次,加入50 μL稀释的FITC-羊抗小鼠二抗(1∶2 000),37 ℃孵育45 min;弃掉二抗,用PBS洗涤3次,显微镜下观察并拍照。
1.7 VP4和VP7基因扩增和序列分析
RV-VP4-F和RV-VP4-R、RV-VP7-F和RV-VP7-R扩增VP4和VP7基因片段,反应程序为:95 ℃预变性3 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min 10 s,共35个循环;72 ℃延伸10 min。扩增产物送南京擎科生物科技有限公司进行测序。利用生物信息学软件DNAStar对VP4(表2)和VP7(表3)基因与NCBI中的G基因型和P基因型代表毒株序列进行核苷酸同源性分析和遗传进化分析。

表2 RV P[7](VP4基因)参考序列信息

表3 RV G1(VP7基因)参考序列信息
1.8 兔源多克隆抗体制备和效价测定
将灭活剂β-丙内酯按照0.05%比例加入到PoRV(TCID50=106/mL)病毒液中,充分混匀后4 ℃灭活24 h,经灭活检验合格后,与MONTANIDETM ISA 201VG佐剂按照1∶1混合乳化制备的免疫原,背部皮下注射新西兰大白兔,1 mL/只。共免疫3次,首免和2次加强免疫之间分别间隔21 d,分别于免疫前和免疫后耳静脉采血测定抗体效价。
采用中和抗体方法测定抗体效价。首先将200 TCID50的病毒液与10倍比稀释的兔血清等体积混合,放37 ℃孵育1 h,然后加入到长满单层MA104的96孔板中,5% CO2培养箱中继续孵育1 h。然后弃掉病毒血清混合液后,加入含有终浓度为2 μg/mL胰酶的病毒维持液(MEM),继续培养。同时设置免疫前血清对照,所有试验孔和对照孔都设置3个重复。每日观察并统计细胞病变情况,计算中和效价。
1.9 兔源多克隆抗体的反应性鉴定
Western blot和IFA对多克隆抗体反应性鉴定。IFA参照1.6方法操作,将PoRV VP6单克隆抗体替换为兔源多克隆抗体(1∶10 000),替换使用FITC-羊抗兔荧光二抗(1∶2 000),其他操作相同,显微镜下观察并拍照。
Western blot检测方法:吸取实验室保存的P7血清型重组蛋白His-sumo-VP4*P7,10 μL,按照1/5(体积比)加入5×上样缓冲液,震荡混匀加热处理10 min后,上样进行SDS-PAGE分析,然后使用半干式转印仪进行免疫印迹操作。转印结束,使用5%脱脂乳封闭醋酸纤维(NC)膜,洗涤后加入兔源多克隆抗体(1∶20 000),室温孵育2 h,弃掉一抗,用PBS洗涤3次,加入稀释的HRP-羊抗兔二抗(1∶10 000),室温孵育1 h;弃掉二抗并洗涤后,ECL方法曝光显色并拍照。
2 结果
2.1 腹泻相关病原的检测
将腹泻样品提取RNA,RT-PCR分别检测RV、PEDV、TGEV、PDCoV、PRV和BVDV,只有RV-VP6引物成功扩增出长度为309 bp的条带(图1),而PEDV、TGEV、PDCoV和BVDV核酸全为阴性。提取腹泻样品DNA,PCR扩增PRV,也呈现阴性扩增。扩增6种病毒阳性对照全部成立。

M.DL2000 分子量标准;1.RV;2.PEDV;3.TGEV;4.PDCoV;5~6.RV阴性对照;7.RV阳性对照;8~10.分别为PEDV、TGEV和PDCoV阳性对照;11.PRV阳性对照;12.PRV阴性对照;13.PRV;14.BVDV阳性对照;15.BVDV阴性对照;16.BVDV。
2.2 病毒分离、鉴定和传代培养
将RV阳性滤液接种单层MA104细胞,初次接种48 h后,显微镜下即可观察到融合、圆缩,最后瓦解脱落的CPE。按照相同方法传至第5代,VP6基因检测均为阳性,且都可以产生明显CPE。通过IFA检测,感染细胞呈现RV VP6蛋白特异性荧光(图2),表明成功分离到RV,将其命名为JSNJ2019株。新分离病毒适应细胞需传代以提高病毒滴度。将JSNJ2019在MA104细胞上连续传到第11代(P11),并分别测定半数组织细胞感染量(TCID50),病毒滴度从P8到P11逐步升高,介于105~106.5TCID50/mL(图3)。

图2 PoRV接种MA104细胞出现的病变

图3 PoRV JSNJ2019不同代次滴度
2.3 VP4和VP7基因扩增、序列同源性和遗传进化分析
VP4基因决定PoRV的P基因型,设计引物采用RT-PCR扩增出特异性条带,测序后序列比较确定为P[7]基因型。利用DNAStar软件对7株P[7]基因型的PoRV的VP4基因进行序列相似性比对分析,发现本试验分离毒株JSNJ2019株与参考毒株的PoRV VP4基因核苷酸相似性为91.8%~99.8%(图4)。使用DNAStar软件中的Clustal W方法对7个NCBI数据库来源和JSNJ2019株的VP4基因序列进行比对分析,并构建遗传进化树(图5),发现JSNJ2019株单独形成1个进化分支,介于猪源与牛源之间的分支。

注:◀为本研究分离株,下同。
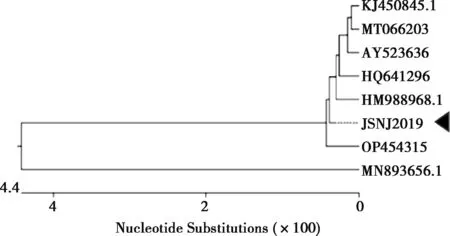
图5 VP4基因遗传进化分析
VP7基因是决定PoRV的G基因型,设计引物采用RT-PCR扩增出特异性条带,测序后序列比较确定为G1基因型。利用DNAStar软件对7株G1基因型PoRV的VP7基因进行序列相似性比对分析,发现本试验分离毒株JSNJ2019株与参考毒株的PoRV VP7基因核苷酸相似性为96.3%~99.6%(图6)。使用DNAStar软件中的Clustal W方法对7个NCBI数据库来源和JSNJ2019株的VP7基因序列进行比对分析,并构建遗传进化树(图7),发现JSNJ2019株与熊猫源的在同一进化分支。

图6 VP7基因同源性分析

图7 VP7基因遗传进化分析
综上,确定JSNJ2019毒株基因型是G1P[7]。
2.4 高免血清制备和检测
以JSNJ2019全病毒灭活苗为免疫原制备的抗血清,2倍比稀释后测定中和JSNJ2019的能力,3次免疫后中和抗体效价最高可达211(图8A)。同时取JSNJ2019第10代病毒接种单层MA104细胞,进行IFA检测,镜下可见明显的绿色荧光(图8B)。Western blot检测显示,只有PoRV重组蛋白His-sumo-VP8*P[7]出现特异性条带,分子量38 kDa(图8C)。

注:C图中M为预染中分子量标准,1为His-sumo标签蛋白,2~3为His-sumo-VP4*P[7]。
3 讨论
PoRV是呼肠孤病毒科轮状病毒属的成员。到目前为止,国内外流行病学数据显示PoRV的感染率逐年升高,而且A群PoRV是猪场绝对优势的流行血清群[18-19]。PoRVA主要感染新生仔猪肠上皮细胞,多与PEDV等猪腹泻病原混合感染而加重猪腹泻,甚至死亡[20],粪便是腹泻相关病原的主要传播介质,通过粪-口和接触传播方式感染其他猪[21]。本研究采集腹泻猪新鲜粪便,首先通过RT-PCR鉴别检测,只有PoRV为阳性扩增且条带特异,经测序分析进一步明确VP6基因型为A群PoRV。
VP7和VP4蛋白决定PoRV的G型与P型以及它的毒力[2]。G/P型之间会产生不同的组合,不同组合型的PoRVA毒株诱导的交叉保护性低[22-23]。因此,加强不同G/P型的监测和毒株分离对系统了解PoRVA的遗传进化和研发时效疫苗非常重要。本研究中从腹泻猪粪便中检测到G1和P[7]的组合基因型,成功分离到毒株,并可以稳定传代,国内鲜见报道从猪体分离到猪源G1P[7]型,丰富了国内PoRVA的资料,有利于对国内RVA的监测。VP4基因序列遗传进化分析发现JSNJ2019株单独形成1个进化分支,介于猪源与牛源之间的分支;VP7基因序列遗传进化进一步发现,JSNJ2019株与我国2009年报道分离的熊猫来源的CH-1毒株在同一个进化分支。由此可见,PoRVA不同G/P基因型组合具有明显的多样性和复杂性,对有效防控PoRVA的流行和感染具有很大的挑战。
综上,通过对南京附近猪腹泻样本主要流行腹泻病原的检测,发现仅PoRVA为阳性,通过系列分型检测和序列分析,首次鉴定G1P[7]基因型组合在猪群的流行;进一步采用敏感细胞系传代培养和血清学鉴定成功分离得到G1P[7]型毒株JSNJ2019,并制备了高滴度的兔源多克隆抗体,表现出优秀的免疫原性。因此,本研究丰富了PoRV流行病学数据,并为时效疫苗的研制奠定了物质基础。
