刻点血蜱成蜱中肠菌群结构的分析
2024-04-11刘龙江刘潇雨程天印段德勇吴平顺
刘龙江,刘潇雨,程天印,段德勇,吴平顺*
(1. 甘肃省迭部县动物疫病预防控制中心,甘肃 迭部 747400;2. 湖南农业大学动物医学院,湖南 长沙 410128)
刻点血蜱(Haemaphysalispunctata)属于硬蜱科、血蜱属,常寄生于牛、马、羊等家畜,广泛分布于英国、美国、西班牙、意大利、以色列等国[1],在我国其主要分布于新疆地区[2]。已有研究表明,刻点血蜱可传播大巴贝斯虫(Babesiamajor)、莫氏巴贝斯虫(B.motasi)、双芽巴贝斯虫(B.bigemina)、伯纳特氏立克次氏体(Rickettsiaburneti)、斑点热群立克次体(Spotted fever group rickettsiae)、羊泰勒虫(Theileriasp.)等病原体[2-3]。由于雌、雄蜱生活习性、生活周期、吸血特性的不同,常导致由致病菌、共生菌组成的蜱菌群结构表现不同[4],如Choubdar等[5]证实小亚璃眼蜱(Hyalommaanatolicum)雌蜱中肠菌群多样性高于雄蜱;Kim等[6]发现不同性别长角血蜱(H.longicornis)体内的菌群结构存在显著差异,其雌蜱体内的柯克斯氏体共生菌(Coxiellaendosymbiont)相对丰度高于雄蜱。因此,了解不同性别蜱中肠菌群结构及差异对防控蜱和蜱传病意义重大。
近年来,随着高通量测序技术的发展,学者们对不同蜱种的不同发育阶段、不同组织器官、不同地域来源、不同饱血状态中肠菌群结构进行了大量研究[7-10]。Portillo等[11]利用Illumina Miseq高通量测序技术,对来源于西班牙拉里奥哈地区不同性别刻点血蜱的中肠菌群结构进行了研究,发现在雌、雄刻点血蜱中变形菌门(Proteobacteria)为优势菌门,埃立克体属(Ehrlichia)为优势菌属,宫本疏螺旋体(Borreliamiyamotoi)为优势菌种,且立克次体属(Rickettsia)在雌蜱中肠内的相对丰度高于雄蜱,埃立克体属、沃尔巴克氏体属(Wolbachia)在雄蜱中肠内的含量高于雌蜱。但有研究证实,地域及宿主不同将影响蜱菌群结构的组成[12-13]。因此,本研究运用Illiumina NovaSeq高通量测序技术对采自于我国新疆地区绵羊体表的不同性别刻点血蜱中肠菌群结构进行分析,探究其特征和差异,为蜱和蜱传病的防控提供科学依据。
1 材料与方法
1.1 主要试剂
带Barcode的细菌16S rDNA V3-V4区扩增引物,341F:5′-CCTAYGGGRBGCASCAG-3′;806R:5′-GGACTACNNGGGTATCTAAT-3′,引物由上海生工生物工程股份有限公司合成。DNA片段快速纯化/回收试剂盒购自Qiagen公司;细菌基因组DNA提取试剂盒购自天根生化科技有限公司(北京);Phusion®High-Fidelity PCR Master Mix、NEB Next®UltraTMDNA Library Prep Kit均购自New England Biolabs公司。
1.2 刻点血蜱样本
20只饱血刻点血蜱雌蜱和30只刻点血蜱雄蜱采自于新疆沙湾市绵羊体表,并送至湖南农业大学动物医学院寄生虫与媒介中心保存。
1.3 细菌DNA提取
取雌蜱5只、雄蜱10只,75%酒精对虫体表面进行消毒,无菌水冲洗,去除体表杂质。在超净工作台中用灭菌眼科剪沿蜱腹部剪开体壁,将雌蜱、雄蜱中肠内容物分别收集至2个含有1 mL 3.8% 柠檬酸钠无菌生理盐水溶液的灭菌离心管中,800 r/min离心10 min;取上清液,12 000 r/min离心1 min;弃去上清液,将雌蜱和雄蜱中肠内容物沉淀物分别编号为Hp.F和Hp.M。按照细菌基因组DNA提取试剂盒说明书提取各样品细菌基因组DNA。
1.4 16S rDNA基因扩增及高通量测序
以雌、雄蜱中肠细菌总DNA为模板,以341F和806R为扩增引物扩增细菌16S rDNA V3-V4区。反应体系(50 μL):DNA模板1 μL,Phusion®High-Fidelity PCR Master Mix 25 μL,上、下游引物(10 mmol/L)各2 μL,ddH2O 20 μL。扩增条件:98 ℃ 1 min;98 ℃ 10 s,50 ℃ 30 s,72 ℃ 30 s,共30个循环;72 ℃ 5 min。PCR产物经1.5%琼脂糖凝胶电泳后切胶回收。将扩增片段经NEB Next®UltraTMDNA Library Prep Kit修饰、加测序接头,并用Qubit@2.0 Fluorometer定量和qPCR检测合格后,运用Illiumina NovaSeq平台进行双末端测序。
1.5 数据处理
根据Barcode序列和PCR扩增引物序列从下机数据中拆分出各样本数据,截去Barcode和引物序列后,使用FLASH(V1.2.11, http://ccb.jhu.edu/software/FLASH/)软件[14]对样本的reads进行拼接,得到Raw Tags。随后使用fastp软件对Raw Tags进行质控,得到Clean Tags。最后使用Vsearch软件将Clean Tags与数据库进行比对以检测嵌合体并进行去除[15],得到Effective Tags。
1.6 扩增子序列变异(ASVs)降噪和物种注释
对以上得到的Effective Tags,使用QIIME2软件中的DADA2模块进行降噪,并过滤掉丰度小于5的序列[16],获得ASVs以及特征表。随后,使用QIIME2软件中的classify-sklearn[17-18]模块将ASVs与数据库比对,得到每个ASV的物种信息,并分别在不同分类水平上统计2个样本的群落组成,以样品中数据量最少的为标准进行均一化处理,进行Alpha 多样性分析。
1.7 Alpha多样性分析
使用QIIME2软件计算Observed otus(直观观测到的物种数目),Shannon(样品中的分类总数及其占比),Simpson(表征群落内物种分布的多样性和均匀度),Chao1(估计群落样品中包含的物种总数),Goods coverage(覆盖度)和Pielou_e(均匀度)指数,并绘制稀释曲线。
2 结果
2.1 数据处理和ASVs统计
经测序雌蜱样本(Hp.F)获得原始序列106 252条,雄蜱样本(Hp.M)获得原始序列114 803条。经过质控和去除嵌合体后,Hp.F和Hp.M 2组样本获得的有效序列分别为87 395条和98 740条,数据有效率分别达到82.3%和86.1%。将有效序列进行降噪后,Hp.F、Hp.M获得的ASVs数分别为523和415个,其中219个为2个样本所共有(图1)。

图1 刻点血蜱2个肠内容样本ASVs分布韦恩图
2.2 细菌在门水平上的分布
获得的ASVs 经物种注释后,在门水平上,Hp.F和Hp.M中共发现11个门,每个细菌门在2组样品中的相对丰度见表1。从表1中可见,Hp.F与Hp.M中含有的共有菌门为8个,包括:变形菌门,厚壁菌门(Firmicutes),异常球菌门(Deinococcota),拟杆菌门(Bacteroid-ota),放线菌门(Actinobacteriota),蓝细菌门(Cyanobacteria),脱硫菌门(Desulfobacterota)和疣微菌门(Verrucomicrobiota),其中变形菌门的相对丰度最高,且在Hp.M内的含量(81.1%)高于Hp.F(65.2%),为2组样本的优势菌门;厚壁菌门、异常球菌门(Deinococcota)、拟杆菌门在Hp.F中的相对丰度(16.9%、10.5%、4.7%)高于Hp.M(13.0%、0.2%、2.3%);放线菌门在Hp.M中的相对丰度(2.4%)高于Hp.F(1.1%)。除共有菌门外,弯曲菌门(Campilobacter-ota)和螺旋体门(Spirochaetota)为Hp.F特有菌门;梭杆菌门(Fusobacteriota)为Hp.M独有菌门。

表1 2组样品在门水平上的物种相对丰度
2.3 细菌在属水平上的分布
Hp.F和Hp.M 2组样本共检测到189个细菌属,其中共有菌属为119个,相对丰度前10的共有细菌属在2组样本中的分布特点见图2,前50除前10 之外的其余40种共有细菌属相对丰度见表2。从图2可见,2组样本中相对丰度较高的细菌属主要为Schlegelella属,不动杆菌属(Acinetobacter),拟杆菌属(Bacteroides),乳杆菌属(Lactobacillus),短波单胞菌属(Brevundimonas)和罗姆布茨菌属(Romboutsia)等,且以上菌属在Hp.F中的相对丰度均高于Hp.M。除上述丰度较高的菌属外,在2组样本中均检测到了柯克斯体属(Coxiella),立克次体属(Rickettsia),寡养单胞菌属(Stenotrophomonas),鞘氨醇单胞菌属(Sphingomonas),泛菌属(Pantoea),肠杆菌属(Enterobacter),葡萄球菌属(Staphylococcus)和链球菌属(Streptococcus)等相对丰度较低的共生菌和致病菌属。另外,Hp.F内特有菌属39种,其中相对丰度较高的菌属有:八叠球菌属(Sarcina),螺杆菌属(Helicobacter),RikenellaceaeRC9gutgroup属,Quinella属,PrevotellaceaeUCG-003属和小杆菌属(Dialister)等;Hp.M内特有菌属31种,其中相对丰度较高菌属包括:CAG-352菌属,巨单胞菌属(Megamonas),劳森菌属(Lawsonia),细杆菌属(Microbacterium),Rubellimicrobium属和土地芽胞杆菌属(Terribacillus)等,这表明雌、雄蜱中肠内菌群结构在属水平上存在较大差异。

表2 前50中40个共有菌属(前10除外)的相对丰度
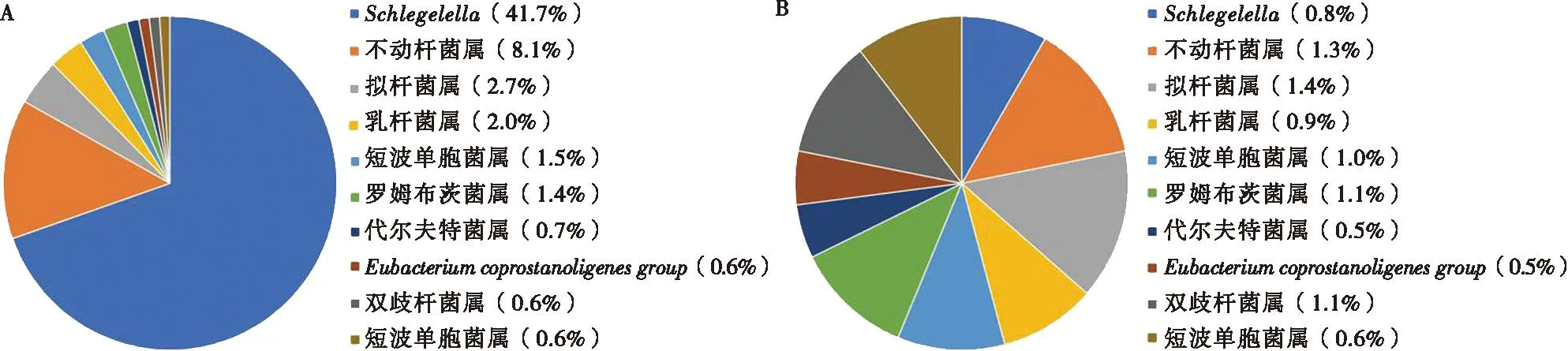
图2 Hp.F(A)和Hp.M(B)样品前10共有菌属的相对丰度
2.4 细菌在种水平上的分布
注释到种水平且Hp.F和Hp.M 2个样本中共有的菌种有28个,各菌种相对丰度见表3。相对丰度较高的菌种包括:西尔瓦诺斯亚栖热菌(Meiothermussilvanus)、鲍曼不动杆菌(Acinetobacterbaumannii)、柯克斯氏体共生菌(Coxiellaendosymbiont)、肠乳杆菌(Lactobacillusintestinalis)、长双歧杆菌(Bifidobacteriumlongum)、巴氏杆菌拟杆菌(B.barnesiae)等。除以上共有菌种外,2个样本中还分别存在独有菌种,如双环瘤胃球菌(Ruminococcusbicirculans)、多氏拟杆菌(B.dorei)、粪便乳杆菌(Lactobacillusfaecis)、Butyricicoccussp.、Paenibacillusdarwinianus、Dialisterinvisus等仅在Hp.F被检测到;类芽胞杆菌(Paenibacilluspasadenensis)、单形拟杆菌(B.uniformis)、马葡萄球菌(S.equorum)、普通拟杆菌(B.vulgatus)、粪便拟杆菌(B.stercoris)、产黑素普氏菌(Prevotellamelaninogenica)等仅在Hp.M中被检测到。

表3 2组样品在种水平上的物种相对丰度
2.5 Alpha多样性分析
对Hp.F和Hp.M 2个样本的Alpha 多样性指数进行统计,结果表明(表4):2个样本的Goods coverage均为1即100%,表明本研究的测序覆盖率高,测序结果具有高精确性、高有效性和高可信度。Hp.F的Simpson指数和Shannon指数均大于Hp.M,表明雌蜱菌群多样性大于雄蜱。

表4 样品的Alpha多样性分析指数
3 讨论
本研究利用Illumina NovaSeq高通量测序技术,对刻点血蜱雌、雄蜱中肠菌群结构进行了分析,发现2组样本菌群结构之间存在显著差异,共鉴定到11个细菌门、189个细菌属、28个细菌种。在门水平上,变形菌门为刻点血蜱雌、雄蜱中肠内的优势菌门,这与微小扇头蜱[10]、长角血蜱[19]、褐黄血蜱(H.flava)[20]的研究结果相一致。Portillo等[11]发现雌、雄刻点血蜱在属水平上存在明显差异,这与本研究的部分研究结果相一致,如本研究中的立克次体属在刻点血蜱雌蜱体内的相对丰度远高于雄蜱。而立克次体属中诸多菌种作为蜱传病原,已在不同地域的革蜱属(Dermacentor)、血蜱属(Haemaphysalis)、硬蜱属(Ixodes)、扇头蜱属(Rhipicephalus)、璃眼蜱属(Hyalomma)等蜱中被相继检测到[21-22]。本研究中雌、雄刻点血蜱中肠内均检测到该菌属,说明不同性别刻点血蜱可携带立克次体,但由于高通量测序技术的局限性,未能将该菌属鉴定到种水平。
不动杆菌属为革兰阴性菌,已被正式命名的菌种达38个,其中大部分为非致病菌,常分布于潮湿的土壤和水域中;少部分菌种为条件性致病菌,可导致呼吸系统、泌尿系统、中枢神经系统等的感染[23]。该菌属已在长角血蜱雌蜱中被检测到,且为优势菌属[24],这与本研究结果相一致。除此之外,本研究还发现刻点血蜱雌蜱中肠内的不动杆菌属相对丰度(8.1%)高于雄蜱(1.3%)。有研究表明[25],不动杆菌广泛存在于土壤中,其在蜱体内的出现通常是由于蜱长时间暴露于宿主体表所致,这与雌蜱寄生在宿主体表至饱血的时间远大于雄蜱的生活习性相一致。
鞘氨醇单胞菌属为好氧型革兰阴性杆菌,包括103余种菌种,广泛分布于各种水体、沉积物和土壤中,对重金属环境的生物修复与多环芳烃的生物降解具有一定作用[26]。少动鞘氨醇单胞菌(S.paucimobilis)是一种条件致病菌,由其污染的水体或土壤可引发社区及医院内感染,常引起关节炎、骨髓炎、败血症及局部化脓性溃疡等病症,该菌种已在西方蜜蜂(Apismellifera)体内被检测到[27]。本研究虽未检测到少动鞘氨醇单胞菌,但发现鞘氨醇单胞菌属在刻点血蜱雌、雄蜱中肠内均存在,说明刻点血蜱可携带该菌属,这与在微形血蜱(H.wellingtoni)、豪猪血蜱(H.hystricis)、二棘血蜱(H.bispinosa)中的发现相一致[28]。
与Portillo等[11]未检测到葡萄球菌属的研究结果不同,本研究在雌、雄刻点血蜱中皆检测到了葡萄球菌属,且其在雄蜱中肠内的相对丰度高于雌蜱。葡萄球菌属中的菌种多为条件性致病菌,是临床上最常见的革兰阳性菌,其中金黄色葡萄球菌(S.aureus)是一种能引起肺炎、菌血症等多种感染性疾病的化脓性病原菌[29],且已在黄粉虫(Tenebriomolitor)[30],黑水虻(Hermetiaillucens)[31],大蜡螟(Galleriamellonella)[32]等昆虫体内被检测到。本试验检测出的葡萄球菌为马葡萄球菌,且该菌种只在刻点血蜱雄蜱中存在,该菌种同样被报道在微小扇头蜱(R.microplus)和一些血蜱属、璃眼蜱属蜱体内存在[33]。
本研究将刻点血蜱雌、雄蜱中肠内的柯克斯体属注释为柯克斯氏体共生菌,且雌蜱中肠内的相对丰度大于雄蜱。柯克斯氏体共生菌已在微小扇头蜱[34],Amblyommanuttalli[35],Ornithodorosmaritimus,边缘革蜱(D.marginatus)和六角硬蜱(I.hexagonus)[36]等蜱种体内被检测到。有研究表明[37-38],蜱在寄生吸血过程中,由于进食条件不平衡,导致其体内缺乏部分必需营养元素,如B族维生素,而柯克斯氏体共生菌正好可为蜱提供 B族维生素,从而促进蜱的生长发育,发挥互利共生的作用。本研究还发现,柯克斯氏体共生菌在刻点血蜱雌蜱中的含量远高于雄蜱,可能是由于雌蜱生长发育速度较雄蜱快,且与雌蜱在新陈代谢、生理活动时物质消耗量高于雄蜱有关[39]。
综上,通过对比不同性别刻点血蜱中肠菌群结构,发现其在门、属、种水平上存在较大差异,这可能与雌、雄蜱吸血及生理特性不同有关。
