弥漫性腹膜肝样腺癌一例
2024-04-10张吴西闫旭王楠娅冬冬
张吴西 闫旭 王楠娅 冬冬

摘要:肝样腺癌是一种罕见的特殊类型腺癌,在组织病理学上类似肝细胞癌,大多数病例发生于胃,临床和影像学表现缺乏特异性,容易造成漏诊和误诊,而腹膜肝样腺癌更为罕见。本文报道1例原发于腹膜、临床表现为腹膜弥漫性增厚的肝样腺癌病例,旨在为临床诊断及治疗提供参考。
关键词:腹膜肿瘤;肝样腺癌;弥漫性
中图分类号: R446 文献标识码: B 文章编号:1000-503X(2024)01-0143-04
DOI:10.3881/j.issn.1000-503X.15643
Diffuse Hepatoid Adenocarcinoma in the Peritoneal Cavity:Report of One Case
ZHANG Wuxi1,YAN Xu2,WANG Nanya3,DONG Dong1
1Department of Radiology,2Department of Pathology,3Tumor Center,The First Hospital of Jilin University,Changchun 130012,China
Corresponding author:DONG Dong Tel:0431-88783476,E-mail:dong_dong@jlu.edu.cn
ABSTRACT:Hepatoid adenocarcinoma is a rare and unique type of adenocarcinoma,resembling hepatocellular carcinoma in histopathology.Most cases occur in the stomach,lacking specific clinical and imaging manifestations,which leads to high rates of missed diagnosis and misdiagnosis.Hepatoid adenocarcinoma in the peritoneal cavity is even rarer.This article reports a case of hepatoid adenocarcinoma with the manifestation of diffuse peritoneal thickening,aiming to provide reference for clinical diagnosis and treatment.
Key words:peritoneal tumor;hepatoid adenocarcinoma;diffuse
Acta Acad Med Sin,2024,46(1):143-146
肝样腺癌是一种罕见的特殊类型腺癌,在组织病理学上类似肝细胞癌,大多数病例原发于胃,偶可见胆囊、子宫、肺脏、膀胱、食管、结肠等器官。原发于腹膜的肝样腺癌(peritoneal hepatoid carcinoma,PHC)极其罕见,截至2023年英文文献报道仅9例[1],其临床和影像学表现均缺乏特异性,容易造成漏诊和误诊,治疗上目前尚无统一的指南或共识。本文报道1例原发于腹膜的弥漫性肝样腺癌病例,旨在为临床诊疗提供参考。
1 临床资料
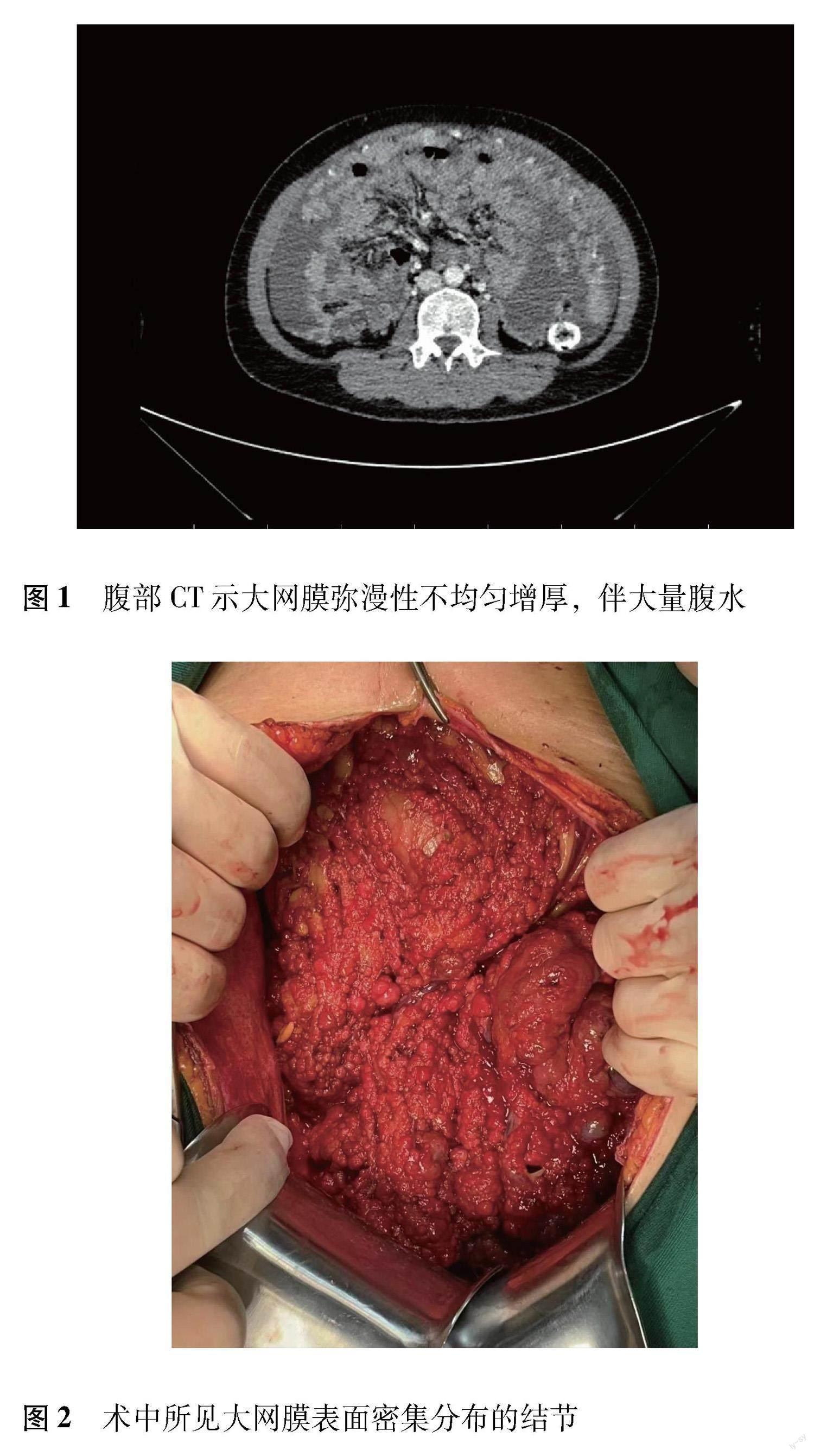
患者女,40岁,因“腹胀1个月,发现盆腔肿物2 d”于2022年10月1日收住吉林大学第一医院妇产科。既往孕3产2,剖宫产术2次,人工流产1次。查体:外阴正常,阴道通畅,黏膜润软,宫颈大小正常,表面光滑,子宫前位,大小触及不清,子宫后方可触及4 cm×5 cm肿物,质地较硬,位置固定,活动度差,压痛(-),双侧附件触诊不清。腹部CT示腹腔大量积液,腹膜、大网膜及肠系膜多发结节及团块状软组织影,双侧卵巢大致正常形态,表面不均匀强化,提示恶性(图1),肝脏、胃肠道未见明确异常。胸部CT示双肺少许炎性改变。实验室检查示人附睾蛋白4 156.8 pmol/L,糖原蛋白125 473 U/mL,甲胎蛋白(alpha-fetoprotein,AFP)25 780 ng/L;血常規、凝血4项、肝功能结果正常;乙肝、丙肝等感染指标阴性;腹水穿刺为血性腹水,腹水常规提示为渗出液;胃镜提示慢性胃炎;基因检测未检出与遗传性肿瘤相关的致病或可能致病变异。
1.1 手术情况
2022年10月9日经腹行双侧附件切除术+大网膜切除术+盆腔粘连松解术+腹腔引流术。术中可见大网膜表面密集分布黄豆大小淡黄色质硬结节,双侧卵巢略增大,表面散在颗粒样结节,质地较脆,双侧输卵管、子宫前后壁表面浆膜均可见密集花生粒大小淡黄色质硬结节,病灶呈浸润性生长,边界不清(图2)。
1.2 病理表现
术后常规病理诊断:卵巢、输卵管壁和大网膜均可见癌灶浸润,提示为肝样腺癌或肝细胞癌可能性大。免疫组织化学染色:AFP(弱+)、GPC-3(+)、HepPar-1(部分+)、GS(+)、Ki-67(+3%)、CK7(散在+)、CK-pan(+)、CK20(-)、绒毛蛋白(+)、SALL4(-)、Oct3/4(-)、波形蛋白(-)、WT-1(-)、
CD34(血管+)、钙结合蛋白(-)、CK5/6(-);特殊染色:网状纤维染色(+)(图3)。
1.3 治疗过程
患者术后转入肿瘤科,2022年11月12日起给予紫杉醇+卡铂方案治疗,同时进行保肝、保胃、止吐等对症治疗,1个疗程后复查血清AFP 9 876 ng/mL。3周后进行第2次化疗,血清AFP降至8 267 ng/mL。随访至2023年5月患者一般状态良好,血清AFP 2 193 ng/mL。
2 讨论
肝样腺癌的发病年龄为21~100岁,平均(63.0±12.8)岁,男女比例为2.4∶1[1]。其临床表现无特异性,多与发生位置相关,起源于腹膜者常以腹胀、腹痛以及腹水就诊。
肝样腺癌的组织学特征是可见腺癌与肝样分化区相互交叉或移行,两者所占比例不同。肝样分化区与肝细胞癌形态相似,即肿瘤细胞大、多角形,呈髓样或梁索样,间质富含毛细血管和血窦。但仅根据组织学结果难以明确诊断,通常需要采用免疫组织化学染色进行鉴别诊断。大多数肝样腺癌AFP染色阳性(91.6%),也可表达其他肝细胞癌特异性标志物,如HepPar-1(38.1%),而几乎所有肝样腺癌患者GPC-3染色呈阳性[2]。此外癌胚抗原也可高表达,上皮标志物如全细胞角蛋白AE1/AE3和CK19通常高表达,这有助于与肝细胞癌进行区分。
血清AFP升高是肝样腺癌的另一特征,其升高程度与肿瘤分化程度相关,也可用于治疗效果判定、肿瘤复发或转移监测。血清AFP升高通常见于肝细胞癌、卵黄囊瘤、肝样腺癌和与肝再生相关的非癌性肝病(如肝硬化和肝炎)。当出现血清AFP明显升高而缺乏诊断肝癌的其他证据时,应考虑肝样腺癌的可能,特别是在老年男性患者中。
肝样腺癌的影像学表现常无明显特征性。胃的肝样腺癌表现为起源于胃黏膜层的肿块,与胃癌相似,单纯依靠影像学诊断较困难。当肝样腺癌转移至肝脏时,影像特征可与肝癌相似,呈快进快出的强化特点。研究表明,腹膜肝样腺癌有两种表现,一种为孤立肿块型,即界限清晰、内部密度不均匀的肿块,容易合并坏死、囊变,邻近脏器多呈受压改变;另一种为弥漫结节型,即腹膜弥漫性增厚,可见多发结节、肿块,伴大量腹水。本例患者影像学表现与弥漫结节型相符。这种类型较为罕见,不易与腹膜转移性肿瘤、腹膜原发腺癌或间皮瘤相鉴别[3]。本例患者初诊时倾向于是卵巢来源的恶性肿瘤伴腹膜广泛转移,特别是血清AFP
的升高,需要与卵黄囊瘤进行鉴别。卵黄囊瘤多发生于儿童及青年女性,确诊需依靠病理结果。卵黄囊瘤的组织形态具有多样性,主要表现为特异性S-D小体微囊性结构、腺泡-腺管样结构、多囊状结构、黏液瘤样结构、实性团巢状结构、肝样型卵黄囊瘤、原始腺管样结构,可特异性地表达AFP、GPC-3、SALL4[4]。然而,本例患者术中显示双侧卵巢略增大,表面散在颗粒样结节,组织病理学结果示卵巢表面肿瘤浸润,可见肝样分化区,免疫组织化学染色SALL4(-),未见卵黄囊瘤典型表现,结合无肝癌危险因素、未发现其他部位原发肝样腺癌,最终诊断为PHC。
肝样腺癌的恶性程度高、侵袭性强,预后通常较原发部位的常见肿瘤差,而弥漫性PHC的平均生存期较其他部位原发的肝样腺癌更低,仅为6个月[1]。肝样腺癌目前尚无治疗的有效方法,早期发现肿瘤并进行手术切除仍是肝样腺癌的主要治疗手段。尽管PHC很难切除所有病灶,但进行肿瘤减灭术获取病理诊断有利于术后化疗或局部治疗以改善患者预后。肝样腺癌特别是PHC的化疗方案尚缺乏可靠的大样本研究。一般认为,以顺铂为基础的化疗是一线全身治疗方案,其他方案如奥沙利铂、伊立替康、吉西他滨和5-氟尿嘧啶可以作为一线或二线治疗,进行单独或联合治疗。一些晚期胃肝样腺癌患者在接受顺铂和依托泊苷一线化疗方案治疗后,获得了完全缓解[5]。Lucas等[6]在PHC手术后辅以5-氟尿嘧啶、亚叶酸鈣和奥沙利铂化疗,使患者疾病复发时间延长至3年以上。本例患者采用的是紫杉醇加卡铂的常用肿瘤化疗方案,经过手术和两次化疗后,血清AFP持续明显下降,说明治疗方案有效,随访7个月患者一般状态良好。近年来,肝细胞癌的常用分子靶向治疗药物,如索拉非尼或仑伐替尼也被尝试应用在肝样腺癌的治疗中,其主要机制是直接促细胞凋亡或抗血管生成。胃肝样腺癌应用靶向治疗后有很好的治疗反应,特别是对于化疗产生耐药的患者[7-11]。但针对PHC的治疗效果还有待进一步临床试验证实。Zou等[1]报道1例PHC采用奥沙利铂+卡培他滨方案后肿瘤几乎消失,血清AFP值显著下降,后期患者应用索拉非尼及仑伐替尼时治疗效果不明显,并出现高血压、二级手足综合征和血小板计数下降等不良反应。因此,肝样腺癌的免疫治疗还有待进一步探索。本例患者因基因检测结果未提示免疫治疗相关靶点,故未采用免疫治疗。
综上,PHC临床和影像学表现缺乏特异性,其诊断主要依靠组织病理学。如何及时、准确地诊断以及避免漏诊和误诊仍是一个挑战。当血清AFP升高,没有出现典型的肝细胞癌表现和除外其他常见腹膜肿瘤时,应怀疑到PHC。目前尚缺乏PHC标准治疗方案,尽早完全手术切除并辅以全身治疗是普遍采用的治疗方法。针对PHC治疗积累更多经验、探索更有效的方法是未来的重要研究方向。
利益冲突 所有作者声明无利益冲突
作者贡献声明 张吴西:撰写论文;闫旭、王楠娅:收集数据、整理数据;冬冬:指导研究、修改论文
参 考 文 献
[1]Zou M,Li Y,Dai Y,et al.AFP-producing hepatoid adenocarcinoma(HAC) of peritoneum and omentum:a case report and literature review[J].Onco Targets Ther,2019,12:7649-7654.DOI:10.2147/OTT.S216501.
[2]Su JS,Chen YT,Wang RC,et al.Clinicopathological characteristics in the differential diagnosis of hepatoid adenocarcinoma:a literature review[J].World J Gastroenterol,2013,19(3):321.DOI:10.3748/wjg.v19.i3.321.
[3]Gopaldas R,Kunasani R,Plymyer MR,et al.Hepatoid malignancy of unknown origin-a diagnostic conundrum:review of literature and case report of collision with adenocarcinoma[J].Surg Oncol,2005,14(1):11-25.DOI:10.1016/j.suronc.2004.09.011.
[4]徐煉,王巍,何英,等.卵巢卵黄囊瘤46例临床病理分析[J].四川大学学报(医学版),2018,49(4):680-682.DOI:10.13464/j.scuxbyxb.2018.04.041.
[5]Xia R,Zhou Y,Wang Y,et al.Hepatoid adenocarcinoma of the stomach:current perspectives and new developments[J].Front Oncol,2021,11:633916.DOI:10.3389/fonc.2021.633916.
[6]Lucas ZDF,Shah M,Trivedi A,et al.Hepatoid adenocarcinoma of the peritoneal cavity:prolonged survival after debulking surgery and 5-fluorouracil,leucovorin and oxaliplatin(FOLFOX) therapy[J].J Gastrointest Oncol,2012,3(2):139-142.DOI:10.3978/j.issn.2078-6891.2011.052.
[7]Doi Y,Takii Y,Mitsugi K,et al.The effectiveness of hepatic arterial infusion chemotherapy with 5-fluorouracil/cisplatin and systemic chemotherapy with ramucirumab in alpha-fetoprotein-froducing gastric cancer with multiple liver metastases[J].Case Rep Oncol Med,2018,2018:1-6.DOI:10.1155/2018/5402313.
[8]Bang YJ,Van Cutsem E,Feyereislova A,et al.Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer(ToGA):a phase 3,open-label,randomised controlled trial[J].Lancet,2010,376(9742):687-697.DOI:10.1016/S0140-6736(10)61121-X.
[9]Hayashi K,Nagasaki E,Nakada K,et al.Chemotherapy for alpha-fetoprotein producing gastric cancers expressing human epidermal growth factor receptor 2[J].J Infect Chemother,2018,24(4):298-301.DOI:10.1016/j.jiac.2017.10.019.
[10]Arakawa Y,Tamura M,Aiba K,et al.Significant response to ramucirumab monotherapy in chemotherapy-resistant recurrent alpha-fetoprotein-producing gastric cancer:a case report[J].Oncol Lett,2017,14(3):3039-3042.DOI:10.3892/ol.2017.6514.
[11]Pandey M,Truica C.Hepatoid carcinoma of the ovary[J].J Clin Oncol,2011,29(15):e446-e448.DOI:10.1200/JCO.2010.33.6321.
(收稿日期:2023-04-20)
