海洋真菌Penicillium sp.HD-1-1 次级代谢产物研究
2024-04-09王玉妃兰建洲孔凡栋周丽曼
王 聪,王玉妃,徐 辉,许 睿,兰建洲,孔凡栋,周丽曼
广西民族大学化学化工学院,林产化学与工程国家民委重点实验室,广西林产化学与工程重点实验室,广西林产化学与工程协同创新中心,广西高校少数民族医药古方挖掘与开发重点实验室,广西 南宁 530006
海洋真菌具备特殊的生态环境(高盐、高压、寡营养等)、强大的基因簇,复杂的遗传背景决定了其在次生代谢产物方面具有高产率的优势,以及具有抗菌、抗炎、抗氧化、抗病毒、抗肿瘤等生物功能多样性[1-4],是探索新型生物活性海洋天然产物(MNPs)的重要源泉[5-6]。
自1893 年Bartolomeo Gosio 首次报道霉酚酸(mycophenolic acid,MPA)以来,MPA 及其衍生物因其广泛的生物活性包括抗炎、抗真菌、抗病毒、免疫抑制等受到广泛关注。当前临床实践中,最常用的2 种MPA 衍生物是霉酚酸酯(mycophenolate mofetil,MMF)[7]以及霉酚酸钠(mycophenolate sodium,MPS)。MPA 的特点是经胃肠道吸收很差,而MMF 的酯化反应显著提高了其生物利用率,在预防器官移植排异领域做出了重要贡献[8],但易导致消化疾病、血液疾病、癌症和神经系统疾病等。这些毒副作用以及MPA 在体内的葡萄糖醛酸化作用限制了MPA 类化合物的临床应用。因此,MPA衍生物的研究和开发成为当前药物研究的热点,寻找更加有效且低毒的MPA 类似物作为潜在的药物候选物成为研究人员关注的重点领域。海洋微生物在高盐、高压、低温、寡营养的环境下产生有别于陆生微生物的独特生理代谢途径,进而更有可能产生结构新颖、活性独特的次级代谢产物,为霉酚酸衍生物类药物研究和开发带来新的机遇。Chen 等[9]从南海深海沉积物来源的细小青霉次级代谢产物中分离得到3 种新的霉酚酸类似物,Zhang 等[10]从珊瑚来源的Penicilliumbialowiezense次级代谢产物中分离得到5 种具有良好免疫抑制活性的新的霉酚酸类似物,显示了海洋天然产物在霉酚酸类似物研究方面的潜在价值。
涠洲岛地处热带和亚热带交界处,是独特的火山兼海洋地貌,具有十分丰富的微生物类群,是有待开发的微生物资源宝库[11]。本研究从广西涠洲岛火山口来源的团扇藻样品中分离得到一株青霉Penicilliumsp.HD-1-1,通过液态培养从发酵物中分离鉴定了1 个新的霉酚酸类化合物(1)和16 种已知的化合物,分别为霉酚酸(mycophenolic acid,2)、甲基麦考酚酸(methyl mycophenolic acid,3)、6-(5-甲氧羰基-3-甲基戊-2-烯)-3,7-二羟基-5-甲氧基-4-甲基苯酚-1-酮 [6-(5-methoxycarbonyl-3-methylpent-2-enyl)-3,7-dihydroxy-5-methoxy-4-methylphthalan-1-one,4]、6-(5-羧基-3-甲基戊-2-烯)-3,7-二羟基-5-甲氧基-4-甲基苯酚-1-酮 [6-(5-carboxy-3-methylpent-2-enyl)-3,7-dihydroxy-5-methoxy-4-methylphthalan-1-one,5]、7-羟基-5-甲氧基-4-甲基-6-(3-甲基-4-氧代戊基)-二氢异苯并呋喃-l-酮 [7-hydroxy-5-methoxy-4- methyl-6-(3-methyl-4-oxopentyl)-phthalan-l-one,6]、6-(3-羧基丁酯)-7-羟基-5-甲氧基-4-甲基苯酞-1-酮[6-(3-carboxybutyl)-7-hydroxy-5-methoxy-4-methylphthalan-1-one,7]、breynivosamide A(8)、伞形香青酰胺(anabellamide,9)、N-(N'-苯甲酰基-S*-苯丙氨酰基)-S*-苯丙氨醇苯甲酸酯[N(N'-benzoyl-S*-phenylalaninyl)-S*-phenylalaninol benzoate,10]、(3S,6R)-6-(对-羟苯基)-1,4-二甲基-3,6-二甲硫基哌嗪-2,5-二酮 [(3S,6R)-6-(p-hydroxybenzyl)-1,4-dimethyl-3,6-bis(methylthio)piperazine-2,5-dione,11]、(3R,6R)-6-(对-羟苯基)-1,4-二甲基-3,6-二甲硫基哌嗪-2,5-二酮[(3R,6R)-6-(p-hydroxybenzyl)-1,4-dimethyl-3,6-bis(methylthio)piperazine-2,5-dione,12]、(+)-新海胆灵A [(+)-neoechinulin A,13]、(3R,8S)-5,7-二羟基-3-(1-羟乙基)苯酚 [(3R,8S)-5,7-dihydroxy-3-(1-hydroxyethyl)phthalide,14]、5,7-二甲氧基-4-甲基异苯并呋喃-1(3H)-酮 [5,7-dimethoxy-4-methylisobenzofuran-1(3H)-one,15]、saccharonol A(16)、6,8-二羟基-3-羟甲基异香豆素(6,8-dihydroxy-3-hydroxy-methylisocoumarin,17)。其结构见图1。通过CCK-8 法测试化合物对5 种肿瘤细胞(人非小细胞肺癌A549 细胞、人非小细胞肺癌NCI-H1581 细胞、人乳腺癌MCF7 细胞、人胃癌AGS 细胞、人结直肠癌HT29细胞)的细胞毒活性。结果显示,化合物2 和3 对于AGS 细胞显示出强细胞毒活性,半数抑制浓度(median inhibition concentration,IC50)值分别为0.69、1.12 µmol/L。此外,化合物2 对NCI-H1581细胞显示出一定的抑制活性,其IC50值为17.95µmol/L,化合物3 对HT29 细胞显示出中等抑制活性,其IC50值为19.30 µmol/L,丰富了霉酚酸衍生物作为海洋微生物来源天然产物的基础研究。

图1 化合物1~17 的结构Fig.1 Structures of compounds 1—17
1 仪器与材料
1.1 仪器与试剂
HCB-1300V 型洁净工作台(青岛海尔特种电器有限公司),LRH-500A 型生化培养箱(广东泰宏君科学仪器股份有限公司),AD500S-P 型高剪切分散乳化机(上海昂尼仪器仪表有限公司),LDZX-75KBS 型立式高压蒸汽灭菌器(上海申安医疗器械厂),ZF-20D 型暗箱式紫外分析仪(巩义市予华仪器有限责任公司),Agilent 1260 高效液相色谱仪(美国Agilent 公司),Nacalai tesque COSMOSIL 5C18-MS-Ⅱ型(250 mm×10 mm,5 μm)半制备柱,COSMOSIL 5C18-MS-Ⅱ型(250 mm×20 mm,5 μm)色谱柱,YMC*GEL ODS-A-HG 反相硅胶(日本YMC Group),细胞级DMSO(SIGMA 公司),MCO-18AC 二氧化碳细胞培养箱(PHcbi 公司),布鲁克400 MHz 核磁共振波谱仪(布鲁克公司),MULTISKAN MK3 多功能酶标仪(Thermo 公司),CHEETAH 9200 型中压制备色谱(天津博纳艾杰尔科技有限公司),LC3000 型高效液相色谱仪(上海楚定分析仪器有限公司),实验试剂为色谱纯(苏州速研医药科技有限公司)或分析纯(成都市科隆化学品有限公司)。细胞毒活性测定的5 种肿瘤细胞(A549 细胞、NCI-H1581 细胞、MCF7 细胞、AGS细胞、HT29 细胞)均购自武汉普诺赛公司,所用阳性对照为盐酸阿霉素(doxorubicin hydrochloride,Dox,Solarbio Life Sciences 公司)。
1.2 菌株来源及鉴定
菌株 HD-1-1 分离自广西涠洲岛火山口(N21°1′42.97′′,E109°7′46.29′′)的团扇藻样品中,由上海生工生物工程股份有限公司完成菌株基因组DNA 提取、扩增、纯化与测序工作,在NCBI 数据库中对ITS 测序鉴定的结果进行比对,综合菌株生长形态与ITS 测序鉴定结果(GenBank accession No.OR742886),将菌株鉴定为Penicilliumsp.HD-1-1,并利用MEGA(Version 7.0)绘制菌株的系统进化树。
2 方法
2.1 菌株发酵
在PDA 培养基上接种Penicilliumsp.HD-1-1 置28 ℃恒温培养箱中培养4 d,在超净工作台将长有菌的培养基划成小块投入灭菌后的真菌2 号液体培养基中,室温条件下,静置发酵30 d,发酵规模为300 mL×100 瓶。
真菌2 号发酵培养基:味精0.01 g/mL、磷酸二氢钾0.000 5 g/mL、海水素0.033 g/mL、酵母膏0.003 g/mL、琼脂0.02 g/mL、麦芽糖0.02 g/mL、葡萄糖0.01 g/mL、甘露醇0.02 g/mL。
2.2 次级代谢产物的提取分离
使用醋酸乙酯对Penicilliumsp.HD-1-1 菌株的发酵物进行了3 次萃取,经滤过和减压浓缩,最终获得了35.6 g 粗提物。用石油醚和90%甲醇-水各3 L 将粗提物充分溶解,在分液漏斗中混匀、静置过夜。对完全分层的2 种液体分别进行减压浓缩,得到石油醚萃取物4.05 g 和90%甲醇-水萃取物29.24 g。
对90%甲醇-水萃取物进行减压硅胶柱色谱,采用石油醚-醋酸乙酯(1∶0、10∶1、9∶1、8∶1、6∶1、4∶1、2∶1、1∶1、0∶1)梯度洗脱,经过TLC-HPLC 的分析,合样后获得了12 个组分Fr.1~12。Fr.6(168.3 mg)通过HPLC 制备(C18半制备柱,甲醇-0.1%三氟乙酸水溶液65∶35,4 mL/min),得到了化合物6(tR=6.7 min,6 mg)和16(tR=7.7 min,7 mg)。Fr.8(137.3 mg)通过HPLC(C18半制备柱,甲醇-酸水70∶30,4 mL/min)制,得到化合物9(tR=18.6 min,12.3 mg)。Fr.9(1.901 1 g)通过高效液相色谱(C18色谱柱,甲醇-水70∶30,10 mL/min),得到化合物7(tR=17.2 min,9 mg)、10(tR=17.8 min,119 mg)、15(tR=17.9 min,35 mg)。Fr.10(5.643 7 g)经中压制备色谱,甲醇-水(10%→100%)梯度洗脱,共分得12 个组分Fr.10.1~10.12。Fr.10.4 经半制备HPLC,乙腈-酸水(40∶60,4 mL/min)分离得到化合物3(tR=14.82 min,80 mg)。Fr.10.8 经半制备HPLC,乙腈-酸水(40∶60,4 mL/min)分离得到化合物2(tR=14.9 min,5 mg)。Fr.11(7.776 6 g)经中压制备色谱,甲醇-水(20%→100%)梯度洗脱,共分得9 个组分Fr.10.1~10.9。Fr.11.2 经半制备HPLC,甲醇-水(20∶80,体积流量4 mL/min)分离得到化合物14(tR=9.1 min,3.2 mg)。Fr.11.4 经半制备HPLC,甲醇-酸水(40∶60,体积流量4 mL/min)分离得到化合物11(tR=25.3 min,8.1 mg)、12(tR=26.5 min,14.7 mg)、17(tR=9.6 min,7.5 mg)。Fr.11.6经半制备HPLC,甲醇-酸水(60∶40,体积流量4 mL/min)分离得到化合物13(tR=8.4 min,250 mg)。Fr.11.7 经半制备HPLC,甲醇-酸水(60∶40,体积流量4 mL/min)分离得到化合物4(tR=16.5 min,7.5 mg)。Fr.11.9(3.75 g)经中压制备色谱梯度洗脱,洗脱体系:甲醇-水(20%→100%),共分得10个组分Fr.11.9.1~11.9.10。Fr.11.9.3 经半制备HPLC,甲醇-酸水(55∶45,体积流量4 mL/min)分离得到化合物5(tR=13.2 min,6.1 mg)。Fr.11.9.6经半制备HPLC,甲醇-酸水(60∶40,体积流量4 mL/min)分离得到化合物8(tR=16.1 min,5.2 mg)、1(tR=20.2 min,41.3 mg)。
2.3 电子圆二色谱(electronic circular dichroism,ECD)计算
根据密度泛函理论(density functional theory,DFT)在Gaussian 09 软件中进行ECD 计算。首先通过hyperchem 软件对在5.0 kcal/mol(1 kcal=4.2 kJ)内进行了初步构象搜索,之后在B3LYP/6-31G(d)水平上进行几何优化和单点能计算,获得Boltzmann 占比在1%以上稳定构象。用SCRF/PCM方法在相同的DFT 水平上评价甲醇溶液的溶剂效应并通过B3LYP/6-31G(d)中的TDDFT 计算得到化合物甲醇中的电子激发能和旋转强度(选择的激发态数目为30 个)。
2.4 化合物抗肿瘤活性测试
采用CCK-8 法测定细胞毒活性[12],用DMSO将化合物溶解为20 μmol/L 的溶液。用10 %胎牛血清培养液将细胞稀释成单细胞悬液,96 孔板每孔接种90 μL 5×104个/mL 的贴壁细胞,在37 ℃、5%CO2的条件下预培养24 h。之后每孔加入10 μL 样品溶液,培养48 h 后,吸出旧培养基和样品溶液,每孔各加入100 μL 稀释10 倍的CCK-8 溶液,在27 ℃、5% CO2条件下培养4 h(避光操作,实时观察)。用酶标仪检测450 nm 处吸光度(A),用Excel标准化处理原始数据,按照公式计算初筛抑制率。若抑制率大于50 %则说明化合物对肿瘤细胞有较好抑制活性,后续对其进行IC50测定,用GraphPad Prism 8(版本8.0.2,GraphPad Software Inc)计算IC50,实验结果以±s表示。实验中每个浓度设3个复孔,同时设置空白组、药物组和对照组,以盐酸阿霉素为阳性对照。
抑制率=(A对照-A药物)/(A对照-A空白)
3 结果与分析
3.1 菌株鉴定结果
菌株HD-1-1 的ITS 序列PCR 扩增序列长度为508 bp,这与NCBI 数据库中的Penicilliumsp.在系统进化树上是同一分支,进一步观察其形态特征可以发现,菌落绒状致密边缘为白色,能生成大量的孢子,孢子面为蓝绿色,这与青霉菌的形态特征是一致的。因此,初步鉴定HD-1-1 这一菌株是青霉菌Penicilliumbrevicompactum,并将其命名为Penicilliumsp.HD-1-1(图2)。

图2 菌株Penicillium sp.HD-1-1 的系统发育树Fig.2 Phylogenetic tree of Penicillium sp.HD-1-1
3.2 化合物结构鉴定

表1 化合物1 的1H-NMR (400 MHz, CD3OD) 和13C-NMR (100 MHz, CD3OD) 数据Table 1 1H-NMR (400 MHz, CD3OD) and 13C-NMR (100 MHz, CD3OD) data of compound 1
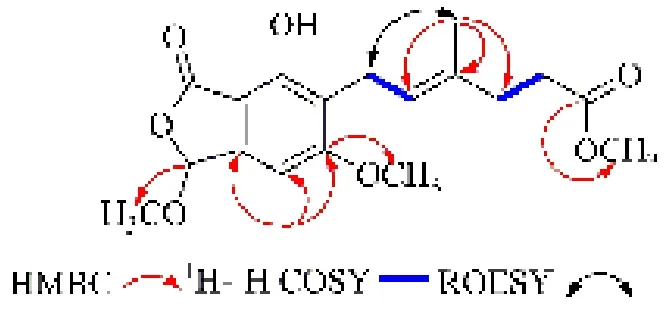
图3 化合物1 的主要1H-1H COSY、HMBC 和ROESY 相关性Fig.3 Key 1H-1H COSY, HMBC and ROESY correlations of compound 1
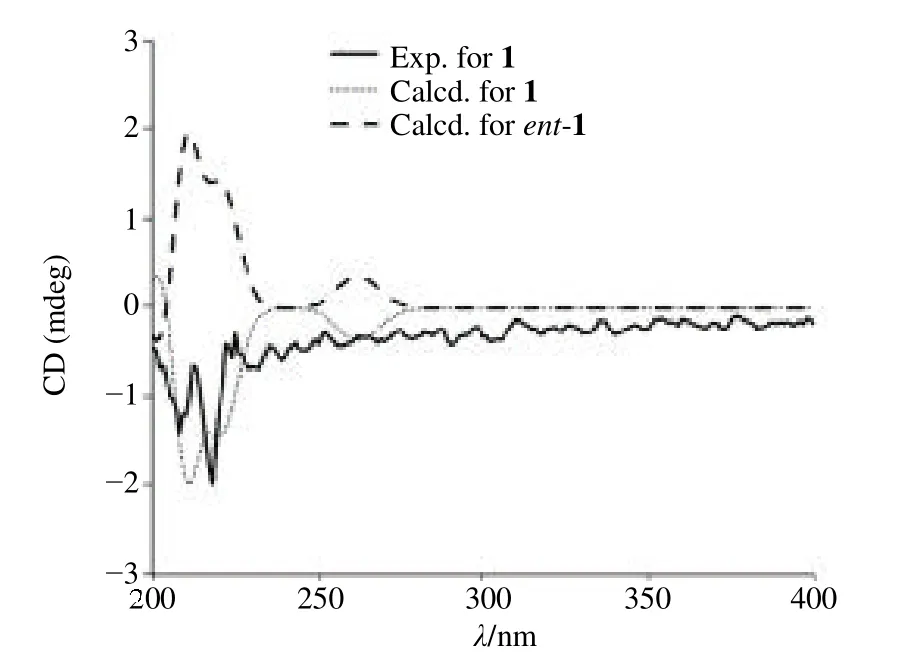
图4 化合物1 的实测和计算ECD 谱图Fig.4 Experimental and calculated ECD spectra of compound 1
化合物2:白色粉末;ESI-MSm/z343.1 [M+Na]+,分子式C17H20O6;1H-NMR (400 MHz, CD3OD)δ: 5.25 (1H, t,J= 6.9 Hz, H-2′), 5.22 (2H, s, H-3),3.76 (3H, s, 5-OMe), 3.38 (2H, d,J= 6.9 Hz, H-1′),2.36 (2H, t,J= 7.2 Hz, H-5′), 2.26 (2H, t,J= 7.6 Hz,H-4′), 2.14 (3H, s, H-8), 1.81 (3H, s, H-7′);13C-NMR(100 MHz, CD3OD)δ: 177.3 (C, C-6′), 173.8 (C,C-1), 164.8 (C, C-5), 154.7 (C, C-7), 146.6 (C, C-3a),135.0 (C, C-3′), 124.4 (CH, C-2′), 123.6 (C, C-6),117.8 (C, C-4), 107.7 (C, C-7a), 70.8 (CH2, C-3), 61.6(CH3, 5-OMe), 35.8 (CH2, C-4′), 33.8 (CH2, C-5′),23.6 (CH2, C-1′), 16.3 (CH3, C-7′), 11.4 (CH3, C-8)。该化合物的数据与文献报道的一致[14],故鉴定化合物2 为霉酚酸。
化合物3:褐色粉末;ESI-MSm/z357.1 [M+Na]+,分子式C18H22O6;1H-NMR (400 MHz, CDCl3):δ: 5.23 (3H, s, H-3, 2′), 3.75 (3H, s, 5-OMe), 3.56 (3H,s, 6′-OMe), 3.37 (2H, d,J= 7.0 Hz, H-1′), 2.39 (2H, t,J= 6.9 Hz, H-5′), 2.26 (1H, t,J= 7.6 Hz, H-4′), 2.14(3H, s, H-8), 1.80 (3H, s, H-7′);13C-NMR (100 MHz,CDCl3)δ: 175.6 (C, C-6′), 173.8 (C, C-1), 164.8 (C,C-7), 154.8 (C, C-5), 146.6 (C, C-4), 134.8 (C, C-3′),124.6 (CH, C-2′), 123.6 (C, C-7a), 117.8 (C, C-6),107.7 (C, C-3a), 70.8 (CH2, C-3), 61.5 (CH3, 5-OMe),52.0 (CH3, 6′-OMe), 35.7 (CH2, C-4′), 33.7 (CH2,C-5′), 23.6 (CH2, C-1′), 16.2 (CH3, C-7′), 11.4 (CH3,C-8)。该化合物的数据与文献报道的一致[15],故鉴定化合物3 为甲基麦考酚酸。
化合物5:棕色粉末;ESI-MSm/z359.2 [M+Na]+,分子式C17H20O7;1H-NMR (400 MHz, CDCl3)δ: 6.60 (1H, brs, H-3), 5.25 (1H, t,J= 6.3 Hz, H-2′),3.76 (3H, s, 5-OMe), 3.40 (2H, d,J= 6.9 Hz, H-1′),2.28~2.38 (4H, m, H-4′, 5′), 2.25 (3H, s, H-8), 1.81(3H, s, H-7′);13C-NMR (100 MHz, CDCl3)δ: 179.5(C, C-6′), 171.7 (C, C-1), 165.2 (C, C-5), 154.5 (C,C-7), 145.7 (C, C-3a), 135.2 (C, C-3′), 125.5 (C, C-6),124.1 (CH, C-2′), 120.3 (C, C-4), 108.8 (C, C-7a),100.9 (CH, C-3), 61.5 (C, 5-OMe), 35.8 (CH2, C-4′),33.9 (CH2, C-5′), 23.7 (CH2, C-1′), 16.3 (CH3, C-7′),11.1 (CH3, C-8)。该化合物的数据与文献报道的一致[16],故鉴定化合物5 为6-(5-羧基-3-甲基戊-2-烯)-3,7-二羟基-5-甲氧基-4-甲基苯酚-1-酮。
化合物10:白色粉末;ESI-MSm/z529.3 [M+Na]+,分子式C32H30N2O4,1H-NMR (400 MHz,CDCl3)δ: 7.66~7.70 (4H, m, H-2′′, 2′′′, 6′′, 6′′′),7.18~7.41 (10H, m, H-2, 2′, 3, 3′, 4, 4′, 5, 5′, 6, 6′),7.35~7.52 (6H, m, H-3′′, 3′′′, 4′′, 4′′′, 5′′, 5′′′), 4.80(1H, dd,J= 9.5, 5.8 Hz, H-8′), 4.57 (1H, m, H-8),4.41 (1H, dd,J= 11.5, 4.5 Hz, H-9α), 4.14 (1H, dd,J= 11.4, 6.4 Hz, H-9β), 3.28 (1H, m, H-7′α), 3.12(1H, dd,J= 13.8, 9.0 Hz, H-7′β), 2.94 (1H, dd,J=13.7, 6.6 Hz, H-7α), 2.88 (1H, dd,J= 13.7, 8.3 Hz,H-7β);13C-NMR (100 MHz, CDCl3)δ: 173.1 (C,C-9′), 170.4 (C, C-7′′), 170.3 (C, C-7′′′), 139.1 (C,C-1), 138.5 (C, C-1′), 135.6 (C, C-1′′), 135.0 (C,C-1′′′), 132.9 (C, C-4′′′), 132.6 (CH, C-4′′), 130.3 (CH,C-2′, 6′), 130.2 (CH, C-2, 6), 129.6 (CH, C-2′′′, 6′′′),129.5 (CH, C-3, 5), 129.5 (CH, C-3′′, 5′′), 129.5 (CH,C-3′′′, 5′′′), 128.5 (CH, C-4′), 128.4 (CH, C-2′′, 6′′),127.9 (CH, C-3′, 5′), 127.6 (CH, C-4), 66.8 (CH2,C-9), 56.3 (CH2, C-8′), 51.9 (CH2, C-8), 38.0 (CH2,C-7′), 37.8 (CH2, C-7)。该化合物的数据与文献报道的一致[20],故鉴定化合物10 为N-(N'-苯甲酰基-S*-苯丙氨酰基)-S*-苯丙氨醇苯甲酸酯。
化合物15:白色粉末;ESI-MSm/z383.1 [2M+Na]+,分子式C9H8O4;1H-NMR (400 MHz, CD3OD)δ: 10.28 (2H, s, 5, 7-OH), 6.41 (1H, s, H-6), 5.09 (2H,s, H-3), 1.90 (3H, s, H-8);13C-NMR (100 MHz,CD3OD)δ: 169.1 (C, C-1), 162.0 (C, C-5), 156.0 (C,C-7), 149.3 (C, C-3a), 108.6 (C, C-4), 102.2 (C, C-7a),102.1 (CH, C-6), 67.7 (CH2, C-3), 10.2 (CH3, C-8)。该化合物的数据与文献报道的一致[24],故鉴定化合物15为5,7-二甲氧基-4-甲基异苯并呋喃-1(3H)-酮。
化合物16:黄色粉末;ESI-MSm/z407.1 [2M+Na]+,分子式C10H8O4;1H-NMR (400 MHz, CD3OD)δ: 6.32 (1H, s, H-4), 6.30 (1H, d,J= 2.1 Hz, H-5),6.28 (1H, d,J= 2.2 Hz, H-7), 2.23 (3H, s, H-9);13C-NMR (100 MHz, CD3OD)δ: 167.9 (C, C-1),167.3 (C, C-3), 164.9 (CH, C-4), 155,6 (C, C-4a),141.5 (CH, C-5), 105.5 (C, C-6), 103.4 (CH, C-7),102.4 (C, C-8), 99.7 (C, C-8a), 19.2 (CH3, C-9)。该化合物的数据与文献报道的一致[25],故鉴定化合物16为saccharonol A。
化合物17:黄色粉末;ESI-MSm/z417.2 [2M+H]+,分子式C10H8O5;1H-NMR (400 MHz, CD3OD)δ: 6.50 (1H, brs, H-4), 6.35 (1H, m, H-5), 6.33 (1H, m,H-7), 4.34 (2H, s, H-9) ;13C-NMR (100 MHz,CD3OD)δ: 167.5 (C, C-1), 167.4 (C, C-8), 164.9 (C,C-6), 157.4 (C, C-3), 140.7 (C, C-4a), 104.8 (CH, C-4),104.4 (CH, C-5), 103.0 (CH, C-7), 99.9 (C, C-8a), 61.3(CH2, C-9)。该化合物的数据与文献报道的一致[26],故鉴定化合物17 为6,8-二羟基-3-羟甲基异香豆素。
3.3 活性测试结果
通过测试13 个化合物对5 种肿瘤细胞(A549、NCI-H158、MCF7、AGS、HT29)的抑制活性(表2)发现,化合物2 和3 对AGS 细胞具有较强抑制活性,IC50分别为0.69、1.12 μmol/L。此外化合物2 对NCI-H1581 细胞具有中等抑制活性,IC50值为17.95 μmol/L,化合物3 对HT29 细胞具有中等抑制活性,IC50值为19.30 μmol/L。

表2 13 个化合物的细胞增殖抑制活性测试Table 2 Antitumor activities for 13 compounds
4 讨论
本研究以涠洲岛火山口海洋真菌Penicilliumsp.HD-1-1 为研究对象,分离得到1 个新的霉酚酸类化合物(1)以及16 个已知化合物(2~17)。通过分析活性测试结果及化合物之间的结构差异,发现化合物2 和3 仅在C-6′位置有差异,说明C-6′位置的COOH 酯化为COOCH3增加了化合物对于HT29 细胞的细胞毒活性,降低了化合物对于AGS细胞和NCI-H1581 细胞的细胞毒活性。化合物2 和5 相比,说明苯并呋喃环上C-3 位置的羟基取代降低了化合物对于5 种肿瘤细胞的细胞毒活性。化合物1、4 与化合物3 相比,说明苯并呋喃环上C-3位置发生的甲氧基取代、及羟基取代降低了化合物对于5 种肿瘤细胞的细胞毒活性。结构的改变可能影响其在体内的吸收和稳定性、对肿瘤细胞的亲和力、片段的酶分解行为,这些因素微妙相关进而造成活性的变化[27]。
本研究发现的新霉酚酸类衍生物,丰富了海洋天然来源的MPAs 家族。此外,还研究了该类化合物对于5 种肿瘤细胞(A549、NCI-H1581、MCF-7、AGS、HT29)的细胞毒活性,为霉酚酸衍生物的生物活性探索研究提供了相应参考,以期获得新的有前途的霉酚酸类药物先导化合物。
利益冲突所有作者均声明不存在利益冲突
