β-人绒毛膜促性腺激素快速高灵敏化学发光POC检测方法的建立及评价
2024-04-09谢海宇秦静张艳妮刘俊杰何小维王羽
谢海宇 秦静 张艳妮 刘俊杰 何小维 王羽
(1.华南理工大学食品科学与工程学院,广州 510641;2.广州万孚生物技术股份有限公司,广州 510670;3.生物岛实验室(广州再生医学与健康广东省实验室),广州 510005)
人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)由胎盘绒毛滋养层细胞分泌,是一种由α和β两个不同亚基通过非共价键结合而成的高度糖基化异二聚体糖蛋白。胎盘绒毛滋养层包括单个核细胞绒毛滋养层内层和多核合体细胞滋养层外层。妊娠早期(4~5周)主要由内层细胞滋养层分泌产生HCG,妊娠6周后主要由外层合体细胞滋养层分泌产生[1-3]。几乎所有滋养细胞肿瘤和多数生殖细胞肿瘤均会分泌HCG及其亚基,因此HCG及其亚基可作为诊断早孕和监测妊娠及相关疾病的可靠标志物[4-7]。临床检测通常将HCG的β亚基(β-HCG)作为检测靶标,对β-HCG检测方法的性能要求主要体现在两方面:①灵敏度:妊娠早期血清β-HCG含量很低,一般仅有5~25 mU/ml,需高灵敏度的检测方法[8-9];②线性范围:β-HCG水平在妊娠期间呈指数级增长,约每2~3 d增加1倍,第8~10周可达到3×104~2×105mU/ml,浓度超出检测方法线性范围可能由于钩状效应出现假低浓度,严重影响临床医生对病情的预判[10-12]。因此,发展一种灵敏度高、检测范围宽的β-HCG即时检测(POCT)法对基层社区诊断早孕、监测妊娠及相关疾病等具有重要意义。
目前已发展了多种β-HCG检测法,其中化学发光免疫分析(chemiluminescence immunoassay,CLIA)是一种将化学发光技术与免疫化学反应相结合的分析方法,因其灵敏度高、动态范围宽、反应快速,且易于自动化广泛用于临床诊断[13-18]。传统的全自动CLIA通常配备大型仪器且需要专业技术人员操作,限制了CLIA在基层社区医疗单位的推广使用[19]。基层社区的大规模筛查不仅需要微型、自动化的分析仪,还需要智能、简单的操作系统。因此,妊娠及相关疾病的快速筛查迫切需要快速、简便的全自动化学发光POC分析仪配套的检测试剂[20-21]。本研究基于小型化学发光仪建立β-HCG快速高灵敏化学发光即时检测方法(POC-CLIA),并对其检测性能及临床应用进行评价。
1 材料与方法
1.1 材料 β-HCG单克隆抗体购自中国南京金斯瑞生物科技有限公司;β-HCG抗原购自中国南京艾得普生物科技有限公司;碱性磷酸酶(Alp)和牛血清白蛋白购自美国Roche公司;磁颗粒(Mps)购自日本JSR公司;化学发光底物(AMPPD)和其他化学发光试剂均由广州万孚生物技术股份有限公司提供;脱盐柱购自上海Thermo Fisher Science;所有缓冲试剂和其他无机化学品均购自Sigma-Aldrich;商业试剂盒购自美国Abbott公司;临床血清和血浆标本由广州万孚生物技术股份有限公司临床实验室提供;化学发光全自动小型化系统(Shine i2900)由广州万孚生物技术股份有限公司提供;对照试剂及仪器由美国Abbott公司提供(ARCHITECT i2000 SR化学发光检测仪及配套β-HCG化学发光检测试剂盒)。
1.2 方法
1.2.1 β-HCG抗体包被Mps 10 mg Tosyl Mps用0.1 mol/L硼酸盐缓冲液(pH=9.5)洗涤3次进行活化,活化后将50 μl β-HCG抗体(4.4 mg/ml)加入333 μl硫酸铵缓冲液(3 mol/L,pH=9.5)和617 μl硼酸盐缓冲液(0.1 mol/L,pH=9.5)进行偶联。37 ℃振荡孵育16 h后分离上清,加入1 ml 0.5%BSA溶液(0.02 mol/L,pH=7.2)封闭Mps,37 ℃继续孵育4 h后去上清,洗涤3次,获得免疫磁珠(Mps-Ab)。将Mps-Ab重悬于含0.1%BSA的磷酸盐缓冲液(0.02 mol/L,pH=7.2),4 ℃保存备用。
1.2.2 β-HCG抗体标记碱性磷酸酶(Alp) 将Alp和β-HCG抗体用超纯水分别稀释至2 mg/ml和4 mg/ml。600 μl Alp溶液与200 μl β-HCG抗体溶液轻轻混合,加入含1%戊二醛的磷酸盐缓冲液(0.1 mol/L,pH=7.4) 37 ℃避光孵育4 h,加入100 μl单乙醇胺溶液(1 mol/L) 37 ℃孵育2 h,用脱盐柱除去混合物中多余的颗粒。将得到的Alp标记的β-HCG抗体(Alp-Ab)转移至试管,与等量甘油混合,-20 °C保存备用。
1.2.3 免疫检测程序 全自动化学发光免疫分析仪使用过程:①样品装载:将血清或血浆样品放入样本位置;②试剂装载:将装有Alp-Ab、Mps-Ab、样本处理液的试剂船放置到相应位置;③打开仪器并运行,启动自动检测程序。POCT-CLIA免疫反应采用一步夹心法:5 μl临床样品或校准品、50 μl Alp-Ab和50 μl Mps-Ab混合,37 ℃振荡孵育5 min,形成夹心Mps-Ab-β-HCG-Alp-Ab免疫复合物,磁分离系统洗涤4 min去除游离组分,加入200 μl发光底物(AMPPD)反应4 min后检测发光值。
1.2.4 β-HCG标准品配制及孵育时间和上样体积确定 量取不同量β-HCG抗原溶于含0.5%BSA的Tris-HCl溶液,制成标准品S0~S9(0、8、28、80、224、379、650、1 950、5 500、10 924 mU/ml)。测试S1~S9标准品信噪比以及62例临床血清样本信号与浓度的相关性,确定孵育时间及上样体积。
1.2.5 标准曲线建立 对标美国Abbott公司化学发光检测试剂盒,按照溯源程序,由美国Abbott公司的ARCHITECT i2000 SR化学发光检测仪标定出100例血清样本浓度,血清样本继续校准广州万孚Shine i2900后即可标定出10个标准样本浓度。检测后将浓度与发光值进行四参数拟合获得标准曲线。
1.2.6 最低检测限 采用空白样本S0重复测定20次,计算其发光值平均值CM1和标准差SD;测定S1样本3次,计算发光值平均值CM2,对S0与S1的浓度-发光值结果进行两点回归拟合,得出拟合方程,将CM1+2SD结果代入拟合方程得出最低检测限[22]。
1.2.7 精密度试验 使用两种不同浓度标准品(25.3 mU/ml和920.6 mU/ml)进行批内和批间分析。1 d内测试各浓度样本6次计算批内精密度,连续6 d对各样品进行2次测试获得批间精密度。
1.2.8 准确度试验 分别测试低浓度质控品(AL:25.3 mU/ml)和高浓度质控品(AH:463.6 mU/ml),各样本测试3次,利用相对偏差评价POC-CLIA体系测定结果的准确性。
1.2.9 线性稀释试验 高浓度β-HCG血清样本(1.092×104mU/ml)采用牛血清稀释,按高浓度样本∶血清=0∶1、1∶99、1∶9、1∶4、2∶3、3∶2、4∶1、1∶0稀释,稀释后浓度分别为0、109、1 092、2 184、4 368、6 551、8 736、10 920 mU/ml。将混合稀释样本实际测定的平均值与理论值进行线性回归分析。
1.2.10 抗干扰试验 血清样本中添加一定量可在免疫检测中引起干扰的常见组分(如胆红素、三酰甘油、血红蛋白),与未添加干扰物质的血清样本进行对照测试。干扰表现为偏差值,偏差(%)=(实验组浓度-对照组浓度)/对照组浓度×100%。
1.2.11 稳定性试验 根据行业标准[23-25],将Alp-Ab、Mps-Ab和样本处理液各分为3份,37 ℃保存0 d、7 d和10 d,保存前后均测试血清样本3次,计算测试结果与原始值偏差,偏差(%)=(热加速后浓度-原始浓度)/原始浓度×100%。
1.2.12 钩状效应试验 用标准品稀释液将已知高浓度β-HCG阳性临床样本(2.6×105mU/ml)按临床样本∶稀释液=11∶9、11∶5、12∶5、13∶5、1∶2、1∶4、1∶8、1∶16、1∶32、1∶64、1∶128、1∶256进行系列稀释。每个样本分别测定3次,拟合其浓度和发光值曲线。
1.2.13 临床应用评估 采用建立的POC-CLIA方法与商业试剂盒对照检测100例临床血清样本,对两种方法的结果进行Passings-Bablok相关性分析、Bland-Altman一致性分析以及配对t检验。采用EDTA-K2、肝素锂和常规采血管收集20例不同人血液样本,POC-CLIA进行β-HCG检测,比较EDTA-K2血浆样本、肝素锂血浆样本与血清样本β-HCG检测结果差异。
1.3 统计学处理 四参数和线性拟合采用Origin Pro 2021软件进行;性能评价按美国临床实验室标准化协会标准EP文件进行,数据采用SPSS25.0软件进行统计学分析(P<0.05为差异有统计学意义);Bland-Altman一致性分析和Passing-Bablok相关性分析采用Med Calc软件进行。
2 结果
2.1 孵育时间与上样体积确定 选择抗原抗体反应时间为5 min、上样量为5 μl。低段信噪比(S1/S0)为3.45,随着浓度升高,信噪比逐步增大,中段信噪比(S5/S0)达到182.43,高段信噪比(S9/S0)高达7 086(图1A)。不同β-HCG浓度临床血清样本与其对应信号值具有高度相关性(R2=0.989 8,图1B)。因此,抗原抗体反应时间为5 min和样本量5 μl满足方法学要求。

图1 孵育时间与上样体积确定Fig.1 Incubation time and sample volume determination
2.2 β-HCG标准曲线建立 检测β-HCG系列标准品,建立的标准曲线如图2所示。标准曲线方程为:y=30 431 860+(4 743-30 431 860)/[1+(x/11 789)1.179],R2=0.999 9。
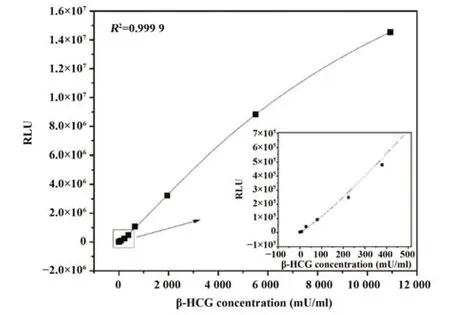
图2 POC-CLIA检测β-HCG的标准曲线Fig.2 Standard curve of POC-CLIA for β-HCG detection
2.3 最低检测限 建立的POC-CLIA最低β-HCG检测限为0.71 mU/ml,满足妊娠早期血清β-HCG检测(5~25 mU/ml)要求。
2.4 精密度 批内和批间变异系数(CV)分别≤3.11%和≤5.58%(表2),优于行业标准要求(≤8%和≤15%),表明该方法的重现性和精密度良好。
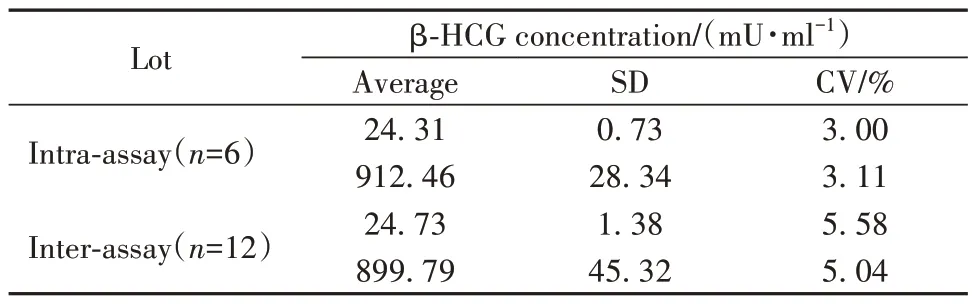
表2 批内和批间变异系数Tab.2 Intra and inter CV
2.5 准确度 实际结果与标示值相对偏差均在±10%之内,表明所开发的POC-CLIA方法具有较高的准确性,具有临床应用价值(表3)。

表3 准确度测试结果Tab.3 Results of accuracy tests
2.6 线性稀释 稀释后的β-HCG测定浓度与其理论浓度呈高度线性关系(r=0.999 0,k=0.974 5,图3),证明该方法在0.710~1.092×104mU/ml工作范围内具有较好的检测准确性。

图3 β-HCG线性范围Fig.3 Linear range of β-HCG detection
2.7 抗干扰性 添加胆红素(0.02 g/dl)、三酰甘油(4 g/dl)、血红蛋白(0.8 g/dl)的临床血清标本与未添加干扰物质的样本检测结果偏差在±10%之内,具有较好的抗干扰能力,特异性较好(表4)。

表4 β-HCG抗干扰能力评价Tab.4 Evaluation of resistant interference capability of β-HCG detection
2.8 稳定性 将Alp-Ab、Mps-Ab和样本处理液热加速处理7 d和10 d后检测高、中、低3个样本(表5),测试结果与原始值偏差在±10%之内,说明试剂具有良好的稳定性。
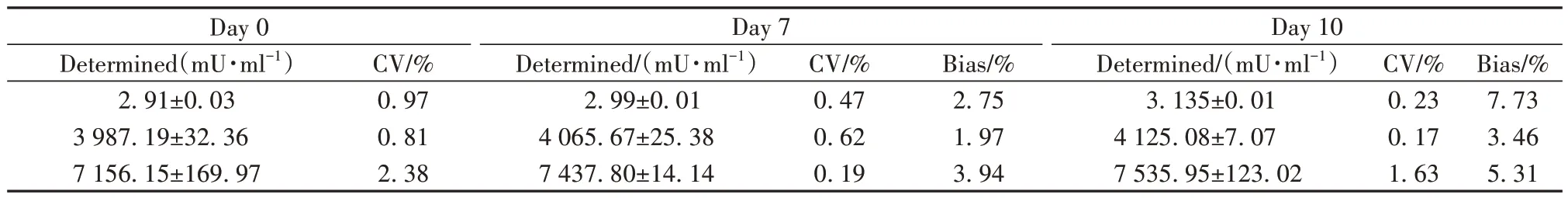
表5 试剂热加速稳定性Tab.5 Reagents stability by accelerated testing
2.9 钩状效应 对钩状效应进行评价(图4),信号在1.7×105mU/ml进入平台期,而2.6×105mU/ml时仍未出现明显下降,表明本试剂盒检测高浓度样本时具有很好的抗钩状效应能力。

图4 钩状效应评估Fig.4 Evaluation of hook effect
2.10 临床应用评估 使用本方法与商业试剂盒平行测试批量临床样本,Passing-Bablok相关性分析显示两种方法的相关系数为0.997 0(图5A);Bland-Altman一致性分析发现两种方法的平均相对差值仅为4%(95%CI,图5B);配对t检验P值为0.327,差异无统计学意义。表明建立的POC-CLIA法与对照试剂盒检测结果高度相关,检测一致性良好,可用于临床血清β-HCG定量检测。同步检测肝素锂血浆样本、EDTA-K2血浆样本与血清样本β-HCG发现,血浆样本与血清样本的检测结果R2分别为0.999 0(图6A)和0.998 7(图6B),斜率k分别为0.918 0和0.998 7,表明血浆样本与血清样本检测结果高度相关,可通用于血清及血浆β-HCG检测。

图5 商品化直接化学发光方法与POC-CLIA的Passing-Bablok(A)和Bland-Altman(B)分析Fig.5 Passing-Bablok (A) and Bland-Altman (B) analysis of commercial direct chemiluminescence and proposed method

图6 肝素锂血浆样本(A)、EDTA-K2血浆样本(B)与血清样本的Passing-Bablok分析Fig.6 Passing-Bablok analysis of serum samples with lithium heparin plasma samples(A) and EDTA-K2 plasma samples (B)
2.11 方法学比较 比较建立的POC-CLIA与已报道的β-HCG检测方法,目前定量检测β-HCG的技术主要为免疫分析技术,包括胶体金免疫层析法(GICT)、ELISA、时间分辨荧光免疫分析法(TRFIA)、直接化学发光免疫分析法(dCLIA)等,本研究的POC-CLIA方法灵敏度更高,线性范围更宽,检测速度快,且可实现全自动POC检测,具有较高临床应用价值(表6)。

表6 已报道的β-HCG检测方法与本研究建立方法比较Tab.6 Comparison of reported assay for β-HCG detection and established method in this study
3 讨论
HCG是包含237个氨基酸的异二聚体,由α亚基(α-HCG)和β亚基(β-HCG)组成,通过电荷非共价连接,共包含8个糖基侧链[29]。其中,β-HCG是HCG的特有结构,决定了其分子生物学和免疫学特性,其含量测定在临床中应用广泛,常用于诊断妊娠、监测妊娠过程、估计妊娠时间;在异位妊娠、唐氏综合征、滋养层肿瘤、非妊娠性恶性瘤等疾病中也有显著变化,如正常宫内妊娠时血清β-HCG倍增时间为1.7~2.4 d,异位妊娠则需3~8 d。因此,建立简单、快速的β-HCG检测方法具有重要临床意义。
本研究将免疫反应、磁分离技术和化学发光检测技术相结合,建立了一种灵敏度高、线性范围宽、检测速度快、特异性强的POC-CLIA检测方法。由于磁微粒表面积大,增加了抗体承载能力,且Alp-AMPPD发光系统稳定性好,可持续发光,因此本试剂盒具有高灵敏度,最低检测限仅为0.71 mU/ml。本研究使用了一步程序,比通常使用的两步程序更快,孵育时间仅为5 min,仅需14.5 min即可获得准确结果,线性范围为0.710~1.092×104mU/ml,且在1.7×105mU/ml高浓度时无钩状效应影响。可在37 ℃稳定保存10 d,相当于4 ℃下18个月。准确度相对偏差在±10%之内,批内、批间精密度良好(CV<10%),干扰物质与β-HCG均无交叉反应。将该方法用于临床血清标本β-HCG检测,结果与对照厂家美国Abbott公司的试剂盒结果具有较高一致性(R2=0.997 0),且可用于血浆β-HCG检测。
β-HCG检测最早使用的放射免疫技术由于其放射性污染等逐渐淘汰。胶体金免疫层析法虽不需要特殊仪器设备,易于操作,但仅适用于β-HCG定性检测,不能用于定量检测,且灵敏度有限。目前定量检测β-HCG的技术主要包括ELISA、TRFIA、dCLIA,其中ELISA存在酶稳定性差、光度测量范围窄、灵敏度较低等问题,易造成假阳性或漏诊。TRFIA具有较高的特异度和灵敏度,但易受自然存在的稀土类物质(主要来源于空气中的灰尘、实验用蒸馏水、反应容器等)影响,需在实验室干净环境下进行。dCLIA灵敏度高,检测速度较快,但需配备较大仪器设备,不能用于POCT检测。本研究的POC-CLIA方法灵敏度更高、线性范围更宽、检测速度快,且可实现全自动POC检测。此外,配套仪器体积小,可连续装载样本,可实现β-HCG的POC检测,利于在社区医院推广,实现早期妊娠和妊娠相关疾病筛查和监测。
