鸢尾黄素通过调节TLR4/MyD88/NF-κB信号通路改善血管性痴呆大鼠认知缺陷
2024-04-09丁旭邓祥敏殷紫刘旭谭东明尹红英江苏护理职业学院中医药学院淮安3005江苏护理职业学院附属淮安市淮阴医院肿瘤科淮安300
丁旭 邓祥敏 殷紫 刘旭 谭东明 尹红英 (.江苏护理职业学院中医药学院,淮安 3005; .江苏护理职业学院附属淮安市淮阴医院肿瘤科,淮安 300)
血管性痴呆(vascular dementia,VD)又称脑梗后痴呆,指大脑因缺血、缺氧等原因造成神经功能异常,引发机体记忆、认知功能及行为障碍的神经系统疾病[1]。VD发病原因众多,是老年痴呆常见病因之一,主要与脑血管因素有关。VD患病率越来越高,且趋于年轻化,临床主要表现为认知障碍,且随时间推移逐渐加重,严重时影响患者生活和社交[2-3]。VD发病机制尚不明确,迄今为止未发现可有效改善认知障碍症状的抗精神病药物。Toll样受体4(Toll-like receptor 4,TLR4)作为病原体主要受体,可激活机体固有免疫应答,在天然免疫应答中起关键作用[4]。核因子κB(nuclear factor-κB,NFκB)是B细胞中存在的主要核转录因子,参与调控多种炎症细胞因子、免疫应答等多种生物学过程。髓样分化因子88(myeloid differentiation factor 88,MyD88)是TLR信号通路关键连接蛋白,可激活NFκB,参与炎症反应,在多种非髓样组织中表达[5]。多项研究均表明TLR4/MyD88/NF-κB信号通路在免疫及炎症机制中发挥作用[6]。研究显示芹菜素可能通过抑制NF-κB表达改善动脉粥样硬化大鼠病情发展[7]。射干是一种常见中药材,具有清热解毒、化痰散结功效。鸢尾黄素是存在于中药材射干中具有抗炎、抗氧化和抗肿瘤等药物活性的异黄酮类化合物。研究显示鸢尾黄素可减轻糖尿病肾病大鼠肾脏损伤,发挥肾功能保护作用,可能通过调节NF-κB途径发挥作用,但尚无研究报道鸢尾黄素在VD中的作用[8]。本研究旨在分析鸢尾黄素对VD大鼠认知缺陷的影响,并初步探讨其可能作用机制。
1 材料与方法
1.1 材料
1.1.1 主要试剂与仪器 鸢尾黄素购于北京华威锐科化工有限公司(纯度>98%);吡拉西坦片购于百正药业股份有限公司(批准文号:国药准字H4102-2772,规格:0.4 g×100片);戊巴比妥钠购于上海氟德化工有限公司;动物用青霉素钠购于宁海源泰兽药有限公司;小动物磁共振成像仪购于上海玉研科学仪器有限公司;MT-200 Morris水迷宫购于北京友诚嘉业生物科技有限公司;脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、高亲和力受体酪氨酸激酶(phosphorylated tyrosine kinase receptor b,TrkB)、磷酸化TrkB(p-TrkB)、TLR4、MyD88、磷酸化NF-κB p65(p-NF-κB p65)、NF-κB p65和β-actin抗体及相应二抗购于美国ABsci公司。
1.1.2 实验动物 SPF级健康Wistar大鼠72只,6~8周龄,体质量(280±18) g,雌雄各半,购自扬州大学,许可证号:SCXK(苏)2017-0007。所有大鼠均饲养于标准环境,光照/黑暗各12 h,温度(25±5) ℃,湿度45%,自由饮水采食,适应性喂养7 d后构建VD大鼠模型。本研究经淮安市第一人民医院实验动物伦理委员会批准。
1.2 方法
1.2.1 建模和分组[9]将72只大鼠随机分为假手术组、模型组、鸢尾黄素低、中、高剂量组和阳性对照组,每组12只。所有大鼠建模前禁食1 d后称重。所有大鼠采用戊巴比妥钠麻醉后于锁骨上缘至颌下局部区域消毒,剔毛备皮。模型大鼠沿正中线切开,分离双侧颈总动脉,采用双侧颈动脉结扎法建立VD模型。假手术组大鼠仅分离双侧颈总动脉后缝合。整个手术过程取暖保证大鼠体温,确保存活率。以造模大鼠新物体偏爱系数降低为造模成功标准[10]。除去建模过程中死亡大鼠,保证每组应有数量。
1.2.2 给药方式 术后2周,鸢尾黄素低、中、高剂量组分别灌胃25、50、100 mg/kg鸢尾黄素,阳性对照组大鼠灌胃324 mg/kg吡拉西坦。假手术组和模型组大鼠灌胃等剂量生理盐水,1次/d,连续28 d。
1.2.3 Morris水迷宫实验 灌胃给药结束后,各组大鼠进行Morris水迷宫实验,1~5 d每天上午进行认知功能检测:空间探索实验及定位航行试验。测量目标区域停留时间及穿越平台次数,检测大鼠学习记忆能力。
1.2.4 样本采集 麻醉大鼠,采用微透析探针采集大鼠海马组织间液35 μl,-80 ℃保存,用于大鼠海马组织间液神经递质水平检测。大鼠麻醉后手术剥离脑组织并分离双侧海马组织,-80 ℃保存,用于大鼠海马组织BDNF、TrkB水平检测。
1.2.5 高效液相色谱-电化学检测大鼠海马组织间液神经递质水平 高效液相色谱-电化学检测海马组织间液去甲肾上腺素(noradrenaline,NE)、多巴胺(dopamine,DA)、5-羟色胺(serotonin,5-HT)和5-羟吲哚乙酸(5-hydroxyindole acetic acid,5-HIAA)水平。
1.2.6 RT-qPCR检测大鼠海马组织BDNF、TrkB表达 取海马组织,Trizol法提取大鼠海马组织总RNA,紫外分光光度计测定RNA浓度。按TaqMan©MicroRNA Reverse Transcription kit逆转录试剂盒说明以RNA为模板进行逆转录获得cDNA并于4 ℃保存,置于RT-PCR仪进行PCR扩增,反应条件:95 ℃预变性5 min;95 ℃变性10 s,60 ℃ 退火35 s,65 ℃延伸 30 s,扩增35个循环。以β-actin为内参,引物序列BDNF F:5′-AGGGGCATAGACAATCG-3′,R:5′-TTCCCCTTGATAATGGTC-3′;TrkB F:5′-AGTCGTCGAGACATGTC-3′,R:5′-CTGAAGACGACTGTTG-3′;β-actin F:5′-CTCGCTTCGGCAGCACA-3′,R:5′-ACGCTTCACGAATTTGCGT-3′。采用2-ΔΔCt方法统计BDNF和TrkB mRNA相对表达。
1.2.7 Western blot检测海马组织蛋白表达 取出海马组织,加入RIPA裂解液提取组织总蛋白,BCA法测定蛋白浓度。沸水浴中煮沸10 min,电泳后转膜,5%脱脂牛奶室温封闭1 h。加入一抗(1∶5 000)4 ℃孵育过夜。次日PBS洗涤3次,加入相应二抗(1∶1 000)室温孵育1 h,PBS洗涤3次,ECL发光液进行显色,内参选择β-actin。
1.3 统计学处理 使用SPSS22.0软件分析数据。计量资料±s行t检验比较两组间差异,单因素方差分析多组间差异。检验水准为α=0.05,双侧P<0.05为差异有统计学意义。所有数据均采用Graph Pad Prism 8.0软件绘图。
2 结果
2.1 各组大鼠逃避潜伏期比较 模型组大鼠1~5 d逃避潜伏期均长于假手术组(P<0.05)。与模型组相比,鸢尾黄素中、高剂量组和阳性对照组大鼠1~5 d逃避潜伏期均下降(P<0.05)。模型组和鸢尾黄素低剂量组大鼠1~5 d逃避潜伏期差异无统计学意义(P>0.05)。鸢尾黄素高剂量组和阳性对照组大鼠1~5 d逃避潜伏期差异无统计学意义(P>0.05,表1)。
表1 各组大鼠逃避潜伏期比较(±s,n=12,s)Tab.1 Comparison of escape latency in each group (±s, n=12,s)
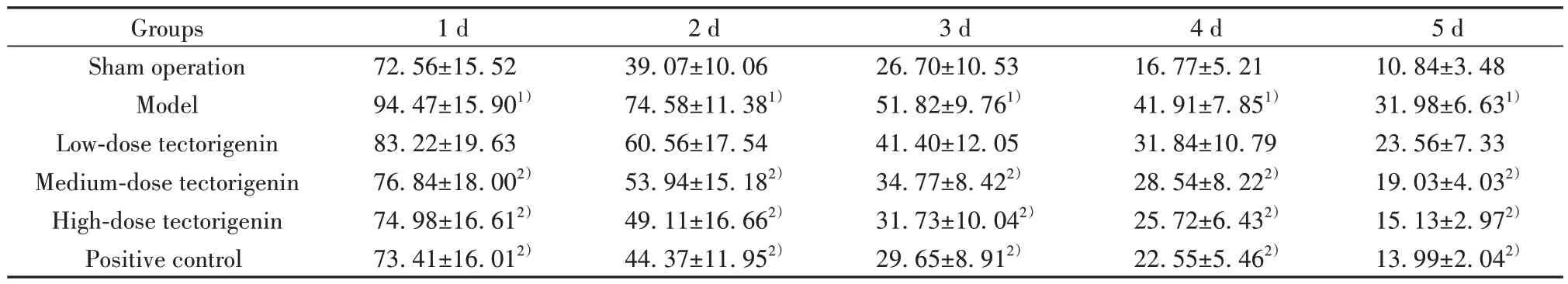
表1 各组大鼠逃避潜伏期比较(±s,n=12,s)Tab.1 Comparison of escape latency in each group (±s, n=12,s)
Note:Compared with sham operation group, 1)P<0.05; compared with model group, 2)P<0.05.
Groups1 d2 d3 d4 d5 d am operation72.56±15.5239.07±10.0626.70±10.5316.77±5.2110.84±3.48 Model94.47±15.901)74.58±11.381)51.82±9.761)41.91±7.851)31.98±6.631)23.56±7.33 19.03±4.032)15.13±2.972)13.99±2.042)Sh Low-dose tectorigenin Medium-dose tectorigenin High-dose tectorigenin Positive control 83.22±19.63 76.84±18.002)74.98±16.612)73.41±16.012)60.56±17.54 53.94±15.182)49.11±16.662)44.37±11.952)41.40±12.05 34.77±8.422)31.73±10.042)29.65±8.912)31.84±10.79 28.54±8.222)25.72±6.432)22.55±5.462)
2.2 各组大鼠目标区域停留时间、穿越平台次数模型组大鼠目标区域停留时间和穿越平台次数小于假手术组(P<0.05)。与模型组相比,鸢尾黄素中、高剂量组和阳性对照组大鼠目标区域停留时间和穿越平台次数增加(P<0.05)。模型组和鸢尾黄素低剂量组目标区域停留时间和穿越平台次数差异无统计学意义(P>0.05)。鸢尾黄素高剂量组和阳性对照组目标区域停留时间和穿越平台次数差异无统计学意义(P>0.05,表2)。
表2 各组大鼠目标区域停留时间和穿越平台次数比较(±s,n=12)Tab.2 Comparison on stay time in target area and times of crossing platform in each group (±s,n=12)

表2 各组大鼠目标区域停留时间和穿越平台次数比较(±s,n=12)Tab.2 Comparison on stay time in target area and times of crossing platform in each group (±s,n=12)
Note:Compared with sham operation group, 1)P<0.05; compared with model group, 2)P<0.05.
Times of crossing platform/times 6.43±1.57 2.48±1.451)3.87±1.37 4.85±1.322)5.19±1.712)5.47±1.652)Groups Sham operation Model Low-dose tectorigenin Medium-dose tectorigenin High-dose tectorigenin Positive control Stay time in target area/s 39.52±7.61 19.31±6.711)27.45±6.92 29.38±6.892)33.63±6.712)35.42±6.742)
2.3 各组大鼠海马组织间液NE、DA、5-HT和5-HIAA水平比较 模型组大鼠海马组织间液NE、DA、5-HT和5-HIAA水平均低于假手术组(P<0.05);与模型组相比,鸢尾黄素中、高剂量组和阳性对照组大鼠海马组织间液NE、DA、5-HT和5-HIAA水平均升高(P<0.05);模型组和鸢尾黄素低剂量组大鼠海马组织间液神经递质水平差异无统计学意义(P>0.05)。鸢尾黄素高剂量组和阳性对照组大鼠海马组织间液神经递质水平差异无统计学意义(P>0.05,表3)。
表3 各组大鼠海马组织间液神经递质水平比较(±s,n=12)Tab.3 Comparison on levels of neurotransmitters in hippocampus interstitial fluid in each group (±s,n=12)

表3 各组大鼠海马组织间液神经递质水平比较(±s,n=12)Tab.3 Comparison on levels of neurotransmitters in hippocampus interstitial fluid in each group (±s,n=12)
Note:Compared with sham operation group, 1)P<0.05; compared with model group, 2)P<0.05.
5-HIAA/(ng·ml-1)28.39±3.64 15.67±2.271)17.45±2.82 22.99±2.752)25.00±3.492)27.67±3.552)Groups Sham operation Model Low-dose tectorigenin Medium-dose tectorigenin High-dose tectorigenin Positive control NE/(ng·ml-1)41.76±6.79 23.23±4.211)24.96±3.73 31.51±3.822)34.84±4.282)36.96±6.552)DA/(ng·μl-1)38.20±3.13 15.43±1.661)28.94±3.54 31.24±3.482)35.46±4.412)36.74±2.462)5-HT/(ng·ml-1)60.41±6.13 34.88±4.341)37.11±3.38 43.66±3.242)50.77±3.712)58.29±2.402)
2.4 各组大鼠海马区组织BDNF、TrkB mRNA水平比较 模型组大鼠海马区组织BDNF、TrkB mRNA水平明显低于假手术组(P<0.05);鸢尾黄素中、高剂量组和阳性对照组大鼠海马区组织BDNF、TrkB mRNA水平明显高于模型组(P<0.05)。模型组和鸢尾黄素低剂量组大鼠海马区组织BDNF、TrkB mRNA水平差异无统计学意义(P>0.05)。鸢尾黄素高剂量组和阳性对照组大鼠海马区组织BDNF、TrkB mRNA水平差异无统计学意义(P>0.05,表4)。
表4 各组大鼠海马组织BDNF、TrkB mRNA水平比较(±s,n=12)Tab.4 Comparison on mRNA levels of BDNF and TrkB in hippocampus in each group (±s,n=12)
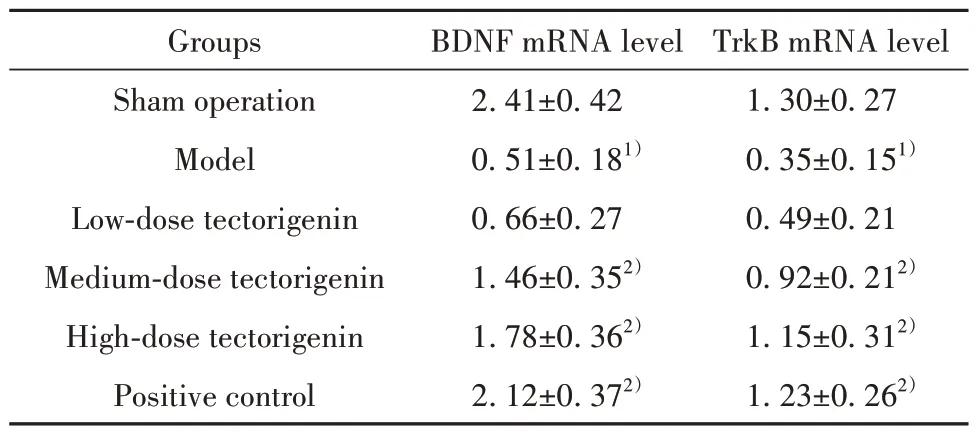
表4 各组大鼠海马组织BDNF、TrkB mRNA水平比较(±s,n=12)Tab.4 Comparison on mRNA levels of BDNF and TrkB in hippocampus in each group (±s,n=12)
Note:Compared with sham operation group, 1)P<0.05; compared with model group, 2)P<0.05.
TrkB mRNA level 1.30±0.27 0.35±0.151)0.49±0.21 0.92±0.212)1.15±0.312)1.23±0.262)Groups Sham operation Model Low-dose tectorigenin Medium-dose tectorigenin High-dose tectorigenin Positive control BDNF mRNA level 2.41±0.42 0.51±0.181)0.66±0.27 1.46±0.352)1.78±0.362)2.12±0.372)
2.5 各组大鼠海马组织BDNF、TrkB 蛋白水平比较 模型组大鼠海马组织BDNF、p-TrkB /TrkB蛋白水平明显低于假手术组(P<0.05);鸢尾黄素中、高剂量组和阳性对照组大鼠海马组织BDNF、p-TrkB/TrkB蛋白水平明显高于模型组(P<0.05)。模型组和鸢尾黄素低剂量组大鼠海马组织BDNF、p-TrkB/TrkB蛋白水平差异无统计学意义(P>0.05)。鸢尾黄素高剂量组和阳性对照组大鼠海马组织BDNF、p-TrkB/TrkB蛋白水平差异无统计学意义(P>0.05,表5、图1)。
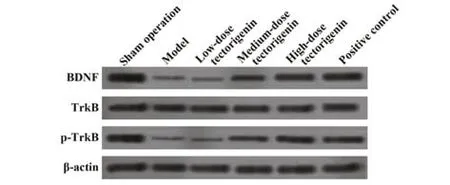
图1 各组大鼠海马组织BDNF、TrkB 蛋白水平比较Fig.1 Comparison on BDNF and TrkB proteins levels in hippocampus in each group
表5 各组大鼠海马组织BDNF、TrkB蛋白水平比较(±s,n=12)Tab.5 Comparison on BDNF and TrkB proteins levels in hippocampus in each group (±s,n=12)
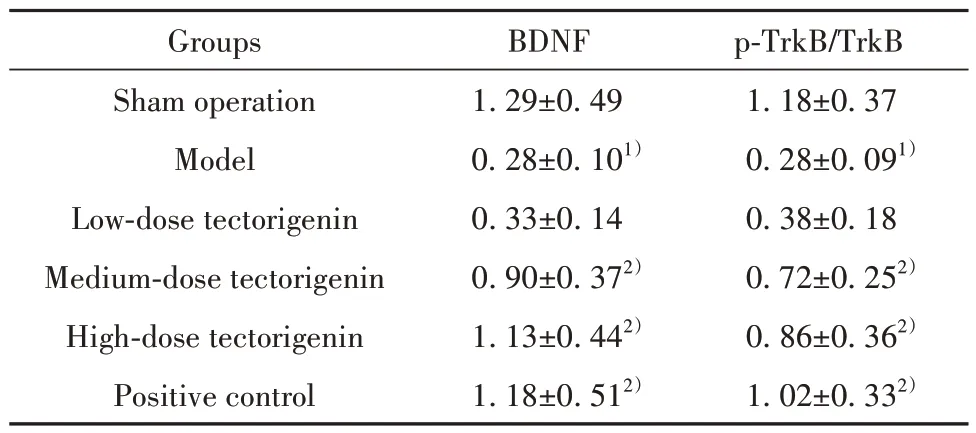
表5 各组大鼠海马组织BDNF、TrkB蛋白水平比较(±s,n=12)Tab.5 Comparison on BDNF and TrkB proteins levels in hippocampus in each group (±s,n=12)
Note:Compared with sham operation group, 1)P<0.05; compared with model group, 2)P<0.05.
p-TrkB/TrkB 1.18±0.37 0.28±0.091)0.38±0.18 0.72±0.252)0.86±0.362)1.02±0.332)Groups Sham operation Model Low-dose tectorigenin Medium-dose tectorigenin High-dose tectorigenin Positive control BDNF 1.29±0.49 0.28±0.101)0.33±0.14 0.90±0.372)1.13±0.442)1.18±0.512)
2.6 各组大鼠海马组织TLR4、MyD88、p-NF-κB p65/NF-κB p65蛋白水平比较 模型组大鼠海马组织TLR4、MyD88、p-NF-κB p65/NF-κB p65蛋白水平明显高于假手术组(P<0.05);与模型组相比,鸢尾黄素中、高剂量组和阳性对照组大鼠海马组织TLR4、MyD88、p-NF-κB p65/NF-κB p65蛋白水平明显降低(P<0.05)。模型组和鸢尾黄素低剂量组大鼠海马组织TLR4、MyD88、p-NF-κB p65/NF-κB p65蛋白水平差异无统计学意义(P>0.05)。鸢尾黄素高剂量组和阳性对照组大鼠海马组织TLR4、MyD88、p-NF-κB p65/NF-κB p65蛋白水平差异无统计学意义(P>0.05,表6、图2)。

图2 各组大鼠TLR4、MyD88、p-NF-κB p65/NF-κB p65蛋白水平Fig.2 TLR4,MyD88 and p-NF-κB p65/NF-κB p65 protein levels in hippocampus in each group
表6 各组大鼠海马组织TLR4、MyD88、p-NF-κB p65/NFκB p65 蛋白水平比较(±s,n=12)Tab.6 Comparison on of TLR4, MyD88 and p-NF-κB p65/NF-κB p65 proteins levels in hippocampus in each group (±s,n=12)
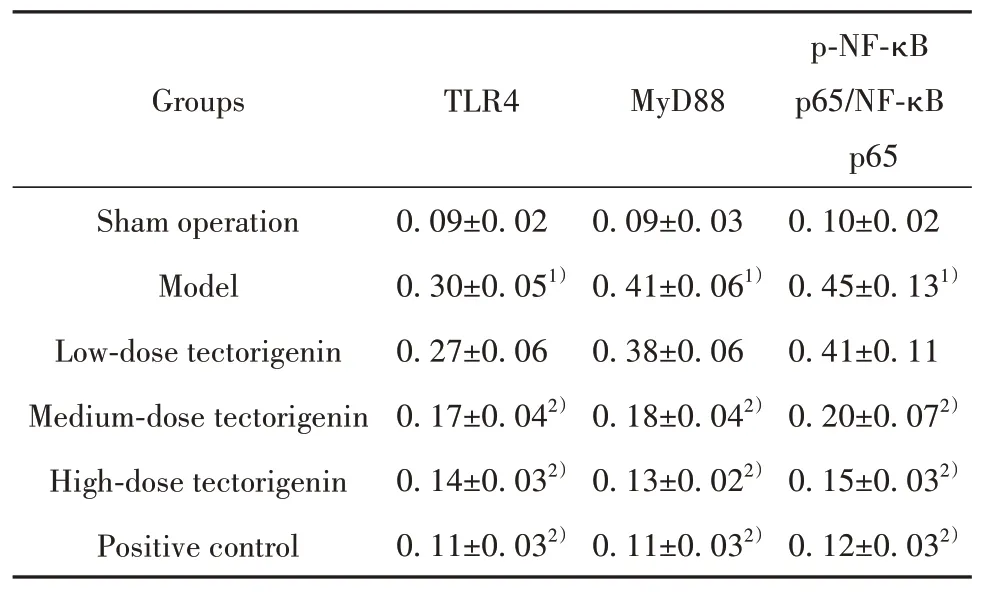
表6 各组大鼠海马组织TLR4、MyD88、p-NF-κB p65/NFκB p65 蛋白水平比较(±s,n=12)Tab.6 Comparison on of TLR4, MyD88 and p-NF-κB p65/NF-κB p65 proteins levels in hippocampus in each group (±s,n=12)
Note:Compared with sham operation group, 1)P<0.05; compared with model group, 2)P<0.05.
p-NF-κB p65/NF-κB p65 Groups TLR4 MyD88 0.10±0.02 0.45±0.131)0.41±0.11 0.20±0.072)0.15±0.032)0.12±0.032)Sham operation Model Low-dose tectorigenin Medium-dose tectorigenin High-dose tectorigenin Positive control 0.09±0.02 0.30±0.051)0.27±0.06 0.17±0.042)0.14±0.032)0.11±0.032)0.09±0.03 0.41±0.061)0.38±0.06 0.18±0.042)0.13±0.022)0.11±0.032)
3 讨论
VD是脑血管病变所致智力障碍,与多种危险因素有关。尽管该病具有早期可预防性,但患病率和致死率常年居高不下[11-12]。本研究发现VD模型大鼠记忆能力明显受损,经不同剂量鸢尾黄素干预后,大鼠空间学习记忆能力提高,说明鸢尾黄素在Morris水迷宫实验中提高了VD模型大鼠学习记忆能力,对大脑神经有保护作用,有望成为改善认知缺陷的潜在治疗药物。
本研究中,模型组大鼠海马组织间液NE、DA、5-HT和5-HIAA水平明显低于假手术组,经不同剂量鸢尾黄素干预后,大鼠海马组织间液NE、DA、5-HT和5-HIAA水平明显升高。神经递质是大脑中枢中存在的一类活性化学物质,主要抑制大脑清醒兴奋,控制肌肉收缩、命令指令[13-14]。NE神经元是最主要的交感神经突触递质,参与中枢系统记忆学习[15];DA属于儿茶酚胺类物质,用于传递脉冲,调控神经系统[16];5-HT是一种单胺神经递质,属于抑制性神经递质,其水平变化与人体记忆、睡眠及情绪有关[17]。研究显示益肾调气法可提高VD大鼠右侧海马、前额叶皮质5-HT、NE、DA含量,改善大鼠学习记忆能力[18]。本研究显示,鸢尾黄素干预VD大鼠可提高海马组织间液NE、DA、5-HT和5-HIAA水平,说明鸢尾黄素可改善VD大鼠大脑海马区域神经递质减少情况,提高记忆能力。
海马结构主司大脑记忆和认知,其结构破坏可影响大脑记忆功能,严重时可诱发VD。本研究中,模型组大鼠海马组织BDNF、TrkB mRNA和蛋白水平明显低于假手术组;VD模型大鼠给予不同剂量鸢尾黄素干预后,海马组织BDNF、TrkB mRNA和蛋白水平明显升高。BDNF主要存在于大脑皮质、海马体,是一种具有生物学功能的神经营养因子,支持大脑缺血后中枢和周围神经元存活[19]。已有研究证实BDNF与神经存活、学习、记忆、突触活动等行为有关,通过与受体TrkB结合改善大脑学习记忆功能[20]。大脑细胞因缺氧、缺血等因素受损伤时,脑组织BDNF、TrkB水平显著下降,学习记忆衰减。研究显示VD大鼠海马区组织BDNF、TrkB蛋白表达明显下降,经滋肾活血方干预后提高VD大鼠海马组织BDNF、TrkB蛋白表达,改善VD大鼠学习记忆能力[21]。本研究表明,鸢尾黄素干预VD模型大鼠可提高BDNF、TrkB表达,有效刺激下游因子,修复受损海马神经元,最终提高VD大鼠学习、记忆能力。
本研究中,VD模型大鼠海马组织TLR4、MyD88、p-NF-κB p65/NF-κB p65蛋白水平较假手术组大鼠明显升高,经不同浓度鸢尾黄素干预28 d,大鼠海马组织TLR4、MyD88、p-NF-κB p65/NF-κB p65蛋白水平较VD模型大鼠明显下调,且鸢尾黄素高剂量组大鼠海马组织TLR4、MyD88、p-NF-κB p65/NF-κB p65蛋白水平下降最为显著。NF-κB是一种能调节多种炎症反应的核转录因子,能够介导多种炎症介质和生长因子转录和表达[22-23]。MyD88是TLR4通路重要的衔接分子,NF-κB作为重要的多向性核转录因子,位于TLR4通路下游中心位置参与免疫应答[24]。研究显示肌肽可通过抑制NF-κB信号通路提高对VD大鼠的神经保护作用[25]。本研究表明VD模型大鼠脑组织海马区TLR4/MyD88/NFκB信号通路被激活,鸢尾黄素干预后TLR4/MyD88/NF-κB信号通路明显受抑制。
综上,本研究证实鸢尾黄素可能通过调节TLR4/MyD88/NF-κB信号通路改善VD大鼠认知功能障碍,为脑健康领域研究提供了依据,但仍存在不足,鸢尾黄素能否通过调控其他信号通路改善VD大鼠认知缺陷尚未进行深入研究,也是今后研究方向。
