美沙拉秦介导TGF-β1/Smad信号通路减轻脂多糖诱导的结肠上皮细胞炎症及凋亡
2024-04-09侯静刘加宁冯如陆伟王云苏峰徐州医科大学附属宿迁医院消化内科宿迁3800徐州医科大学附属宿迁医院药学部宿迁3800
侯静 刘加宁 冯如 陆伟 王云 苏峰 (.徐州医科大学附属宿迁医院消化内科,宿迁 3800;.徐州医科大学附属宿迁医院药学部,宿迁 3800)
溃疡性结肠炎(ulcerative colitis,UC)是一类慢性炎症性复发性疾病,表现为结肠、直肠黏膜及黏膜下层持续性、融合性炎症反应,临床表现为腹痛、腹泻和便血,严重者可发展为结直肠癌[1]。UC发病较为复杂,主要与地域、遗传、环境、饮食和自身免疫等多种因素相关,随着社会经济不断发展,全球UC发病率持续上升,且研究发现UC可能参与结直肠癌发生及发展,但具体发病机制尚不清楚[2-3]。目前UC主要治疗手段包括药物治疗和手术治疗,治疗初期通常选择药物治疗,而美沙拉秦(Mesalazine,MS)肠溶片是常见UC治疗西药,主要成分为5-氨基水杨酸,具有非甾体类抗炎药效果[4];重症UC患者则选择手术治疗,过早手术患者会失去保留结肠的机会,过晚又会错过最佳手术时间。MS治疗UC具有显著效果,但MS预防UC的临床证据尚需实验研究证实,且MS治疗UC的作用机制尚未阐明。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-6及可溶性白细胞介素-2受体(soluble interleukin-2 receptor,sIL-2R)作为被广泛研究的炎症因子,可促进白细胞活化,使肠道黏膜炎症反应持续[5-7]。MAVROPOULOU等[8]证明克罗恩病(Crohn's disease,CD)患者血清IL-6水平和UC患者sIL-2R水平可作为非侵入性生物标志物识别疾病活动状态。
多项研究表明结肠上皮细胞与UC发生相关,其中增殖、凋亡与结肠生长息息相关[9]。TGF-β1/Smad信号通路在UC进程中发挥重要作用,且该通路可作为UC治疗药物靶点[10-11]。MS是否通过介导TGF-β1/Smad通路调节UC的报道较少。因此本研究为探求MS介导的可能机制,构建体外UC细胞模型,研究MS对LPS诱导的结肠上皮细胞生长、增殖和凋亡的影响,明确MS对炎症因子TNF-α、IL-6和sIL-2R表达及TGF-β1/Smad信号通路的调控作用,从分子角度说明MS对UC的治疗作用,为MS临床治疗UC提供重要依据。
1 材料与方法
1.1 材料 人结肠上皮细胞NCM-460购自河南省工业微生物菌种工程技术研究中心;LPS、MS(纯度≥99%,上海源叶生物科技有限公司);胎牛血清、DMEM-H培养基(美国Gibco公司);Hoechst 33258染色试剂盒(江苏凯基生物技术股份有限公司);ELISA试剂盒(北京贝博生物科技有限公司);EdU细胞增殖检测试剂盒(上海碧云天生物技术有限公司);二喹啉甲酸(bicinchoninic acid,BCA)蛋白试剂盒(英国Abcam公司);鼠抗人TGF-β1、Smad2、Smad3、Smad7、p-Smad2、p-Smad3和β-actin抗体(一抗)、碱性磷酸酶标记的山羊抗鼠IgG(二抗)(美国CST公司);MF52-N型倒置荧光显微镜(广州市明美光电技术有限公司);Multiskan FC酶标仪(美国Thermo公司);OI 1000型凝胶成像系统(广州光仪生物科技有限公司)。
1.2 方法
1.2.1 KEGG信号通路富集分析 使用KEGG数据库(https://www.kegg.jp/pathway/)对炎症性肠病细胞相关通路进行分析,物种选择“human”。
1.2.2 人结肠上皮细胞NCM-460培养 人结肠上皮细胞NCM-460在37 ℃、5%CO2条件下培养,培养基选用DMEM-H培养基(补加10%胎牛血清),待细胞贴壁达80%以上时进行传代,取第4代对数生长期细胞用于后续实验。
1.2.3 细胞分组与给药 细胞分为Con组、LPS组、MS组(0.1、0.2、0.4 mg/L MS)和inhibitor组,Con组细胞不加药物干预,LPS组加入1 mg/L LPS诱导24 h构建UC细胞模型,MS组分别采用0.1、0.2、0.4 mg/L MS干预LPS组细胞,inhibitor组在0.2 mg/L MS组基础上添加10 μmol/L LY2109761进行干预,每组3个重复。
1.2.4 细胞形态学观察 将各组药物干预24 h的NCM-460细胞置于倒置显微镜下观察形态并拍照记录。
1.2.5 EdU法测定NCM-460细胞增殖率 取各组干预48 h的细胞进行EdU处理,去除培养液,0.5 ml 4%多聚甲醛室温固定15 min,0.5 ml 3%BSA洗涤3次;0.5 ml 0.3%TritonX-100室温去除BSA 10 min,BSA洗涤3次;12孔板中每孔加200 μl Click反应液(现配现用),室温避光孵育30 min,3%BSA洗涤3次去除Click反应液;每孔加入0.5 ml Hoechst,室温避光孵育10 min;3%BSA洗涤3次去除Hoechst;装片,荧光显微镜拍照,Image J软件处理图片。以EdU阳性染色细胞(红色)占总细胞(蓝色)的百分比表示细胞增殖率。
1.2.6 Hoechst 33258染色测定NCM-460细胞凋亡 PBS缓慢清洗药物干预24 h的NCM-460细胞2次,5 min/次;4%多聚甲醛(现用现配) 4 ℃固定10 min;PBS洗涤3次(5 min/次),5 mg/L Hoechst 33258染色液染色10 min,PBS清洗3次(5 min/次),封固后荧光显微镜观察细胞凋亡情况,随机选择3个视野拍照。
1.2.7 ELISA试剂盒检测NCM-460细胞培养液中炎症因子水平 收集各组干预24 h后的细胞上清,分别按照TNF-α、IL-6和sIL-2R ELISA试剂盒说明书操作,测定炎症因子TNF-α、IL-6和sIL-2R释放量。细胞培养液离心收集上清,分别将100 μl标准品及待测上清加入酶标板,37 ℃孵育2 h,弃上清;加100 μl生物素化抗体工作液和酶结合物工作液37 ℃孵育1 h;洗涤后用90 μl底物溶液37 ℃孵育10 min;加入50 μl终止液,5 min内测量各孔450 nm处OD值。
1.2.8 Western blot测定NCM-460细胞中TGF-β1/Smad通路相关蛋白表达 干预24 h后,收集各组细胞于RIPA液冰上裂解,4 ℃、12 000 r/min离心20 min,取上清进行蛋白变性,制胶,上样,SDS-PAGE凝胶电泳,100 mA恒流转PVDF膜,5%脱脂牛奶封闭2 h,参照抗体说明加入一定比例稀释的一抗(TGF-β1、Smad2、Smad3、Smad7、p-Smad2、p-Smad3和β-actin),再加碱性磷酸酶标记的山羊抗鼠IgG二抗稀释液,显影,一抗孵育2~3 h,二抗孵育2 h,分别用TBST洗涤3次,凝胶成像系统拍照记录。蛋白灰度值用G表示,蛋白相对表达量=G目的蛋白/G内参蛋白(β-actin)。
1.3 统计学分析 采用SPSS23.0软件进行统计学分析。多组间比较采用单因素方差分析,P<0.05表示差异有统计学意义。GraphPad Prism 8.0软件作图,Image J软件计算EdU增殖细胞数、总细胞数和蛋白灰度值。
2 结果
2.1 TGF-β1/Smad通路及炎症因子选择 使用KEGG PATHWAY数据库对人炎症性肠病细胞进行通路富集分析(图1),TGF-β可间接抑制炎症性肠病、参与CD发生,UC属于炎症性肠病的一种,因此选择TGF-β通路进行研究。人炎症性肠病细胞中TGF-β通路直接调控下游Smad2/3基因,通过磷酸化发挥作用,Smad7可抑制Smad2/3蛋白表达(图2),因此选择TGF-β及下游Smad2/3、Smad7基因进行研究。炎症因子TNF-α和IL-6与炎症性肠病发生相关(图1),且MAVROPOULOU等[8]证明UC患者sIL-2R水平可作为非侵入性生物标志物识别疾病活动状态,所以本研究选择IL-6、TNF-α和sIL-2R炎症因子进行实验。

图1 人类炎症性肠病相关信号通路图Fig.1 Signaling pathways associated with human inflammatory bowel disease
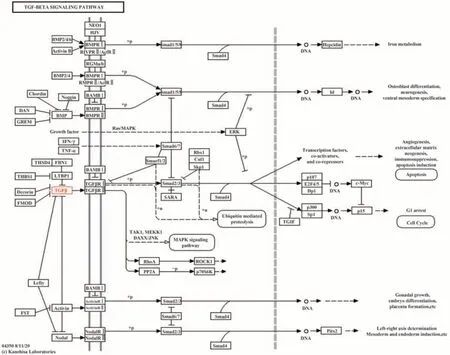
图2 人炎症性肠病中TGF-β信号通路图Fig.2 TGF-β signaling pathway in human inflammatory bowel disease
2.2 MS对人结肠上皮NCM-460细胞形态学的影响 人结肠上皮NCM-460细胞经LPS诱导24 h后,细胞生长受到抑制;0.1、0.2、0.4 mg/L MS处理LPS组细胞24 h后,细胞生长抑制能力下降,轮廓逐渐清晰,贴壁能力增强,Inhibitor组细胞生长趋势和形态变化与MS组细胞相同(图3)。
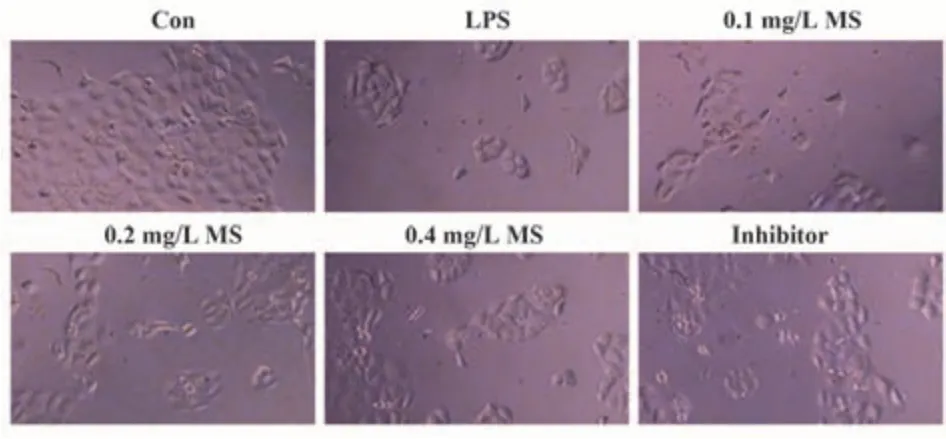
图3 倒置显微镜观察NCM-460细胞形态学变化(×20)Fig.3 Morphological changes of NCM-460 cells observed by inverted microscope (×20)
2.3 MS促进NCM-460细胞增殖 LPS处理24 h后,EdU阳性细胞数比Con组明显减少,提示LPS处理降低NCM-460细胞增殖率(图4);与LPS组相比,随着MS浓度增加,细胞增殖率逐渐升高,其中0.2和0.4 mg/L MS增加显著(P<0.05);与0.2 mg/L MS组相比,抑制剂进一步提升细胞增殖率(P<0.05)。

图4 EdU检测NCM-460细胞增殖情况(×20)Fig.4 NCM-460 cell proliferation detected by EdU assay (×20)
2.4 MS抑制NCM-460细胞的凋亡 正常细胞核呈淡蓝色,形态呈圆形,凋亡细胞核呈亮蓝色。LPS处理24 h后,LPS组细胞与Con组相比,凋亡细胞数明显增加;与LPS组相比,MS组细胞凋亡数随着处理浓度增加逐渐减少,而Inhibitor组细胞凋亡数进一步减少(图5)。

图5 荧光倒置显微镜下观察NCM-460细胞凋亡(×40)Fig.5 NCM-460 cells apoptosis observed under fluorescent inverted microscope (×40)
2.5 MS抑制NCM-460细胞炎症 ELISA检测不同处理组NCM-460细胞培养液中TNF-α、IL-6和sIL-2R表达(图6),与Con组相比,LPS组细胞炎症因子TNF-α、IL-6及sIL-2R表达均显著升高;MS处理后,炎症因子水平逐渐降低,呈剂量依赖性(P<0.05);与0.2 mg/L MS组相比,抑制剂进一步降低炎症因子表达(P<0.05)。

图6 ELISA检测NCM-460细胞炎症因子释放量Fig.6 Release of inflammatory factors from NCM-460 cells by ELISA
2.6 MS抑制NCM-460细胞TGF-β1/Smad通路活化 Western blot测定不同处理组NCM-460细胞TGF-β1、Smad2、Smad3、p-Smad2、p-Smad3和Smad7表达(图7),各组Smad2和Smad3蛋白表达无显著差异(P>0.05)。与Con组相比,LPS组细胞Smad7表达显著减少,而TGF-β1、p-Smad2和p-Smad3蛋白表达显著增加;与LPS组相比,MS组细胞Smad7表达显著升高,而TGF-β1、p-Smad2和p-Smad3蛋白表达显著降低,且呈剂量依赖性(P<0.05);与0.2 mg/L MS组相比,Inhibitor组Smad7表达显著升高,而TGF-β1、p-Smad2和p-Smad3蛋白表达显著降低。
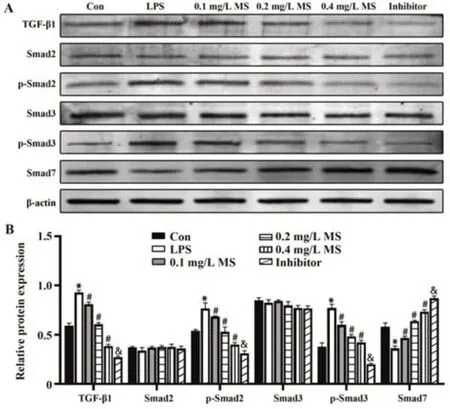
图7 Western blot检测NCM-460细胞TGF-β1/Smad通路相关蛋白表达Fig.7 TGF-β1/Smad pathway-related proteins expressions in NCM-460 cells detected by Western blot
3 讨论
UC是一种常见的消化道疾病,病程较长,极难治愈,具有易复发、治疗病程长等特点,且极易恶化发展为结直肠癌[12]。最近报道指出UC在我国乃至全世界发病率逐年上升,因此,对UC发病机制的研究及治疗方法的探讨成为医疗卫生界重要课题。多数研究者认为该病主要由促炎因子(TNF-α、IL-6等)以及抗炎因子不平衡导致,临床一般选用药物消除炎症反应,而MS作为治疗UC的常见药物,能有效抑制炎症介质白三烯形成、肠壁组织炎症反应和机体肠道病菌炎症递质,清除氧自由基,改善机体或血小板活化因子活性状况,从而改善UC患者临床症状[13-15]。为探求MS介导的可能新机制,本研究探讨其对结肠上皮细胞NCM-460功能、炎症及TGF-β1/Smad信号通路的影响,发现MS可能通过降低TGF-β1/Smad通路活性抑制其凋亡和炎症。
研究表明LPS能够诱发促炎因子表达从而引发炎症。李迪等[16]利用LPS诱导的小鼠BV-2小胶质细胞构建炎症细胞后IL-6释放量显著增加,而郝浩扬等[17]发现LPS诱导的小鼠乳腺组织中TNF-α显著增加,与本研究结果一致。本研究发现LPS诱导人结肠上皮细胞NCM-460增殖受到抑制,凋亡增加,且炎症因子TNF-α、IL-6、sIL-2R水平升高。祝斌等[18]研究发现,葡萄糖硫酸钠诱导的小鼠UC模型中,MS可能通过T细胞亚群发挥抗炎及治疗UC作用;耿艳丽等[19]研究表明MS治疗后UC患者症状显著减轻,且体内TNF-α、IL-6、IL-1β水平显著低于治疗前,证实了MS对UC的治疗作用。本研究利用不同浓度MS处理细胞,发现随着MS浓度增加,NCM-460细胞增殖率升高,细胞凋亡率降低,且TNF-α、IL-6、sIL-2R表达呈浓度依赖性降低,说明MS能够保护NCM-460细胞免受LPS伤害,促进NCM-460细胞生长。
TGF-β1/Smad信号通路能够参与机体发育过程中的细胞生长、分化、凋亡和细胞动态平衡过程,且与炎症性肠病相关[20-21]。陶鹏宇等[22]研究表明TGFβ1/Smad信号通路可能是六味地黄丸减轻糖尿病肾病炎症损伤的机制之一。于芝等[23]研究发现右美托咪定通过抑制TGF-β1/Smad信号通路激活减轻炎症对人软骨细胞的损伤作用。本研究发现LPS诱导的细胞中Smad7蛋白表达明显下降,而TGF-β1、p-Smad2和p-Smad3蛋白表达显著增加,表明LPS组细胞TGF-β1/Smad信号通路被激活;而MS组和抑制组细胞Smad7蛋白表达显著升高,而TGF-β1、p-Smad2和p-Smad3蛋白表达显著降低,说明MS可通过抑制TGF-β1/Smad信号通路发挥其抗炎作用。
综上,MS通过抑制TGF-β1/Smad信号通路从而减轻LPS诱导的细胞炎症反应和促凋亡作用,抑制UC细胞增殖,促进NCM-460细胞生长。
