TLR4/ERK1/2信号通路在不明原因自然流产蜕膜组织中的作用研究
2024-04-09李娜栾兆进杨美霞宫晓玲赵紫薇宋芳
李娜 栾兆进△ 杨美霞 宫晓玲 赵紫薇 宋芳
(1.包头医学院组织学与胚胎学教研室,包头 014000; 2.包钢第三职工医院,包头 014000)
自然流产(spontaneous abortion,SA)是指妊娠不足28周,胎儿体质量不足1 000 g而终止者,其病因十分繁杂,在临床上仍有近半数的患者病因不明。越来越多的研究认为SA与蜕膜免疫微环境异常有关[1],在正常妊娠期间占主导地位的细胞型是Th2型细胞,具有维持母体和胎儿免疫耐受的作用;一旦Th1型细胞占主导地位,将导致流产发生[2]。Toll受体4(Toll-like receptor 4,TLR4)是蜕膜局部微环境重要的刺激信号之一,可经过转导途径引起母胎界面的免疫活性因子Th1/Th2失衡[3]。细胞外信号调节蛋白激酶(extracellular signal regulated protein kinase 1/2,ERK1/2)可诱导Th1型细胞分化,在母胎免疫调节和炎症反应中发挥着关键调节作用[4]。LUO等[5]研究发现TLR4是ERK1/2的激活剂,病毒感染机体后,随着TLR4的激活免疫反应启动,MAPKs信号通路被激活,进一步磷酸化转录因子和细胞蛋白,最终加重了炎症反应。然而,TLR4是否通过激活ERK1/2引发SA,是亟待解决的问题。因此,本文拟通过研究TLR4和ERK1/2在不明原因SA和正常妊娠蜕膜组织的表达差异及二者的相关性,探讨蜕膜组织中TLR4通过ERK1/2信号途径参与SA发生的可能性,为不明原因SA防治提供理论依据。
1 资料与方法
1.1 资料
1.1.1 一般资料 流产组:2019年5月至2020年5月在包钢第三职工医院妇产科门诊就诊,夫妻双方身体健康而B超提示胚胎死亡,需进行手术的32例不明原因SA患者。年龄22~31岁,平均(23.31±3.76)岁,妊娠时间(51±5) d。纳入标准:①无明确致流产的因素;②初次发生自然流产。排除标准:有遗传性疾病、不良饮食史、服药史的患者。对照组:同期健康孕妇32例,年龄21~32岁,平均(24.32±3.38)岁,妊娠时间(53±5) d。无腹痛、阴道流血等症状,自愿行人工流产术。以上两组所有研究对象均签署知情同意书且本研究获包头医学院医学伦理委员会审批[包医审2022第(1号)]。
1.1.2 主要试剂 小鼠抗人TLR4单克隆抗体(sc-293072,Santa Cruz公司);兔抗人ERK1/2(4696S)、兔抗人p-ERK1/2单克隆抗体(4370S,Cell Signaling Technology公司);免疫组化通用型试剂盒(PV-6000,中杉金桥公司)、辣根过氧化物酶二抗(A0208、A0216,碧云天公司)。
1.2 方法
1.2.1 标本收集与处理 将两组患者手术后的蜕膜组织,快速用0.9%NaCl溶液清洗至无血色后,分为两部分进行收集,一部分蜕膜组织用于免疫组织化学染色而进行包埋制成切片;另一部分蜕膜组织保存于-80 ℃冰箱,用于后续的Western blot检测。
1.2.2 免疫组织化学染色(IHC)法 石蜡切片常规脱蜡水化;滴加鼠抗人TLR4(1∶200)、兔抗人ERK1/2(1∶250)和p-ERK1/2(1∶400)一抗,4 ℃冰箱内孵育12 h;滴加二抗进行孵育;显色及细胞核复染后,常规操作直至封片完成,用SMART生物显微镜(B301)进行光镜镜检。视野下每个标本留取5个不重复的清晰图片(×200),用Image Pro Plus 6.0图像分析软件计算TLR4、ERK1/2和p-ERK1/2蛋白表达相对含量,对两组蜕膜组织进行半定量分析。
1.2.3 Western blot检测 取流产组和对照组的每例蜕膜组织20 g收集到EP管中,通过BCA试剂盒检测其蛋白浓度;电泳转膜后将PVDF膜进行封闭;洗涤液洗膜后,滴加鼠抗人TLR4(1∶1 000)、兔抗人ERK1/2(1∶1 000)和兔抗人p-ERK1/2(1∶2 000)一抗,4 ℃冰箱孵育;二抗孵育后,洗膜后将膜放入显影液中,避光3 min,将膜放入一体式凝胶成像系统(OI100 Touch),观察条带,根据内参条带灰度值调整上样量。使用Image J软件进行灰度定量分析。
1.3 统计学处理 采用SPSS20.0统计软件进行独立样本t检验;相关性用Pearson等级相关性分析。P<0.05表示差异具有统计学意义。
2 结果
2.1 免疫组织化学染色 在不明原因SA组和正常妊娠对照组蜕膜细胞的细胞质上都有TLR4、ERK1/2和p-ERK1/2蛋白的表达,呈棕黄色颗粒,且各组阳性反应强弱有别(图1)。

图1 TLR4、ERK1/2和p-ERK1/2蛋白在蜕膜组织中的表达(×200)Fig.1 Expressions of TLR4, ERK1/2 and p-ERK1/2 proteins in decidual tissue (×200)
图像分析结果显示,TLR4、p-ERK1/2蛋白在不明原因SA患者蜕膜组织的表达明显高于正常妊娠对照者(P<0.01);与正常妊娠对照组相比,不明原因SA组蜕膜组织上ERK1/2的表达差异无统计学意义(P>0.05),见表1。
表1 TLR4、ERK1/2和p-ERK1/2蛋白在蜕膜组织中的表达差异(±s)Tab.1 Different expressions of TLR4, ERK1/2 and PERk1/2 proteins in decidua tissues (±s)

表1 TLR4、ERK1/2和p-ERK1/2蛋白在蜕膜组织中的表达差异(±s)Tab.1 Different expressions of TLR4, ERK1/2 and PERk1/2 proteins in decidua tissues (±s)
Note:Compared with control group,1)P<0.01.
p-ERK1/2 0.436±0.0761)0.323±0.080 Control 0.102±0.0660.331±0.074 Groups SA TLR4 0.174±0.0301)ERK1/2 0.340±0.149
2.2 Western blot 结果显示,在不明原因SA组蜕膜组织中,TLR4的蛋白相对含量高于正常妊娠对照组(P<0.05),p-ERK1/2的蛋白相对含量明显高于正常妊娠对照组(P<0.01),ERK1/2的蛋白相对含量与正常妊娠对照组相比差异无统计学意义(P>0.05,图2)。

图2 Western blot分析TLR4、ERK1/2、p-ERK1/2蛋白在蜕膜组织中的表达差异(±s)Fig.2 Western blot analysis of TLR4, ERK1/2, p-ERK1/2 protein expressions in decidua tissues (±s)
2.3 TLR4与p-ERK1/2的相关性分析 在不明原因SA组的蜕膜组织中,TLR4与p-ERK1/2的表达呈显著正相关(r=0.890,P<0.01,图3)。
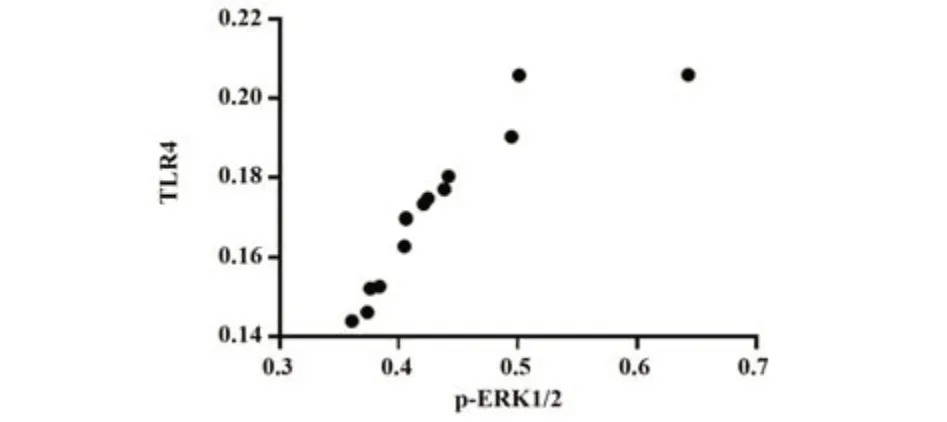
图3 SA组TLR4与p-ERK1/2的相关性分析Fig.3 Correlation analysis of TLR4 and p-ERK1/2 in SA group
3 讨论
SA病因与发病机制极其复杂,目前已经证明母体内分泌紊乱、感染性因素等都会引起SA的发生,但仍有约40%~50%的患者病因不明。在妊娠障碍相关疾病中,不明原因SA的发病率逐年增高,引起众多学者的关注。目前,有研究表明不明原因SA的发生与蜕膜微环境免疫失衡有关。正常妊娠期间的关键细胞型是Th2型细胞,以分泌IL-4和TGF-β等细胞因子为主,这些Th2型细胞因子起到阻抑免疫炎症反应作用,促进胎儿生长维持妊娠;Th1型细胞主要分泌的细胞因子有IL-2、IL-12和IFN-γ等,这些Th1型细胞因子在滋养细胞侵袭时具有一定的抑制作用,从而导致流产的发生。在胚泡植入的过程中,子宫内膜蜕膜化后成为蜕膜,蜕膜的免疫细胞群可以调控免疫平衡,发挥免疫抑制作用,同时能抵抗氧化应激、炎症反应和免疫排斥等,维持母体对胎儿的耐受[6-7]。DU等[8]的研究表明蜕膜异常发育将引发SA,与金丽颖[9]的研究所得结论一致,在SA患者的蜕膜免疫微环境中,具有促血管生成能力的蜕膜自然杀伤(decidual natural killer,dNK)细胞数量有所降低,同时dNK细胞分泌IL-10和TGF-β减少,使滋养细胞入侵能力减弱,影响子宫螺旋动脉重塑,进一步影响胎盘形成,从而导致妊娠失败。
TLR4与各种妊娠障碍有关,因为TLR4在妊娠维持尤其是免疫耐受中发挥重要调节作用,可激活其下游信号转导通路NF-κB、MyD88、ERK等,引发Th1型细胞因子的分泌和免疫应答的发生[10]。从本实验研究结果中可见:在不明原因SA患者蜕膜细胞的细胞质内TLR4蛋白有所表达,说明TLR4可能参与不明原因SA;Western blot结果显示,TLR4蛋白表达量在不明原因SA患者蜕膜组织中高于正常对照组,该结果与XU等[11]的研究结果趋于一致。以往的动物实验中发现,Th1型细胞激活会激活NK细胞,引起胎儿SA的级联反应[12],因此推测,TLR4蛋白表达上调促进Th1型细胞分泌更多的Th1型细胞因子,Th1型细胞因子参与免疫应答时抑制dNK细胞的表达,从而引起胚胎血管生成能力降低,子宫螺旋动脉重塑受阻,导致胚胎缺血、缺氧,阻碍胚胎发育,发生流产。
ERK1/2是经典的MAPK家族成员之一,ERK1/2活化能诱导Th1型细胞分化,促进细胞因子IL-2、IL-6、IL-8和TNF-α等的产生,调控Th1/Th2的平衡,在蜕膜免疫调节中发挥着关键作用。TLR4作为上游信号分子可以调控下游级联反应,包括MAPKs的激活,刺激信号可激活磷酸化ERK1/2(p-ERK1/2),将信息转至细胞核内[13]。有研究表明,p-ERK1/2可以防止滋养细胞过度增殖,为胚胎的着床和生长发育提供所需的物质基础[14],但是关于ERK1/2在不明原因SA蜕膜组织中的作用未见报道,而且关于TLR4介导ERK1/2信号通路的研究主要集中在病毒感染免疫方面。本研究发现蜕膜细胞的细胞质是p-ERK1/2蛋白的表达定位点,且p-ERK1/2蛋白在不明原因SA组呈高表达,在对照组呈低表达;同时Western blot实验结果与上述半定量结果趋于一致,p-ERK1/2蛋白水平在流产组明显高于对照组,而ERK1/2蛋白的表达水平,在两组中差异无统计学意义。以上结果提示,ERK1/2信号被激活后,其活化形式p-ERK1/2可能参与不明原因SA的发生。另外,在不明原因SA患者蜕膜组织中,TLR4与p-ERK1/2具有正相关性,推测TLR4/ERK1/2信号通路参与SA的发生,但不明原因SA蜕膜组织中TLR4/ERK1/2信号通路的改变是不明原因SA发生的原因还是结果尚不清楚。
研究发现,下调TLR4、ERK1/2基因及蛋白表达,可抑制炎症反应[15]。由此推测,在不明原因SA蜕膜组织中,Th1型细胞因子的释放可能是通过TLR4/ERK1/2信号途径促进的,导致胚胎发育原本的蜕膜微环境被Th1型细胞因子的分泌而破坏,从而引发不明原因SA。在胚泡着床后,胚胎和蜕膜组织都有大量生长因子及其受体的转录,其中核转录因子激活蛋白1(activator protein-1,AP-1),在人胎盘中表达较广泛,且AP-1活化后对胎盘形成及胎儿发育具有调控作用。VIEDT等[16]研究发现Th1型细胞因子的释放过程需要AP-1参与调控,另外,OLDENHOF等[17]发现MAPK信号通路的激活可调节AP-1活性影响其活化。因此,可能是TLR4/ERK1/2/AP-1信号通路被激活后,增加Th1型细胞因子的分泌量,引起蜕膜微环境免疫失衡,导致SA的发生。
综上所述,不明原因SA的发生过程可能涉及TLR4和ERK1/2参与,而且ERK1/2的活化可能是通过TLR4激活引起,但是关于TLR4/ERK1/2下游有哪些信号因子,共同参与不明原因SA的发生发展,有待于进一步研究。因此进一步研究蜕膜细胞中TLR4/ERK1/2通路发挥作用的机制将为阐明不明原因SA的分子机制提供帮助,对蜕膜细胞信号转导的研究也可能为不明原因SA的治疗提供新的思路。
