HMGB1-TLR4介导的NF-κB信号通路在腺苷预处理保护脑缺血再灌注损伤中的作用
2024-04-09张振祥高守媛栗延伟季禾谭军
张振祥 高守媛 栗延伟 季禾 谭军
(1.新乡医学院第三临床学院,新乡 453003;2.新乡医学院第三附属医院,新乡 453003)
脑缺血再灌注损伤是缺血性脑卒中后,通过各种途径疏通血管实现再灌注对脑组织再次的创伤,严重影响神经功能的恢复,其发病机制错综复杂,主要涉及炎症反应、兴奋性氨基酸毒性作用、细胞凋亡等,其中炎症反应在此过程中发挥的作用不容忽视[1-2]。因此,保护神经功能的重要手段之一即是抑制炎症反应的发生发展;Toll样受体广泛存在于各种免疫细胞,作为模式识别受体是高迁移率族蛋白1(high mobility group box 1,HMGB1)的重要受体之一[3];在炎症反应过程中,HMGB1主要通过与Toll样受体4(Toll-like receptor 4,TLR4)、Toll样受体2(Toll-like receptor 2,TLR2)相结合,从而激活下游信号通路,如胞内磷脂酰肌醇激酶/蛋白激酶B、丝裂原活化蛋白激酶/细胞外调节蛋白激酶、髓样分化因子(myeloid differentiation factor 88,MyD88)/核转录因子κB(nuclear factor-κB,NF-κB)等,进而诱发肿瘤坏死因子、IL-1、IL-6等炎症因子的释放[4-5]。HMGB1在脑组织中多种类型的神经细胞中均有表达,当缺血性脑卒中发生后,缺血坏死的神经细胞主动将HMGB1转移至细胞间,通过特异性识别并结合TLR4,使NF-κB发生核转移而被活化,引发一系列细胞炎症因子的产生,刺激神经发生炎症反应[6-7]。有动物实验表明,HMBG1、TLR4、NF-κB信号通路参与了大鼠脑缺血再灌注损伤中的神经炎症反应[8]。目前较多研究发现,腺苷作为一种内源性核苷,在机体能量代谢过程中能够减少氧自由基的产生,抑制细胞程序性死亡,保护血脑屏障,抑制炎症因子释放,对神经功能起保护作用,但其具体机制尚不完善[9-11]。本实验通过建立大鼠脑缺血再灌注损伤模型探讨HMGB1/TLR4/NF-κB信号通路在脑缺血再灌注损伤中的影响及腺苷预处理与该信号通路之间的联系,为临床研究提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 从新乡医学院动物中心选取80只体质量220~270 g的成年雄性SD大鼠,饲养环境通风良好,温度、湿度适宜,食物水分充足,研究过程严格遵循实验动物管理和保护相关规定,经新乡医学院第三附属医院医学研究伦理委员会审核通过(新医三附院伦审[K2021-038-01号])。
1.1.2 实验试剂及仪器 腺苷(北京索莱宝科技有限公司);大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)栓线(西浓科技有限公司);2,3,5-氯化三苯基四氮唑粉剂(美国Sigma公司);改进型柠檬酸钠抗原修复液、DAB辣根过氧化物酶显色试剂盒(碧云天生物技术有限公司);SP试剂盒(北京中杉金桥生物技术有限公司);NF-κB p65抗体、TLR4抗体、重组Anti-HMGB1抗体(南京川博生物技术有限公司);Nikon显微镜(Nikon);一体化智能蒸馏仪(山东济南市盛泰有限公司);HH600恒温水浴箱(邦西仪器科技有限公司产品);DHG-9055A鼓风干燥箱(上海一恒科学仪器有限公司)。
1.2 方法
1.2.1 动物分组 从80只SD大鼠中剔除实验过程中造模失败的11只,其余69只按照随机原则,分为假手术组(F组)、缺血再灌注组(I/R组)、腺苷预处理组(AP组)共3组,每组23只。其中AP组大鼠在术前3 d腹腔注射腺苷注射液1.5 mg/kg,用2 ml生理盐水稀释后注射,1次/d;F组、I/R组大鼠术前3 d于相同条件下腹腔注射等量生理盐水。
1.2.2 制备大鼠MCAO模型 I/R组、AP组于术前12 h禁食,术前4~6 h禁水,配制10%水合氯醛溶液,避光条件下用注射器抽取适量溶液(3 ml/kg),对大鼠进行腹腔注射麻醉,直至角膜反射消失,取仰卧位,用专用绷带固定其四肢及头部,用电动剃刀剔除大鼠颈部的背毛,然后进行局部皮肤消毒处理,沿颈正中线切开4 cm小口,逐层分离各层组织,使用玻璃分针钝性分离血管、神经,动作轻柔避免操作中大鼠神经、血管断裂导致大鼠死亡,充分暴露出大鼠的左颈总动脉(common carotid artery,CCA)、颈外动脉(external carotid artery,ECA)以及颈内动脉(internal carotid artery,ICA),用小动脉夹临时夹住ICA,用细线结扎CCA和ECA的近心端并在距CCA分叉处剪一斜行小口插入栓线,在CCA远心端系牢栓线,松开小动脉夹,然后轻推栓线直至遇到轻微阻力,在CCA远端用细线固定栓线避免脱出,消毒皮肤,缝合伤口,分笼饲养,2 h后将栓线轻轻拔出10 mm。操作全程用60 W白炽灯照射,使体温保持在37 ℃。操作过程中密切观察大鼠的生命体征,苏醒后观察大鼠右侧肢体瘫痪程度,评估造模是否成功。F组大鼠仅暴露分离ICA、ECA、CCA而不结扎,其余操作步骤同AP组及I/R组。
1.2.3 神经功能评分 参照LONGA等[12]的方法对各组大鼠进行神经功能评分,0分:正常(无神经功能损伤);1分:提尾时大鼠对侧(瘫痪侧)前肢内收屈曲(轻度神经功能损伤);2分:向瘫痪侧旋转爬行(中度神经功能损伤);3分:站立或爬行时,大鼠身体向瘫痪侧倾倒(重度神经功能损伤);4分:意识障碍且无自主活动。将轻度、中度、重度神经功能损伤的大鼠纳入实验,剔除评分0分、4分以及死亡的大鼠。
1.2.4 大鼠脑梗死体积计算 脑缺血再灌注24 h后随机从每组大鼠中选取3只,同上述方法深部麻醉后,解剖脑组织,并将大脑组织放入-20 ℃的冰箱中冷冻30 min,然后植入脑切片模具中,沿冠状轴将大脑切成2 mm厚的脑片,然后放入2%TTC染色剂中避光保存,37 ℃下孵育30 min,每5 min翻动1次,均匀染色后拍照记录。使用Image J软件准确测量出各组大鼠的脑梗死面积(S),参考公式:V=∑n(Sa+Sb)×d/2(其中V为脑梗死体积,n为脑组织切片的数量,Sa与Sb为同一脑片上下两面的面积,d为脑片厚度),计算每组大鼠脑梗死体积。
1.2.5 标本的采集和处理 缺血再灌注2 h、6 h、24 h、48 h各取5只大鼠经10%水合氯醛溶液深度麻醉后,仰卧于手术架上,开胸充分暴露心脏,剪开心包,血管钳固定心脏,从心尖处插入穿刺针到主动脉并固定穿刺针,剪开右心耳后往心脏中反复注射4 ℃的生理盐水,直至右心耳流出液变澄清,肺、眼珠及足部变白,随即用冰冻4%多聚甲醛溶液灌注心脏至前肢、颈部僵硬,断头取脑,将脑组织于固定液中固定24 h,切取视交叉前后2 mm行脱水、透明、浸蜡、包埋、切片(厚约4 μm),于 4 ℃冰箱中保存备用。
1.2.6 HE染色 将石蜡切片置于60 ℃恒温箱中,2 h后取出,分别放入两道二甲苯中,各需10 min,由高到低经梯度浓度乙醇各浸泡5 min,然后用蒸馏水冲洗,再将切片放入苏木素溶液中,7 min后用自来水冲洗,再经1%盐酸乙醇分化30 min,自来水冲洗返蓝后再用蒸馏水冲洗,然后通过伊红染液染色2 min,再经过低浓度到高浓度乙醇各5 min,随后经两道二甲苯透明,然后放置风干后用封片胶封片。将切片依次放在显微镜下观察并采集图像。
1.2.7 免疫组化检测各组大鼠脑组织HMGB1、TLR4、NF-κB的表达 石蜡切片脱蜡方法同HE染色,脱蜡后,经磷酸盐缓冲液(0.01 mol/L PBS)冲洗3次×5 min;然后将切片浸入改进型柠檬酸盐修复液(1×)中,经微波炉加热至沸腾,持续亚沸腾10 min(95~98 ℃)后冷却30 min;取出切片并滴加适量内源性过氧化物酶阻断剂覆盖组织,然后放置于室温环境下,10 min后用0.01 mol/L PBS缓冲液反复冲洗3遍×3 min;取出切片并滴加100 μl正常山羊血清工作液封闭覆盖组织,室温环境下放置,10 min后倒去血清,滴加稀释后的一抗(兔抗HMGB1、兔抗TLR4、兔抗NF-κB),37 ℃环境下放置60 min后用0.01 mol/L PBS缓冲液反复冲洗3遍×3 min;取出切片,滴注适量的生物素标记山羊抗兔IgG聚合物覆盖组织,室温环境下放置,10 min后用0.01 mol/L PBS缓冲溶液反复冲洗3遍×3 min;取出切片并滴加适量辣根酶标记的链霉亲和素工作溶液,室温下放置10 min。0.01 mol/L PBS缓冲液反复冲洗3遍×3 min;加入新制备的DAB彩色溶液并在室温下孵育8 min。流动水冲洗后放入苏木素染液中染色20 s,同HE染色依次分化、返蓝、脱水、透明、封片。所用切片均通过低倍镜(×100)随机定位于额顶叶梗死周边区,即缺血半暗带,然后置于高倍镜(×400)下选取不连续的5个视野采集图像,用ImageJ 1.53e图像处理软件计算每张图片HMGB1、TLR4、NF-κB的平均光密度值,求其平均值并记录。
1.3 统计学处理 采用SPSS26.0统计软件对实验所得各组数据进行统计分析,统计结果用±s来表示,运用单因素方差分析法对各组数值的变量资料进行统计,采用最小显著差LSD检验对各组之间进行比较分析;检验水准α=0.05,P<0.05表示差异有统计学意义。
2 结果
2.1 各组大鼠神经功能评分 由表1可见,F组大鼠的神经功能无异常,而另外两组大鼠的神经功能均出现了不同程度的受损,且AP组神经功能评分相比I/R组明显减少,差异有统计学意义(P<0.05)。
表1 各组大鼠神经功能评分比较(±s,n=5)Tab.1 Comparison of neurological function scores in each group (±s,n=5)
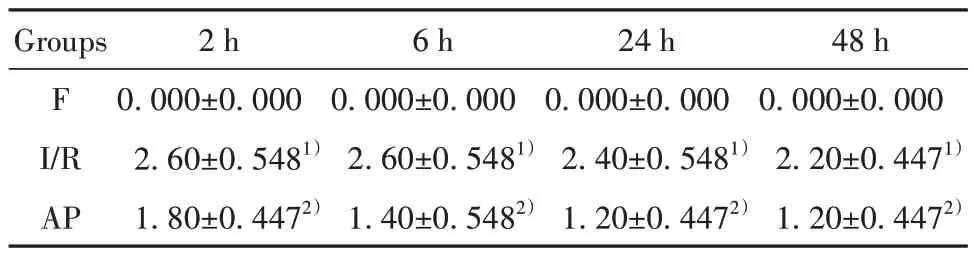
表1 各组大鼠神经功能评分比较(±s,n=5)Tab.1 Comparison of neurological function scores in each group (±s,n=5)
Note:1)P<0.05,vs F group; 2)P<0.05,vs I/R group.
48 h 0.000±0.000 2.20±0.4471)1.20±0.4472)Groups F I/R AP 2 h6 h24 00±0.0000.000±0.0000.000±0.0 2.60±0.5481)1.80±0.4472)2.60±0.5481)1.40±0.5482) h0.000 2.40±0.5481)1.20±0.4472)
2.2 各组大鼠脑梗死体积 F组、AP组、I/R组脑梗死体积分别为(0.000±0.000)mm3、(93.670±4.509)mm3、(123.670±7.234)mm3,组间差异有统计学意义(F=515.372,P<0.05)。见图1。
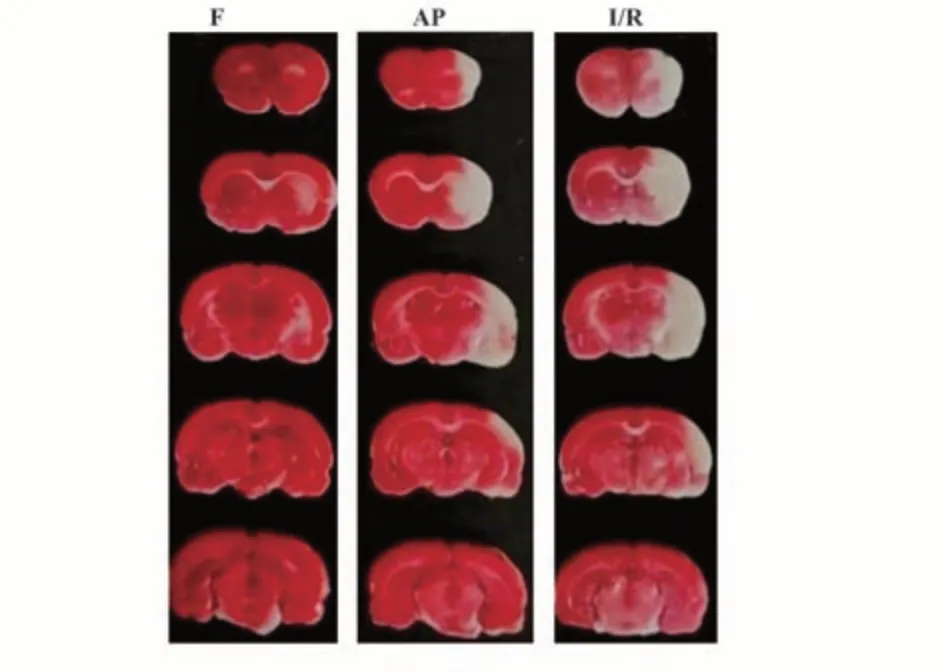
图1 各组大鼠脑切片TTC染色Fig.1 TTC staining of brain section of rats in each group
2.3 HE染色观察各组大鼠脑细胞形态学改变将HE染色后的各组大鼠脑组织切片置于(×400倍)显微镜下观察,其中F组大鼠脑组织可见细胞结构和形态规则无破坏,胞核清晰可见呈类圆形,细胞间质无水肿;I/R组大鼠脑组织可见细胞结构破坏,气球样改变,细胞间质疏松,胞核固缩,部分细胞未见细胞核。而AP组大鼠脑梗死区细胞损伤程度较I/R组轻。见图2。

图2 各组大鼠脑皮质细胞病理形态学变化(HE,×400)Fig.2 Pathological changes of cerebral cortex cells in each group(HE,×400)
2.4 各组大鼠脑缺血再灌注损伤后HMGB1表达情况 各组大鼠脑缺血再灌注后不同时间段的HMGB1表达差异具有统计学意义(P<0.05),见图3、表2。
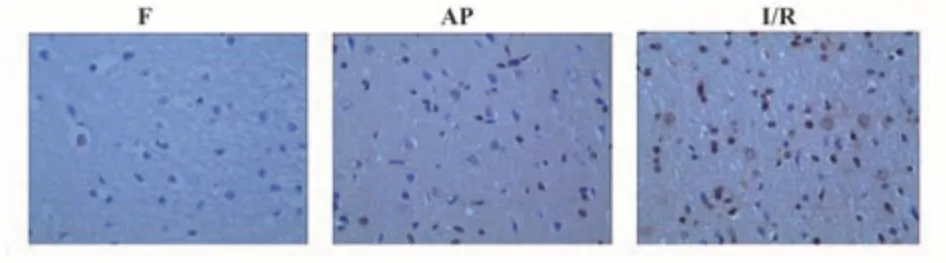
图3 各组大鼠脑组织中HMGB1的表达情况(IHC,×400)Fig.3 Expression of HMGB1 in brain tissues of rats in each group (IHC,×400)
表2 各组大鼠脑组织HMGB1蛋白表达量(±s,AOD)Tab.2 Expression level of HMGB1 protein in rat brain tissues in each group (±s,AOD)

表2 各组大鼠脑组织HMGB1蛋白表达量(±s,AOD)Tab.2 Expression level of HMGB1 protein in rat brain tissues in each group (±s,AOD)
Note:1)P<0.05,vs F group; 2)P<0.05,vs AP group.
48 h 0.189 6±0.004 5 0.235 8±0.006 01)0.288 0±0.002 52)Groups F AP I/R 2 h6 h 0.170 4±0.013 10.202 6±0.014 90.21 0.211 0±0.008 51)0.476 8±0.012 61)0.49 0.269 6±0.027 82)0.605 8±0.029 02)24 h0 6±0.015 9 9 0±0.006 31)0.617 6±0.013 12)
2.5 各组大鼠脑缺血再灌注损伤后TLR4表达情况 各组大鼠脑缺血再灌注后不同时间段的TLR4表达差异具有统计学意义(P<0.05),见图4、表3。

图4 各组大鼠脑组织中TLR4的表达情况(IHC,×400)Fig.4 Expression of TLR4 in brain tissues of rats in each group (IHC,×400)
表3 各组大鼠脑组织TLR4蛋白表达量(±s,AOD)Tab.3 Expression level of TLR4 protein in rat brain tissues in each group (±s,AOD)

表3 各组大鼠脑组织TLR4蛋白表达量(±s,AOD)Tab.3 Expression level of TLR4 protein in rat brain tissues in each group (±s,AOD)
Note:1)P<0.05,vs F group; 2)P<0.05,vs AP group.
48 h 0.196 0±0.022 2 0.294 0±0.021 61)0.342 0±0.013 12)Groups F AP I/R 2 h 6 h 2 0.192 1±0.009 6 0.359 6±0.039 71)0.569 0±0.018 32)0.188 3±0.022 2 0.523 6±0.032 11)0.665 6±0.047 22)4 h 0.191 3±0.017 1 0.315 6±0.013 01)0.451 8±0.038 62)
2.6 各组大鼠脑缺血再灌注损伤后NF-κB表达情况 各组大鼠脑缺血再灌注后不同时间段的NF-κB表达差异均具有统计学意义(P<0.05),见图5、表4。

图5 各组大鼠脑组织中NF-κB的表达情况(IHC,×400)Fig.5 Expression of NF-κB in brain tissues of rats in each group (IHC,×400)
表4 各组大鼠脑组织NF-κB蛋白表达量(±s,AOD)Tab.4 Expression level of NF-κB protein in rat brain tissues in each group (±s,AOD)

表4 各组大鼠脑组织NF-κB蛋白表达量(±s,AOD)Tab.4 Expression level of NF-κB protein in rat brain tissues in each group (±s,AOD)
Note:1)P<0.05,vs F group; 2)P<0.05,vs AP group.
Groups F AP I/R 2 h6 h.198 8±0.013 30.202 0±0.012 50.200 1)1)0 0.339 2±0.014 9 0.431 0±0.031 92)48 h 0.203 2±0.011 8 0.269 0±0.007 31)0.366 8±0.028 42)0.362 8±0.016 8 0.454 2±0.031 52)24 h6±0.014 9 0.328 2±0.041 71)0.482 0±0.034 62)
3 讨论
脑缺血再灌注损伤是缺血性卒中后通过静脉溶栓或机械取栓等措施实现血管再通、组织再灌注后引起二次损伤,从而加重神经功能损伤的过程,其病理过程主要包括氧化抗氧化作用失衡、炎症反应、线粒体功能异常、凋亡基因过度表达等[13-14]。目前研究发现,采用药物预处理的方式提前激活神经保护过程,从而减轻脑缺血再灌注后对脑组织的再次伤害,为临床诊治提供新的治疗方案,改善患者的运动功能,减轻其痛苦。
本实验发现腺苷预处理不仅可以减轻脑缺血再灌注的神经损伤同时可以减轻脑细胞的破坏,这与既往研究者的研究结果相吻合,由此可见腺苷预处理对神经有保护作用[15]。腺苷是机体能量代谢过程中产生的一种核苷酸,当机体受到各种病理刺激后,导致机体缺血、缺氧,能量供应减少,腺苷被释放到细胞外,以此来减少ATP的消耗,恢复缺血部位的能量供应,从而避免组织损伤[16]。腺苷分布广泛,存在于心、脑、胃肠等多个组织中,在脑组织中,其主要通过激活相应的受体(腺苷A1受体)对缺血脑组织起神经保护功能[17-18]。目前研究证实,腺苷预处理可以通过多种途径减轻MCAO大鼠再灌注引起的脑组织损伤[9-11];但具体机制尚未阐明。
本课题通过探讨HMGB1-TLR4介导的NF-κB信号通路在腺苷预处理对脑缺血再灌注中的影响,来作为对上述作用机制的补充,为后续的科学研究提供依据。
研究发现,在缺血性卒中发生后,由于药物或机械作用导致生物体血流再灌注进而对组织引起的再次损伤,在此过程中炎症反应起着关键性作用,而抑制炎症反应则能很大程度上来减轻缺血性脑组织的损伤[19-21]。
高迁移率族蛋白1是其家族中蛋白含量最丰富的非组核蛋白,在心、肝、肾、脑等全身多个器官中均有明显表达,其主要通过与DNA结合发挥生物学效应,可维持DNA的正常空间结构,调节类固醇激素受体的活性以及基因的转录[22]。病理情况下,当组织受到病原微生物攻击或受到机械、理化因素刺激后,组织缺血缺氧,进而导致细胞变性、坏死,HMGB1被转移到细胞间隙,作为配体通过与其受体结合,激活相应的信使,继而促进NF-κB核转移发挥其显著的促炎作用。
HMGB1不仅参与感染性疾病的发生发展,而且参与肿瘤、创伤、风湿免疫等非感染性疾病过程[23]。TLRs受体包括TLR1-13等受体,作为一种模式识别受体能够感知各种危险信号,存在于非特异免疫中,可以在巨噬细胞、树突状细胞以及上皮细胞等多种细胞表面表达[24];HMGB1主要通过与受体TLR4结合发挥促炎效应,两者结合后可使TLR4的结构发生变化,从而激活NF-κB,促使IL-1、IL-6及TNF等炎症因子大量释放,触发炎症反应[25]。NF-κB是重要的核转录因子,正常情况下,其与抑制蛋白IκBα结合以非活性状态存在于细胞质中,当机体受到病理刺激后被激活,从而由细胞质转到细胞核,促进炎症细胞因子的释放,如TNF-α、IL-1、IL-6,启动炎症反应和细胞凋亡的过程[26]。体外实验证实,TLR4可以通过调控抑癌基因、胞内磷脂酰肌醇激酶、蛋白激酶B、NF-κB等蛋白的表达,诱导海马神经元发生炎症反应[27]。
本研究通过免疫组化检测各组大鼠脑缺血再灌注后不同时间点的HMGB1、TLR4、NF-κB等蛋白水平的表达,发现I/R组及AP组大鼠各时间点的HMGB1、TLR4、NF-κB蛋白表达水平明显高于F组,差异有统计学意义;各组大鼠HMGB1、NF-κB蛋白表达水平从脑缺血再灌注后2 h开始升高,24 h后逐步下降,而TLR4的表达水平从脑缺血再灌注后6 h即开始下降,提示HMGB1、TLR4、NF-κB蛋白均在脑缺血再灌注损伤的早期阶段发挥重要作用。AP组大鼠缺血再灌注各个时间点的HMGB1、TLR4、NF-κB蛋白表达水平较I/R组明显下降,差异有统计学意义,由此推测HMGB1、TLR4、NF-κB三组蛋白作为炎症反应中的重要媒介,参与缺血性脑卒中后,由于血管再通引起的脑组织损伤的病理生理过程,而腺苷预处理则可通过抑制此类蛋白的表达,减轻炎症反应,减轻脑组织损伤,对机体发挥保护作用。
综上所述,腺苷预处理不仅能够减轻脑缺血再灌注的细胞损伤,缩小缺血坏死的脑组织,同时能够挽救更多的神经细胞,改善其功能;而HMGB1、TLR4、NF-κB蛋白共同参与了脑缺血再灌注损伤的病理过程中,腺苷预处理可以减轻上述蛋白的表达,抑制其信号通路进而发挥神经保护作用,这为后续的科学研究提供依据,为未来的临床研究指明新的方向。
