膀胱癌m6A调节因子预后模型建立与分析
2024-04-08白洋洋郭依琳陈瑞廷潘世杰孙继建
白洋洋,郭依琳,陈瑞廷,潘世杰,孙继建
1. 河南省中医院(河南中医药大学第二附属医院)泌尿外科(郑州 450002) 2. 郑州大学第二附属医院妇科肿瘤临床医学研究中心(郑州 450014)
膀胱癌(bladder cancer, BC)是常见的男性泌尿系统恶性肿瘤之一。2020年全球BC 新发病例数超过55 万,死亡病例数超过20 万[1]。在中国,BC 发病率位居全部恶性肿瘤的第13 位,严重威胁男性的生命健康[2-3]。根据是否侵犯膀胱肌层,BC 可分为非肌层浸润性和浸润性。非肌层浸润性BC 患者首选经尿道膀胱肿瘤切除术联合膀胱内治疗,术后生活质量较好,但约30%患者存在局部浸润或远处转移可能[4]。对于浸润性BC,约25%患者伴有淋巴结转移,5%出现远处转移,预后较差[5]。近年来,随着免疫治疗的应用,BC患者预后有所改善,但由于肿瘤异质性,并非所有BC 患者均能从中获益[6-7]。因此,探究BC 发生发展的分子机制对提高BC 患者治疗反应率意义重大。
N6-甲基腺嘌呤(N6-methyladenosine, m6A)是在RNA 腺嘌呤残基的第6 位含氮碱基位置上添加一个甲基基团,是真核生物中最丰富的表观转录组学修饰[8]。研究发现,m6A 修饰主要由m6A调节因子,即编码器-甲基转移酶复合物、消码器-去甲基化酶和读码器-m6A 读取蛋白调控[9]。有研究指出,m6A 调节因子具有免疫调节功能,可影响肿瘤微环境(tumor microenvironment, TME)中免疫细胞浸润,并对免疫治疗疗效产生影响[10]。目前,m6A 调节因子对BC 预后影响的相关研究较少。本研究利用预后相关的m6A 调节因子构建BC 预后预测模型,评估TME 中免疫细胞浸润情况,进一步预测免疫治疗和靶向治疗的疗效,为BC 的临床治疗提供参考。
1 资料与方法
1.1 RNA测序转录组数据和临床数据获取
利用癌症基因组图谱(The Cancer Genome Atlas, TCGA)数据库(https://www.cancer.gov/ccg/research/genome-sequencing/tcga),获取397 例BC组织的高通量转录组测序数据和对应的临床病理特征数据。397 例BC 患者的临床病理特征见表1。
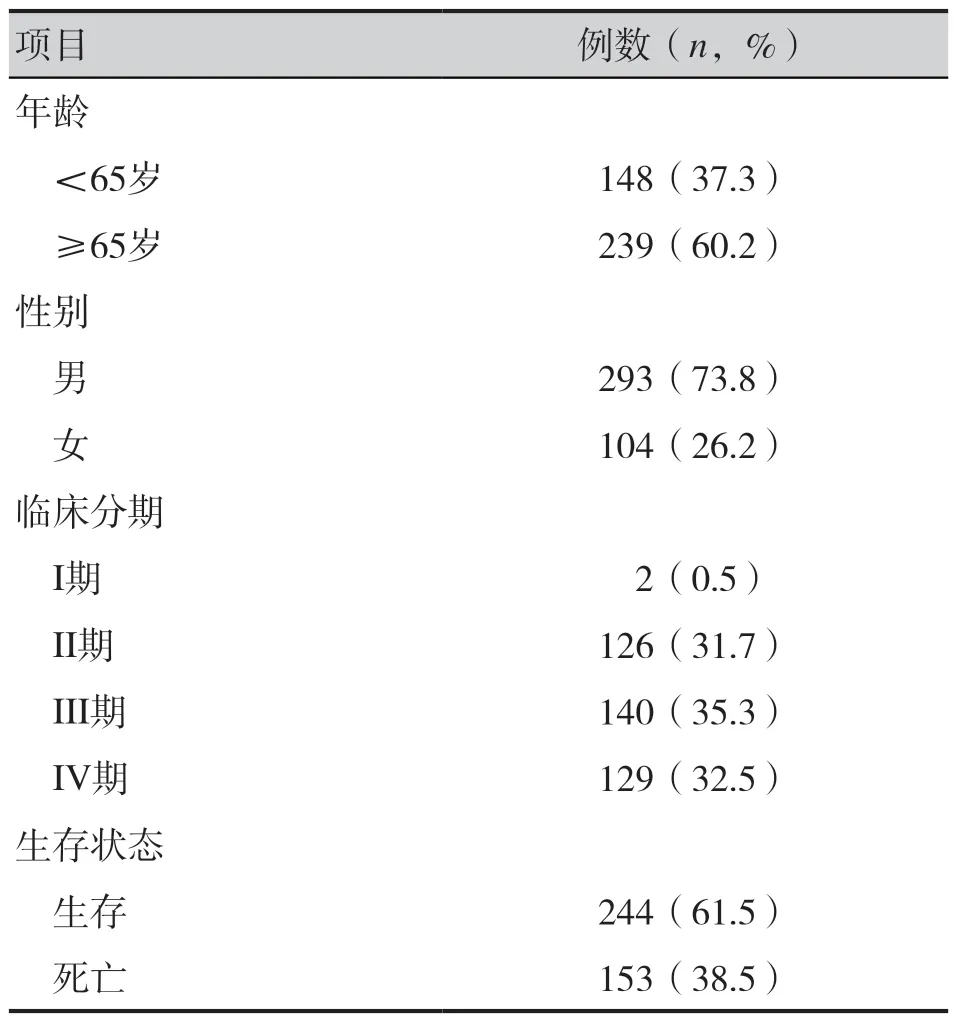
表1 397例BC患者的临床病理特征Table 1. Clinical and pathological characteristics of 397 patients of BC
1.2 预后相关的m6A调节因子筛选
检索中国知网、Pubmed、Embase 数据库,中文检索词包括m6A 调节因子、m6A 修饰,英文检索词包括m6A RNA methylation、m6A regulatory factors。共筛选到26 个m6A 调节因子,包括9 个编码器(WTAP、ZC3H13、RBM15、METTL3、RBM15B、KIAA1429、METTL5、METTL14、METTL16)、14 个读码器(LRPPRC、HNRNPA2B1、IGF2BP1、IGF2BP2、IGF2BP3、YTHDF1、YTHDF2、YTHDF3、HNRNPC、FMR1、ELAVL1、YTHDC1、YTHDC2、RBMX)和3 个消码器(ALKBH5、FTO、ALKBH3)。通过R 软件corrplot 包计算26 个m6A 调节因子之间表达的相关性,利用survival 包对26 个m6A调节因子进行单因素Cox 回归分析,结果通过forestplot 包输出,筛选预后相关的m6A 调节因子。
1.3 预后预测模型构建及验证
利用最小绝对值选择与收缩算子(least absolute selection and shrinkage operator, LASSO)Cox 回归,筛选出5 个预后相关m6A 调控因子(P<0.05),构建预后预测模型。每例BC 患者的风险评分等于5 个m6A 调控因子中每个基因表达量乘以系数之和(Coefi为风险系数,Xi 为基因表达量)。计算公式如下:风险评分=分别计算397例BC患者的风险评分,根据中位风险评分分为高风险组和低风险组,比较两组间5年生存差异。绘制受试者工作特征(receiver operating characteristic curve, ROC)曲线并计算ROC 曲线下面积(area under ROC curve, AUC),评估所构建预后预测模型的预测价值。利用单因素Cox 回归和多因素Cox 回归评估预后预测模型和临床病理特征对BC 预后的影响。
1.4 基因集富集分析和免疫浸润分析
在上述构建的BC 预后预测模型中,通过MSigDB 数据库(http://www.broadinstitute.org/gsea/msigdb/index.jsp)获取京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)相关通路基因集,利用R 软件GSVA 包对高风险组和低风险组进行富集分析,明确两组KEGG 相关信号通路。利用聚类分析和单样本基因集富集分析(single sample gene set enrichment analysis, ssGSEA)[12]评估高风险组和低风险组中23 种免疫细胞类型的频率差异,并计算免疫细胞的相对浸润丰度。利用估计恶性肿瘤组织中基质和免疫细胞(estimation of stromal and immune cells in malignant tumors using expression data,ESTIMATE)方法评估高风险组和低风险组中每个样本中免疫、基质成分及两者之和在TME 中的比例,即Immune 分数、Stromal 分数和Estinate 分数。
1.5 基因相关性分析
利用R 软件limma 包,比较高风险组和低风险组在免疫检查点相关基因PD-L1和CTLA- 4[13]、靶向治疗相关基因HER-2[14]、BRAF[15]、KRAS[16]和EGFR[17]的表达差异,绘制箱式图,以P<0.05为差异具有统计学意义。
2 结果
2.1 预后相关m6A调节因子筛选
本研究纳入397 例BC 组织样本。利用R 软件分析26 个m6A 调节因子在BC 中表达水平之间的相关性,结果显示除IGF2BP2 与YTHDC1、IGF2BP2 与METTL3,以及ALKBH3 与FMR1 外,大部分m6A 调节因子之间的表达存在显著正相关性,其中HNRNPC 与HNRNPA2B1 的正相关性最强(r=0.66),见图1-A、图1-B。为进一步筛选与BC 预后相关的m6A 调节因子,参考Feng 等[18]的研究,通过单变量Cox 回归发现YTHDC1、IGF2BP3、LRPPRC、FTO 和ALKBH3 是BC 独立的预后因素,其中IGF2BP3、LRPPRC、FTO 和ALKBH3 为危险调节因子,其高表达与较差的预后有关,而YTHDC1 为保护调节因子,其高表达与较好的预后有关,见图2。
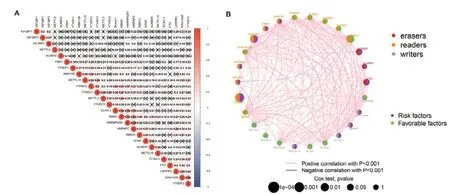
图1 BC中m6A调节因子表达相关性Figure 1. Correlation of m6A regulator expression in BC注:A. 26个m6A调节因子表达的相关性热图;B. 26个m6A调节因子表达的相关性圈图。
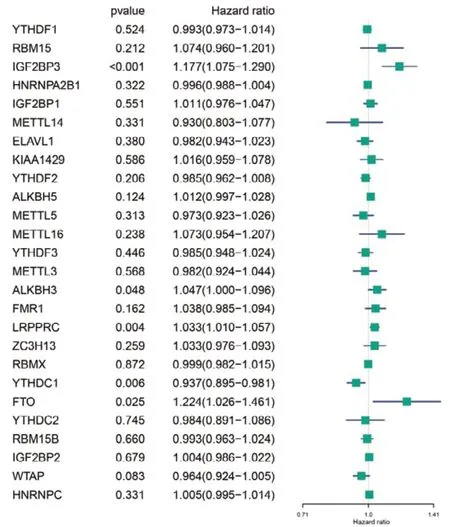
图2 BC中m6A调节因子单因素Cox回归分析Figure 2. Univariate Cox regression analysis of m6A regulators in BC
2.2 构建BC预后预测模型
利用上述筛选的YTHDC1、IGF2BP3、LRPPRC、FTO 和ALKBH3,通过LASSO Cox 回归方法建立BC 预后预测模型,见图3-A。在模型中,YTHDC1、IGF2BP3、LRPPRC、FTO 和ALKBH3 的系数分别为-0.08、0.12、0.03、0.19和0.03。根据模型计算每例BC 患者的风险评分,将患者分为高风险组和低风险组。低风险组的OS显著高于高风险组(P<0.001),见图3-B。利用ROC 曲线分析预后模型预测BC 患者5年生存率的准确性,结果显示AUC 值为0.665。
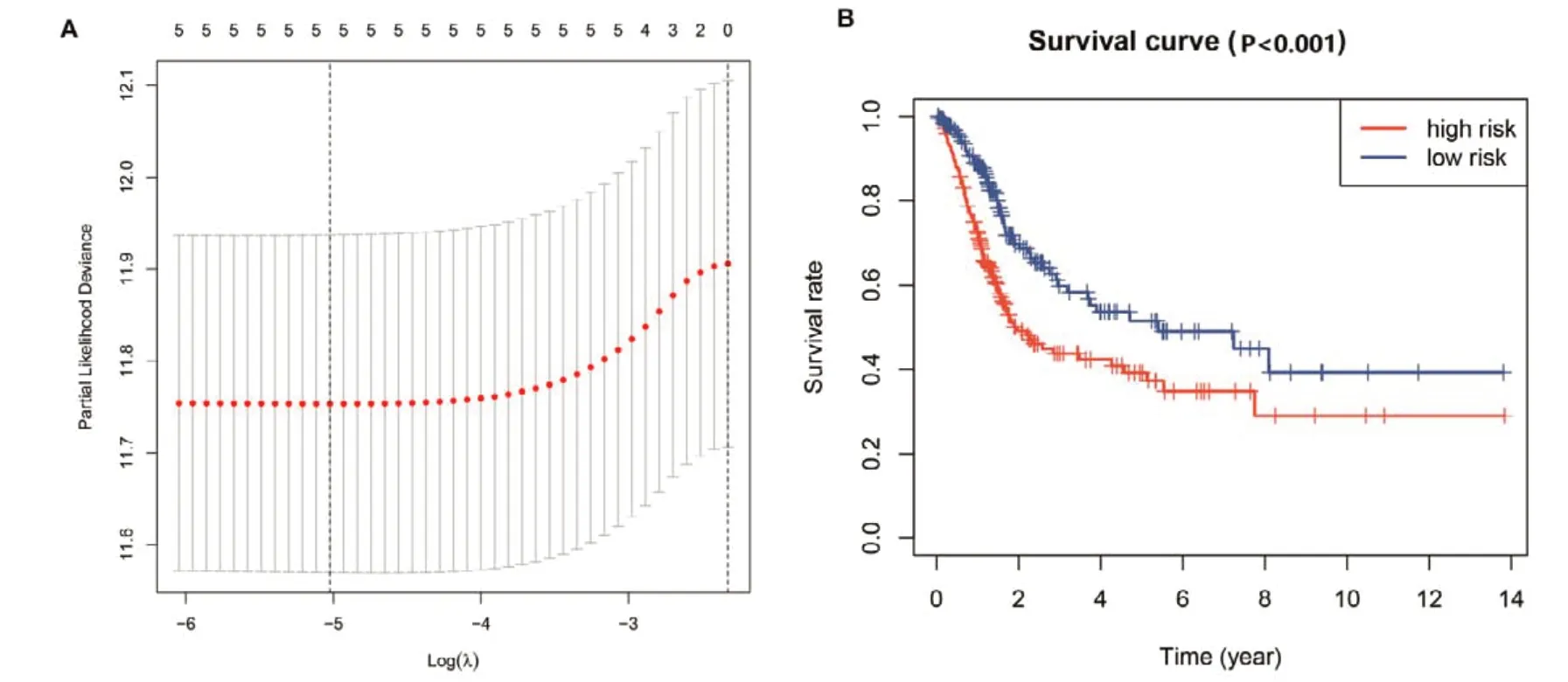
图3 基于m6A调节因子构建BC风险预后模型Figure 3. Prognostic risk model of BC based on m6A regulators注:A. LASSO Cox回归模型构建预后预测模型;B. 高风险组和低风险组生存分析。
2.3 预后预测模型的临床价值
绘制YTHDC1、IGF2BP3、LRPPRC、FTO 和ALKBH3 在高风险组和低风险组中的表达量及与临床特征的热图,结果显示其表达量在临床分期中的差异有统计学意义,见图4。单因素Cox 回归和多因素Cox 回归分析结果显示,年龄、临床分期和风险评分与OS 相关(P<0.001),均为BC 独立的预后影响因素,见表2。
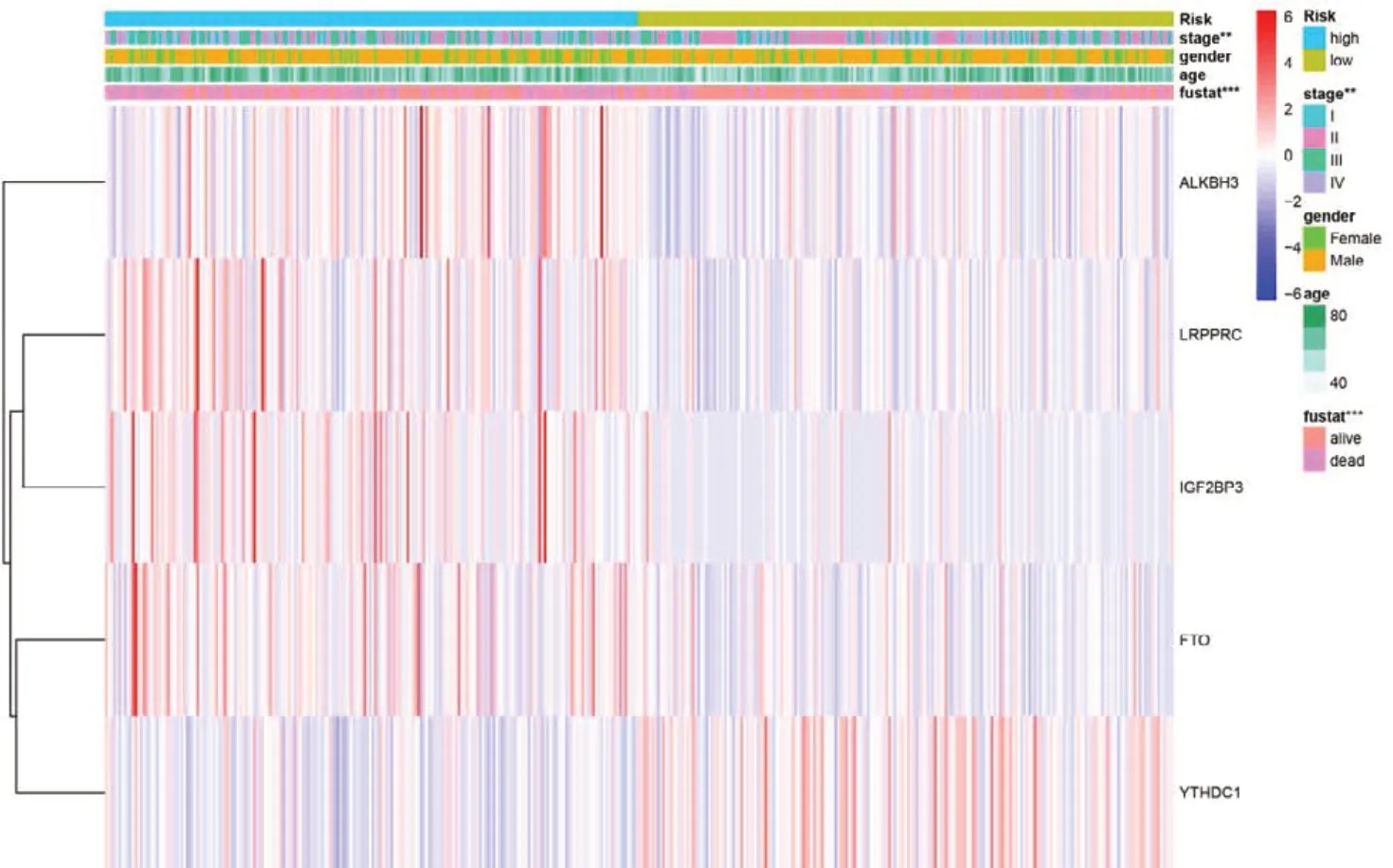
图4 基于5个m6A调节因子构建的预后模型与临床特征的关系热图Figure 4. Heatmap of the relationship between prognostic model based on five m6A regulators and clinical characteristics注:***P<0.001,**P<0.01。
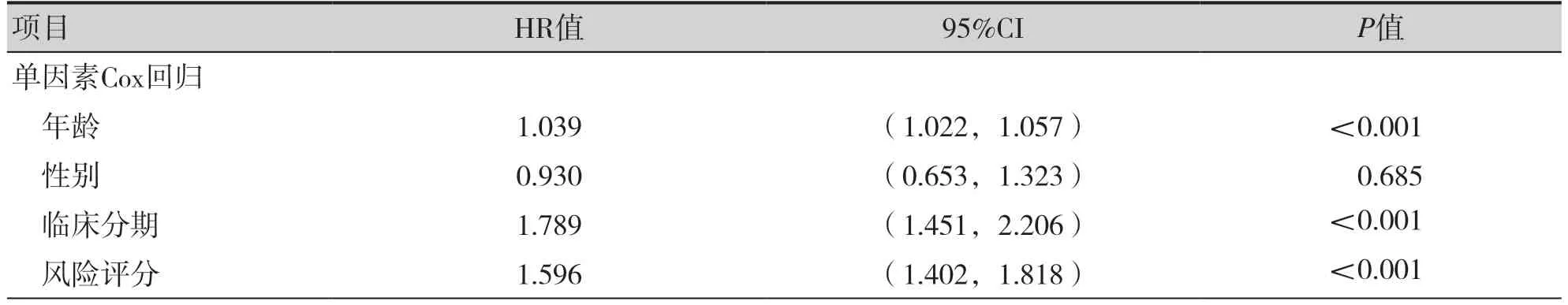
表2 BC预后预测模型与临床特征的关系Table 2. Relationship between BC prognostic prediction model and clinical characteristics
2.4 基因集富集分析
基因集富集分析结果显示,高风险组在趋化因子、NOD 样受体、嘌呤代谢、丙酮酸代谢等信号通路富集,而低风险组在药物代谢细胞色素P450、亚油酸代谢、α-亚麻酸代谢等信号通路富集,见图5。
2.5 免疫浸润分析
采用ssGSEA 评估高风险组和低风险组中23种免疫细胞类型的频率差异,结果发现高风险组免疫细胞浸润程度显著高于低风险组,特别是激活的CD4+T 细胞、激活的CD8+T 细胞、激活的B细胞、嗜酸性粒细胞、激活的树突细胞、Th1 细胞、Th17 细胞、中性粒细胞等,提示高风险组和低风险组具有不同的免疫细胞浸润特征,见图6-A。ESTIMATE 计算高风险组和低风险组中每个样本中免疫、基质成分及两者之和在TME 中的比例,发现高风险组Immune 分数、Stromal 分数和Estinate 分数均高于低风险组,见图6-B。上述结果表明高风险组的TME 为免疫炎症型,具有丰富的免疫细胞浸润。
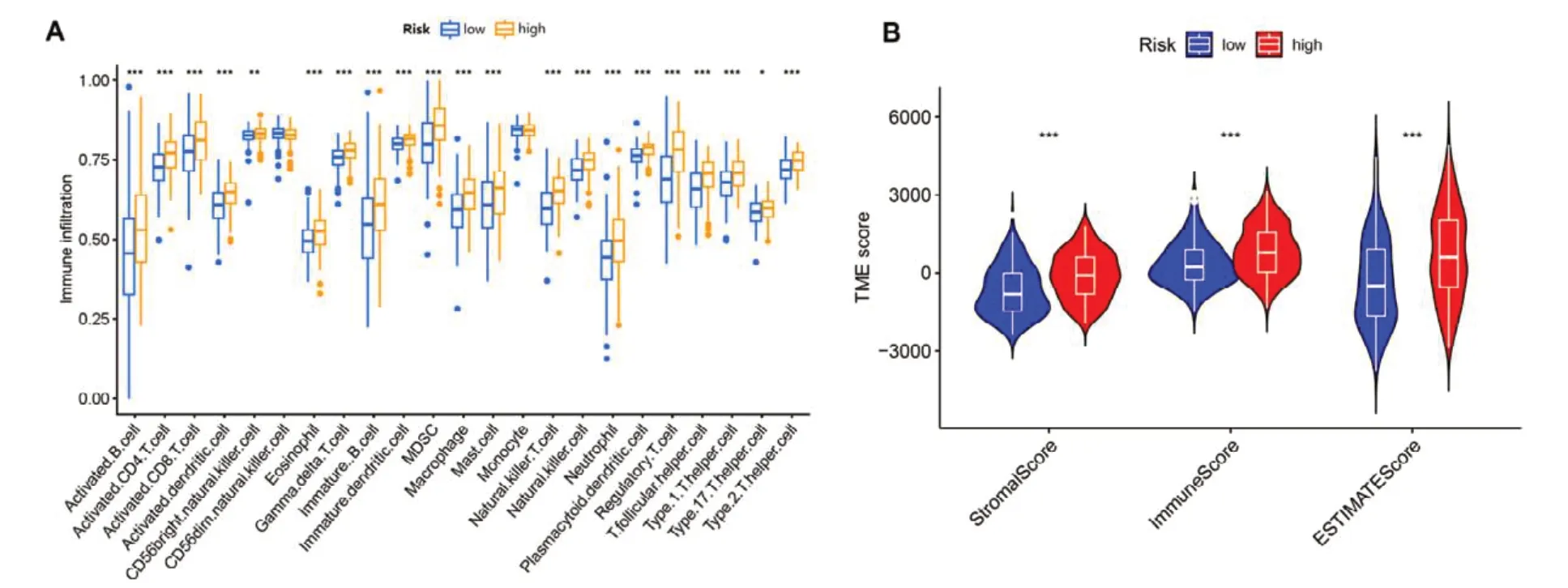
图6 BC预后预测模型的免疫浸润分析Figure 6. Immune infiltration analysis of prognostic risk model in BC注:A. ssGSEA分析;B. ESTIMATE分析;***P<0.001。
2.6 基因相关性分析
进一步分析免疫检查点相关基因PD-L1和CTLA-4、靶向治疗相关基因HER-2、BRAF、KRAS和EGFR在高风险组和低风险组之间的表达差异,结果发现PD-L1、CTLA-4、EGFR和KRAS在高风险组中表达更高,HER-2和BRAF在低风险组表达更高,差异均有统计学意义(P<0.05),见图7。以上结果提示高风险组可能对PD-L1 抑制剂、CTLA-4 抑制剂、EGFR 抑制剂和KRAS 抑制剂更敏感,而低风险组可能对HER2 抗体和BRAF 抑制剂更敏感。
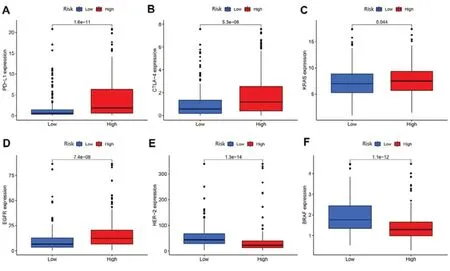
图7 高低风险组间免疫检查点相关基因和靶向治疗相关基因表达差异Figure 7. Differences in the expression of immune checkpoint related genes and targeted therapy related genes between high and low risk group注:A. PD-L1基因;B. CTLA-4基因;C. KRAS基因;D. EGFR基因;E. HER-2基因;F. BRAF基因。
3 讨论
BC 是一种来源于膀胱黏膜的恶性肿瘤。手术和放化疗是其主要的治疗方式,然而即使接受标准治疗,仍有50%~70%患者出现复发或转移,晚期和转移性BC 的治疗效果不理想[5]。目前BC仍缺乏特异性预后标志物,因此,探究新型预后预测标志物并建立预后预测模型对治疗BC 具有重要的临床价值。
m6A 调节因子的异常表达可能影响肿瘤的发生发展[9]。随着m6A 修饰研究领域的不断突破,越来越多的新m6A 调节因子被发现。本研究分析了26 个m6A 调控因子表达的相关性,发现BC中m6A 调节因子之间的表达存在显著相关性。进一步筛选与BC 预后相关的m6A 调节因子,单变量Cox 回归结果显示YTHDC1、IGF2BP3、LRPPRC、FTO 和ALKBH3 是BC 独立的预后因素。IGF2BP3 和IGF2BP1 同属IGF2BP 家族,是m6A阅读蛋白的一种。有研究证实IGF2BP3 在BC 组织内的高表达,可通过调节HMGB1 信号通路促进BC 的发展,进而影响BC 患者预后[19]。周子健等通过临床标本验证了BC 组织内IGF2BP1 的高表达可提示BC 患者预后不良,转染IGF2BP1 siRNA 后BC 细胞的增殖和生长被显著抑制[20]。脂肪量和肥胖相关蛋白FTO 在多种癌症组织中表达,刺激肿瘤细胞代谢,诱导肿瘤细胞浸润和进展。苏甲林通过检测24 例BC 组织及癌旁正常组织FTO 的表达,发现与对应癌旁组织相比,BC组织中FTO 相对低表达,且与病理分期分级呈负相关[21]。
近年来,有研究利用m6A 调节因子建立头颈鳞癌[22]、肝癌[23]、结直肠癌[24]的预后预测模型,并验证发现其具有较好的预测价值,可以指导后续临床治疗。Wu 等分析了23 个m6A 调节因子与临床病理特征和预后的相关性,提示m6A 调节因子可以作为BC 预后评估的潜在分子靶点[25]。Chen 等分析了13 个m6A 调节因子在BC 中的表达情况,并选择FTO、YTHDC1 和WTAP 构建预后预测模型[26]。Zheng 等利用FTO 和YTHDF2评估BC 预后预测模型的应用价值[27]。本研究纳入了更多m6A 调控因子,更全面地探讨了m6A修饰对BC 预后预测的价值。通过Cox 回归模型选择5 个m6A 调节因子(YTHDC1、IGF2BP3、FTO、ALKBH3和LRPPRC)建立BC预后预测模型,ROC 曲线检测风险评分预测BC 患者5年生存率的准确性,结果显示AUC 值为0.665。本研究与Zheng 等[27]建立的模型(5年AUC=0.614)相比,5年AUC 值更高,进一步分析发现Zheng 等[27]利用单因素Cox 筛选预后相关m6A 调节因子时设置筛选标准为P<0.15,最后纳入预后模型构建的YTHDF2(P=0.112)对BC 患者预后的影响较小,本研究将筛选标准设置为P<0.05,以确保参与模型构建的每个m6A 调节因子都与BC 预后相关。另外,按照风险评分将BC 患者分为高风险组和低风险组,经过单因素Cox 回归及多因素Cox 回归发现年龄、临床分期和风险评分与OS 相关,是BC 独立的预后影响因素。
m6A 调节因子具有免疫调节功能,可影响TME 中免疫细胞浸润,并对免疫治疗疗效产生影响[10]。利用ssGSEA 和ESTIMATE 法比较高风险组和低风险组中免疫细胞浸润水平的差异,结果发现,两组具有不同的免疫细胞浸润特征,高风险组具有丰富的免疫细胞浸润,其TME 为免疫炎症型,即热肿瘤对免疫治疗疗效更好[28]。
靶向治疗和免疫治疗的快速发展极大程度提高了BC 患者的OS,并改善了其预后。但由于肿瘤异质性,并非所有的BC 患者均能从靶向治疗和免疫治疗中获益。为了探讨建立的预后预测模型对靶向治疗和免疫治疗的指导作用,本研究选择了免疫检查点相关基因PD-L1和CTLA- 4、靶向治疗相关基因HER-2、BRAF、KRAS和EGFR,比较高风险组和低风险组中这些基因表达的差异,结果发现PD-L1、CTLA-4、EGFR和KRAS在高风险组中表达更高,HER-2和BRAF在低风险组中表达更高,提示高风险组可能对PD-L1 抑制剂、CTLA-4 抑制剂、EGFR 抑制剂和KRAS 抑制剂更敏感,而低风险组可能对HER2抗体和BRAF 抑制剂更敏感,间接预测了高低风险组患者对免疫治疗和靶向治疗的疗效差异。本研究存在一定局限性,仅分析了TCGA 数据库,未进行临床试验验证。
综上所述,本研究利用5 个m6A 调节因子在BC 中构建预后预测模型并验证其临床应用价值,评估预后预测模型中免疫细胞浸润程度,该模型可能成为评估BC 患者是否适合免疫治疗和靶向治疗的参考指标,为临床医师的治疗选择提供依据。
