食管神经鞘瘤超声内镜下误诊为食管间质瘤1例
2024-04-08熊佩玲
熊佩玲,王 帆,方 军,赵 秋
武汉大学中南医院消化内科(武汉 430071)
神经鞘瘤来源于神经鞘的神经膜细胞,常起源于颅神经根、脊神经根及周围神经干等部位,少部分起源于消化道,起源于食管极少见。食管神经鞘瘤是一种罕见的肿瘤,是食管黏膜下肿瘤(esophageal submucosal tumors, SMTs)之一[1-3]。该疾病主要与巨大食管平滑肌瘤相鉴别,其诊断方式主要依靠生长部位、胸部影像学检查和内镜下活检及活检组织的免疫组化,但由于受累部位和肿块大小不同,其临床表现和影像学特征不典型,术前活检结果常常无法帮助确诊,临床易致误诊[4-5]。术后病理是目前唯一可以帮助确诊的金标准,在临床疾病诊治过程中,需全面考虑食道肿块的大小、部位、症状体征及病理结果。
1 临床资料
患者,女,63 岁,因“体检发现食管黏膜增厚20 余天”入院。患者2022年3月15日外院体检肺部CT 提示食管黏膜增厚,无吞咽困难、反酸、嗳气、恶心、呕吐、腹胀、腹痛、腹泻、便秘、便色改变等症状,未予特殊治疗。2022年3月29日于武汉大学中南医院门诊行胃镜检查,提示食管黏膜下隆起性病变、胃底息肉;胸部增强CT 提示食管中段管壁明显增厚,呈软组织肿块影,轻度强化,大小约30 mm×23 mm,局部管腔闭塞(图 1-A)。遂于2022年4月5日至我院住院治疗,门诊以“食管黏膜下隆起性病变:间质瘤?”收治入院。既往史:否认高血压、糖尿病、冠心病、脑血管病等慢性病史,否认乙肝、结核等传染病史,否认手术外伤史,否认吸烟饮酒史。查体:体温36.5 ℃,血压 126/78 mmHg,呼吸19 次/分,脉搏76 次/分。神志清楚,浅表淋巴结未及肿大,腹软,触诊无明显压痛,无反跳痛,肝脾肋下未扪及,移动性浊音阴性,墨菲征阴性。入院后辅助检查:三大常规、肝肾功能电解质、肿瘤标志物、凝血象、降钙素原、脑钠肽(brain natriuretic peptide, BNP)等未见明显异常。彩超:肝、胆、脾、胰(含门静脉):肝内无回声区(囊肿?),余未见明显异常。2022年4月7日行胃镜检查,提示食管距门齿30 cm 处可见半球样隆起,表面光滑,探头置于隆起处可见低回声病灶,起源于固有肌层(图1-B)。于当天行超声内镜引导下细针穿刺活检(endoscopic ultrasoundguided fine-needle aspiration biopsy, EUS-FNA)。超声内镜提示食管距门齿30 cm 可见半球样隆起,表面光滑,探头隆起处可见低回声病灶,起源于固有肌层,大小为2.3 cm×2.4 cm,内部无血流,考虑为食管低回声病灶(间质瘤可能),见图1-C。
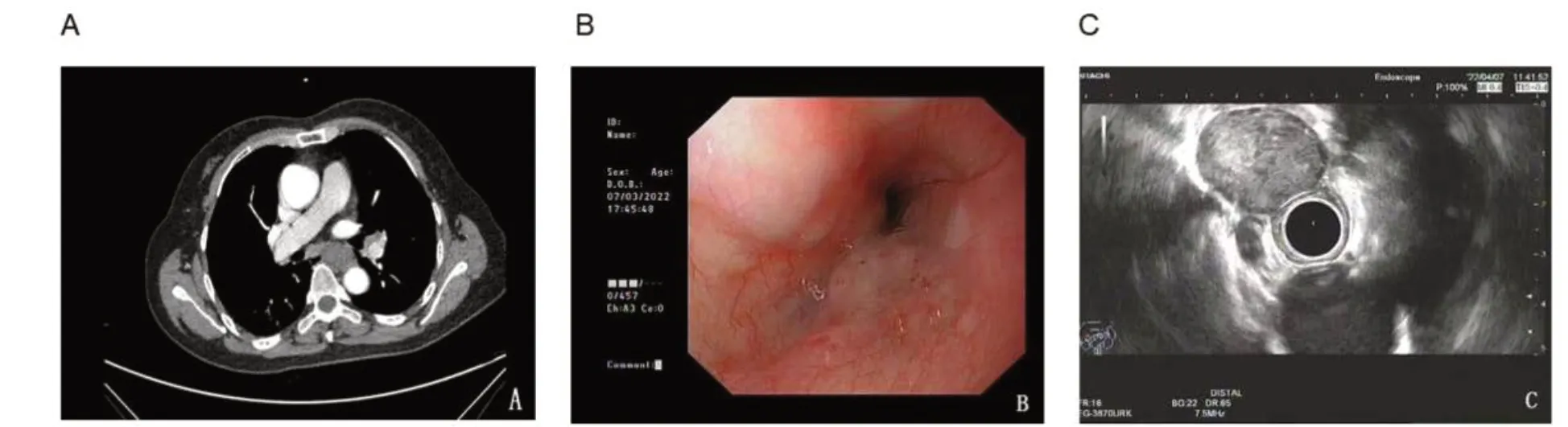
图1 胸部CT和消化道内镜结果Figure 1. Results of chest CT and dgestive endoscopy
EUS-FNA 细胞学提示镜下可见数量丰富的炎性细胞(中性粒细胞、淋巴细胞)及分化尚好的鳞状上皮,未见异型上皮细胞(图2-A)。EUS-FNA 组织学活检提示送检穿刺组织可见大量血凝块、黏液及少许梭形细胞增生。免疫组化检测肿瘤细胞呈:CD34(+)、Desmin(-)、DOG1(-)、Ki-67(LI <1%)、CD117(-)、S-100(+)、SDHB(+ 未缺失)、SMA(-)。结合病理及免疫表型,考虑为神经鞘瘤可能性大(图2-B)。患者遂于2022年4月14日转入胸外科行胸腔镜下纵隔病损切除术及胸腔镜下胸膜粘连松解术。术中发现:肿物位于后纵隔,右主支气管后方,食管前外侧,与食管之间有明确界限。瘤体大小约3 cm×3 cm,质稍硬,肿块周围结缔组织疏松,未见周围组织侵犯,仔细解离后将肿物完整切除,标本送常规病理。术后病理证实为神经鞘瘤(图2-C)。手术顺利,术后予以抗感染、止痛、雾化等对症支持治疗,术后患者生存状态良好,无明显异常后出院。定期随访五次。最后随访时间为2024年2月28日,患者未诉特殊不适,辅助检查各项指标未见明显异常,健康生活至今。
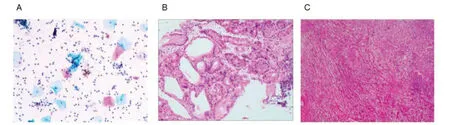
图2 病理图Figure 2. Pathological images
2 讨论
胸部神经鞘瘤常起源于后纵隔,其次为胸壁和肺实质。起源于食管的神经鞘瘤占所有SMTs 的2%~3.4%,是一种罕见的胃肠道良性肿瘤,女性多发于男性,其临床表现多不典型,可以表现为进行性吞咽困难,也可压迫支气管表现为呼吸困难[6-7]。目前依靠内镜、钡剂食管造影和CT 检查进行术前诊断较困难,易误诊为有恶性倾向的间质瘤,从而给患者及其家属增加经济及精神负担,甚至影响患者的生活质量和生存率。二者相比,食管神经鞘瘤的预后通常较好,即使直径≤2 cm 且组织学判定为良性的胃肠间质瘤也有可能局部复发和转移,故而均应被切除[8-10]。因此,临床鉴别食管神经鞘瘤与间质瘤对指导其治疗具有重要意义。目前鉴别消化道黏膜隆起性病变的首选检查为超声内镜检查术(endoscopic ultrasonography,EUS)。EUS 能清楚显示肿物的属性,如直径大小、起源位置、累及层面、边缘光滑性、内部回声强度、均匀度等,以及所在消化道管壁的各层结构[11]。但由于食管神经鞘瘤与间质瘤在EUS 下图像十分相似,且食管神经鞘瘤发病率较低,临床诊疗经验较少,易被误诊。
典型的胃肠道间质瘤(gastrointestinal stromal tumor, GIST)起源于肌间神经丛中的Cajal 间质细胞,该细胞被认为是胃肠运动活动的起搏细胞,启动和维持胃肠道蠕动。GIST 发病率每年在(10~20)/100 万,多为散发。食管间质瘤极为罕见,其临床表现症状不典型,诊断困难,容易漏诊。临床通过消化道钡餐、超声内镜、CT、MRI 等检查可以发现,免疫组化可以帮助诊断,其中CD34 和CD117 阳性表达是诊断食管间质瘤最具特异性的免疫组化标志,但仍无法以此确诊。肿瘤组织在EUS 图像中常起源于黏膜肌层、固有肌层中,呈低回声,其内部回声分布均匀或稍不均匀,边界清晰[12-13];而当其发生恶变时,可能会出现回声混杂不均匀、中央坏死区域,甚至钙化,边界欠清晰[14]。
食管神经鞘瘤起源于食管固有肌层,病理学显微镜下有梭形细胞排列,免疫组化表现为CD117、CD34、Dog-1 阳性,而S-100 阴性[15],与食管间质瘤的组化表现类似,导致两者之间鉴别困难。但神经鞘瘤在EUS 图像中通常呈低回声,其内部回声分布欠均匀,边界清晰,同时在其周围可能呈现一种光晕特征。有研究表明,这种光晕特征的产生与肿瘤外周的淋巴袖套结构有关[16]。在本例中,患者术前胸部CT、消化道内镜检查及肿块免疫组化提示CD34(+),CD117(-),这三项检测均未能完全与间质瘤鉴别,但是该病灶EUS 表现为起源于固有肌层低回声,边界清楚,内部回声欠均匀,存在周围光晕,符合神经鞘瘤的超声内镜下表现,最终病理确诊为神经鞘瘤。
综上所述,食管神经鞘瘤发病率低,EUS 下与食管间质瘤鉴别较困难,易误诊。临床中遇到EUS 图像显示起源于固有肌层,呈低回声、内部回声欠均匀、边界清晰的消化道黏膜隆起性病变,需考虑是否为神经鞘瘤,注意肿物内部回声分布是否均匀,是否有中央坏死区域、钙化以及周围光晕现象,鉴别困难时可行 EUS-FNA 帮助诊断。
