ASXL3基因在前列腺癌中的表达
2024-04-08张晋辉刘梦洋崔金龙任一鸣蔡谊明道靖任学群袁帅
张晋辉,刘梦洋,崔金龙,任一鸣,蔡谊,明道靖,任学群,袁帅
1.河南大学淮河医院普外科(河南开封 475000)
2.武汉大学中南医院循证与转化医学中心(武汉 430071)
3.武汉大学中南医院泌尿外科(武汉 430071)
前列腺癌是男性最常见的恶性肿瘤之一,也是全球癌症死亡的主要原因之一[1]。相对于欧美发达国家,亚洲地区前列腺癌发病率较低[2-3],然而,近年来我国前列腺癌的发病率呈逐年上升趋势,已逐渐演变为威胁我国老年男性健康的重要疾病[4-5]。因此,寻找新的前列腺癌生物标志物和治疗靶点迫在眉睫。
ASXL(Additional sex combs-like)基因家族属于表观遗传学调节因子之一[6]。该家族成员参与形成Trithorax-group(TrxG)蛋白和Polycombgroup(PcG)蛋白复合物,进而在转录中发挥调控作用。TrxG 蛋白和PcG 蛋白在转录中分别起到激活和抑制作用,通过形成不同的复合物,维持关键发育调控基因的特异性转录[7]。ASXL3 能够与PcG 蛋白形成复合物,在发育过程中维持同源基因的抑制状态,还可能通过组蛋白的甲基化引起染色质结构的变化[8]。ASXL3基因突变可以引起Bainbridge-Ropers 综合征和自闭症[9-10]。近年来的研究发现,ASXL3基因在多种癌症中发挥重要作用,例如ASXL3 与BRD4 结合形成的BAP1 复合物能够控制小细胞肺癌中增强子的活性[11]。此外,在前列腺癌中,循环游离DNA 中的ASXL3基因甲基化改变可能是神经内分泌性前列腺癌的诊断标志物[12-13]。
本研究通过探索ASXL3在前列腺癌中的表达及其对患者预后的影响,并分析ASXL3在前列腺癌中可能发挥的调控作用,以及与免疫细胞浸润之间的关系。此外,还通过qRT-PCR 对前列腺癌细胞系中ASXL3mRNA 的表达进行初步验证,旨在为前列腺癌治疗提供新的靶点,并为探寻其发病机制提供理论基础。
1 材料和方法
1.1 细胞培养
人正常前列腺基质永生化细胞WPMY-1 以及前列腺癌细胞系(LNCaP、PC-3 和DU145)均来源于上海中科院细胞库,C4-2 来源于武汉普诺赛生命科技有限公司。WPMY-1 细胞在含有5% FBS的DMEM 培养液中培养,LNCaP、C4-2 细胞在含有10% FBS 的1640 培养液中培养,PC-3 细胞在含有10% FBS 的F-12K 培养液中培养,DU145 细胞在含有10% FBS 的DMEM 培养液中培养,以上培养液均购自Gibco 公司;培养液中添加青霉素-链霉素-两性霉素B溶液(碧云天生物技术有限公司)。所有细胞在37℃、5% CO2的培养箱(赛默飞世尔科技公司)中培养2~3 代,取对数生长期的细胞(约1×106个)进行后续的RNA 提取和qRT-PCR。
1.2 RNA的提取和qRT-PCR
使用 Eastep® Super 总RNA提取试剂盒(Promega 公司)对 WPMY-1、LNCaP、C4-2、PC-3、DU145 细胞进行RNA 提取。随后, 采用逆转录试剂盒(Takara Bio 公司) 将RNA 逆转录成cDNA。 使用Genious 2X SYBR Green Fast qPCR Mix(ABclonal 公司)进行qPCR 检测。GAPDH的正向引物:5'-CCATGGAGAAGGCTGGGG-3', 反向引物:5'-CAAAGTTGTCATGGATGACC-3'。ASXL3的正向引物:5'-TTACCGTGGCCTCTGGTTTC-3',反向引物:5'-CCGTACAGACGATGCTACCC-3'。
1.3 差异表达及临床特征分析
使用R(version 4.3.2)软件进行数据提取和分析。使用TCGAbiolinks 软件包(version 2.30.0)下载TCGA 数据库(https://www.cancer.gov/ccg/research/genome-sequencing/tcga)中前列腺肿瘤样本及正常组织的RNA 测序数据及临床信息数据。利用dplyr 软件包(version 1.1.4)对数据进行整合和预处理,比较ASXL3mRNA 在正常样本与肿瘤组织中的表达情况以及不同临床特征中的表达变化情况,ggplot2(version 3.4.4)和gghalves 软件包(version 0.1.4)用于绘图 ,使用ggsignif 包(version 0.6.4)通过t检验比较不同分组之间的差异,并绘制显著性标记,探讨其与Gleason 评分、TP53 突变、区域淋巴结转移以及年龄的关系。
1.4 生存分析
使用GEPIA2(http://gepia2.cancer-pku.cn/#index)工具分析ASXL3的表达与前列腺癌总生存期的关系[14]。
1.5 相互作用蛋白分析
使用STRING Version 12.0(https://cn.stringdb.org/)[15]探索ASXL3最为相关的基因构建蛋白作用网络及其他相关信息。
1.6 GO和KEGG分析
使用R 软件通过Pearson 相关分析筛选出在TCGA 数据库中与ASXL3最相关的基因(r>0.5,P<0.05)。选取该基因集及在STRING 数据库中与ASXL3 最为相关的前50 个相互作用蛋白分别在DAVID(https://david.ncifcrf.gov/)上进行GO 和KEGG 分析,使用ggplot2 软件包(version 3.4.4)进行绘图。在GO 功能富集分析中,分别从生物学过程(biological process, BP)、细胞组成(cellular component, CC)、分子功能(molecular function, MF)三个方面进行研究。使用R 软件分析ASXL3mRNA表达与其它基因的相关性,并采用Pearson 相关性系数筛选cor 相关系数>0.5 且P值<0.05 的基因。
1.7 免疫浸润分析
使用TIMER(https://cistrome.shinyapps.io/timer/)分析前列腺癌中ASXL3 与肿瘤的纯度、B细胞、CD8+T 细胞、CD4+T 细胞、巨噬细胞、中性粒细胞、树突状细胞的相关性[16-17]。
1.8 统计学分析
采用R 语言分析ASXL3mRNA 的差异表达以及与临床特征的相关性,通过t检验计算统计学差异。利用SPSS 22.0 进行正常及前列腺癌细胞系中ASXL3mRNA 的表达分析,采用t检验计算统计学差异。P<0.05 表示差异有统计学意义。
2 结果
2.1 ASXL3 mRNA在前列腺癌组织中的表达分析
从TCGA 数据库中下载了554 例RNA 测序数据,表达差异分析结果显示,ASXL3mRNA 水平在前列腺癌组织中的表达显著低于正常组织(图1)。
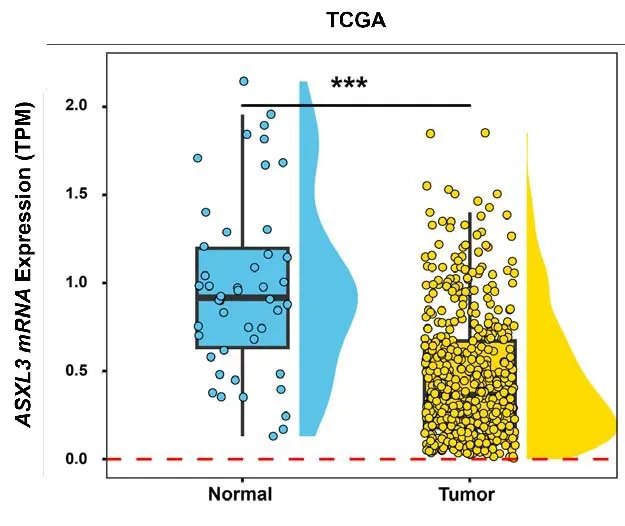
图1 ASXL3 mRNA在正常组织和前列腺癌组织中的表达差异Figure 1. The difference expression of ASXL3 between normal and prostate tumor tissues
2.2 ASXL3 mRNA表达与前列腺癌患者临床特征的关系
ASXL3mRNA 的表达与Gleason 评分呈负相关,8~10 分的肿瘤样本中ASXL3mRNA 的表达显著低于6~7 分患者(P<0.05)(图2-A)。与TP53 未突变患者相比,TP53 突变患者中ASXL3mRNA 的表达水平显著降低(P<0.01)(图2-B)。在区域淋巴结转移方面,淋巴结转移(N1)患者组织中ASXL3mRNA 水平显著低于无淋巴结转移(N0)患者(P<0.05)(图2-C)。此外,ASXL3mRNA 的表达在不同年龄(41~60 岁vs.61~80 岁)患者中差异无统计学意义(图2-D)。

图2 ASXL3 mRNA表达水平与前列腺癌患者临床特征的相关性分析Figure 2. Correlation analysis between ASXL3 mRNA expression level and clinical characteristics in prostate cancer patients
2.3 ASXL3 mRNA表达与前列腺癌患者预后的关系
根据ASXL3mRNA 表达水平的中位数,患者被分为高表达组和低表达组。结果显示,高表达ASXL3mRNA 组患者的总生存期显著优于低表达组患者(HR=0.14,P<0.05)(图3)。提示ASXL3可作为前列腺癌的预后生物标志物。

图3 ASXL3 mRNA表达与前列腺癌患者总生存期的关系Figure 3. The relationship between ASXL3 mRNA expression and overall survival in prostate cancer patients
2.4 ASXL3相互作用蛋白及功能分析
蛋白质相互作用网络结果展示了前20 位最相关的互作蛋白(图4-A),评分前4 位分别为BAP1(0.917)、EZH2(0.810)、ASXL2(0.786)、BRD4(0.773)。GO 功能富集分析显示,这些蛋白在 BP 方面主要富集在染色质重塑(GO:0006338, chromatin remodeling)、RNA 聚合酶II对转录的负调节(GO: 0000122, negative regulation of transcription from RNA polymerase II promoter)、染色质组织(GO: 0006325, chromatin organization)(图4-B);在CC 方面主要富集在PcG 蛋白复合体(GO: 0031519, PcG protein complex)、PRC1复合体(GO: 0035102, PRC1 complex)、核质(GO: 0005654, nucleoplasm)(图4-C);在MF 方面主要富集在核染色质结合(GO:0003682, chromatin binding)、组蛋白结合(GO:0042393, histone binding)、 甲基化组蛋白结合(GO: 0035064, methylated histone binding)(图 4-D)。在KEGG 通路分析中,ASXL3及其相关互作蛋白主要富集在多梳蛋白抑制复合物(hsa03083, polycomb repressive complex)、干细胞多能性调控通路(hsa04550, signaling pathways regulating pluripotency of stem cells)、ATP 依赖的染色质重塑(hsa03082, ATP-dependent chromatin remodeling)(图4-E)。提示ASXL3 及其相互作用蛋白可能在染色质的重塑以及PcG 复合体功能中发挥重要作用。
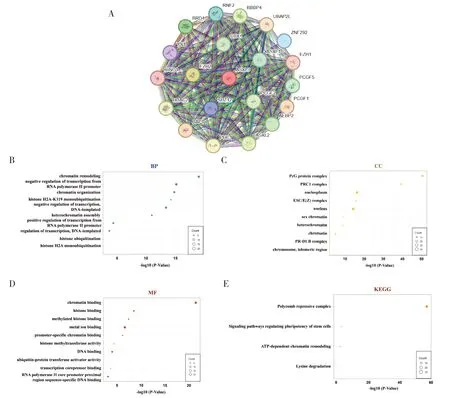
图4 蛋白质相互作用网络分析及GO、KEGG富集分析Figure 4. Protein interaction network analysis and GO and KEGG enrichment analysis
2.5 ASXL3 mRNA表达相关基因的GO、KEGG 通路分析
首先利用TCGA 数据库筛选出与ASXL3mRNA 表达正相关的基因(r> 0.5,P< 0.05),随后进行GO 功能富集和KEGG 通路分析。结果显示,ASXL3mRNA 表达相关基因GO 功能富集和KEGG 通路分析显示,ASXL3 的正相关基因在BP 方面主要富集在JAK-STAT 级联正向调节(GO:0046427, positive regulation of JAK-STAT cascsde)、肽代谢过程(GO: 0006518, peptide metabolic process)、复制叉处理(GO: 0031297, replication fork processing)(图5-A);在CC 方面主要富集在核质(GO: 0005654, nucleoplasm)、受体复合物(GO:0043235, receptor complex)、 胞浆(GO: 0005829,cytosol)(图5-B);在MF 方面主要富集在蛋白质结合(GO: 0005515, protein binding)、RNA 结合(GO: 0003723, RNA binding)、大分子复合物的结合(GO: 0044877, macromolecular complex binding)(图5-C)。而在KEGG 通路分析中,ASXL3mRNA 的正相关基因主要富集在ECM 受体相互作用(hsa04512, ECM-receptor interaction)、多巴胺能突触(hsa04728,dopaminergic synapse)、光传导(hsa04744,phototransduction)、内吞作用(hsa04144, endocytosis)(图5-D)。

图5 ASXL3 mRNA表达相关基因的GO分析和KEGG通路分析Figure 5. GO analysis and KEGG pathway analysis of ASXL3 mRNA expression related genes
2.6 ASXL3 mRNA表达与免疫细胞浸润的相关性分析
ASXL3mRNA 表达与免疫细胞浸润的相关性分析显示,ASXL3mRNA 表达与肿瘤的纯度(P<0.01)呈负相关,而与B 细胞(P<0.01)、CD8+T 细胞(P<0.01)、CD4+T 细胞(P<0.01)、巨噬细胞(P<0.01)、中性粒细胞(P<0.01)、树突状细胞(P<0.01)的浸润呈正相关(图6)。提示ASXL3 可能参与免疫细胞浸润过程。
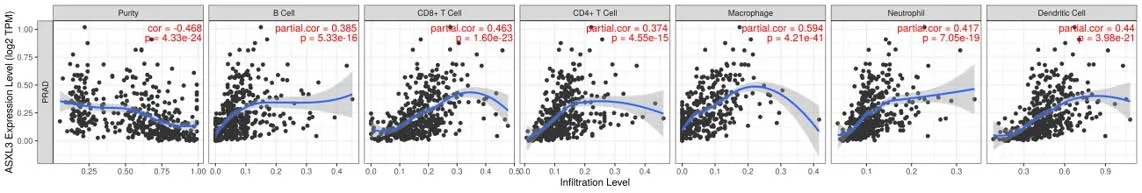
图6 前列腺癌中ASXL3 mRNA表达与免疫细胞浸润的相关性Figure 6. Correlation between ASXL3 mRNA expression and immune cells infiltrating in prostate cancer
2.7 ASXL3 mRNA在前列腺癌细胞系中的表达
qRT-PCR 检测结果显示,与WPMY-1 相比,ASXL3mRNA 在前列腺癌细胞系LNCaP、C4-2、PC-3、DU145 中显著低表达(图7),P<0.01。

图7 ASXL3 mRNA在前列腺癌细胞系中的表达水平Figure 7. The expression levels of ASXL3 mRNA in prostate cancer cell lines
3 讨论
本研究发现前列腺癌组织中ASXL3mRNA 表达水平显著低于正常组织,高ASXL3mRNA 表达与患者总生存期正相关,表明ASXL3可能参与抑制前列腺癌的发生发展。
ASXL3作为一种重要的表观遗传因子,可以作为BAP1 复合体的一部分,通过调节细胞中H2A 的去泛素化水平或解除染色质上的抑制状态,进而影响基因的表达[18-20]。ASXL3在肺癌中发挥着重要的作用,其编码的蛋白可将BRD4 桥接到BAP1 复合物进而控制小细胞肺癌的增强子活性[11],同时其被证明是人呼吸道上皮细胞中的一种新型多能性因子,可作为小细胞肺癌的潜在靶点[21-22]。在前列腺癌中,有研究发现在神经内分泌性前列腺癌中可检测到循环游离DNA 中的ASXL3高甲基化,有望成为神经内分泌性前列腺癌的潜在靶点[12-13]。本研究发现,ASXL3mRNA表达与患者年龄无相关性,但与区域淋巴结转移和TP53 突变相关。同时,Gleason 评分为6~7 分的患者ASXL3mRNA 表达水平显著高于8~10 分的患者,表明ASXL3可能作为前列腺癌恶性进展的标志物。STRING 数据库分析显示最可能与ASXL3 相互作用的蛋白,包括BAPl、EZH2、ASXL2 等。已有研究表明ASXL3 可能与BRD4 和BAP1 复合物相互作用,调控增强子活性,为治疗ASCL1 依赖性小细胞肺癌提供潜在靶点[11,22]。也有研究表明ASXL 家族可以与BAP1、EZH2、NCOA1和核受体等共同调节表观遗传[23],但ASXL3如何参与并调节表观遗传尚未可知,仍需更深入的研究。此外,GO 和KEGG 富集分析发现ASXL3正相关基因主要富集在JAK-STAT 级联的正向调控、蛋白质结合和ECM 受体相互结合等过程,提示ASXL3可能在这些通路中发挥重要作用。
免疫系统是人体重要的防御系统,对于预防包括癌症在内的多种疾病至关重要。免疫细胞是免疫系统重要的组成部分,可以分为固有性免疫应答细胞和适应性免疫应答细胞,主要的免疫细胞有B 细胞、CD8+T 细胞、CD4+T 细胞、巨噬细胞、中性粒细胞和树突状细胞。由于不同肿瘤中免疫细胞的数量并不相同,有学者提出依据免疫细胞的多少将肿瘤分为“冷肿瘤”和“热肿瘤”[24]。在“热肿瘤”中,存在更多的免疫细胞可以使得肿瘤被免疫系统识别和攻击,而“冷肿瘤”内存在极少的肿瘤细胞使得肿瘤无法被免疫系统识别,这为肿瘤的免疫治疗带来了极大的难度。前列腺癌为“冷肿瘤”[25],其在发展过程中难以被免疫系统识别和攻击,治疗较为困难[26],但目前研究仍在探寻有效的针对前列腺癌免疫治疗的方法。本研究中,ASXL3mRNA 与这些免疫细胞的浸润呈正相关,这可能为前列腺癌免疫治疗提供新的思路,但仍需更为透彻地研究ASXL3mRNA与免疫浸润之间的关系,探讨其作为免疫治疗靶点的可行性。此外本研究通过qRT-PCR 技术验证了ASXL3mRNA 在前列腺癌细胞系中的低水平表达,为后续细胞实验奠定基础。
综上,ASXL3在前列腺癌中低表达且与患者预后显著相关,提示ASXL3有望成为潜在的前列腺癌生物标志物。同时,ASXL3mRNA 与免疫细胞浸润呈正相关,可能为前列腺癌治疗提供新的靶点。
