DBIL/TBIL表达与超声引导下射频消融治疗原发性肝癌患者复发的关系
2024-04-08杜轲锋邵亚丽崔斌
杜轲锋,邵亚丽,崔斌
(漯河市中心医院 超声科,河南 漯河 462000)
射频消融治疗原发性肝癌(primary carcinoma of liver,PLC)自1900年报道以来,迅速在全球范围内广泛开展,以射频消融为代表的局部治疗与肝切除、肝移植共列为PLC的根治性技术,并且具有微创、价廉及快速康复等特点[1]。但有研究报道,即使治疗直径≤3 cm的肝癌,射频消融的复发率与肝切除相比并未降低[2]。复发是影响PLC患者射频消融治疗后长期生存的主要原因,并且高复发率一直是PLC难以解决的治疗难题,如何减少复发是改善PLC患者远期生存的关键。胆红素是一项肝功能评估指标,包括间接胆红素(indirect bilirubin,IBIL)、直接胆红素(direct bilirubin,DBIL)及总胆红素(total bilirubin,TBIL),DBIL是肝细胞摄取血液中IBIL并结合葡萄糖醛酸后合成,TBIL即体内IBIL与DBIL的总和[3]。DBIL与TBIL最常用于评估肝胆疾病,DBIL、TBIL表达上调通常提示肝细胞损害。DBIL、TBIL也被用于评估恶性肿瘤的治疗预后,是肿瘤侵袭及患者生存的影响因素[4-5],但在肿瘤患者中的表达,研究结果尚未统一。前期研究指出,计算DBIL/TBIL能更加准确评估肝内胆汁淤积情况,相比单纯DBIL、TBIL能提高黄疸鉴别率[6]。但DBIL/TBIL在PLC患者中的临床意义还需要研究验证。本研究将分析DBIL/TBIL与PLC患者射频消融治疗后复发的关系,希望为PLC复发的预测提供线索。
1 对象与方法
1.1 研究对象
入选2018年3月至2021年2月124例拟行射频消融治疗的PLC患者作为研究对象,本研究获得医院医学伦理委员会批准实施(批件号:KY2018~016号)。
纳入标准:(1)符合《原发性肝癌诊疗规范(2017年版)》[7]中PLC的诊断;(2)年龄40岁以上;(3)中国肝癌临床分期(clinical staging of liver cancer in China,CNLC) Ⅰ~Ⅱ期;(4)单发肿瘤直径≤5 cm,或肿瘤数量≤3且最大直径≤3 cm;(5)符合射频消融指征,首次接受射频消融治疗;(6)签订知情同意书。
排除标准:(1)其他肝脏疾病急性发作导致DBIL或TBIL表达上调;(2)正在服用任何保肝药物;(3)接受过任何肝胆手术;(4)其他部位原发性恶性肿瘤;(5)食管胃底静脉曲张破裂;(6)活动性感染累及肝胆系统。
1.2 研究方法
1.2.1治疗过程
全部患者均接受超声引导下射频消融术治疗,患者取平卧位,常规术区皮肤消毒,超声引导下进行局部逐层麻醉直至肝包膜。麻醉满意后,采用消融穿刺探头引导,确定病灶位置及范围,超声引导消融针穿刺至病灶中央部位,根据病灶情况设置消融参数及消融时间。射频功率130~150 W,温度≤120℃,消融范围达到肿瘤及肿瘤外0.5~1.0 cm正常肝组织,消融时间15~20 min。若肿瘤直径<2 cm则采用一点两处消融,≥3 cm的肿瘤采用多点多针消融。治疗结束后采用超声造影观察病灶是否清除彻底,若可见参与病灶则立即补充消融。术后常规使用抗生素预防感染。
1.2.2预后评估
(1)消融成功率。以完全消融视为消融成功。完全消融定义为:射频消融治疗后超声造影、MRI或CT增强确定肿瘤完全坏死,肿瘤消融病灶动脉期未见强化。(2)复发:参考《原发性肝癌诊疗规范(2017年版)》中关于PLC射频消融治疗后随访内容,射频消融治疗达到完全消融后2 a内每3个月复查1次,复查内容为超声、CT、MRI增强扫描及肿瘤标志物。复发定义为:至少2项影像学检查提示肿瘤病灶边缘出现新发病灶,或肝内远处新发病灶、肝外转移灶。以完全消融后2 a内复发视为预后不良。
1.2.3检查项目
射频消融治疗前常规采集患者空腹外周血6 mL,采用贝克曼库尔特公司Microfuge 16型微量离心机,以3 000 r·min-1离心10 min获取血清,采用放射免疫法检测检测血清甲胎蛋白(Alpha fetoprotein,AFP)、糖类抗原(carbohydrate antigen,CA)125、CA199,采用ELISA法检测血清癌胚抗原(carcinoembryonic antigen,CEA),采用胆红素氧化酶法检测血清DBIL、TBIL,并计算DBIL/TBIL比值。
1.3 资料收集
根据研究目的,收集患者一般临床资料,包括年龄,性别,CNLC分期,病理类型,肿瘤数目,瘤体最大直径,血清AFP、CA125、CA199、CEA、DBIL、TBIL、DBIL/TBIL。
1.4 统计学方法

2 结果
2.1 射频消融治疗预后
2018年3月至2021年2月共收录124例PLC患者,一次消融成功率为93.55%(124/126),116例患者随访时间为8~24月,平均(22.14±4.08)月,25例患者随访期间相继复发,复发率为21.55%(25/116)。
2.2 复发与未复发患者临床资料比较
射频消融治疗后复发患者肿瘤数目、肿瘤直径大于未复发患者,血清TBIL、DBIL低于未复发患者,AFP,DBIL/TBIL比值高于未复发患者,差异有统计学意义(P<0.05)。见表1。
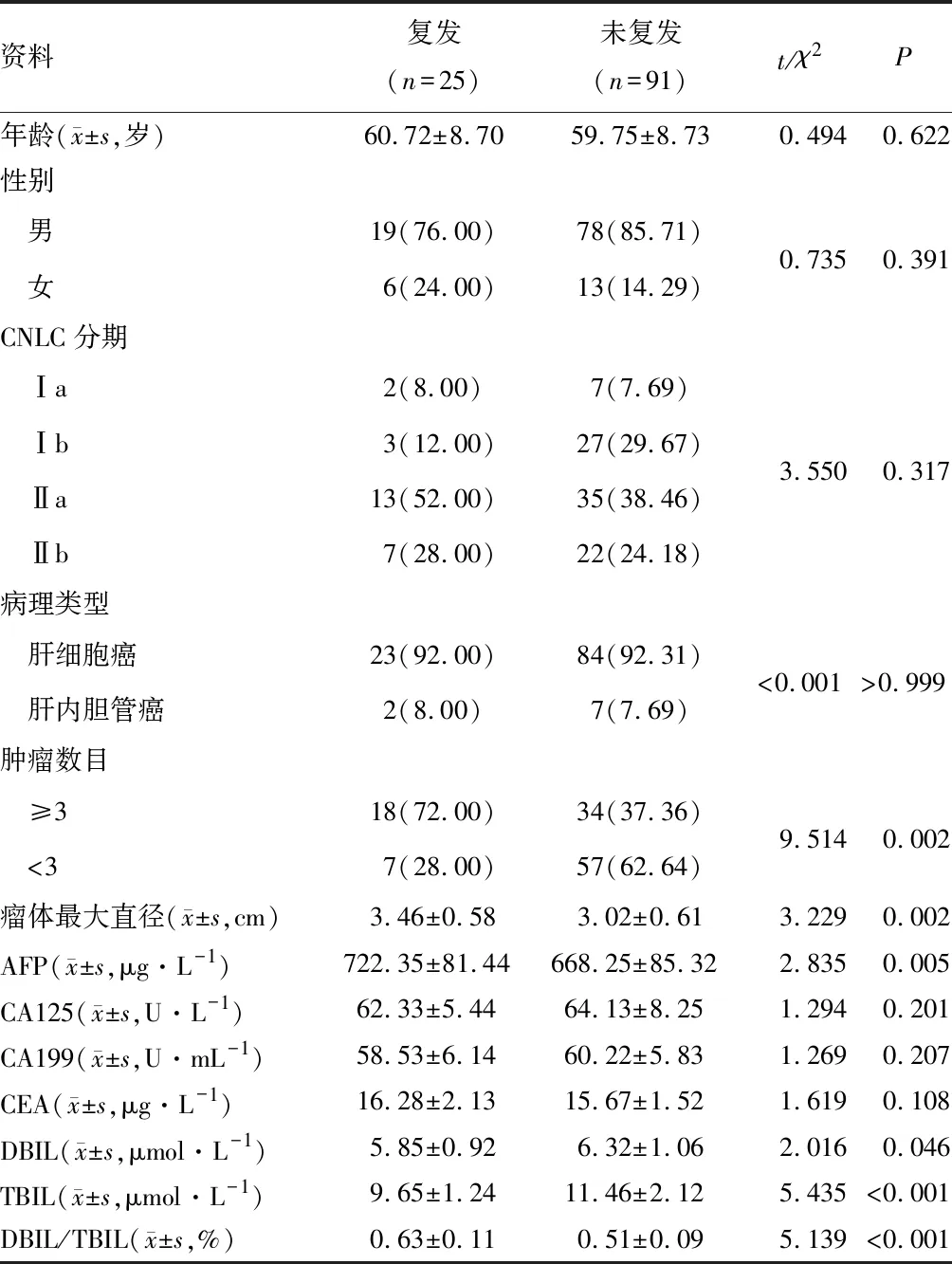
表1 复发与未复发患者临床资料比较
2.3 血清DBIL/TBIL对PLC患者射频消融治疗后复发的影响
以PLC患者射频消融治疗后复发作为因变量,纳入肿瘤数目、瘤体最大直径、血清AFP、DBIL、TBIL、DBIL/TBIL作为自变量,赋值说明为瘤体最大直径、AFP、TBIL、DBIL、DBIL/TBIL均为连续变量,赋值为实际值,肿瘤数目(≥3=1,<3=0)。构建Cox回归模型,数据显示,肿瘤数量≥3、瘤体直径、血清TBIL表达下调,DBIL/TBIL比值升高导致PLC患者射频消融治疗后复发风险增加(P<0.05)。见表2。
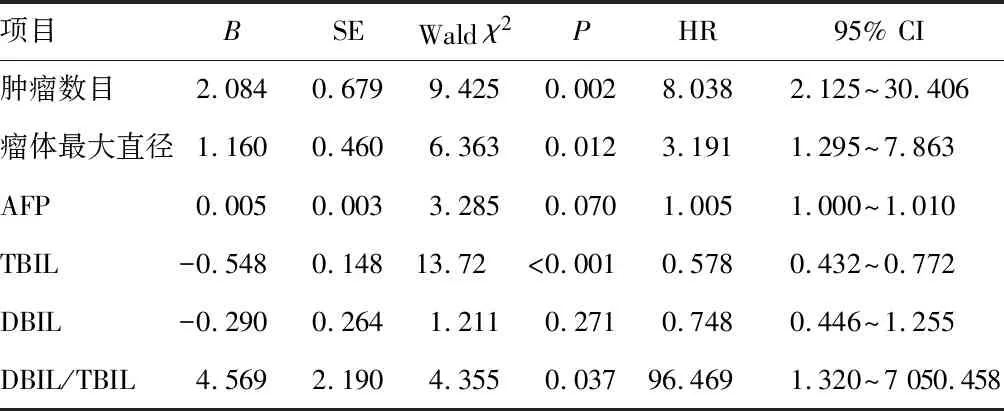
表2 血清DBIL/TBIL对PLC患者射频消融治疗后复发的影响
2.4 血清DBIL/TBIL预测PLC患者射频消融治疗后复发的ROC曲线
以PLC患者射频消融治疗后复发作为状态变量,以血清DBIL/TBIL比值作为检验变量。绘制ROC曲线,血清DBIL/TBIL比值预测PLC患者射频消融治疗后复发的曲线下面积为0.776,95% CI:0.678~0.873,P<0.05,当DBIL/TBIL截断值达到0.50时,可以获得最高灵敏度(0.920)和特异度(0.495)。
3 讨论
PLC治疗后复发根据时间分布可分为早期复发(2 a及以内)和晚期复发(2 a以上),晚期复发被认为是多中心的新生肿瘤,而早期复发则是原发肿瘤转移的危险因素,直接影响患者远期生存[8]。因此,减少PLC早期复发一直是临床治疗的难点。射频消融治疗是PLC比较常用的局部疗法,其疗效与外科手术相媲美,然而复发仍是局部消融的主要缺点[9]。本研究中,25.11%的患者在射频消融成功后2 a内复发,由此看出高复发率是射频消融治疗PLC的最大缺陷,减少复发势必能为射频消融治疗PLC患者带来更多临床获益。
胆红素是机体中铁卟啉化合物的主要代谢产物,具有神经毒性,但也有抗氧化剂功能,是临床中判断黄疸的主要依据。早在2011年英国一项大样本调查即证实,成人血清TBIL水平处于偏高范围时,其肺癌疾病及全因死亡风险会降低,TBIL水平每增加0.1 mg·dL-1,肺癌发病率即减少8%~11%[10]。本研究中,复发患者血清DBIL、TBIL表达低于未复发患者,这就与胆红素的抗氧化剂功能有关。肿瘤细胞中过氧化氢酶含量减少及活性减弱抑制机体对氧化剂的清除,同时导致氧自由基的大量产生,从而激活氧化应激,而氧化应激导致癌基因激活或抑癌基因沉默,从而引起癌症启动[11]。胆红素的抗氧化活性在于能清除机体氧自由基,经血红素加氧酶作用后转化为胆绿素,再经过还原酶作用转化为IBIL,该过程能提供2个氢原子,发挥抗氧化作用[12]。另外,胆红素在人体内的浓度低于抗氧化剂谷胱甘肽,但其抗氧化作用占机体总抗氧化能力的30%[13]。有理由认为,胆红素减少导致机体抗氧化能力减弱,从而引起肿瘤复发。健康人群胆红素含量并不高,这是因为胆红素作为抗氧化剂在体内被快速消耗。这也解释本研究复发患者血清DBIL、TBIL表达为何低于未复发患者。
蔡春仙等[14]研究显示,肝癌患者以DBIL升高为主,这是因为肿瘤压迫肝管或胆管,影响胆汁代谢,从而引起DBIL堆积。DBIL在TBIL中的占比约30%,由衰老红细胞降解产生的IBIL在肝内转化而成。研究指出,DBIL的抗氧化活性不及IBIL,因为DBIL水溶性强,难以通过生物膜与细胞内氧自由基结合,因此在抗氧化过程中以IBIL消耗为主,从而导致DBIL减少并不明显[15]。
本研究中,复发患者DBIL/TBIL高于未复发患者,说明IBIL的过度消耗导致DBIL在TBIL中占比增加。通过计算DBIL/TBIL比值明确DBIL在TBIL中的占比,即使血清TBIL处于正常范围,DBIL表达上调或降低均会导致DBIL/TBIL产生波动,不仅能反映IBIL在机体中被消耗程度,评估抗氧化能力,还能够反映肝功能损害程度,从而评估肿瘤病情。进一步分析提示血清DBIL/TBIL升高是PLC患者射频消融治疗后早期复发的独立因素(HR=96.469,95% CI:1.320~7 050.458),当血清DBIL/TBIL达0.50时,提示PLC患者为复发的高危人群,需要重视随访及胆红素监测,以改善机体抗氧化能力。
4 结论
PLC患者血清DBIL/TBIL升高导致射频消融治疗后早期复发风险增加,射频消融治疗前计算血清DBIL/TBIL有助于预测早期复发风险,当DBIL/TBIL升高至≥0.50时,提示机体抗氧化能力减弱,肿瘤复发风险增加。
