高渗环境调控钙黏蛋白表达并影响拟胚体分化*
2024-04-07许健宜吴引弟方丽君蒋虹婧孙盱衡林展翼
许健宜, 吴引弟, 方丽君, 蒋虹婧, 孙盱衡, 刘 青, 肖 聪, 林展翼△
[1华南理工大学医学院,广东 广州 510006,2南方医科大学附属广东省人民医院(广东省医学科学院),广东 广州 510180]
诱导多能干细胞具有多功能的分化潜力和伦理优势,已成为多种疾病(如退行性疾病、心肌损伤、骨组织再生等)治疗与研究的潜在种子细胞来源[1-3]。拟胚体(embryoid body, EB)是多能干细胞在悬浮培养中形成的三维细胞聚集体[4],可以响应生物力学信号[4],编程为特定细胞谱系,对心肌细胞[5]、神经细胞[6]和血管细胞[7]等依赖于初始EB 步骤的定向分化至关重要。然而,诱导多能干细胞广泛临床应用的挑战之一是高效地引导其进入特定谱系,因为单纯依赖EB 的自发分化常导致分化多样性不可控[8]。越来越多的研究者开始关注EB 分化影响因素的研究,希望通过理清各种体外影响因素的规模化调控,实现EB的可扩展和可重复分化[9]。
细胞外环境中的物理信号,例如力学刺激[10]、几何形状和刚度等[4,9],对于谱系规范有着重要影响。另外已有研究表明,细胞大小和细胞形态对细胞状态和分化表型有着显著影响[11-13],由于渗透压能够直接影响细胞的大小和形态,因此,本研究考虑环境中渗透压也是规范化调控过程中必不可少的因素之一。聚 乙 二 醇300(polhethylene glycol 300, PEG 300)是一种非离子型的水浆性聚合物,已被用于改变培养液渗透压,GUO 等[14]研究者表明,添加2%的PEG 300后,细胞大小和力学在2 min内达到平衡,并且无明显的细胞毒性。但对于培养液中的渗透压对EB的分化影响尚不明确。
在细胞动态变化的过程中,细胞黏附分子提供了从细胞到细胞外环境、以及细胞之间的双向信号通路[15]。物理信号能够通过细胞黏附分子来激活细胞外基质和细胞间的相互作用,从而影响细胞的形成和分化。上皮钙黏蛋白(E-cadherin, CDH1)和神经钙黏蛋白(N-cadherin, CDH2)是两种重要的细胞黏附分子,参与维持细胞之间的物理连接,并直接或间接地调节细胞状态和细胞分化[16-17]。例如,在干细胞培养过程中,CDH1介导的细胞间黏附会改变细胞和细胞集落的形态,可能激活参与维持未分化状态或致力于特定谱系的信号通路[18-19]。此外,研究还发现CDH1 和CDH2 分子与成骨分化[20]、神经分化和中胚层分化[21-22]等过程密切相关。
本研究旨在阐明高于常规培养液的渗透压对EB 分化的影响,并探讨其潜在的作用机制,以促进EB 直接分化为给定的细胞类型的稳定性和可重复性,从而提高其在疾病研究的应用潜力。在不同渗透压力的培养液中,本研究观察到EB 的分化行为与渗透压之间存在一定的相关性两组EB 中的细胞黏附因子CDH1 和CDH2 表达存在差异,特别是CDH2的差异表达更加显著。这些差异影响了渗透压导致的EB 分化方向变化,即在较高渗透压条件下培养的EB 显示出更强的中胚层谱系承诺趋势和更低的外胚层谱系承诺趋势。通过使用TGF-β 特异性抑制剂SB431542 改变CDH2 的表达水平,观察到高渗透压培养液中胚层标志物的高表达趋势被抑制,同时外胚层标志物的表达上调。这提示高渗透压可以通过调节CDH2来改变EB的分化方向。这些结果表明环境渗透压是规范干细胞分化的一个关键因素,为干细胞在医学研究中的应用提供了新的视角。
材料和方法
1 实验对象的准备
1.1 人诱导多能干细胞(human induced pluripotent stem cells, hiPSCs)的培养与传代 从赛贝公司(中国)购买源于人成纤维细胞的诱导多能干细胞,将其培养于37 ℃和5% CO2的环境中。在培养和传代前,首先在培养皿上铺减生长因子的Matrigel®(hESCqualified Matrix,1∶100 in DMEM/F12; Corning),使用mTeSR plus 培养液(STEMCELL Technologies)维持干细胞多能性。每培养4天传代1次,传代时尽量保证细胞团聚。
1.2 EB 的培养与形成 在hiPSCs 传代当天,使用ReLeSR ™(STEMCELL Technologies)收获并解离hiPSCs。将这些细胞传代至超低悬浮培养板(Corning)中,培养于mTeSR plus培养液和EB培养液的混合溶液中以形成EB。此混合溶液按照mTeSR plus 和EB 培养液2∶0(传代当天,第0 天)、2∶1、1∶1、1∶2 和0∶2 的比例每天更换,在第4 天以后只使用EB培养液培养EB。EB 培养液为高葡萄糖DMEM(Gib‐co)中添加10%胎牛血清(Thermo Fisher Scientific)、1%非必需氨基酸(Gbico)、2 mmol/L GlutaMAX(Gib‐co)、0.1 mmol/L 2-巯基乙醇(Sigma-Aldrich)、50 U/mL 青霉素和50 µg/mL 链霉素(Thermo Fisher Scien‐tific)。EB 培养阶段实验组将添加不同浓度的PEG 300以改变渗透压。
2 检测方法
2.1 测定培养液中的渗透压 在培养液中添加0%、1%、1.5%、1.75%、2%、2.25%和5%的PEG 300后,通过冰点渗透压仪(FPOSM-V2.0)测量渗透压来验证PEG 300对于提高培养液渗透压的有效性。
2.2 RT-qPCR 检测使用Trizol 试剂提取EB 的RNA,每个样本定量至1 µg。使用反转录试剂盒(TaKaRa)对总RNA 进行反转录。然后将反转录得到的cDNA 与SYBR Premix Ex Taq(TaKaRa)结合,进行RT-qPCR扩增,反应条件:95 ℃ 10 s,60 ℃ 30 s,40个循环。内参照为GAPDH。所用引物详见表1。

表1 引物序列Table 1. Primer sequences
2.3 Western blot 检测 使用含有蛋白酶抑制剂(Roche)的RIPA 裂解液提取蛋白质。使用Pierce™BCA 蛋白检测试剂盒(Thermo Fisher Scientific)对总蛋白浓度进行定量。按每孔20 µg 蛋白的量将样品加于4%~12% SDS-聚丙烯酰胺凝胶上,样品总体积不超过25 µL。电泳电压为100~120 V,持续时间为40~60 min。随后将凝胶转移到聚偏二氟乙烯膜(Millipore),电压为140-160 V,30 min。转移后,用1%吐温20 的三相缓冲盐水(TBST)配置的5%脱脂牛奶溶液封闭膜。随后使用特异性Ⅰ抗(GAPDH 抗体,1∶10 000;Tubb3 抗体,1∶50 000;T/Bry 抗体,1∶1 000;histone H3 抗体,1∶10 000;CDH1 抗体,1∶1 000;CDH2 抗体,1∶3 000;p-SMAD3 抗体,1∶2 000)对膜进行孵育。使用ECL 蛋白印迹底物(Pierce)进行化学发光检测,使用ImageJ 软件进行灰度值定量分析。所用抗体详见表2。
表2 抗体信息Table 2. Antibody Information
2.4 免疫荧光染色 培养EB 2、4 和6 d 后,在室温下用4%多聚甲醛固定30 min,随后进行石蜡包埋和切片。使用柠檬酸溶液(pH 6.0)在高温高压条件下进行抗原修复。自然冷却后,切片在蒸馏水中冲洗3次,每次5 min。然后使用10%山羊血清封闭,37 ℃孵育30 min。封闭完成后,每个切片上加入Ⅰ抗(CDH1 和CDH2 抗体,1∶200),在4 ℃冰箱中孵育过夜。次日,在每个切片中加入Ⅱ抗,室温下孵育60 min。使用TBST 洗去Ⅱ抗后,在黑暗环境中用50µL DAPI 工作溶液(Abcam;DAPI 原液按1∶500 稀释制备)进行5 min 的核染色。完成这一过程后,用荧光封片剂封好切片,避光保存在4 ℃冰箱。拍摄时,使用LSM Meta共聚焦显微镜(LSM980;Zeiss)或荧光显微镜(Axio vert5;Zeiss)对切片进行拍照。
2.5 CCK-8实验 将6孔板中一个孔的hiPSCs进行消化后,加入2 mL mTeSR 培养液,然后在低附着96孔板上每孔加66 µL 细胞悬浮液以测定EBs 细胞的活力。移除培养液后,重新添加含有10 µL CCK-8溶液的100 µL 新鲜培养液,分别在培养箱中孵育2 h。接着,使用分光光度计测定细胞在450 nm 处的吸光度,分析细胞活力时采用实验组与空白组的吸光度值的比值。
2.6 AM/PI 凋亡染色检测 使用超低吸附悬浮6 孔板培养EB。在实验当天,首先将培养液弃去,然后使用PBS缓冲液对细胞进行3次洗涤,以确保去除残留的培养液。随后,按照AM/PI 染色试剂的使用说明书,加入适量的AM/PI 工作液。接下来,将细胞在37 ℃中避光的条件下孵育30 min。孵育结束后,通过荧光显微镜对染色情况进行观察。
3 统计学处理
使用GraphPad Prism 8 软件进行统计分析。数据以均数±标准差(mean±SEM)表示。为评估结果的显著性,采用了独立样本Student´st检验和单因素方差分析。以P<0.05为差异有统计学意义。
结 果
1 PEG 300增加了培养液的渗透压
如图1所示,加入PEG 300明显提高了培养液的渗透压。随着PEG 300 浓度的逐渐增加,渗透压也相应呈上升趋势,并且这两者之间表现出显著的线性关联(R2=0.998 4,P<0.01)。这些结果表明,PEG 300的使用有效提升了培养液的渗透压。
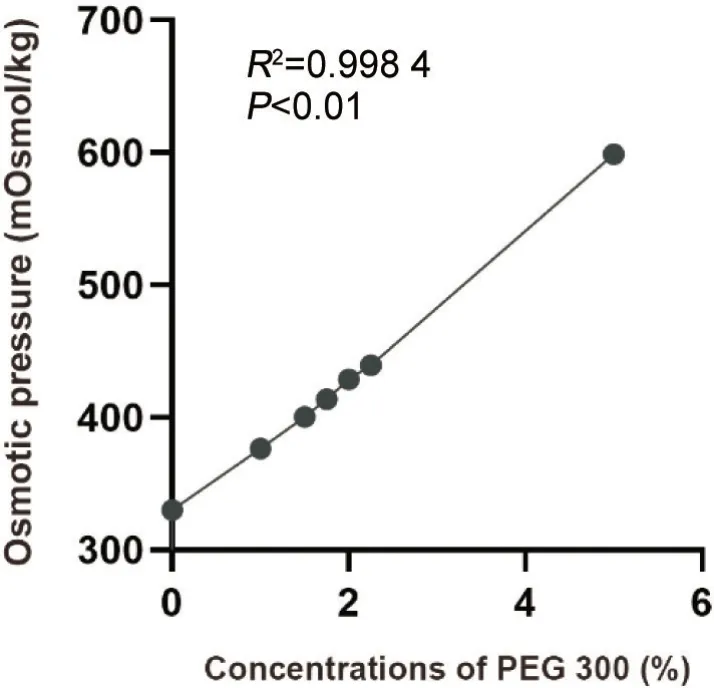
Figure 1. Osmotic pressure curve of the culture medium.图1 培养液渗透压曲线
2 高渗透压对EB活力和增殖无明显毒副作用
为了确认将PEG 300 添加到培养液中对细胞的生物安全性,本研究进行了细胞活力测定。研究比较了在不同渗透压浓度中的EB 形成形态。在渗透压浓度较高(4% PEG 300)的情况下,EB 出现散乱不聚集的现象,无法正常存活至培养结束(图2A)。因此接下来只探究2%浓度PEG 300 与对照组细胞的存活情况。通过对高渗组和对照组的EB进行AM/PI染色检测结果显示,两组EB 中含有相当大比例的活细胞(绿色荧光染色)。EB 的死细胞染色并不明显(红色荧光染色,用白色箭头表示的簇),相较而言,高渗组中红色荧光更少,并且EB 的形态良好,无明显凋亡坏死现象(图2B)。
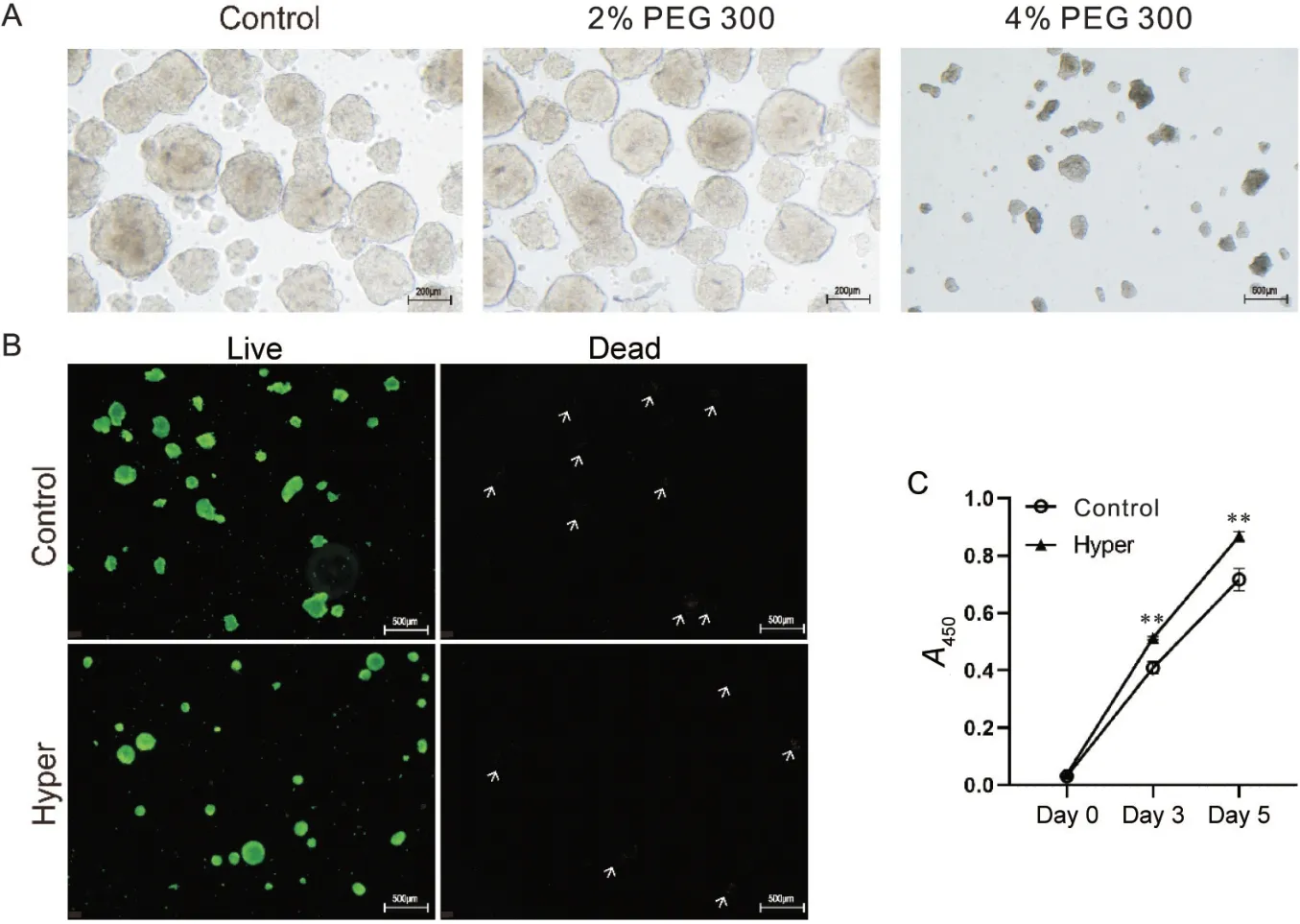
Figure 2. Activity assay of embryoid bodies( EBs). A: suspension cultured EBs in different concentrations of osmotic pressure; B:AM/PI staining to detect the activity of EBs; C: A450 values of suspended EBs from day 0 to day 5 were detected by CCK-8 assay. Mean±SEM. n=5. **P<0.01 vs control group.图2 拟胚体的活力检测
CCK-8 实验检测了培养过程中EB 的增殖活性情况。CCK-8 实验的生长曲线显示,EB 在整个培养周期持续增殖,其中,从第3 天开始,高渗组的细胞较对照组相比优势增殖率升高,差异均有统计学意义(P<0.01),见图2C。
3 高渗透压引起EB 中CDH1 表达维持同时CDH2表达下调
在EB 形成和分化过程中,钙黏蛋白在细胞连接和功能中扮演重要角色,而CDH1 和CDH2 的表达与EB的分化相关[23-24]。为了探究高渗透压培养环境对EB 分化方向的影响,检测了第2、4、6 天高渗组和对照组EB 中CDH1 和CDH2 的表达情况。实验结果显示,与第2 天相比,第4 天和第6 天高渗组和对照组的EB 中CDH1(红色荧光)和CDH2(绿色荧光)荧光强度呈下降趋势,二者表达呈现相似的变化趋势。然而,组间比较结果显示,高渗组的CDH1 的荧光强度更高,而CDH2 荧光强度更低。另外,研究观察到,高渗组的EB 在第2 天和第4 天表现出规则形态,并形成完整的球形结构,见图3A、B。
这些结果提示,增加培养液的渗透压影响了CDH1和CDH2的表达。为进一步探讨PEG 300导致的培养液渗透压变化对EB 中CDH1 和CDH2 表达的影响,我们进行了Western blot 实验,检测不同浓度渗透压中EB 的蛋白表达量。结果显示,CDH1 和CDH2的表达量与渗透压浓度相关,随着渗透压浓度的升高,CDH2 的表达逐渐下调,而CDH1 总体上呈轻微上升趋势。相关性统计分析显示渗透压与CDH1 和CDH2 的表达存在着直接相关性(P<0.05),见图3C。
4 高渗透压对EB中MET进程的影响
由于CDH1 和CDH2 是MET 进程两个关键生物标志物,而顺序性EMT-MET 在干细胞命运决定和转换过程中发挥重要作用[25-26],为了了解不同渗透压培养液中EB 的EMT 进程,我们检测了EMT 相关基因的表达情况,RT-qPCR 结果显示,EMT 经典标志物(Snail 和Twist)的上下调趋势不具有统计学意义,vi‐mentin出现明显上调,CDH1略有上调,而CDH2则明显下调,见图4。
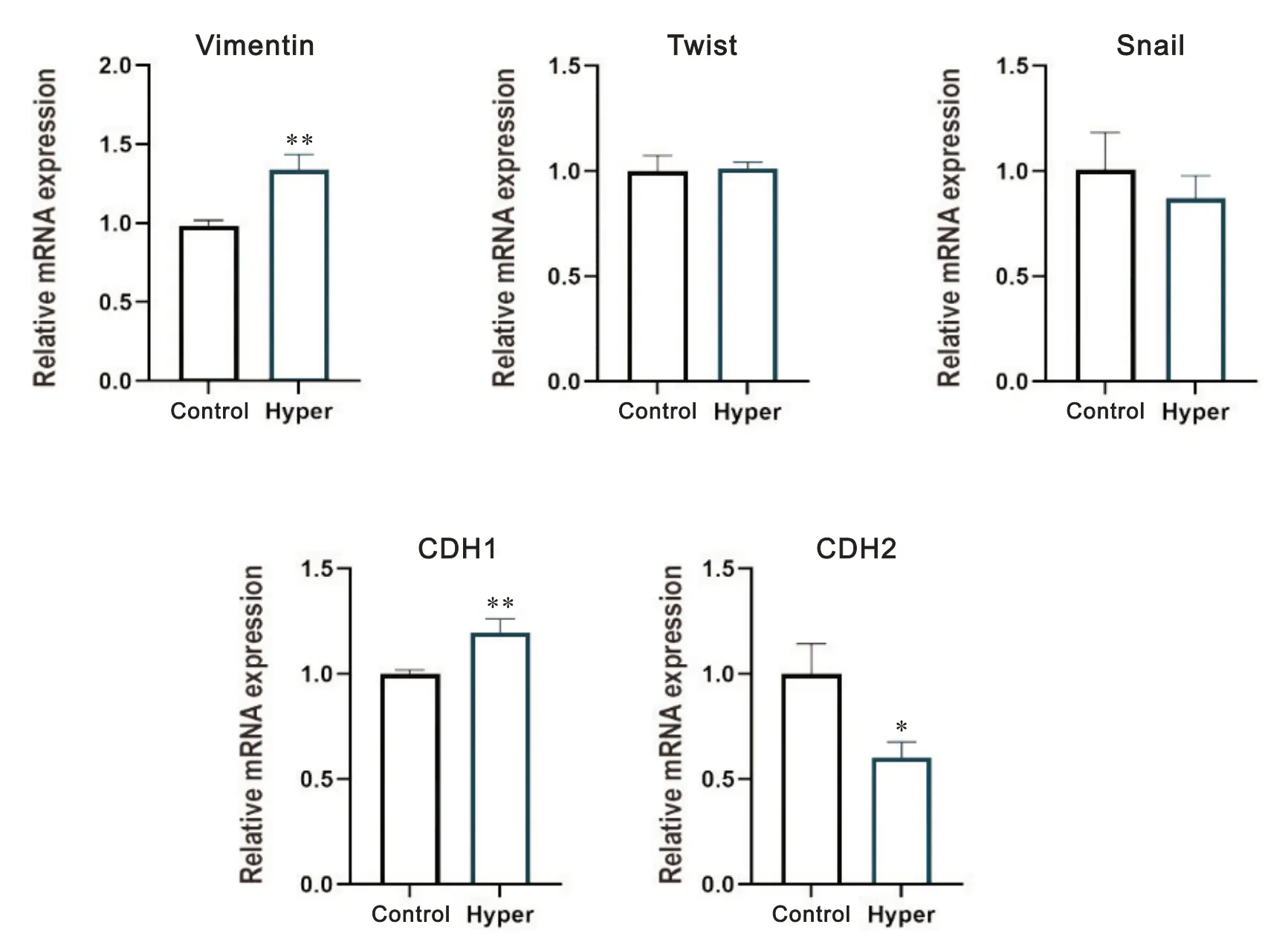
Figure 4. The expression of EMT markers in embryoid bodies. Mean±SEM. n=3. *P<0.05, **P<0.01 vs control group.图4 拟胚体EMT标志物检测
5 高渗透压对EB分化方向的影响
在EB 形成过程中,钙黏蛋白的变化与EB 的分化有着一定关联性[27]。我们从EB形成的第1天开始检测了两组EB 的三胚层标志物的表达情况,以探讨高渗透压培养液和对照组培养液对EB 形成阶段分化方向的影响。研究发现,高渗组EB 中的中胚层相关标志物(T/Bry、Eome、Mixl1 和Hand1)的表达在EB的第4天开始显现(图5A)。同时,高渗组EB 中胚层标志物的表达量在第4 天或之后显著高于对照组,提示高渗组EB的中胚层分化趋势更强。
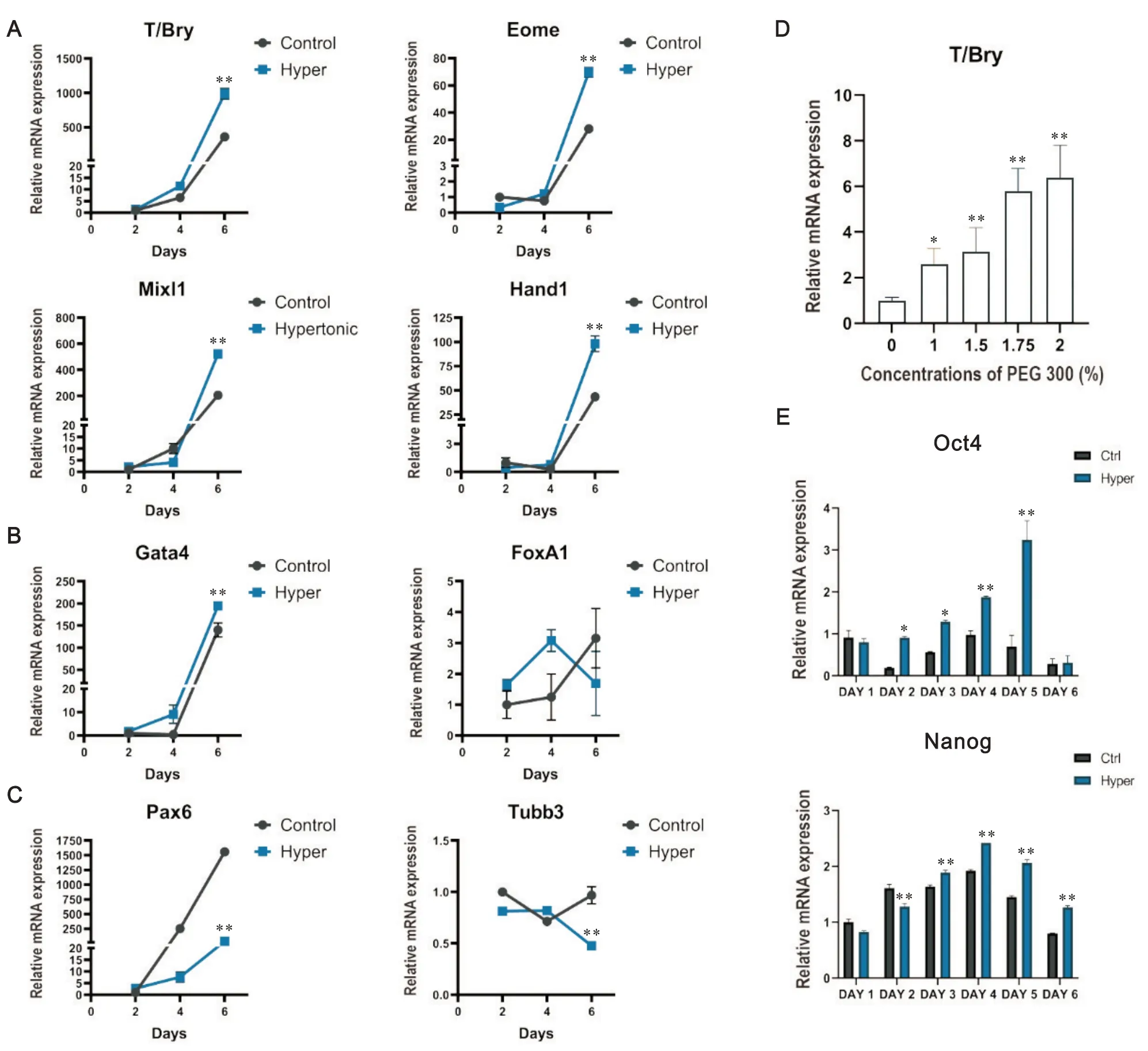
Figure 5. Expression of differentiation markers in embryoid bodies( EBs) at different time points. A: the expression of mesoderm-re‐lated markers( T/Bry, Eome, Mixl1 and Hand1) in the 2 groups of EBs at different time points; B: the expression of endo‐derm-related markers( Gata4 and FoxA1) in the 2 groups of EBs at different time points; C: the expression of ectoderm-re‐lated markers( Pax6 and Tubb3) in the 2 groups of EBs at different time points; D: the expression of T/Bry in EBs cultured with different concentrations of PEG 300; E: the expression of pluripotency-related markers (Oct4 and Nanog) in the 2 groups of EBs at different time points. Mean±SEM. n=3. *P<0.05, **P<0.01 vs contorl.图5 各组拟胚体在不同时点的分化标志物表达情况
内胚层和外胚层相关标志物的表达检测结果显示,内胚层标志物的表达趋势不一致,在高渗组,EB中Gata4 的表达相对高于对照组,FoxA1 无明显趋势(图5B)。高渗组EB中,外胚层标志物Pax6在第4天和第6天的表达量都显著低于对照组,而Tubb3在第6天的表达量也低于对照组(图5C)。
在含有不同浓度PEG 300 的培养液中培养EB 6 d后,检测了中胚层标志物T/Bry的表达情况,以明确渗透压浓度与中胚层标志物表达情况的关联性。结果显示,T/Bry 的表达量随着培养液渗透压的增加而增加(P<0.05),见图5D,提示培养液渗透压的变化与中胚层标志物的表达存在一定的浓度相关性。
6 高渗透压对EB多能性的影响
由于CDH2 和CDH1 的表达往往提示EB 的多能性发生了转变,为了验证高渗透压培养液对EB 多能性的影响,检测了第1 至第6 天EB 的多能性标志物Oct4 和Nanog 的表达情况。总体来看,这两组标志物在时间推移中显示出一时性的升高趋势(图5E)。在高渗组中,Nanog和OCT4在第2至第5天的表达均明显高于对照组,这可能与高渗组EB 中CDH1 的保持有关[15,21]。
7 抑制p-Smad3上调CDH2并抑制中、外胚层分化
已有研究表明了Smad3 的存在会下调CDH2 的表达水平[28-30]。本研究通过SB431542[21]来抑制p-Smad3 的功能。蛋白相对定量结果显示,在高渗+抑制剂组(以下简称Anti组)中,p-Smad3的表达水平受到抑制,表明SB431542成功抑制了p-Smad3的表达。免疫荧光染色结果显示,与高渗组相比,Anti 组的CDH2呈现明显的上调趋势,其荧光表达强度接近于对照组(图6B)。此外,Western blot 实验结果显示,Anti 组的CDH2 显著上调(P<0.05),同时CDH1 的表达水平略有下降,表明SB431542 可以调节EB 的CDH2表达水平(图6A)。进一步的Western blot检测显示,Anti 组EB 中胚层的表达情况呈现出T/Bry 表达量明显下调,同时外胚层标志物Tubb3 的表达水平明显回升(P<0.05),见图6C。这提示改变CDH2的表达水平可能调节了EB的胚层分化方向。
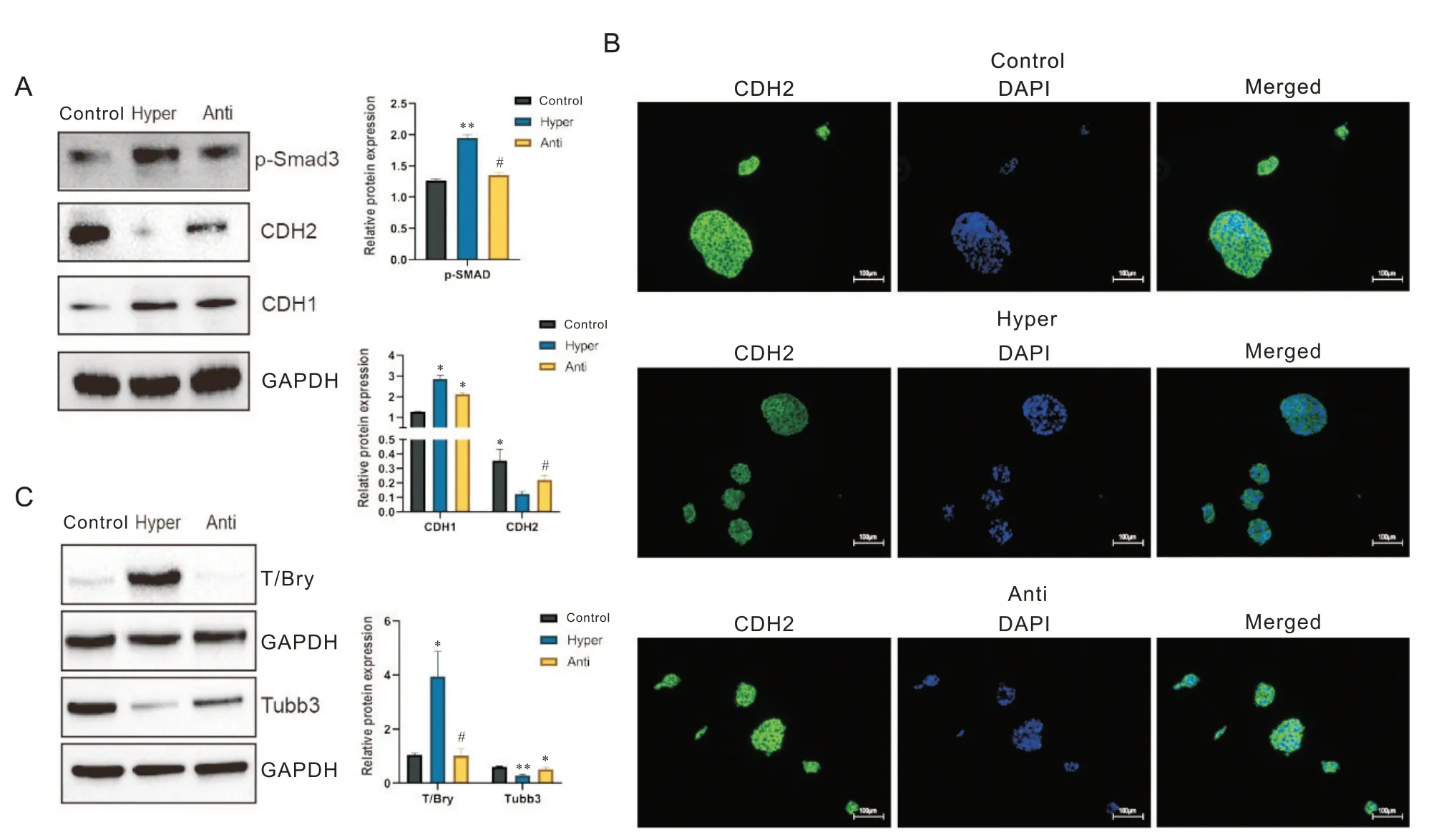
Figure 6. Influence of up-regulated CDH2 on differentiation of embryoid bodies( EBs) in high-osmolarity group. A: Western blot re‐sults for p-Smad3, CDH1 and CDH2 in the 3 groups of EBs; B: the immunofluorescence intensity of CDH2 in the 3 groups of EBs( scale bar =100 µm); C: the protein expression levels of T/Bry and Tubb3 in the 3 groups of EBs. Mean±SEM. n=3. *P<0.05, **P<0.01 vs control group; #P<0.05 vs Hyper group.图6 上调CDH2对高渗组拟胚体分化的影响
讨 论
干细胞在微环境中能够精确感知并传导生物化学信号进入细胞,对细胞的行为、细胞命运或生长变化产生显著影响[31,32]。目前,关于较高渗透压环境因素对于诱导多能干细胞来源的EB 发生发育影响的研究相对较少,本研究为探讨组织与培养环境对干细胞的功能与分化的影响提供了新的视角。本研究使用PEG 300 来提高培养液渗透压。结果显示,PEG 300对EB没有即时毒性作用,并且在EB形成过程中能够维持EB 的良好形态,具有良好的生物安全性。
体外研究已经充分证明了钙黏蛋白对于干细胞增殖、自我更新、黏附和多谱系分化的调节发挥着重要作用[23-24,27,33-35]。本研究观察到,培养液渗透压对EB 的CDH1 和CDH2 的表达水平产生影响。在高渗组中,CDH1 和CDH2 表达量与渗透压浓度呈显著的线性相关。然而,与CDH1 相比,高渗组与对照组之间CDH2 表达量的差异更为显著,表明培养环境渗透压的提高可能与CDH2 表达水平相关联相关性更强。由于CDH1和CDH2同时是EMT过程的标志物,其转变可能与EMT 过程的改变相关,但由于其他的经典EMT 标志物没有与CDH1 和CDH2 改变相符的趋势,与EMT-MET 过程的标志物转变不相符,提示高渗透压对EMT 过程的影响不甚明显,CDH1 和CDH2可能是作为独立因素在发挥作用。
另外,在EB 形成过程中,钙黏蛋白与中胚层和外胚层分化的最早阶段事件相关[27],了解EB 的三胚层分化情况对于更充分地利用EB 在再生医学和临床应用上至关重要。对三个胚层的标志物的表达情况分析显示,第6 天EB 的中胚层相关标志物表达量显著高于前4 天,提示EB 的中胚层分化开始于第4天之后。同时,高渗组的中胚层标志物表达量在第4天后显著高于对照组,提示高渗促进了EB 的中胚层分化效率。相比之下,高渗抑制了EB 的外胚层标志物的表达,但对内胚层标志物的表达影响不明确。
进一步比较不同渗透压浓度对EB 中胚层分化的影响发现,随着渗透压浓度的升高,EB 中胚层标志物的表达明显增强,并且与CDH1 随着渗透压浓度增加而上调、CDH2随着渗透压浓度增加而下调的趋势一致。这提示渗透压升高可能通过稳定CDH1及抑制CDH2 的表达,从而影响了EB 的分化过程。此外,CDH1可能直接或间接参与多能性相关转录因子的表达,进而影响转录因子OCT4 的表达[15]。因此,高渗组EB 中多能性相关基因的高表达量可能提示着渗透压可以通过调节钙黏蛋白来影响细胞内的这些过程。
Sally 等[21]的研究结果显示,阻断CDH1 的下调能够抑制神经诱导分化,同时促进多能性或中胚层分化。在本研究中,渗透压引起的CDH1 表达差异并不如CDH2 显著。相对于高渗组,Anti 组的CDH1降低没有统计学意义。然而,高渗组与对照组的比较结果显示,在较高渗透压环境中,CDH1 的表达量高于对照组,与Sally 等的研究结果一致。这也提示在较高渗透压环境中,CDH2 可能对EB 的分化扮演更为重要的角色,这与其他关于CDH2 对分化影响的研究相符[28,35-37]。
通过上调高渗组EB 的CDH2 表达,本研究发现Anti 组中胚层标志物的表达量下降,而外胚层标志物的表达量上调。这表明高渗对于EB 分化的影响是可以通过上调CDH2被逆转的。Pei等人的研究也显示,在iPSCs 中强制表达CDH2 显著提高了分化效率,而shRNA 敲低CDH2 则阻断了神经分化[36]。这些研究结果支持了本研究的发现,即较高渗透压环境导致CDH1 相对维持而CDH2 下调,尤其是CDH2的下调,对EB 产生倾向于中胚层分化和神经外胚层抑制具有显著影响(图7)。
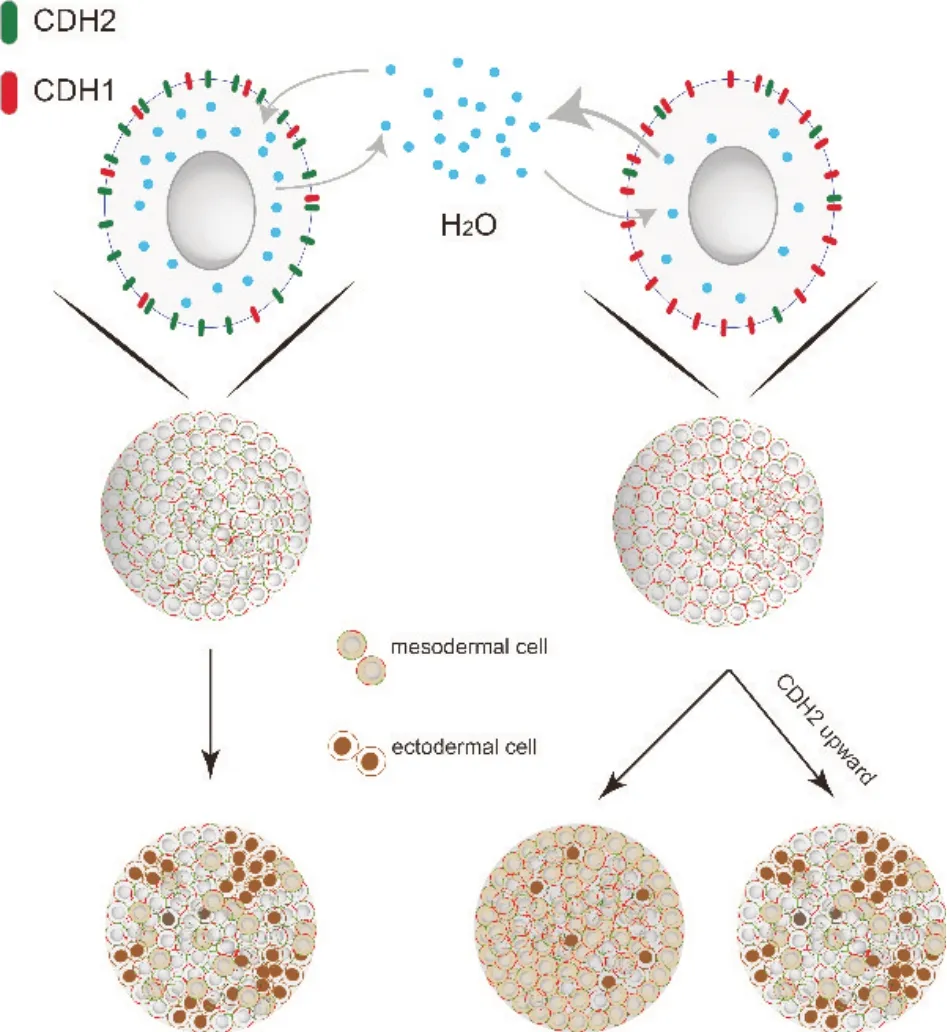
Figure 7. Schematic diagram depicting the influence of hyperos‐motic pressure on the differentiation of embryoid bodies.图7 高渗透压影响拟胚体分化示意图
综上所述,本研究结果强调了细胞外环境中渗透压对干细胞分化的重要影响:增加环境渗透压对EB 的中胚层分化起到了促进作用,而对外胚层分化起到抑制作用。这种作用与较高渗透压环境引发的CDH1 的维持和CDH2 的下调相关联。本研究为物理环境因素影响细胞功能提供了新的线索,为基础医学研究提供了新的思路。
