糖尿病肾病小鼠中前纤维蛋白1的表达和免疫细胞浸润分析*
2024-04-07麦丽萍黄桂萍邓春玉郑丹琳李晓红何国东
麦丽萍, 黄桂萍, 邓春玉, 郑丹琳, 李晓红, 何国东
[南方医科大学附属广东省人民医院(广东省医学科学院)医学研究部,广东 广州 510080]
糖尿病肾病(diabetic nephropathy, DN)是导致终末期肾病的主要原因之一,与肾小球、血管和肾小管损伤有关。数据显示,我国20%~40%的糖尿病患者可并发DN,这些病人常伴有心血管和神经系统疾病等基础病,加重了DN 的疾病进展和增加死亡风险[1]。因此,探索DN 的发病机制和有效的药物研发备受关注,然而目前DN 的发病机制尚不明确。既往研究显示,高血糖和氧化应激引起的血管功能障碍是DN 发病的重要因素;晚期糖基化终产物(ad‐vanced glycation end products, AGEs)积累,与其受体RAGE 结合,诱导产生活性氧(reactive oxygen spe‐cies, ROS)激活相关的信号通路,活化下游靶分子,如:核因子κB(nuclear factor-κB,NF-κB),引起肾脏损伤,在DN的发生与发展过程中起着关键作用[2-4]。
前纤维蛋白1(profilin 1, PFN1)是前纤维蛋白(profilin, PFN)的亚型之一,在进化上高度保守的一种肌动蛋白结合蛋白,普遍存在于所有真核生物中,被认为有3 个结构域:肌动蛋白结合结构域、聚L-脯氨酸结合结构域和磷脂酰肌醇结合结构域。PFN1作为关键的小分子肌动蛋白调节蛋白,通过其结构域调控肌动蛋白的聚合-解聚动态平衡,介导细胞收缩和细胞骨架的改变[5]。PFN1还作为关键信号分子的相互作用网络枢纽,通过结构域与靶蛋白的相互结合参与蛋白质的跨膜转运、小G 蛋白信号通路的活化以及核内转录等一系列重要的生理、病理过程[6]。由此可见,PFN1 在许多细胞功能中起着至关重要的作用,包括膜运输、内吞、细胞周期、运动、增殖、细胞存活、转录、干细胞和自噬等。PFN1 的异常表达或缺失可影响细胞的正常生理活动并导致疾病的发展。目前,PFN1 在人类恶性肿瘤、神经系统疾病和内皮功能障碍中异常表达[7-8]。PFN1在AGEs诱导的心肌细胞肥大和凋亡中起到强而有力的调节作用。AGEs 通过提高ROS 的产生,RhoA 和ROCK2 的表达来增加PFN1 的表达,PFN1 升高促进肌动蛋白细胞骨架的紊乱;下调PFN1 可减轻H9c2 细胞AGEs诱导的心肌细胞肥大和凋亡[9]。
PFN1 可调节滋养层细胞侵袭和巨噬细胞分化;在滋养层细胞中下调PFN1 可通过NF-κB 信号通路促进肿瘤坏死因子α 分泌,诱导巨噬细胞极化为M1表型[10]。DN 肾小管上皮细胞与巨噬细胞之间的通讯通过细胞外小泡转移形成负反馈环,促进肾脏炎症和凋亡[11]。课题组前期研究显示:PFN1 可通过Hedgehog信号通路促进DN肾小管上皮细胞凋亡[12]。本项工作拟进一步观察DN 小鼠中PFN1的表达和免疫细胞浸润情况。
材料和方法
1 实验动物
SPF 级8 周 龄雄性C57BL/6 小 鼠16 只,体重量(20±5) g,购自广东省医学实验动物中心[许可证号:SCXK(粤)2022-0002]。饲养室温、湿度、光照适宜,普通饲料喂养。
2 细胞株
人肾皮质近曲小管上皮细胞系HK-2 购自赛业生物科技有限公司(货号: H4-0501),该细胞株已鉴定。HK-2 细胞在含有10%胎牛血清的DMEM/F12培养液中,37 ℃,5% CO2的环境中培养生长。
3 主要实验试剂
链脲佐菌素(streptozotocin, STZ)购自Sigma;PFN1 抗体(67390-1-Ig)、胱天蛋白酶3(caspase-3)抗体(19677-1-AP)和单核细胞趋化蛋白1(monocyte chemotactic protein-1, MCP-1)抗体(26161-1-AP)购自Proteintech;B 细胞淋巴瘤2(B-cell lymphoma-2,Bcl-2)抗体(BA0412)、Bcl-2 相关X 蛋白(Bcl-2-asso‐ciated X protein, Bax)抗体(A00183)、GAPDH 抗体(A00227-1)和HRP Ⅱ抗(BA1050 和BA1054)均购自Boster;CC 趋化因子受体4(CC chemokine receptor 4,CCR4)抗体(TD10206S)和白细胞介素1 受体I型(in‐terleukin-1 receptor type I, IL-1R1)抗体(PK06667S)购自Abmart;CD11b 抗体(ab133357)和山羊抗兔IgG-HRP(ab205718)购自 Abcam;F4/80 抗体(70076S)购自CST;Harris苏木素染色液(BA4041)购自珠海贝索生物技术有限公司;DAB 显色试剂盒(DAB-4033)购自福州迈新生物技术开发。胎牛血清(AB-FBS-ED1050)购自Abwbio;DMEM/F12 培养液(C11330500BT)购 自Gibco;Lipofectamine 2000(11668019 )购自Invitrogen。
4 主要方法
4.1 数据下载 从GEO 数据库官网(https://www.ncbi. nlm. nih. gov/geo/)下载样本来源可靠的DN 患者芯片表达数据集GSE30122[13-14],使用R 软件(ver‐sion 4.0.2,http://r-project. org/)的affy 包[15]读 取 数据,通过背景校正,数据均一化处理,最终获得该数据集的基因表达矩阵。数据集中的样本均来自于Homo sapiens,平台基于GPL571[HG-U133A_2] Af‐fymetrix Human Genome U133A 2.0 Array,其中包括19例DN患者和50例正常肾脏样本。
4.2 DN 患者肾脏组织免疫细胞浸润水平 CIBER‐SORT 是基于线性支持向量回归原理对人类免疫细胞亚型的表达矩阵进行去卷积的工具。对芯片表达矩阵进行非负矩阵分解后计算不同细胞类型的比例。该方法基于已知参考数据集,提供22 种免疫细胞亚型的基因表达特征集[16]。本研究通过利用CIBERSORT 分析并比较DN 与非DN 患者肾脏组织免疫细胞浸润水平。
4.3 实验动物的分组和造模 将16 只C57BL/6 小鼠编号,称量体重,并随机分为正常组和模型组(DN组),每组各8 只。参照课题组前期的研究方法[12],采用腹腔注射STZ 法建立DN 小鼠模型[17-19],适应性喂养1 周后,腹腔连续5 d 注射STZ(50 mg/kg), 5 d后检测血糖水平,若血糖>16.7 mmol/L 可判断糖尿病模型造模成功,此后每周监测小鼠血糖和24 h 尿微量蛋白水平。8 周后若24 h 尿微量蛋白大于 30 mg则认为DN 模型成功[20-21]。造模成功后,脊椎脱臼法处死小鼠后开腹取肾脏,立即放于4%多聚甲醛固定,备用。
4.4 苏木精-伊红(hematoxylin-eosin, HE)、过碘酸-雪夫(periodic acid-Schiff, PAS)和马松(Masson)染色观察肾脏病理学变化 将各组小鼠肾组织用4%多聚甲醛固定液固定,常规石蜡包埋组织、切片和脱蜡水化后,分别进行HE、PAS、Masson 染色,封片,正置显微镜下观察切片,放大200倍采集图像。
4.5 巨噬细胞、Th17细胞和凋亡相关标记物的免疫组织化学染色 组织连续切片法将各组小鼠肾组织石蜡块切取4 µm 厚度的,常规脱蜡水化,抗原修复后冷却,浸泡于3 %的H2O2中30 min 去除内源性过氧化物酶活性后,滴加10 %山羊血清室温封闭30 min,甩去血清,用10 %山羊血清稀释Ⅰ抗[PFN1(1∶100)、CD11b(1∶6 000)、F4/80(1∶500)、CCR4(1∶200)、IL-1R1(1∶100)、Bax(1∶200)、Bcl-2(1∶200)、caspase-3 抗体(1∶200)],4℃孵育过夜,TBST 漂洗后滴加羊抗兔的Ⅱ抗,37 ℃孵育45 min,新鲜配制的DAB 显色液显色后用苏木素染核,盐酸酒精分化1~2 s,洗净,返蓝液返蓝数秒后洗净,封片剂封片,晾干,镜检。显微镜下在阳性细胞区域随机选择5 个视野,对染色进行评分:以染色强度评分值[阴性(无着色)0 分、弱阳性(淡黄色)1 分、中阳性(棕黄色)2分和强阳性(棕褐色)3分]与相应的阳性细胞百分比乘积为总评分。
4.6 Western blot 检测PFN1、MCP-1 和caspase-3 蛋白的表达情况 为研究PFN1 在DN 中的作用,课题组前期已用高糖诱导HK-2 细胞建立DN 细胞模型;并将PFN1基因过表达或敲除[12]。
将第3~12 代HK-2 细胞(P3-P12)接种到6 孔板中(每孔约2×105个细胞)。将细胞分为6 组,每组3个复孔。即对照组(5.5 mmol/L D-葡萄糖)、高糖(45 mmol/L D-葡萄糖)诱导72 h 组、shRNA 载体转染+高糖诱导72 h组、PFN1 shRNA 转染+高糖诱导72 h组、质粒载体转染+高糖诱导72 h 组和PFN1 质粒转染+高糖诱导72 h 组。细胞经Lipofectamine 2000 转染shRNA 或PFN1 质粒24 h 后,换成高糖培养液(45 mmol/L D-葡萄糖DMEM+10% FBS)继续培养72 h。
细胞去除培养液,PBS洗3次,加入细胞裂解液,冰上刮取细胞进行总蛋白提取;使用BCA 法测定细胞总蛋白浓度;100 ℃蛋白变性5 min;使用预制胶进行SDS-PAGE,各孔的上样体积根据所测得的蛋白浓度计算,电压调至140 V,电泳50 min 后停止。电泳结束后,取出胶,快速转膜16 min;取出膜,用无蛋白快速封闭液在摇床下封闭10 min;4 ℃摇床上孵育Ⅰ抗过夜;TBST 漂洗3 次,每次5 min;常温摇床上孵育Ⅱ抗1 h;TBST 漂洗3 次,每次5 min;ECL 显色和曝光。
5 统计学处理
生信分析的数据处理与分析均通过R 软件(4.0.2版本)完成。对于两组连续变量的比较,通过独立Studentt检验估计正态分布变量的统计显著性,并通过Mann-Whitney U检验(即Wilcoxon秩和检验)分析非正态分布变量间的差异。卡方检验或Fisher精确检验用于比较和分析两组分类变量之间的统计显著性。PFN1 与免疫细胞浸润水平相关性分析采用Pearson分析。所有的统计P值均为双侧,以P<0.05为有统计学意义。
其他数据处理采用GraphPad Prism 9.0 统计软件,所有数据以均数±标准差(mean±SD)表示。两组间比较用独立样本t检验进行分析,以P<0.05 为差异有统计学意义。
结 果
1 生物信息学分析DN患者肾组织芯片表达数据集GSE30122中细胞免疫浸润情况
DN 患者肾组织芯片表达数据集GSE30122 中,与正常肾脏组织相比,PFN1基因在DN 患者的肾脏组织中表达量显著升高(P<0.01),见图1A。本研究进一步分析不同免疫细胞亚群与PFN1 表达的相关性,见图1B。结果显示,PFN1基因的表达与T 细胞和巨噬细胞具有显著相关性,其中与CD4初始细胞、γδT 细胞、巨噬细胞(M1 和M2)、浆细胞和肥大细胞(静息)呈现显著的正相关性;与幼稚B 细胞、树突状细胞和活化的肥大细胞呈现显著的负相关性。
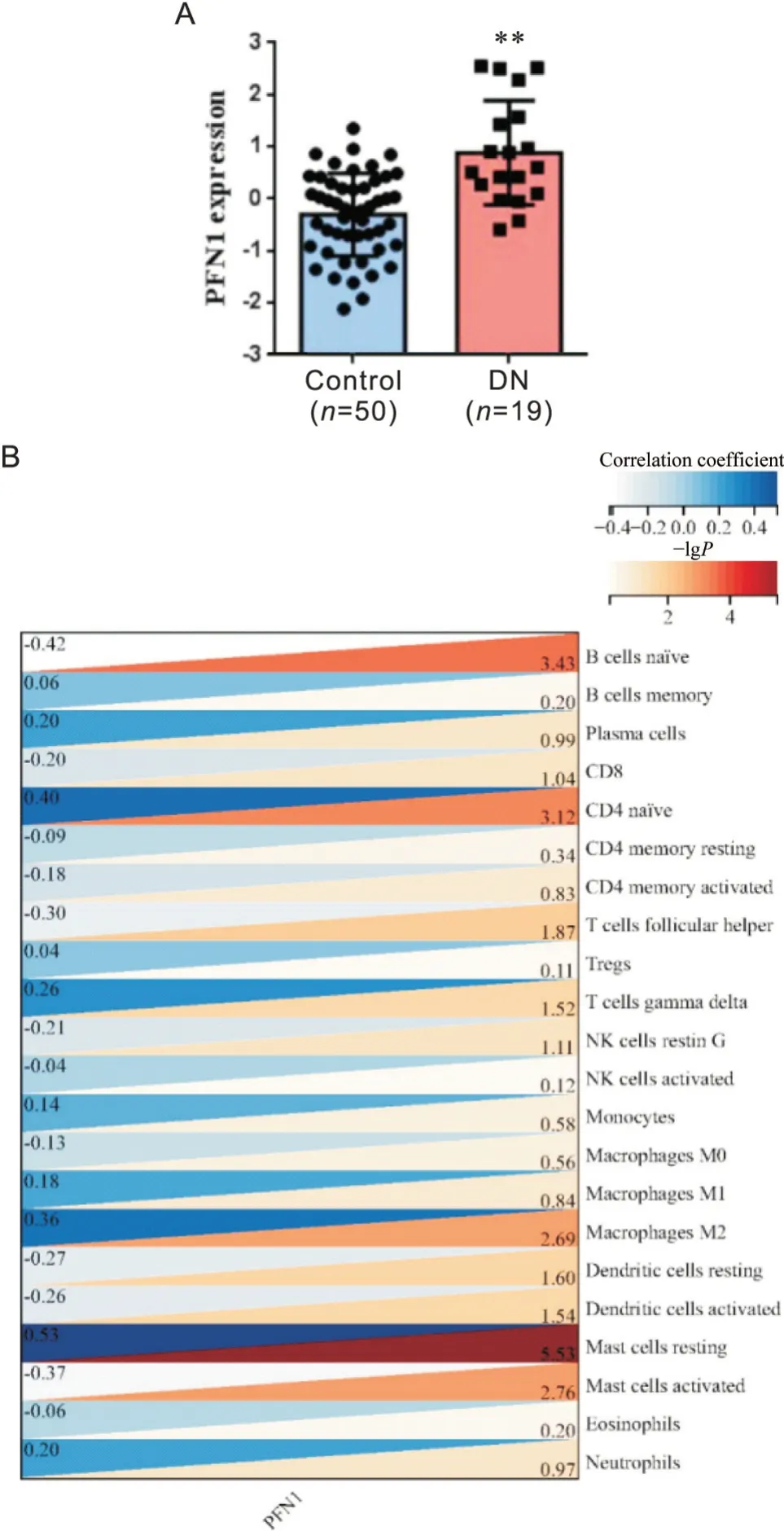
Figure 1. The correlation expression of PFN1 and immunocyte infiltration in the data set GSE30122 of transcriptome expression in diabetic nephropathy (DN) kidney tis‐sues. A: PFN1 gene expression in kidney tissue of DN patients. **P<0.01 vs control group. B: the corre‐lation expression of PFN1 and different subsets of im‐mune cells. A stronger correlation is indicated by a deeper shade of red, while a weaker correlation is rep‐resented by a deeper shade of blue. The color scale is represented as follows: a higher positive correlation(approaching 1) is associated with a deeper shade of blue, while a higher negative correlation(approaching−1) is associated with a deeper shade of red.图1 糖尿病肾病患者肾组织芯片转录组数据集GSE30122中PFN1的表达和免疫细胞浸润情况
2 DN小鼠中肾组织病理变化和PFN1的表达
DN 小鼠肾组织HE 染色可见肾小球肥大,系膜扩张;肾小管肥大、管腔增大;间质可见少量炎症细胞浸润。PAS 染色结果显示,DN 组可见肾小球系膜区明显增宽,基底膜明显增厚,细胞外基质累积。Masson染色可见DN组肾小球基底膜明显增厚,胶原纤维增多。见图2。

Figure 2. Pathological changes of kidney tissue in diabetic ne‐phropathy (DN) mice (scale bar=100 µm). A and B: HE staining of renal tissue in mice. In DN group,glomerular hypertrophy, mesangial dilation, renal tu‐bule hypertrophy and lumen enlargement. C and D:PAS staining of renal tissue in mice. In DN group,the glomerular mesangial zone exhibited significant widening, the basement membrane displayed notice‐able thickening, and there was evident accumulation of extracellular matrix. E and F: Masson staining of renal tissue in mice. In DN group, the glomerular basement membrane exhibited a substantial increase in thickness, accompanied by a notable augmentation in collagen fibers. Blue color represents the positive expression of collagen fiber.图2 糖尿病肾病小鼠中肾组织病理变化
进一步对小鼠肾组织进行免疫组织化学染色,与正常组比较,DN 组PFN1 表达显著上调(P<0.01),见图3。
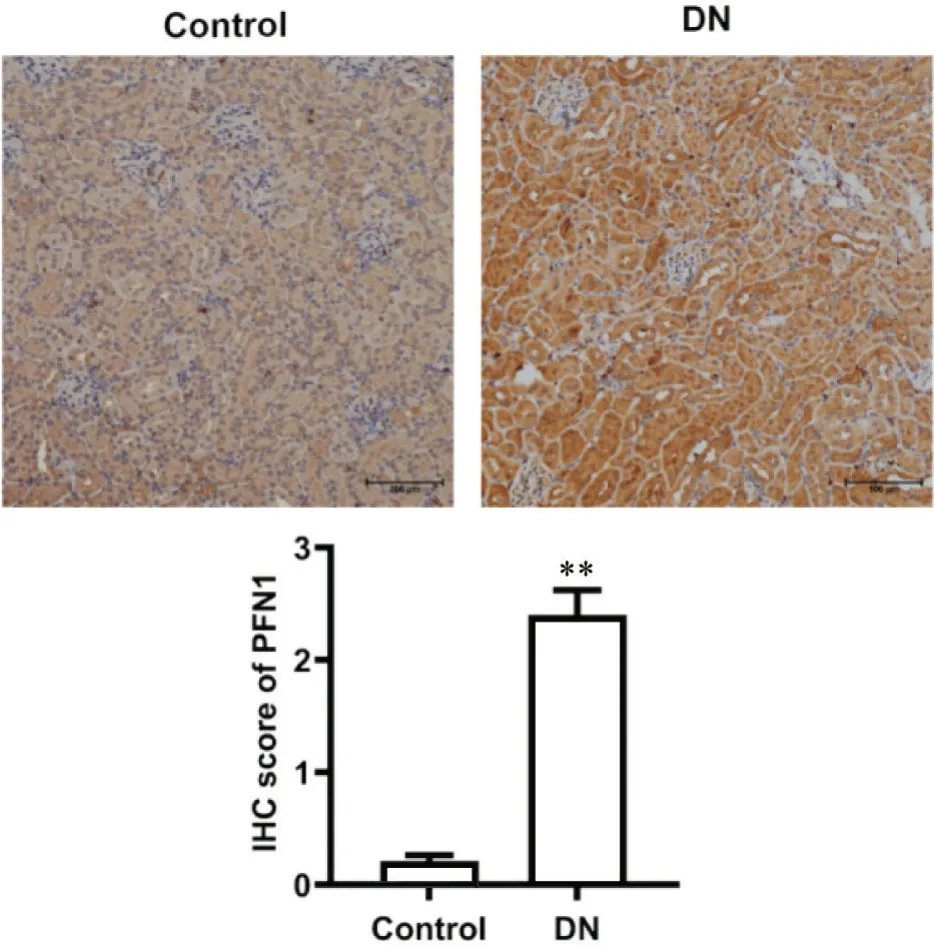
Figure 3. The expression of PFN1 in renal tissue of diabetic ne‐phropathy (DN) mice was detected by immunohisto‐chemical (IHC) staining (scale bar=100 µm). The expression of PFN1 was significantly increased in DN group. The brown hue is indicative of PFN1 positivi‐ty, with increased intensity of staining correlating with heightened expression levels. Mean±SD. n=8.**P<0.01 vs control group.图3 糖尿病肾病小鼠中肾组织PFN1的表达情况
3 DN 小鼠中巨噬细胞和Th17 细胞相关蛋白表达情况
根据图1B 生信分析的结果,选择了巨噬细胞的CD11b 和F4/80,Th17 细胞的CCR4 和IL-1R1 表面标记物进行分析。与正常组比较,DN 组免疫指标CD11b、F4/80 表达显著增多(P<0.01)。CCR4 在肾小球中部分表达; IL-1R1 在肾小管和肾小球中表达均显著增多(P<0.01),见图4、5。

Figure 4. Immune infiltration of macrophage in renal tissue of diabetic nephropathy(DN) mice. The expression of CD11b and F4/80 in renal tissue was detected by immunohistochemical (IHC) staining(scale bar=100 µm). The expression of CD11b and F4/80 increased significantly in DN group. The color brown is indicative of positive expression, with increased intensity of staining correlating with heightened expression levels. Mean±SD. n=8. **P<0.01 vs control group.图4 糖尿病肾病小鼠中肾组织中巨噬细胞免疫浸润情况
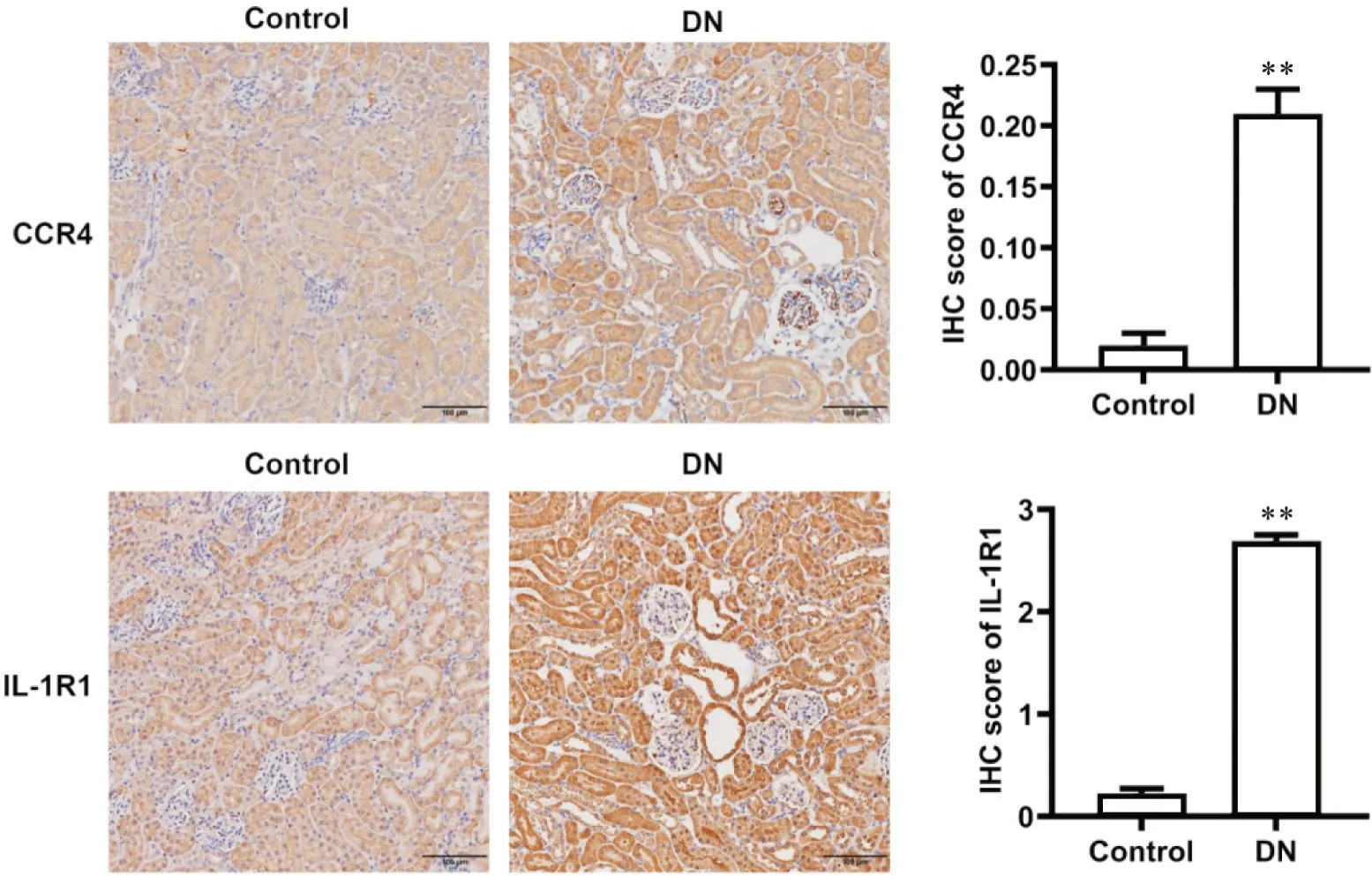
Figure 5. Immune infiltration of Th17 cells in renal tissue of diabetic nephropathy(DN) mice. The expression of CCR4 and IL-1R1 in renal tissue detected by immunohistochemical (IHC) staining (scale bar=100 µm). The expression of CCR4 and IL-1R1 increased significantly in DN group. The color brown is indicative of positive expression, with increased intensity of staining correlating with heightened expression levels. Mean±SD. n=8. **P<0.01 vs control group.图5 糖尿病肾病小鼠中肾组织Th17细胞免疫浸润情况
4 DN小鼠中肾组织细胞凋亡相关蛋白表达情况
进一步检测DN 小鼠中肾组织细胞凋亡相关蛋白Bax、Bcl-2 和caspase-3,与正常组比较,DN 组肾小管中细胞胞浆中可见棕色或棕褐色着色;肾小管中Bax、Bcl-2 和caspase-3 蛋白的表达均显著升高(P<0.01),见图6。
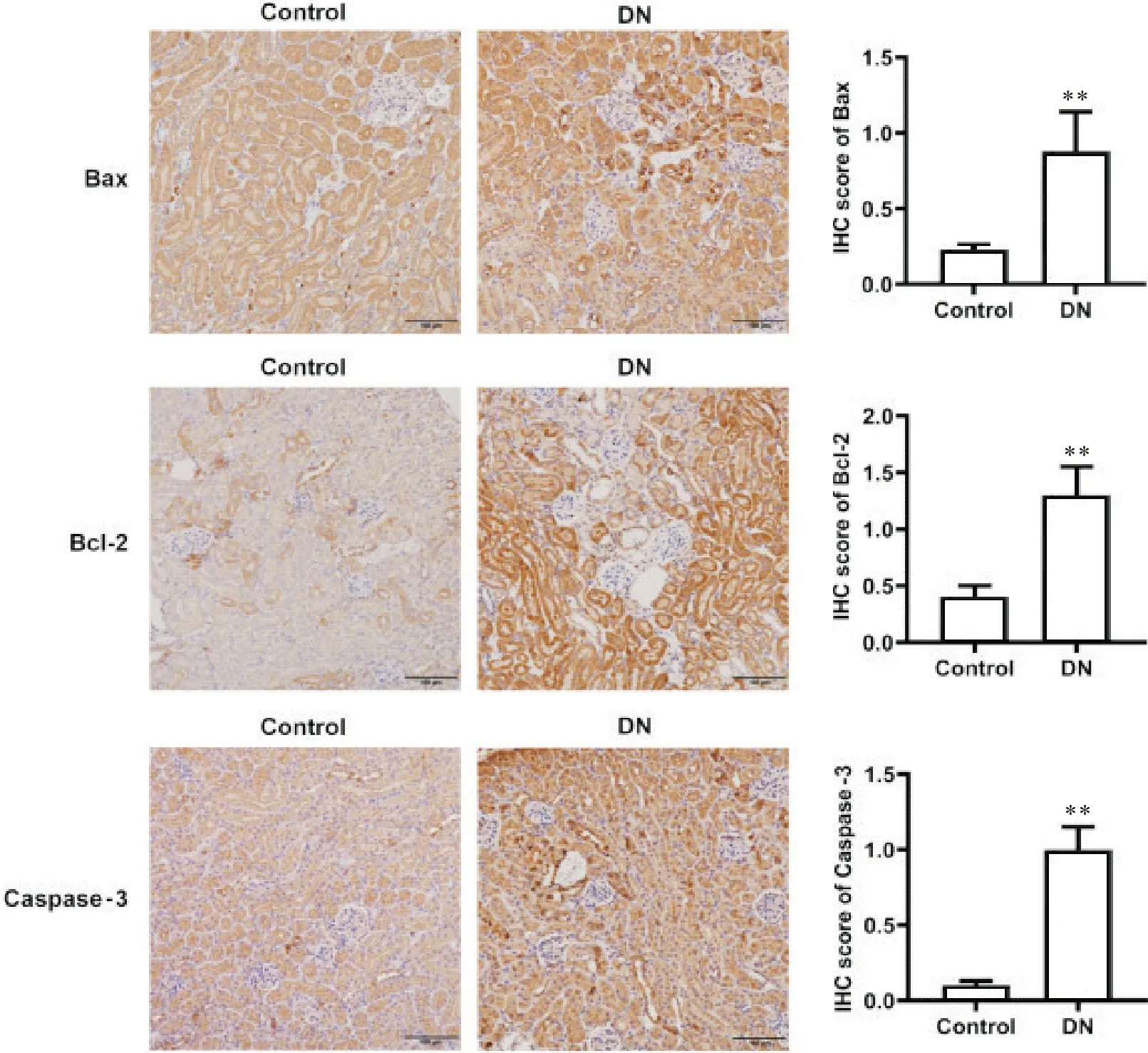
Figure 6. Expression of apoptosis markers in renal tissue of diabetic nephropathy( DN) mice. The expression of Bax, Bcl-2 and cas‐pase-3 in renal tissue detected by immunohistochemical( IHC) staining( scale bar=100 µm). The expression of Bax, Bcl-2 and caspase-3 increased significantly in DN group. The color brown is indicative of positive expression, with increased in‐tensity of staining correlating with heightened expression levels. Mean±SD. n=8. **P<0.01 vs control group.图6 糖尿病肾病小鼠中肾组织细胞凋亡指标的表达情况
5 在高糖诱导HK-2 细胞中,过表达PFN1 促进MCP-1和caspase-3蛋白表达
过表达PFN1后,高糖诱导HK-2 细胞培养72 h,MCP-1和caspase-3蛋白表达上调(P<0.01),见图7。
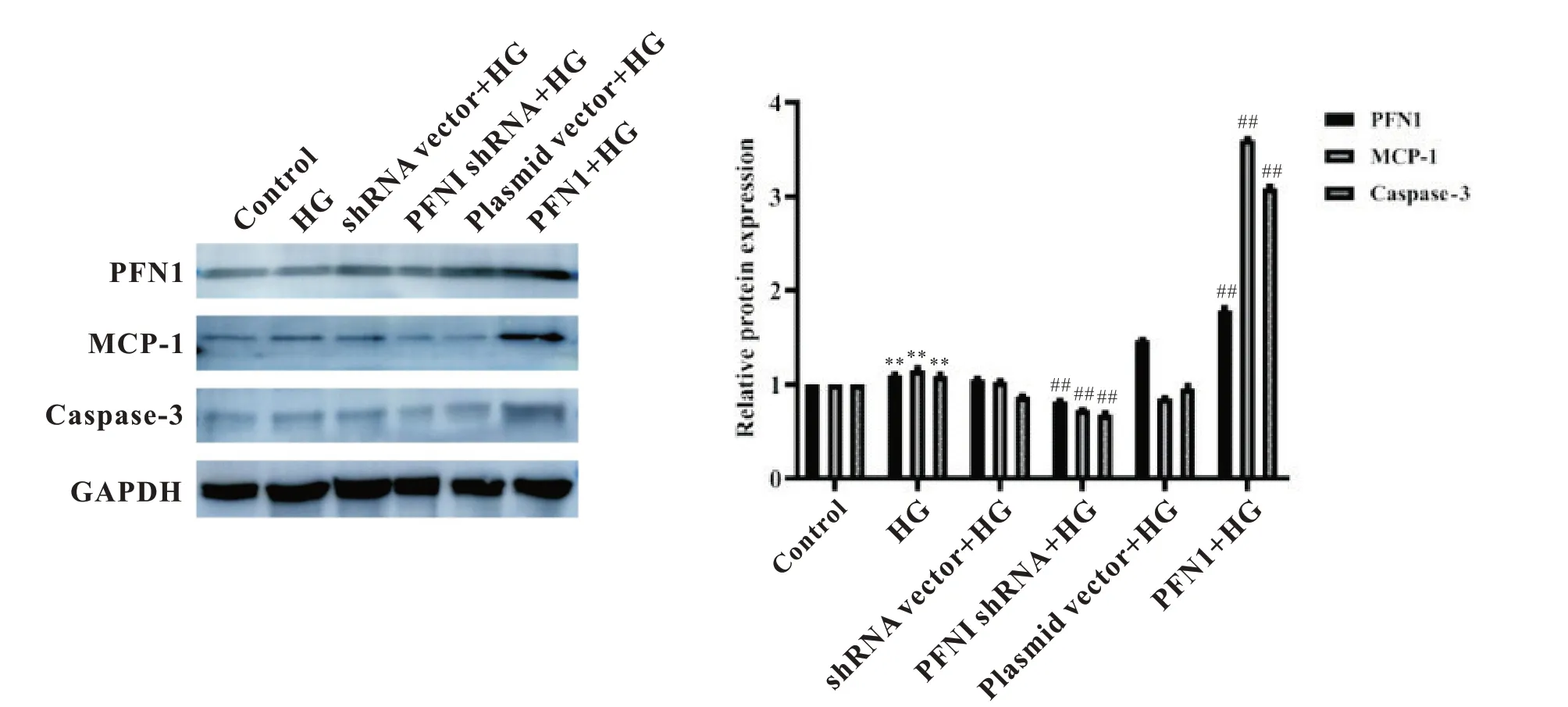
Figure 7. Effects of PFN1 overexpression on the protein expression of MCP-1 and caspase-3 in HK-2 cells induced by high glucose(HG) for 72 h. The protein levels of PFN1, MCP-1 and caspase-3 were assessed by Western blot. Mean±SD. n=3. **P<0.01 vs control group; ##P<0.01 vs HG group.图7 过表达PFN1对高糖诱导HK-2细胞中MCP-1和caspase-3蛋白表达的影响
讨 论
DN 是常见的慢性肾脏疾病,其发病率和死亡率在人群中迅速上升[22-23]。研究表明,DN 的发病机制涉及高血糖、AGEs、肾素-血管紧张素系统、氧化应激等多种代谢和血流动力学因素的相互作用[24-26]。慢性炎症是DN的致病因素之一。
PFN1 作为一种肌动蛋白结合蛋白,其失调已被报道与人类恶性肿瘤、神经系统疾病、内皮功能障碍、心血管等疾病有关。PFN1 通过缺氧诱导因子-1依赖途径介导糖尿病视网膜病变微血管内皮功能障碍,促进细胞凋亡[27]。研究表明:PFN1 在动脉粥样斑块处的表达显著增加,提示其在介导内皮功能障碍中发挥重要作用。而晚期糖基化终产物诱导的心肌细胞肥大以及免疫反应是糖尿病心肌病发病和发展的重要病理基础[9,28]。因此,PFN1 参与血管内皮功能调控,在血管性疾病的发生与发展中起着重要的作用。此外,PFN1 可通过上调整合素α5β1 介导星形孢菌素诱导乳腺癌细胞凋亡[29]。而α5β1 已被报道与肿瘤免疫逃逸有关,这就提示了PFN1可能具有调节免疫微环境的功能[30]。然而,目前关于PFN1与DN的免疫浸润关系的报道较少。
本研究首先利用DN 患者肾组织芯片转录组表达数据分析PFN1的表达水平和免疫细胞浸润情况,结果显示:PFN1基因表达量显著升高且与巨噬细胞和T 细胞有显著的相关性。随后,DN 小鼠实验中可见模型组小鼠的肾脏组织中PFN1表达量显著升高,且CD11b、F4/80、CCR4 和IL-1R1 免疫指标以及Bax、Bcl-2 和caspase-3 凋亡相关蛋白表达升高。最后,细胞实验结果显示PFN1过表达后可促进人肾皮质近曲小管上皮细胞MCP-1和caspase-3蛋白的表达。本研究显示PFN1失调与DN有关,同时提示PFN1的致病机制可能与免疫调节作用有关。
炎症分子和细胞因子间形成的复杂细胞因子网,构成细胞免疫浸润和慢性炎症反应等肾脏继发性病理改变。葡萄糖和代谢产物的积累激活肾脏中巨噬细胞增多;巨噬细胞免疫浸润和高血糖水平、AGEs、血管紧张素-II 和促炎因子诱导肾小管细胞和足细胞产生MCP-1,募集外周单核细胞,引起肾细胞(足细胞、系膜细胞和肾小管上皮细胞等)损伤[31]。MCP-1 可以与细胞表面的CCR2 趋化因子受体相互作用,介导炎症免疫反应[32]。肾小管上皮细胞与巨噬细胞通讯通过细胞外囊泡转移形成负反馈环促进DN 肾脏炎症和细胞凋亡,在DN 的发生和发展和进展中起着重要作用[33]。抑制巨噬细胞活化/转变和巨噬细胞及其他细胞相互作用可能是减弱DN 的方法[34]。此外,TH17 辅助性T 细胞表达CCR4 并分泌细胞因子,如IL-17A 和粒细胞巨噬细胞集落刺激因子。研究表明,Toll 样受体 4(TLR 4)活化可促进DN足细胞损伤和间质纤维化,过表达TLR 4 可能通过激活TH17 细胞参与DN 的免疫发病机制[35]。IL-1R1信号转导已被认为在TH17 细胞分化和自身免疫性疾病发生中的作用[36]。Th17 可能在DN 的进展中发挥独立的作用,或与其他炎症细胞共同作用,促进DN肾脏炎症和细胞凋亡。
而本研究结果显示DN 小鼠肾组织中PFN1表达升高,巨噬细胞和Th17 细胞免疫浸润。高糖诱导HK-2 细胞模型中过表达PFN1可促进MCP-1 和cas‐pase-3 蛋白的表达。综上所述,我们推测DN 小鼠肾组织中PFN1 的表达可能与巨噬细胞和Th17 细胞免疫浸润有关,促进DN 细胞凋亡。后续将继续在整体水平明确PFN1通过免疫调节促进DN 细胞凋亡的作用,并阐明PFN1调控MCP-1和caspase-3蛋白表达的分子机制。
