DCLK1在胃癌干细胞中的作用及机制研究*
2024-04-07王光辉刘辉琦刘永年
张 威, 王光辉, 刘辉琦, 刘永年
(青海大学医学部,青海 西宁 810001)
胃癌是全球最常见的恶性肿瘤之一,是肿瘤相关死亡的第四大原因[1]。即使在手术联合放化疗后,晚期胃癌患者的预后仍然很差[2]。靶向治疗目前在提高抗肿瘤疗效的特异性、显著降低非选择性耐药性和毒性方面已成为研究热点。胃癌干细胞是一类存在于胃癌中少量具有干细胞特性并能诱导分化产生肿瘤谱系异质性的肿瘤细胞[3]。研究提示,GCSCs 与胃癌的侵袭、转移和治疗耐药特性密切相关,在胃癌的复发和转移中发挥着关键性作用[4]。目前,现有的治疗手段无法有效针对胃癌干细胞,是导致胃癌治疗失败、复发和转移的主要原因[5]。因此若能靶向杀灭胃癌干细胞将有望有效治疗胃癌的转移和复发,延长患者生存期,改善预后。
双皮质素样激酶1(doublecortin-like kinase 1,DCLK1)最初是在神经系统中发现的一种蛋白激酶,属于微管相关蛋白的双皮质素家族和蛋白激酶超家族成员,具有调节微管聚合以及促进神经元迁移的功能[6]。DCLK1 在多种肿瘤中过表达,其高表达与肿瘤转移和复发及预后差密切相关[7-8]。重要的是,DCLK1 目前被认为是胰腺癌、结肠癌及胆管癌中特异性表达的肿瘤干细胞标志物[9-11]。在小鼠中,敲除DCLK1表达可降低肠肿瘤的发生,而靶向DCLK1 的治疗可以抑制小鼠体内肿瘤生长,提示DCLK1 可作为潜在的抗肿瘤靶点[12]。DCLK1也被证明是宫颈癌及结肠癌的潜在诊断和治疗靶点[13-14]。然而作为一个重要的肿瘤干细胞标志物及潜在的临床治疗靶点,DCLK1 在胃癌干细胞中的潜在作用知之甚少。本研究初步证明了DCLK1 在胃癌干细胞中的潜在生物学作用及其分子机制,可为胃癌分子靶向治疗的开发和应用提供新的思路。
材料和方法
1 主要试剂
DMEM 培养液、胎牛血清(fetal bovine serum,FBS)和磷酸盐缓冲液(phosphate-buffered saline,PBS)购自武汉普诺赛生命科技有限公司;DMEM/F-12 培养液购自HyClone;无血清添加剂B27 和0.25% EDTA 胰蛋白酶购自Gibco:表皮生长因子(epidermal growth factor, EGF)和碱性成纤维细胞生长因子(ba‐sic fibroblast growth factor, bFGF)购自PeproTech;DCLK1 抑制剂DCLK1-IN-1 购自Selleck;DCLK1、SOX2、OCT4、E-钙黏蛋白(E-cadherin)、波形蛋白(vi‐mentin)、Snail、cyclin D1、c-MYC、ABCG2、TOP2A、mTOR、p-mTOR 和β-actin 抗体均购自Proteintech;AKT、p-AKT、PI3K 和p-PI3K 抗体购自CST;Matrigel和Transwell小室购自Corning。
2 实验方法
2.1 细胞培养 HGC-27 胃癌细胞来自于中国医学科学院肿瘤医院。用含10% FBS的高糖DMEM 培养液,于37 ℃、5% CO2的培养箱中培养,常规换液传代。之后接种入含EGF、bFGF 和B27 的DMEM/F-12的无血清培养液中悬浮培养,于37 ℃、5% CO2培养箱中培养3 d,收获胃癌Sphere细胞用于后续实验。
2.2 总蛋白提取和Western blot 检测 待细胞生长状态良好且密度达到80%~90%左右时,常规处理后收集细胞。加入细胞裂解液提取细胞总蛋白,通过BCA 法测定总蛋白浓度。取蛋白样品进行SDSPAGE,经湿转转至PVDF 膜上,5%脱脂奶粉室温封闭1 h 后,孵育Ⅰ抗4 ℃过夜。次日用TBST 洗膜3次,每次10 min,室温孵育Ⅱ抗1 h,TBST 洗膜后显影,用ImageJ软件分析结果。
2.3 CCK-8 法检测DCLK1 对胃癌干细胞活力的影响 使用DCLK1 抑制剂DCLK1-IN-1 抑制胃癌Sphere细胞中DCLK1活性。将两组细胞悬液以每孔2×103个接种至96 孔板,每组设置3 个平行孔,同时制备4 块相同的96 孔板,置于37 ℃、5% CO2培养箱中培养;取出96 孔板,加入10%的CCK-8 试剂,用酶标仪测定450 nm 处的吸光度(A450)。以后每间隔24 h测定各孔A450值,记为相应时点的细胞活力。
2.4 CCK-8 法检测DCLK1 对胃癌干细胞耐药的影响 使用DCLK1抑制剂DCLK1-IN-1抑制胃癌Sphere细胞中DCLK1活性。将两组细胞悬液以每孔5×103个接种于96 孔板中,每组设3 个平行孔,于37 ℃、5% CO2培养箱中孵育24 h;细胞贴壁后,吸弃孔内培养液,每孔加入200 µL 含0、0.062 5、0.125、0.25、0.5、1、2和4 mg/L 顺铂的完全培养液,每组细胞中每个药物浓度设置3个平行孔,置于37 ℃、5% CO2培养箱中培养;3 d后,用CCK-8法检测A450值,计算IC50值。
2.5 甲基纤维素成球实验检测 DCLK1 对胃癌干细胞自我更新能力的影响 使用DCLK1 抑制剂DCLK1-IN-1 抑制胃癌Sphere 细胞中DCLK1 活性。用无血清培养液重悬胃癌Sphere 细胞,以每孔5×102个接种于低黏附24孔板中,每组设3个平行孔,每孔中提前加入2 mL 含0.8%甲基纤维素的半固态无血清培养基,37 ℃、5% CO2培养箱中培养7~14 d,于倒置显微镜观察各组细胞成球情况。
2.6 划痕愈合实验和Trasnwell 实验检测DCLK1 对胃癌干细胞迁移的影响 (1)划痕愈合实验:使用DCLK1 抑制剂DCLK1-IN-1 抑制胃癌Sphere 细胞中DCLK1 活性。将两组细胞悬液以每孔5×105个接种在6孔板中,每组设3个平行复孔。当细胞生长汇合率达到约80%~90%时,使用移液枪头垂直底面划线,PBS 洗去划下细胞,然后将细胞置于含1% FBS的完全培养液中培养。分别于划线后0、24 和48 h观察细胞划痕愈合程度,即反映细胞迁移能力。(2)Transwell实验:使用DCLK1抑制剂DCLK1-IN-1抑制胃癌Sphere 细胞中DCLK1 活性,常规处理后用无血清培养液重悬胃癌Sphere细胞。取200 µL细胞悬液接种到Transwell 小室上室,每个小室内细胞数为4×104,下室加入650 µL 含10% FBS 的完全培养液。置于37 ℃,5% CO2培养箱培养24 h 后,取出小室,弃去孔中培养液,用4%多聚甲醛固定30 min,0.1%结晶紫染色30 min,干燥后,于显微镜下观察并计数。
2.7 Transwell 实验检测DCLK1 对胃癌干细胞侵袭的影响 使用DCLK1 抑制剂DCLK1-IN-1 抑制胃癌Sphere 细胞中DCLK1 活性,用无血清培养液重悬胃癌Sphere 细胞。Matrigel 以1∶8 稀释并均匀铺于Transwell 小室底部的上室面,置于37 ℃培养箱30 min。将两组细胞悬液以每室4×104接种到小室上室,下室加入650 µL 含10% FBS 的完全培养液。置于37 ℃,5% CO2培养箱培养24 h 后,取出小室,弃去孔中培养液,用4%多聚甲醛固定30 min,0.1%结晶紫染色30 min,干燥后于显微镜下观察并计数。
3 统计学处理
本实验采用GraphPad Prism 9.1 软件进行数据处理和统计分析。实验数据以均数±标准差(mean±SD)表示。对照组和实验组的比较采用独立样本t检验。以P<0.05为差异有统计学意义。
结 果
1 Sphere细胞的培养
经无血清培养液悬浮培养,HGC-27 胃癌亲本细胞成球悬浮生长,形成Sphere细胞球,见图1。

Figure 1. Formation of Sphere cells in serum-free culture( ×40).图1 无血清培养Sphere细胞
2 DCLK1在胃癌干细胞中的表达
Western blot 结果显示,Sphere 细胞中DCLK1 表达明显高于HGC-27亲本细胞(P<0.01),见图2。

Figure 2. The protein expression of DCLK1 in gastric cancer stem cells. Mean±SD. n=3. **P<0.01 vs parent group.图2 胃癌干细胞中DCLK1的表达
3 干性相关蛋白在胃癌干细胞中的表达
Western blot 实验结果显示,Sphere 细胞中干性相关蛋白SOX2和OCT4表达水平显著高于亲本细胞(P<0.01),见图3。这表明DCLK1 可能在维持胃癌干细胞干性特征中发挥重要作用。
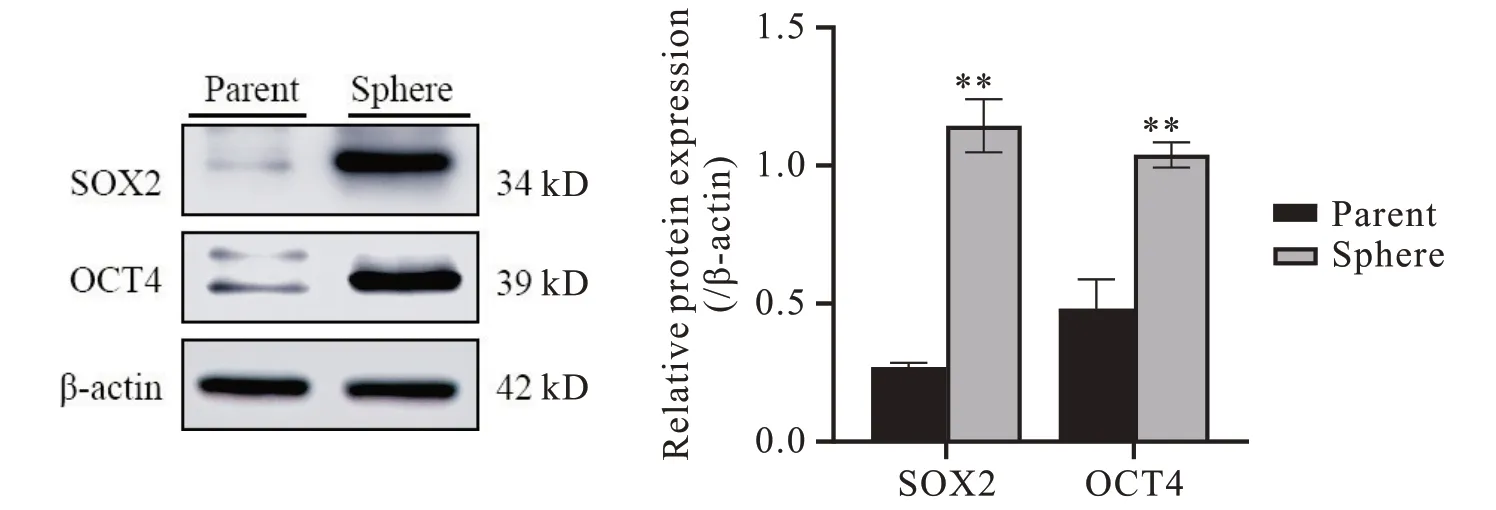
Figure 3. The expression of stemness-related proteins in gastric cancer stem cells. Mean±SD. n=3. **P<0.01 vs parent group.图3 胃癌干细胞中干性相关蛋白的表达
4 抑制DCLK1对胃癌干细胞活力的影响
鉴于DCLK1 在胃癌干细胞中显著高表达,我们用DCLK1 抑制剂DCLK1-IN-1 处理Sphere 细胞抑制DCLK1 活性,以探究DCLK1 对胃癌干细胞的生物学作用。CCK-8细胞活力实验显示,48 h后Sphere组细胞活力显著高于DCLK1 抑制组(P<0.01),见图4A。甲基纤维素成球实验结果显示,Sphere 组与DCLK1抑制组的细胞成球数分别为124.000±3.742 和79.667±2.867,DCLK1 抑制组较Sphere 组自我更新能力更低(P<0.01),见图4B。以上研究表明,抑制DCLK1 可显著降低胃癌干细胞活力和自我更新能力。
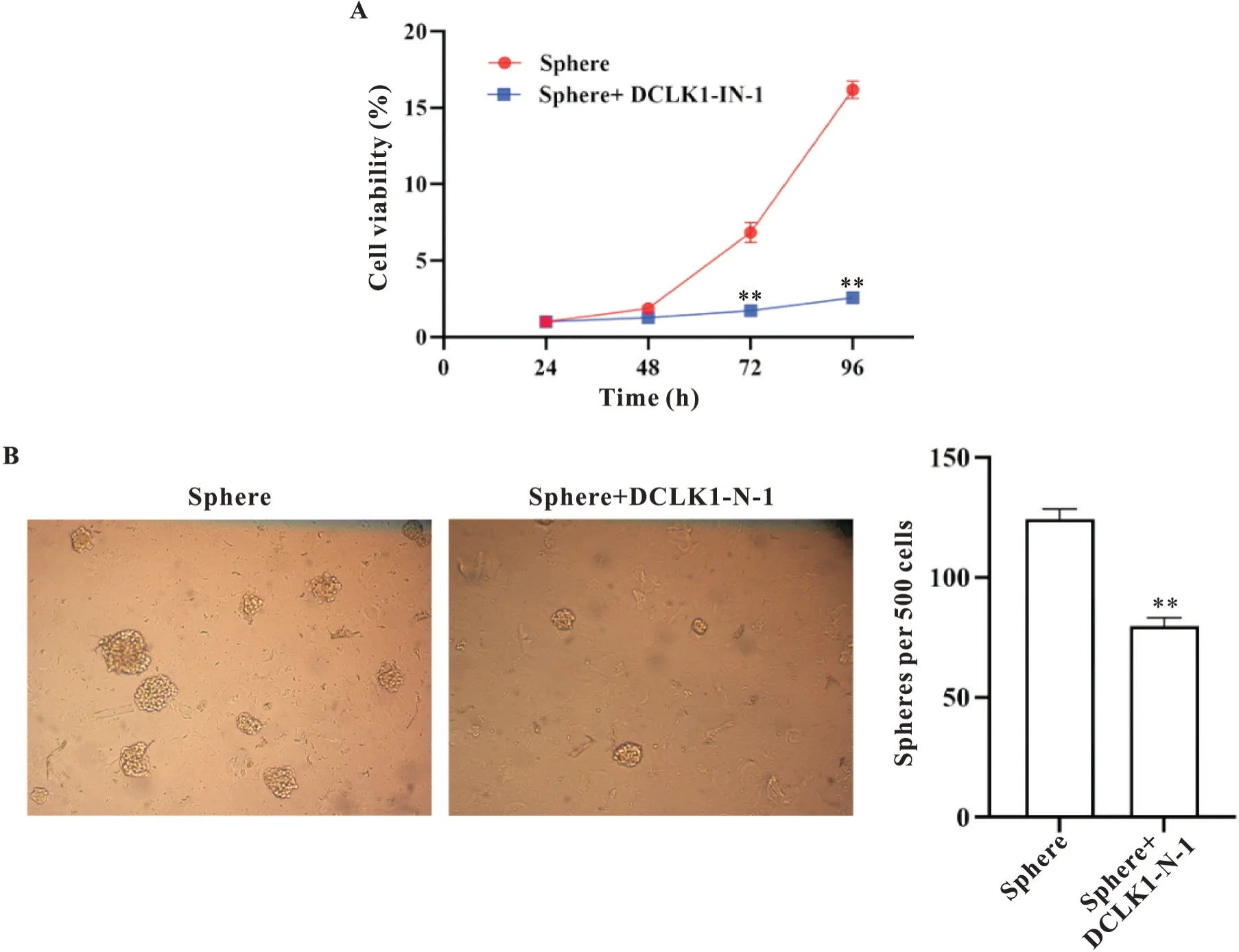
Figure 4. Effect of inhibiting DCLK1 on the viability and self-renewal capacity of Sphere cells. A: the cell viability was detected by CCK-8 assay; B: the self-renewal capacity of the cells was detected by methylcellulose spheroid-forming assay (×40).Mean±SD. n=3. **P<0.01 vs Sphere group.图4 抑制DCLK1对胃癌干细胞活力的影响
5 抑制DCLK1对胃癌干细胞耐药作用的影响
顺铂耐药结果显示,DCLK1 抑制组的IC50值为0.145 mg/L,Sphere 组的IC50值为0.814 mg/L,说明抑制DCLK1后胃癌干细胞耐药性降低,见图5。
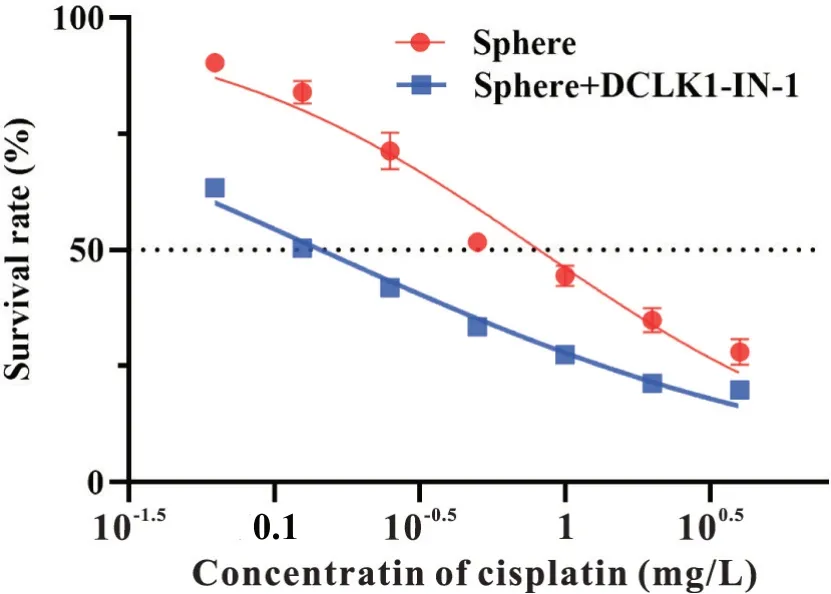
Figure 5. Effect of inhibiting DCLK1 on drug resistance capaci‐ty of gastric cancer stem cells.图5 抑制DCLK1对胃癌干细胞耐药性的影响
6 抑制DCLK1 对胃癌干细胞迁移和侵袭能力的影响
强侵袭能力是胃癌干细胞区别于普通肿瘤细胞的重要特征,我们接着探究了DCLK1 在胃癌干细胞侵袭和迁移中的作用。划痕愈合实验表明,DCLK1抑制组细胞在24和48 h的划痕愈合率分别为3.21%和8.23%,而Sphere 组细胞划痕愈合率为17.33%和27.22%,DCLK1 抑制组划痕愈合率显著低于Sphere组(P<0.01),见图6A。Transwell 迁移实验表明,DCLK1抑制组穿出的细胞数(13.000±1.633)显著少于相应的对照组(140.333±2.055),说明抑制DCLK1可显著抑制胃癌干细胞的迁移能力(P<0.01),见图6B。Transwell 侵袭实验表明,DCLK1 抑制组穿出的细胞数(2.667±0.471)显著少于Sphere 组(116.667±2.867),DCLK1 抑制组侵袭能力低于对照组,见图6C。以上研究表明,抑制DCLK1 可显著抑制胃癌干细胞的迁移和侵袭能力。
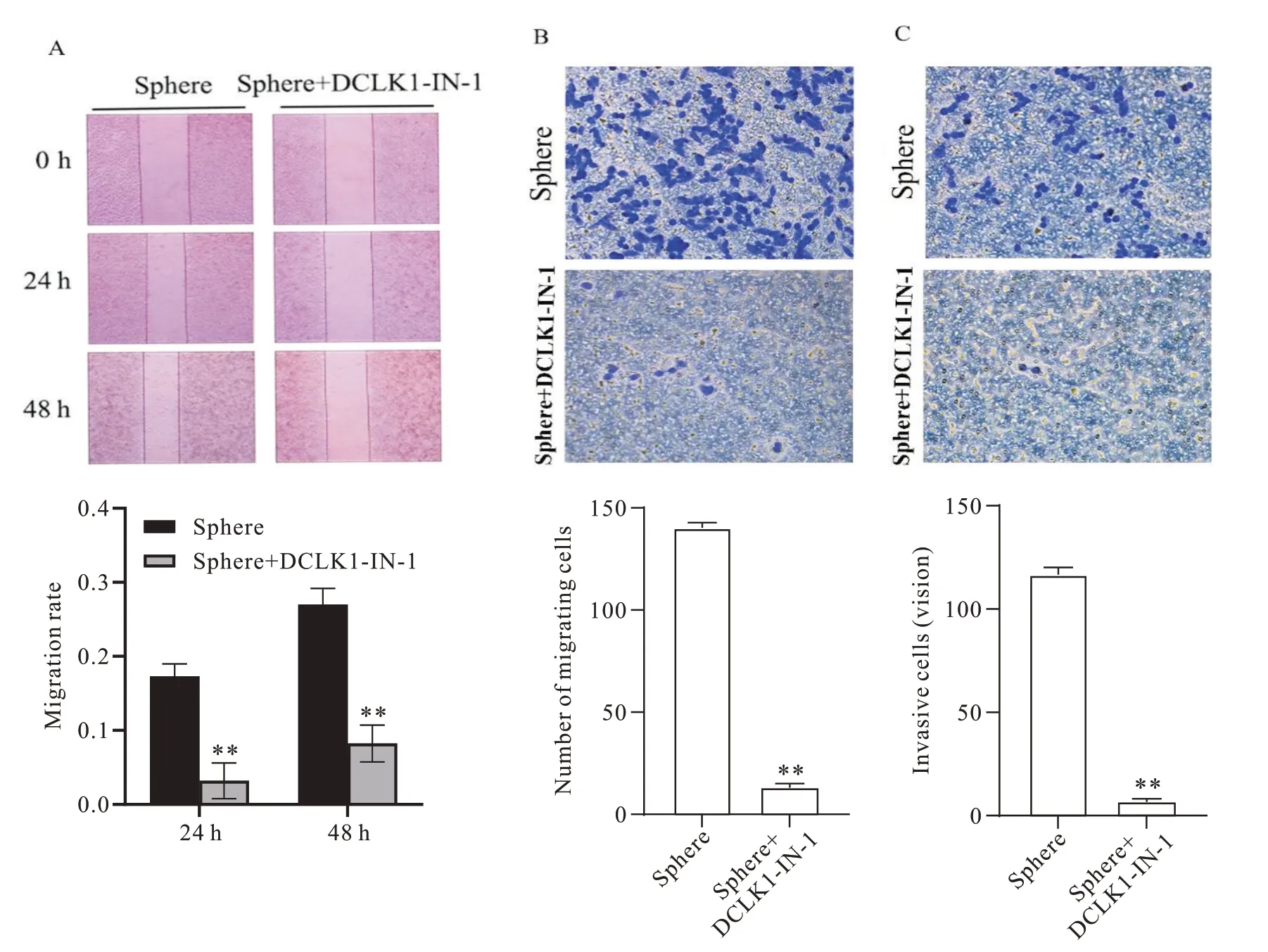
Figure 6. Effect of inhibiting DCLK1 on migration and invasion capacity of Sphere cells. A and B: the effect of inhibiting DCLK1 on the migration of Sphere cells was deteced by wound-healing assay and Transwell assay (×20); C: the effect of inhibiting DCLK1 on the invasion of Sphere cells by Transwell assay( ×20). Mean±SD. n=3. **P<0.01 vs Sphere group.图6 抑制DCLK1对胃癌干细胞迁移和侵袭能力的影响
7 DCLK1对胃癌干细胞作用机制研究
Western blot 结果显示,抑制DCLK1 可显著下调增殖相关蛋白cyclin D1 和c-MYC 的表达(P<0.01),见图7A;抑制DCLK1 可显著下调耐药相关蛋白ABCG2 和TOP2A 的表达(P<0.01),见图7B。上皮-间充质转化(epithelial-mesenchymal transition, EMT)过程与肿瘤细胞侵袭和迁移相关,为了探究DCLK1是否在胃癌干细胞中通过EMT影响细胞的侵袭和迁移能力,我们用Western blot 检测了EMT 相关转录因子。结果表明,抑制DCLK1 显著上调了EMT 过程中上皮标志物E-cadherin蛋白的表达,而降低了间充质标志物vimentin 和Snail 的表达水平(P<0.01),见图7C,表明DCLK1通过调控EMT 过程促进了胃癌干细胞的侵袭和迁移。上述结果表明,DCLK1 通过促进增殖、耐药等相关基因的表达,以及改变EMT相关基因的表达,促进了胃癌干细胞相关生物学行为。

Figure 7. Expression of related mechanism proteins in DCLK1-inhibiting gastric cancer stem cells. A: the expression of proliferationrelated proteins; B: the expression of drug resistance-related proteins; C: the expression of epithelial-mesenchymal transi‐tion-related proteins. Mean±SD. n=3. **P<0.01 vs Sphere group.图7 抑制DCLK1对胃癌干细胞中相关机制蛋白表达的影响
8 DCLK1 在胃癌干细胞中PI3K/AKT/mTOR 信号通路的作用机制
Western blot 实验结果显示,抑制DCLK1 后PI3K/AKT/mTOR 信号通路中相关转录因子总蛋白表达下调,其磷酸化水平降低(P<0.01),见图8。上述结果说明DCLK1 通过PI3K/AKT/mTOR 信号通路的作用机制调控胃癌干细胞增殖、耐药及侵袭迁移等生物学功能。
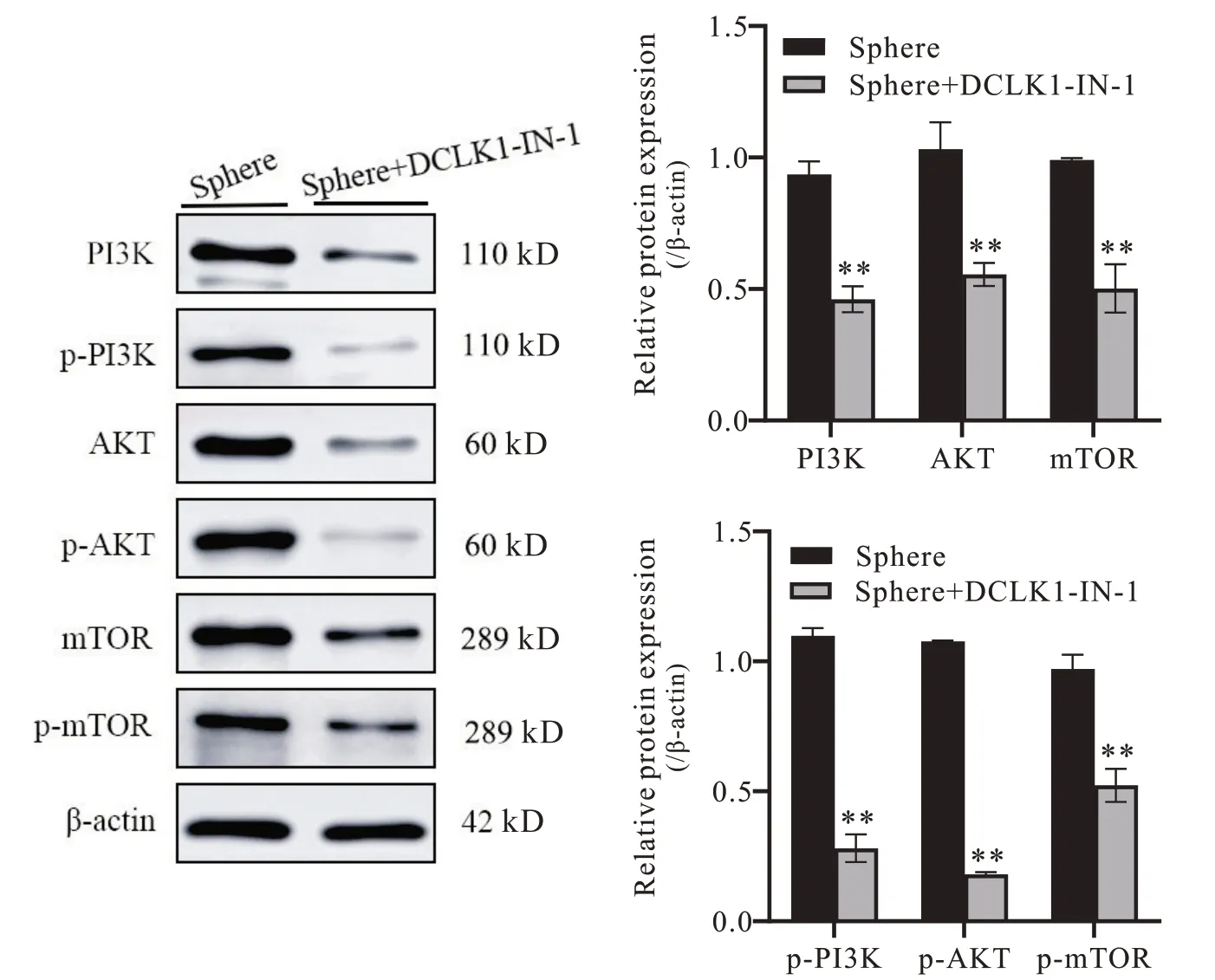
Figure 8. Expression of PI3K/AKT/mTOR signaling pathway-related proteins in DCLK1-inhibiting gastric cancer stem cells. Mean±SD. n=3. **P<0.01 vs Sphere group.图8 抑制DCLK1对胃癌干细胞中PI3K/AKT/mTOR 信号通路相关蛋白表达的影响
讨 论
胃癌是一种全球性重大疾病,每年新发病例超过100 万,是全球第五大常见的恶性肿瘤,也是肿瘤相关死亡的第三大原因[15]。胃癌干细胞是一类存在于胃肿瘤中少量具有干细胞特性,与肿瘤复发、转移和耐药有关的肿瘤细胞,而目前的治疗主要针对胃癌细胞而无法有效杀伤或抑制胃癌干细胞,但干细胞激活后能再次产生胃癌子代细胞导致肿瘤复发。近年来,靶向治疗因其对肿瘤细胞的特异性使其在肿瘤治疗中的地位变得越来越重要。靶向胃癌干细胞的治疗为肿瘤治疗提供了新的研究思路,寻找高特异性治疗的靶点是提高胃癌疗效乃至根治的重要途径。
本研究采用无血清悬浮法培养胃癌干细胞,结果表明HGC-27 胃癌亲本细胞成球悬浮生长,形成Sphere 细胞球,即为本研究细胞模型。肿瘤干细胞在无血清环境下可以持续存活,但肿瘤亲本细胞则因失去相关生长因子的支持而逐渐死亡。存活的肿瘤干细胞持续分裂,成球生长而形成紧密的Sphere细胞球。研究显示无血清培养液悬浮培养的Sphere细胞球在多种肿瘤培养液中显示出更强的致瘤、耐药和侵袭等干细胞特性,因而无血清培养液培养肿瘤Sphere 细胞球成为目前肿瘤干细胞研究的细胞模型[16-17]。
肿瘤干细胞标志物DCLK1 已被证实在胃癌及多种肿瘤中表达上调,是胃肠道肿瘤独立的预后因素,并促进肿瘤细胞干性形成[18-21]。本研究显示DCLK1 在胃癌Sphere 细胞中表达显著高于HGC-27亲本细胞。紧接着我们对Sphere 细胞进行了相关干性转录因子SOX2 和OCT4 的表达检测,发现其表达量显著高于亲本细胞,表明DCLK1 可能在维持胃癌干细胞干性特征方面发挥一定作用。在结肠癌体内外研究中,抑制DCLK1 活性后,其肿瘤细胞自我更新能力及肿瘤增殖能力显著降低,有效减弱了肿瘤细胞干性[22]。本研究中使用DCLK1 抑制剂DCLK1-IN-1 处理Sphere 细胞后,其增殖、耐药、自我更新及体外迁移和侵袭能力均显著降低,表明DCLK1 可能参与了胃癌干细胞的增殖、耐药、自我更新及迁移和侵袭,其在维持胃癌干细胞干性特征方面发挥重要作用。
快速增殖是恶性肿瘤的重要生物学特性。c-MYC 是一种多效转录因子,可调节细胞增殖、分化、细胞周期、代谢和凋亡。c-MYC 在70%的人类肿瘤的启动和维持过程中都异常表达,可作为肿瘤起始和维持的驱动因素。体内研究表明,抑制c-MYC 具有显著的抗增殖作用和持续的肿瘤消退作用[23-24]。cyclin D1 是另一种常用的细胞增殖蛋白生物标志物,通过调节细胞周期转换在肿瘤的发生和发展中起关键作用。我们研究发现在抑制DCLK1 活性的胃癌干细胞中c-MYC 和cyclin D1 表达显著降低,提示DCLK1 可能通过激活c-MYC 及cyclin D1 等细胞增殖相关蛋白促进胃癌干细胞的增殖。
肿瘤细胞的多药耐药(multidrug resistance,MDR)是指肿瘤细胞对多种结构和功能不同的抗肿瘤药物产生耐药性。这一现象已成为肿瘤化疗的一大障碍,严重影响临床疗效。MDR 与细胞药物外流增加有关,这种机制涉及ATP 结合盒(ATP-binding cassette, ABC)转运体,主要是P-糖蛋白(ABCB1)、MDR 相关蛋白1(ABCC1)和乳腺癌耐药蛋白(ABCG2)。ABCG2 介导MDR,且ABCG2 蛋白自被发现以来一直是深入研究的主题,其过表达已在多种类型的肿瘤耐药细胞系中被检测到[25]。而TOP2A是一种关键的肿瘤促进基因,参与多种类型的肿瘤,与肿瘤生长、转移、复发和化疗耐药密切相关[26]。靶向TOP2A与其他治疗药物联合使用可显著抑制肿瘤生长且增强患者对治疗的反应,减少化学耐药性的发展[26-27]。本研究中抑制DCLK1 活性显著下调TOP2A 和ABCG2 表达,提示DCLK1 可能 通过调控TOP2A 和ABCG2 参与胃癌细胞耐药特性形成。此外,现有数据表明ABCG2 在多种肿瘤细胞中表达,在促进干细胞增殖和维持干细胞表型方面起着重要作用,在干细胞和肿瘤治疗中具有应用价值,可能是一种潜在的肿瘤干细胞标志物[28]。
EMT 是细胞表型在上皮细胞和间充质细胞之间互相转化的过程。通过EMT 过程,细胞失去其上皮特征,如顶端-基底细胞极性和细胞-细胞接触,并获得间充质特性,包括细胞迁移、侵袭和抗凋亡等。越来越多的研究表明,EMT 与肿瘤干细胞特征密切相关,在肿瘤的发生、侵袭转移和治疗耐药性中起重要作用。研究表明,DCLK1的敲除可以抑制不同肿瘤背景下肿瘤细胞的体外迁移和侵袭,并抑制体内肿瘤生长,在食管鳞癌中已被证明其可通过抑制EMT进程影响其肿瘤细胞的迁移和侵袭[29-31]。在本研究中,抑制DCLK1 活性后,EMT 过程中的上皮标志物E-cadherin蛋白的表达显著上调,而间充质标志物vi‐mentin 和Snail 的表达水平则明显下调。因此,我们推测DCLK1通过调控EMT过程中E-cadherin、vimen‐tin 和Snail 等蛋白的表达促进了胃癌干细胞的侵袭和迁移。
恶性肿瘤的发生和发展是多种信号转导途径相互作用的结果。PI3K/AKT/mTOR 信号转导通路在许多肿瘤发生过程中异常激活,参与调节肿瘤细胞的存活、增殖、凋亡、自噬、化疗耐药、侵袭迁移和葡萄糖代谢等多个生物学过程[32-34]。AKT 可通过GSK-3和FoxOs 作用于cyclin D1 和c-MYC,介导细胞增殖和细胞周期[35]。在急性髓系白血病和急性淋巴细胞白血病中,PI3K 激活上调了ABCG2 的表达,并增加了肿瘤干细胞的百分比[36]。同时PI3K/Akt/mTOR 信号通路的激活会导致EMT 相关标志物表达上调,而抑制其活性可使EMT过程发生逆转并降低肿瘤干细胞标志物的表达[37-38]。本研究中抑制DCLK1 后PI3K/AKT/mTOR 通路蛋白及其磷酸化蛋白表达下调,表明DCLK1通过调控PI3K/AKT/mTOR 信号通路作用于胃癌干细胞增殖、耐药及侵袭迁移等相关生物学功能。
综上所述,胃癌干细胞中DCLK1 表达上调,并通过作用于PI3K/AKT/mTOR 信号通路促进增殖、耐药、EMT 等相关基因的表达而促进了胃癌干细胞相关生物学特性,提示DCLK1 在胃癌干细胞中发挥着重要的生物学作用,可能作为靶向胃癌干细胞治疗的潜在靶点。
