基于PI荧光图像计数的乳制品荧光性质分析
2024-04-03李蒙蒙陈翔宇徐娟林丽军陆利霞刘元建熊晓辉
李蒙蒙,陈翔宇,徐娟,林丽军,陆利霞,刘元建,熊晓辉
(南京工业大学食品与轻工学院,江苏南京 211816)
现有微生物数量检测技术众多,其中国内外标准方法为平板计数法,但步骤多且耗时长,往往需要2~5 d 才得到结果[1,2]。流式细胞分析法[3,4]、ATP生物发光法[5,6]、电导阻抗法[7-9]、电发光法[10]等新型微生物计数方法成本较高,且需要人员有较高的专业技能。微生物图像计数也成为快速检测微生物数量的一种方法[11]。使用图像对微生物进行计数时需要使用计数板等载体,由于计数板的计数室容积较小,样品检测通量小,这导致图像计数可检测的微生物浓度范围也较小,但是与其他计数方法相比,图像计数不需要复杂的仪器设备,操作简单、无需培养,简化了实验过程并缩短了检测时间[12,13]。
荧光染料对微生物进行处理后,采用图像计数可以实现对活菌和死菌的分别计数[14]。常用的染色菌体的荧光染料有异硫氰酸荧光素(Fluorescein Isothiocyanate,FITC)、绿色荧光核酸染色剂(SYTO 9 Green Fluorescent Nucleic Acid Stain,SYTO 9)、碘化丙啶(Propidium Iodide,PI)等。PI-DNA 复合物的激发与发射波长分别为530 nm 和615 nm。PI 可以进入细胞膜被破坏的细胞内并与细胞的DNA 结合[15],使用PI 时先染色样品中死菌数,而后将样品进行灭活处理,染色后得到样品中的总菌数,将总菌数减去死菌数得到活菌数量。从而达到PI 染料计数样品中活菌效果[14,16,17]。
Mahmoud 等[13]使用荧光图像法对屠宰环境和屠宰设备中的细菌进行计数,以此来评估在屠宰过程中细菌污染风险。Brown 等[18]在检测活性污泥中的细菌总数时使用荧光图像计数,经过统计分析后将其与流式细胞仪的计数结果进行比较,结果表明两种检测方法结果具有一致性。由于在环境样品如海水、污泥中大多数的微生物不可培养,基于显微镜检验荧光图像计数方法成为了环境样品微生物检测的选择方法。Min 等[19]为提高定量荧光显微镜测定结果的准确性,用Percoll 浮力密度梯度离心法从复杂的非乳制品基质中分离细菌以此来减少食物基质的高背景荧光,使用Baclight 染色试剂盒对死活菌分别染色后,通过荧光图像计数定量分析活性长双歧杆菌ATCC 15707。但在使用荧光图像计数食品中的微生物时,由于食品成分的复杂性,其中食物基质存在的荧光干扰有待研究。
牛乳中的蛋白质、维生素A、维生素B1、维生素B2、维生素C、芳香族氨基酸、美拉德反应产物、还原型烟酰胺腺嘌呤二核苷酸、卟啉、叶绿素和脂质氧化产物等物质在激发光250~450 nm,发射光328~700 nm 均具有荧光特性[20-23]。除此之外,乳制品中常用的防腐剂山梨酸钾、增稠剂卡拉胶等也存在荧光[24]。乳制品荧光是其中的荧光成分共同作用的结果,在使用荧光图像计数乳制品中微生物的过程中,乳制品成分在观察微生物荧光染色条件下是否也存在荧光特性及其是否会对微生物的计数造成干扰未见报道,且乳制品中成分与PI 染料是否相互作用产生荧光也需试验研究。
比较是否添加PI 染料时市售不同乳制品及其成分的荧光,并利用显微镜观察荧光图像,进而以不同浓度酿酒酵母的乳制品样品与PI 进行染色,获取荧光图像并计数,比较图像计数结果与平板计数结果,分析乳制品及其成分对PI 荧光图像计数的影响,旨在为利用荧光图像计数乳制品中微生物提供实验依据。
1 材料与方法
1.1 材料与试剂
酿酒酵母ATCC9080,本实验室保藏菌株;0.01 mol/L 磷酸盐缓冲液(Phosphate Buffered Saline,PBS,pH 值 7,pH 值 7.8),上海生工生物工程有限公司;酵母膏胨葡萄糖液体培养基(Yeast Extract Peptone Dextrose Medium,YPD)、马铃薯葡萄糖琼脂培养基(Potato Dextrose Agar,PDA),青岛海博生物技术有限公司;吐温20,国药集团化学试剂有限公司;异丙醇,西陇化工股份有限公司;碘化丙啶,德国Sigma 公司。
乳品中几种常见成分的对照品:维生素B1、维生素B2和维生素C药片剂,湖北华中药业有限公司;酪蛋白,北京索莱宝科技有限公司;黄油,恒天然商贸(上海)有限公司。
根据产品加工工艺以及食品安全标准中微生物限量要求选择10 种不同的乳制品样品:样品a 为巴氏杀菌乳产品;样品b、c 为全脂灭菌乳产品;样品d为脱脂灭菌乳产品;样品e、f、g 为全脂调制乳产品;样品h 为部分脱脂调制乳产品(减脂65%/100 mL);样品i、j 为配制型乳饮料产品(其中样品i 中添加了全脂牛乳粉、食品用香精以及卡拉胶、瓜尔胶等食品添加剂;样品j 中添加了生牛乳、椰果、全脂乳粉、食品用香精和阿斯巴甜等食品添加剂。)
1.2 仪器与设备
自制微型计数板,聚甲基丙烯酸甲酯制作,计数室规格24.00 mm×4.15 mm×0.10 mm;T25均质机,德国IKA 公司;SHP-100 智能生化培养箱,上海三发科学仪器有限公司;F-4700 荧光分光光度计,日立科学仪器(北京)有限公司;Olympus-IX73-DP80倒置荧光显微镜,日本Olympus 公司。
1.3 样品制备
1.3.1 酿酒酵母的培养及死菌液的制备
从保存的平板中挑取酿酒酵母单菌落接种于100 mL YPD 液体培养基中,在30 ℃,160 r/min 下培养15 h,得到酿酒酵母培养液。
取一定量酿酒酵母培养液在1 500 r/min 下离心5 min,去除上清液,菌泥用同体积无菌PBS 重悬,得到酿酒酵母菌悬液,同条件下离心5 min,去除上清液,用体积分数70%的异丙醇进行重悬,处理30 min,同条件再次离心5 min,去除上清液,菌泥用同体积的无菌PBS 重悬,得到酿酒酵母死菌悬液[14,25],并将其使用PBS 进行稀释,得到稀释10 倍、30 倍酵母菌菌悬液备用。荧光图像计数中提到的酿酒酵母均指死菌样品。
1.3.2 乳制品成分荧光强度测定样品制备
根据各个成分在乳制品中以及《中国食物成分表》[26]中记录的其他食品中的含量确定浓度范围。以PBS(pH 值7.8)超声溶解配制5、10、15、20、25 mg/mL 的酪蛋白溶液,并以PBS(pH 值7.8)为空白对照;以0.2%吐温20 水溶液超声均质溶解配制10、20、30、40、46 mg/mL 的黄油溶液[27],并以0.2% 吐温20 水溶液做空白对照;以超纯水超声溶解配制0.000 1、0.000 3、0.015、0.03、0.045、0.06、0.075 mg/mL 的维生素B1 溶液;以超纯水超声溶解配制0.000 1、0.001 4、0.000 3、0.015、0.03、0.045、0.06、0.075 mg/mL 的维生素B2 溶液;以超纯水超声溶解配制0.01、2、4、6、8、10 mg/mL的维生素C 溶液,三种维生素样品均以超纯水为空白对照。分别对五种乳制品成分进行荧光强度测定。
1.3.3 乳制品及其添加PI染色样本的荧光强度测定及荧光显微镜观察
取乳制品样品原液5 mL于离心管中设为原液组;取500 μL 质量浓度20 μg/mL 的PI 染液加入1.5 mL乳制品样品原液于离心管中,涡旋混匀,设为PI 染色样品组。同时测定原液组及PI 染色样品组的荧光强度,并使用荧光显微镜观察其荧光情况。
1.3.4 乳制品中不同浓度酿酒酵母PI染色样品的制备
依据文献报道[28], 在菌液质量浓度为105~107CFU/mL 时,图像计数结果是准确的。10种乳制品各取1.3 mL,随机添加200 μL 制备好的原液、稀释10 倍以及30 倍的酿酒酵母死菌液以及500 μL 质量浓度20 μg/mL 的PI 染液,设为PI 染色酿酒酵母细胞组,用于在PI染色观察获取图像并计数。
1.4 试验方法
1.4.1 乳制品及成分荧光强度测定
在激发光530 nm,使用分光光度计对其进行550~800 nm 波段的波长扫描,并观察不同样品在615 nm 处的荧光强度,对1.3.2、1.3.3 样品组进行荧光强度测定,每组样品做三个平行,取平均值(M)±标准差(SD)表示。其中分光光度计参数为:狭缝宽度5 nm,电压750 V,扫描速度2 400 nm/min。
1.4.2 荧光显微镜观察乳制品荧光
将制备的每种乳制品的原液组与PI 染色样品组滴加在自制微型计数板的计数室中,在荧光显微镜40 倍物镜,绿光激发片下观察其荧光情况。
1.4.3 平板计数酵母菌
平板计数方法按GB 4789.15-2016《食品安全国家标准食品微生物学检验霉菌和酵母计数》[29]所规定的操作执行对酿酒酵母进行计数。
1.4.4 荧光图像计数乳制品酵母菌
参考Atanasova 等[30]的荧光图像计数方法,将制备好的每种乳制品PI 染色酿酒酵母细胞组实验样品滴加在自制微型计数板的计数室中,在荧光显微镜下观察并获取荧光图像,每组样品做三个平行,实验使用绿光激发片,物镜选择40 倍镜。将获取的图像使用Image J 图像处理软件进行计数酵母菌[31],计算图像菌体数量的平均值、中位数以及标准差[32],根据图像中菌体的数量、荧光显微镜的参数计算得出酿酒酵母菌的浓度。计算如公式(1)。
式中:
N——图像计数结果,酿酒酵母活菌的浓度,个/mL;
yi——单个图像中菌体的数量,个;
n——计数图像的数量,个;
h——计数室的深度,本研究中为0.10 mm;
p——美兰染色后在显微镜下观察计算得出活菌数占总菌数的比例;
0.091——荧光显微镜40 倍物镜下单个视野面积,mm2;
10-3——µL 换算为mL 的系数。
1.4.5 数据处理与统计分析
使用Microsoft OfficeExcel 2021 软件进行数据分析,利用Origin 2018 软件进行分析与作图,利用IBM SPSS Statistics 26 软件对每种乳制品样品的三组平行数据进行平均值、标准差以及变异系数分析。
2 结果与分析
2.1 乳制品中不同成分的荧光光谱分析
酪蛋白、维生素是已报道的乳制品中的荧光成分[20],在不同类型乳制品中其含量各不相同。在本实验选择的10 种乳制品中,根据其营养成分表得到蛋白质含量范围在1.0~3.2 g/100.0 mL。乳品蛋白质中79.6%为酪蛋白,即酪蛋白最高质量浓度为25 mg/mL;乳品脂肪含量范围在0~4.6 g/100 mL,即脂肪最高质量浓度为46 mg/mL。牛乳中的维生素含量受原料和季节的影响,《中国食物成分表》[26]中记录牛乳中维生素B1、维生素B2、维生素C 的含量分别为0.000 3、0.001 4、0.01 mg/mL。
选取酪蛋白、黄油、维生素B1、维生素B2、维生素C 五种乳制品成分,探究其不同质量浓度在530 nm 激发光下,550~800 nm 发射波长范围内的荧光,所得荧光光谱如图1 所示。图1 结果表明,五种乳制品成分在550~800 nm 的波长范围内均有荧光产生。乳脂肪本身并没有荧光特性,但是黄油中的生育酚、色素等物质均能发出较强的荧光[33]。牛奶是白色液体,而牛奶中提取的黄油却呈淡黄色,正是因为黄油中含有胡萝卜素,胡萝卜素来源于奶牛食用的牧草中,因此黄油中胡萝卜素的含量根据奶牛食用的食物种类与季节有所不同。


图1 不同质量浓度乳制品成分荧光光谱Fig.1 Fluorescence spectra of different concentrations of dairy ingredients
2.2 乳制品不同成分的荧光强度测定结果
不同质量浓度各个成分在615 nm 发射光处的荧光强度如图2 所示。从图2 可以看出,在实验质量浓度范围内,五种乳制品成分的质量浓度与615 nm 发射光处荧光强度呈现一定的相关性,因此若乳制品成分在实验的最高质量浓度对微生物PI 染色观察无干扰,则低质量浓度也不会造成干扰。实验所用维生素对照品为药用片剂,除了相应的维生素成分外,还含有少量淀粉,会对样品的荧光强度造成一定的影响。
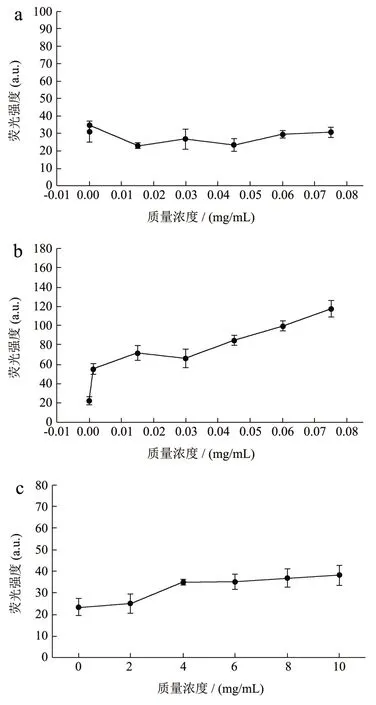
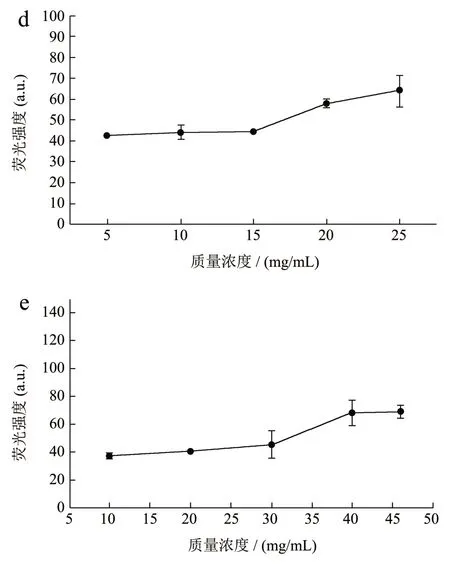
图2 不同质量浓度乳制品成分在615 nm 处的荧光强度Fig.2 Fluorescence intensity of different concentrations of dairy components at emission wavelength of 615 nm (n=3)
酪蛋白、黄油在乳制品的质量浓度范围内的最高质量浓度,以及牛乳中三种维生素的浓度,在615 nm 发射光处的荧光强度结果如表1 所示。从表1 可以看出,在PI 染色观察所需的激发光和发射光条件下,各乳制品成分均有荧光产生,其中黄油产生的荧光强度最高为68.72,其次是酪蛋白为63.96,维生素C 的荧光强度最低为23.46。结果表明,五种乳制品成分在本实验观察所需的激发与发射波长条件下均有荧光产生。

表1 乳制品中不同成分质量浓度的荧光强度Table 1 Fluorescence intensity of different component concentrations in dairy products
2.3 乳制品荧光强度测定结果
乳制品成分复杂,单一成分的荧光特性并不能完全代表乳制品本身的荧光特性,乳制品的荧光特性是其中多种成分相互作用的结果,故需对乳制品本身在530 nm 激发光,615 nm 发射光下是否存在荧光特性进行分析,以进一步探究其是否会对荧光图像计数乳制品中的微生物产生影响。
对10 种乳制品原液组与PI 染色样品组在530 nm激发光,615 nm 发射光处进行荧光强度的测定,结果如表2 所示。在530 nm 激发光激发下,不同种类的乳制品均有荧光产生,PI 染色样品组荧光强度比原液组的荧光强度均有增加,其中样品a 增加了21.71~23.88,增加最多,样品b 增加了0.86~3.94,增加最少,原液组的荧光强度范围在60.25~125.64,PI 染色样品组的荧光强度范围在73.48~128.70,表明乳制品在530 nm 激发光下也有荧光产生。

表2 添加PI染色对不同乳制品荧光强度的影响Table 2 Effect of adding PI dye on the fluorescence intensity of different dairy products
比较表1 与表2 可以看出,同一激发与发射光条件下,乳制品的荧光强度比乳中单一成分对应质量浓度荧光强度高,这是因乳制品中多种成分的荧光特性相互作用,以及成分质量浓度差异导致。
2.4 乳制品荧光显微镜观察结果
将原液组与PI 染色样品组在荧光显微镜下(40倍物镜)进行观察,反复观察视野中未见乳制品样品中荧光现象,说明乳制品原液及PI 染色后不存在可观察的荧光颗粒。对于样品f 与样品h 中的碳酸钙以及样品i 添加的椰果,在视野中也未出现荧光,表明其均不能被PI 染色,从而不会对乳制品中微生物采用PI 染色时造成干扰。Gunasekera 等[34]在使用流式细胞术检测添加到超高温瞬时杀菌牛奶中的大肠杆菌和金黄色葡萄球菌时,在双变量点阵图的分选区域中,目标菌并没有出现明显的分离,从而提出荧光染色剂SYTO BC 与PI 可以染色牛奶中的蛋白质和脂肪球,干扰细菌的检测。本研究的10 种乳制品中未观察到PI 染料对蛋白质、脂肪球染色产生荧光现象。
2.5 乳制品中酿酒酵母观察图像
在10 种乳制品中随机选择添加制备好的原液、稀释10 倍以及稀释30 倍的酿酒酵母,并对酿酒酵母进行计数。其中样品e、f、i 中添加的是稀释30倍的酿酒酵母菌悬液,样品b、c、d 中添加的是稀释10 倍酿酒酵母菌悬液,样品a、g、h、j 中添加的是酿酒酵母菌悬液原液。荧光显微镜对样品可见光观察与荧光观察局部图像如图2、3 所示,其中PBS 中添加的是稀释10 倍酿酒酵母菌悬液。不同的样品观察图像颜色存在差异,除了PBS 与样品b、c、d 图像颜色较浅外,其余样品图像颜色均较深,这是由于使用可见光观察时,为了能够清晰地看到酿酒酵母菌体,调节了显示亮度以及图像的色调。
从图3、4 可以看出,PBS 及10 种样品中荧光下观察到的酿酒酵母与可见光下观察到的酿酒酵母可一一对应,如图3b~3i 红圈中与图4b~4i 红圈中酿酒酵母对应。图3 中,样品f 与样品h 的可见光图像中可以看到许多颜色较深的颗粒。由于样品f与样品h 中添加的碳酸钙,导致产生了沉淀[35]。样品i 的图像中有许多小点,为该乳制品中添加的椰果碎颗粒。从图4 可以看出,酿酒酵母浓度越高,单个视野中菌体数量越多,浓度较低的酿酒酵母在视野中菌体数量少。酿酒酵母荧光图像获取应在1 min 内完成,以防出现荧光淬灭,影响计数结果。

图3 PBS 及10 种乳制品样品中不同浓度酿酒酵母可见光图像Fig.3 Visible images of different concentrations of S. cerevisiae in PBS and ten dairy products

图4 PBS 及10 种乳制品中不同浓度酿酒酵母荧光图像Fig.4 Fluorescence images of different concentrations of S. cerevisiae by PI dye in PBS and ten dairy products
2.6 乳制品荧光图像计数酿酒酵母结果
本课题组已对图像计数统计参数的分析表明[28],以酿酒酵母为分析对象时,其浓度为106~107CFU/mL 时需统计图像数量至少为13 个,浓度为105CFU/mL 时需统计图像数量至少为50 个,且可以平均数和中位数可作为图像计数统计分析的参数。
本实验中,酿酒酵母菌液浓度为105CFU/mL时拍摄60 张荧光显微镜图像,酿酒酵母菌液浓度为106CFU/mL 与107CFU/mL 时拍摄30 张图像,每个样品做三组平行。计数每组图像菌体数量并根据公式(1)计算酿酒酵母浓度,菌液浓度用三组浓度的平均值(M)±标准差(SD)表示,结果如表3 所示。其中酿酒酵母菌液中活菌数占总菌数的98.64%。
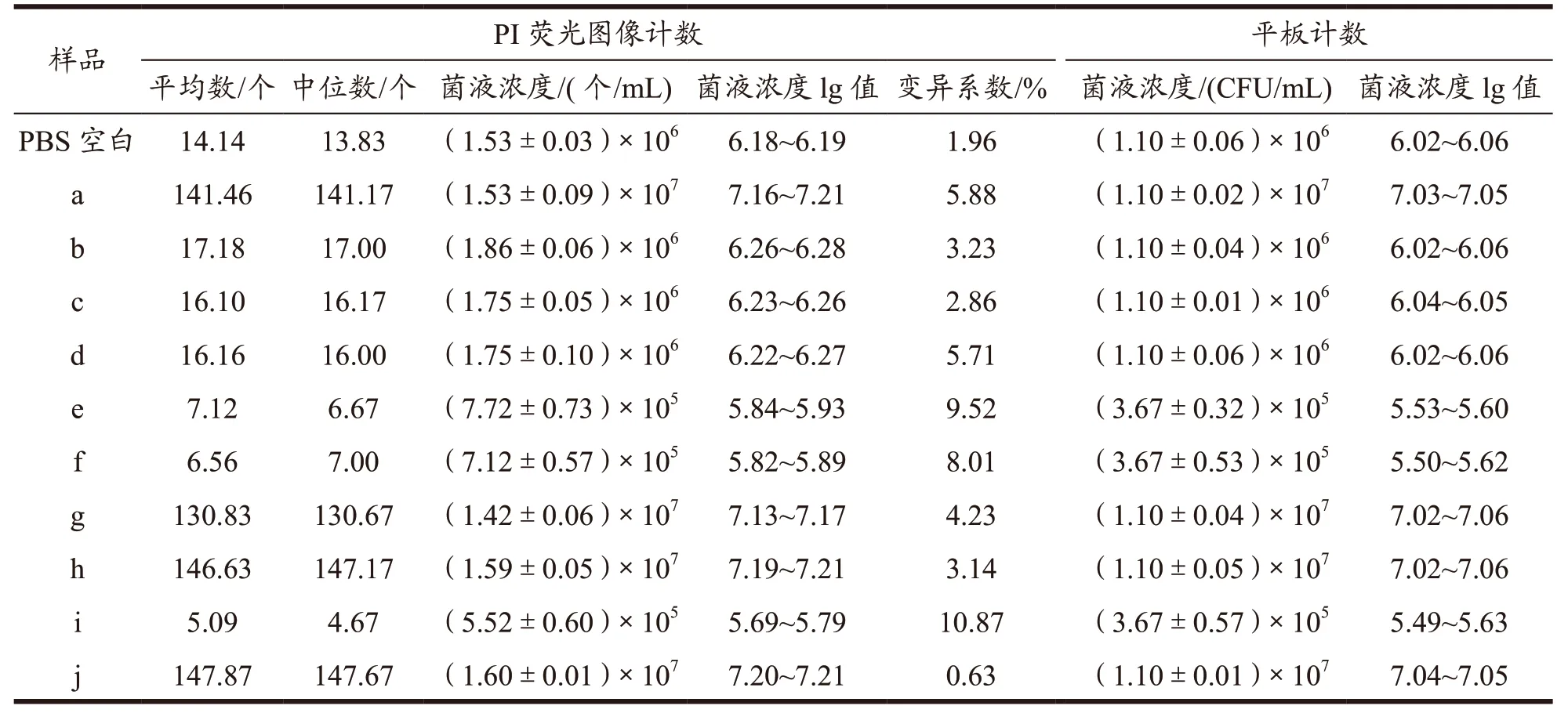
表3 PI荧光图像计数与平板计数不同浓度酿酒酵母结果Table 3 Results of different concentrations of S. cerevisiae by PI fluorescent image counting and plate counting
表3 表明,浓度为105CFU/mL 的荧光图像计数的标准差在0.57~0.73,浓度为106CFU/mL 的荧光图像计数的标准差在0.03~0.10,浓度为107CFU/mL 的荧光图像计数的标准差在0.01~0.09,说明不同图像菌体差异小,菌体分布均匀;105~107CFU/mL 的菌液单个图像中的菌体数量分别在6、17、140 个左右,且图像计数中平均值与中位数数值相差均小于1;变异系数均小于11%,离散程度低;经荧光图像计数后得到的105~107CFU/mL 的菌液浓度对数值分别在5.69~5.93、6.18~6.28、7.13~7.21 之间,平板计数结果的对数值分别在5.49~5.63、6.02~6.06、7.02~7.06 之间,同一浓度菌液的荧光图像计数结果对数值与平板计数结果对数值接近,且数量级相同,说明其结果一致。
乳制品成分虽然在PI 染色观察条件下有荧光,但是在荧光图像观察时并未对酿酒酵母荧光信号产生干扰。生长周期不同的细胞内DNA 含量不同,PI 与细胞DNA 结合后发出的荧光强度与DNA 含量成正比,可以达到2.5×105~7×105[36],与PI 染色酿酒酵母DNA 所产生的荧光信号相比,乳制品成分产生的荧光信号较弱,仅有60.38~125.20,在荧光观察中作为背景光已被处理,未影响计数。在研究使用荧光图像计数非乳制品中微生物时,为减少食品基质背景荧光干扰,需要对样品基质进行处理[19]。然而在使用PI 荧光图像计数乳制品中微生物时由于不存在干扰,因此可以省去样品基质去除处理的步骤,简化了实验流程。
研究结果表明,在乳制品中,即使10 种乳制品加工工艺及所加配料不同,乳制品中的105~107CFU/mL 酿酒酵母都可获得与平板计数一致结果,表明乳品成分及添加物不影响荧光图像计数微生物,且用荧光图像可准确计数。
3 结论
在分析使用PI 染料对乳制品荧光图像计数过程中乳制品的荧光性质及其对微生物计数的影响时,发现乳制品成分酪蛋白、黄油、维生素B1、维生素B2、维生素C 及10 种乳制品本身可在发射光615 nm产生荧光,但不影响PI 染色的酿酒酵母荧光观察。使用荧光显微镜对添加105~107CFU/mL 酿酒酵母菌液的10 种不同乳制品进行PI 染色计数,并将荧光图像计数结果与平板计数结果进行比较,其中经荧光图像计数后得到的105~107CFU/mL 的菌液浓度对数值分别在5.69~5.93、6.18~6.28、7.13~7.21之间,平板计数结果的对数值分别在5.49~5.63、6.02~6.06、7.02~7.06 之间,荧光图像计数结果与平板计数结果一致。表明采用PI 对酿酒酵母荧光图像计数时,乳制品荧光虽然存在但不会对荧光图像观察与计数造成影响。
