等离子体活化水喷淋及浸泡处理的生菜采后品质变化分析
2024-04-03邓子安吴清燕江风郑丹丹李江阔牟文良吴迪孙崇德陈昆松
邓子安,吴清燕,江风,2,郑丹丹,2,李江阔,牟文良,吴迪,2*,孙崇德,陈昆松
(1.浙江大学农业与生物技术学院,浙江杭州 310058)
(2.浙江大学中原研究院,河南郑州 450000)
(3.国家农产品保鲜工程技术研究中心(天津),农业农村部农产品贮藏保鲜重点实验室,天津市农产品采后生理与贮藏保鲜重点实验室,天津 300384)
(4.山东奥维特生物科技有限公司,山东济南 251400)
(5.山东营养源食品科技有限公司,山东济南 251400)
生菜(Lactuca sativavar.ramosaHort.),又名莴仔菜,属菊科莴苣属,常切割后单独或混合其他蔬菜进行即食,并因其柔嫩爽脆的口感,以及富含酚类化合物、维生素、无机盐和天冬碱等营养物质,在国内外拥有巨大的销售市场。但生菜存在含水量高、叶面积大、组织脆弱、易遭受机械伤等问题,在贮藏过程中容易遭受微生物侵染,造成品质劣变和腐败损耗;同时生菜作为即食蔬菜,其表面的食源性病原微生物过多容易造成食源性疾病。因此,减少生菜采后贮藏期间表面的微生物数量对保证生菜优质供给和食品安全十分重要。
等离子体活化水(Plasma Activated Water,PAW)主要由低温等离子体与水面接触或直接引入水中获得,被认为是一种绿色环保的果蔬杀菌技术。已有研究表明,PAW 处理可以有效减少番茄[1]、苹果[2]、圣女果[3]、草莓[4]、菠萝[5]等果蔬表面的微生物。然而上述研究主要采用浸泡方式进行PAW 处理,目前较少有研究关注PAW 喷淋处理对降低果蔬表面菌落总数和品质代谢等指标的影响,也缺少喷淋和浸泡两种PAW 处理方式对于果蔬保鲜的对比分析研究。
PAW 杀菌处理过程中的氧化作用可能会引起果蔬代谢功能发生变化。代谢组学作为探究果蔬品质形成机理的重要研究手段,可通过定量或定性方式分析生物体内小分子代谢物的变化规律,揭示果蔬受到外源刺激前后的生理变化及品质形成机理[6]。除了对代谢物质进行分析,代谢组学技术还可揭示外源刺激引起的果蔬采后初生及次生代谢途径[7]。
本研究以生菜为实验材料,以贮藏期间表面菌落总数、失重率、颜色、叶绿素等为评价指标,研究PAW 喷淋和浸泡处理对生菜采后贮藏保鲜的影响;同时开展PAW 处理后生菜代谢组多变量分析和代谢途径分析,探究两种处理方式引起的生菜差异代谢物变化规律及其发生的主要代谢途径。
1 材料与方法
1.1 材料与试剂
新鲜生菜:购于某市某超市,挑选大小一致、无病虫害的生菜若干,于0.5 h 内运送至本实验室。
PCA 培养基,浙江格陵设备科技有限公司;氯化钠,浙江同力信息科技有限公司;PDA 培养基,浙江格陵设备科技有限公司;乙醇,国药集团化学试剂公司。
1.2 仪器与设备
CTE-2000KW 低温等离子试验电源,南京苏曼等离子科技有限公司;低温等离子体活化水处理反应器,南京苏曼等离子科技有限公司;色差仪,上海信联创作电子有限公司;摇床,华立达公司;超净工作台,苏净集团苏州安泰空气技术有限公司。PAW 喷淋处理采用浙江大学自主研发的果蔬等离体子体活化水传送式喷淋杀菌装置[8],主要包括支撑腿、放置架、工作台、万向轮、喷淋架和传动装置等部件。
1.3 方法
1.3.1 实验设计
实验共设置了5 个处理组,包括:PAW 喷淋处理组(PAW-S-15)、PAW 浸泡处理组(PAW-B-15)、清水喷淋处理组(W-S-15)、清水浸泡处理组(W-B-15)以及对照组(不进行PAW 或清水处理)。通过预实验比较了PAW 喷淋和浸泡不同时间后生菜菌落总数,发现均为处理15 min 后的杀菌效果最好。因此,正式实验中的PAW 喷淋和PAW 浸泡处理组的处理时间均设定为15 min,同时清水喷淋和清水浸泡处理组的处理时间也设定为15 min。为了能够保证实验中使用的PAW 的活性一致,本实验中使用的PAW 都是实时制备并使用。
1.3.2 PAW制备与生菜处理
在室温下采用低温等离子体活化水处理反应器制备PAW,水处理量为30 L/h,制备时间为1.5 h,电流强度为6 A。CTE-2000KW 低温等离子试验电源的输出电压为25 kV,功率为1 500 W。制备所得的等离子体活化水的各项指标如图1 所示,较纯水而言,其pH 值显著降低,电导率、氧化还原电位、过氧化氢含量以及亚硝酸含量都显著升高,表明等离子体活化水中富含H2O2、NO2-、O3等活性物质,有利于杀灭微生物。
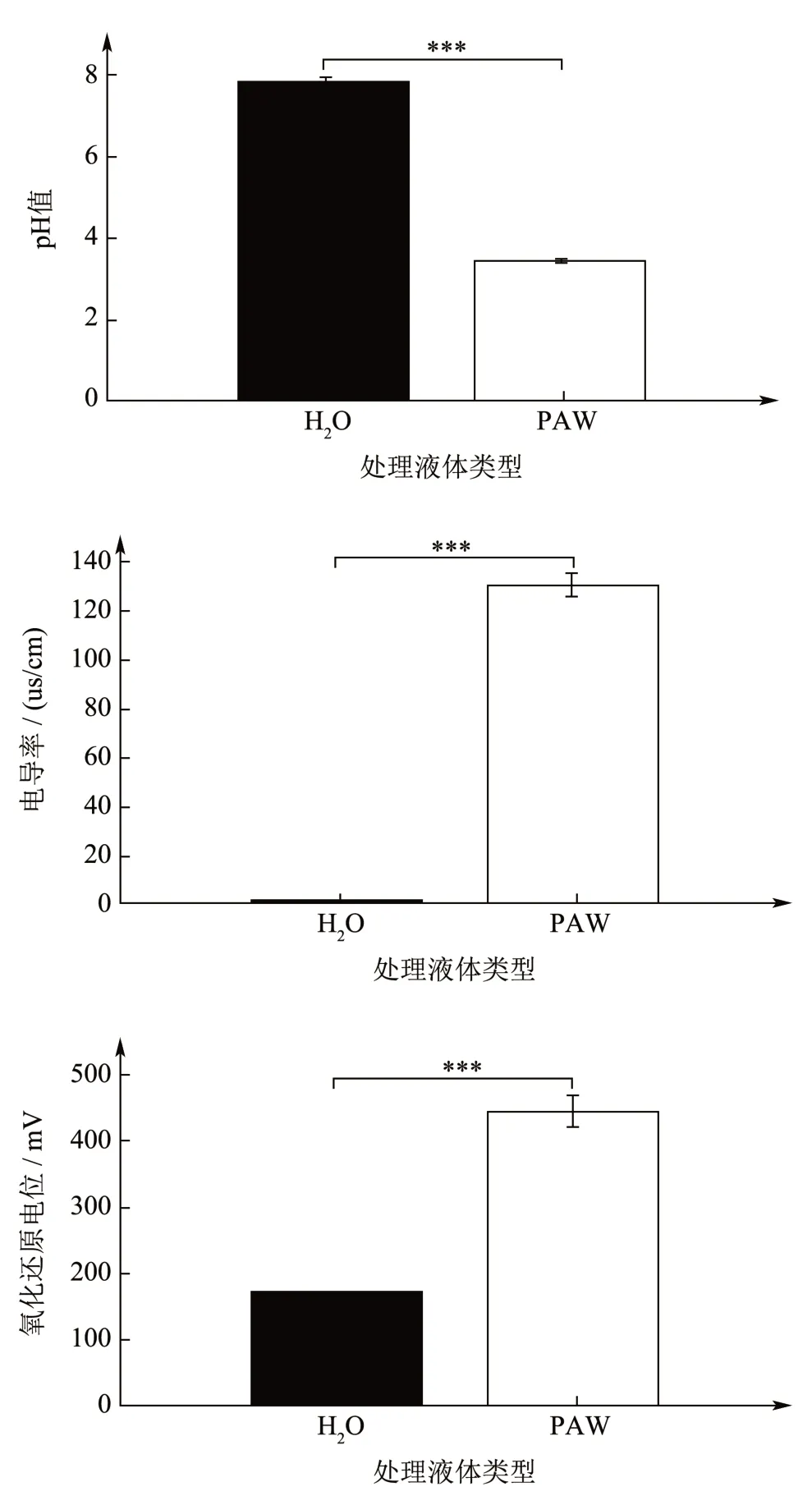

图1 制备所得的等离子体活化水的pH 值、电导率、氧化还原电位、过氧化氢含量以及亚硝酸含量Fig.1 pH value, conductivity, redox potential, hydrogen peroxide content, and nitrous acid content of the prepared plasma-activated water
浸泡处理时,将整颗生菜没入PAW 或清水中处理15 min,不进行搅拌处理。喷淋处理时,将整颗生菜置于果蔬等离体子体活化水传送式喷淋杀菌装置中,从上往下喷淋PAW 或清水15 min;处理完的生菜沥干水分自然晾干。生菜处理时所用的等离子体活化水都为即时制备。
1.3.3 CFU计数法
将PAW 处理完毕的生菜切成4 cm×4 cm 的形状,取(7±1)g 置于63 mL、质量分数为0.85%的氯化钠溶液中,配成质量比为1:10(g/mL)的生菜与氯化钠溶液,置于摇床上充分摇晃。取100 μL 原液,分别用无菌蒸馏水稀释10、100、1 000 倍,共3 个梯度。吸取各稀释液100 μL,于无菌PCA培养基上涂布均匀,等待培养基上无水滴后置于37 ℃恒温培养箱内,培养48 h 后进行平板菌落计数,计算菌落总数。
1.3.4 品质测定
对各处理组的生菜样品在贮藏(4 ℃,90%RH)0、5、10、15 d[9,10]后的品质进行测定。
失重率测定:采用课题组已建的称量法进行测定[11]。按照以下公式计算:
式中:
D——失重率,%;
m前——储藏前质量,g;
m后——储藏后质量,g。
颜色测定:用色差仪进行测定。每株生菜测定3 片叶子相同位置处,每组3 个重复,每个重复3株生菜,记录L*、a*、b*值。
叶绿素测定[12]:称量0.1 g 冷冻材料,用4 mL体积分数80%丙酮冰浴下浸提30 min,4 000 r/min 离心10 min,取上清液,重复1 次,定容10 mL 刻度试管。最后用分光光度计,分别在波长644、662 nm处检测吸光值。然后按照以下公式进行计算:
式中:
Ca——叶绿素a 含量,mg/g Fw;
Cb——叶绿素b 含量,mg/g Fw。
最后再用质量浓度计算生菜的叶绿素含量。
1.3.5 代谢组分析
在贮藏第5 天获取对照组、PAW 喷淋处理组和PAW 浸泡处理组等的生菜冷冻材料(粉末)各100 mg,并在4 ℃下用0.6 mL,质量分数为70%的甲醇水溶液萃取过夜,然后将样品以10 000×g离心10 min,提取液被吸收,用微孔膜(0.22 μm poresize)过滤样品,最后进行超高效液相色谱串联质谱(Ultra Performance Liquid Chromatography/Tandem Mass Spectrometry,UPLC-MS/MS)分析。
1.3.6 代谢组定性
除去同位素信号后,根据二级谱信息再自建迈维代谢数据库(Metware Daetabase,MWDB)的基础上进行物质定性,含K+、Na+、NH4+以及更大分子量物质的重复信号。
1.3.7 主成分分析
主成分分析(Principal Component Analysis,PCA)通过R 软件(www.r-project.org/)的prcomp 函数进行计算。计算前设置参数scale=True,对代谢物含量数据进行归一化处理。
1.3.8 聚类分析
代谢物原始数据数据归一化处理后,通过R 软件的Pheatmap 功能包绘制热图,对代谢物在不同样本间的积累模式进行层级聚类分析(Hierarchical Cluster Analysis,HCA)。
1.3.9 正交偏最小二乘判别分析
将代谢物原始数据数据进行log2 转换并进行中心化处理后,利用R 软件的MetaboAnalystR 包的OPLSR.Anal 函数进行正交偏最小二乘判别分析(Orthogonal Partial Least Squares-Discriminant Analysis,OPLS-DA)计算,用于寻找差异代谢物。
1.3.10 差异代谢物筛选
在OPLS-DA 分析的基础上,基于获得的变量重要性投影(Variable Importance in Projection,VIP)对差异代谢物进行初步筛选,然后结合单变量分析的P-value 或差异倍数值(Fold Change,FC)开展二次筛选。筛选标准如下:(1)初步筛选:选取实验组和对照组中FC ≥2 和FC ≤0.5的代谢物;(2)二次筛选:进一步选取VIP ≥1的代谢物。
1.3.11 差异代谢物京都基因与基因组百科全书分类和代谢物富集分析
根据差异代谢物结果完成京都基因与基因组百科全书分类(Kyoto Encyclopedia of Genes and Genomes,KEGG)和代谢物富集分析。首先进行差异代谢物注释以及基于KEGG 通路类型的分类,然后基于差异代谢物进行KEGG 通路富集,其中富集因子(Rich Factor)越大表示富集程度越高。
1.3.12 数据分析
使用SPSS v19.0 统计软件对菌落总数、失重率、颜色、叶绿素等试验数据进行单因素方差分析,并进行Duncan 检验。使用Origin v.9.0 软件进行绘图。所有试验设3 组平行。
2 结果与讨论
2.1 贮藏期间微生物分析
菌落总数是反应生菜腐败变质发生概率的核心评价指标之一[13]。PAW 灭杀微生物的机制主要是通过等离子气体在水中生成H2O2、NO2-、O3等活性物质,以及增加液体的氧化还原电位和电导率、降低pH 值等方式,使细胞产生氧化应激,从而破坏细菌的细胞膜结构,例如氧化细胞壁脂质双层中的不饱和脂肪酸、裂解肽键和氧化氨基酸侧链,以造成菌体DNA、蛋白质的氧化损伤,最终实现对样品表面微生物的物理灭活[14]。已有研究表明,PAW 对包括真菌、细菌、孢子、病毒以及细菌生物膜在内的多种微生物均具有良好的抗菌活性[15]。本研究采用CFU 法测定了PAW 及清水处理后第0、5、10、15 天时生菜表面的菌落总数,结果如图2所示。PAW 浸泡处理后(第0 天)的菌落总数最低,为3.08 lg CFU/g;其次是PAW喷淋处理后(第0天)的菌落总数为4.36 lg CFU/g;而对照组(第0 天)的菌落总数为5.90 lg CFU/g ;PAW 浸泡和喷淋处理和对照组相比均能显著降低生菜表面菌落总数(分别下降2.82 和1.54 lg CFU/g,P<0.05),下降趋势与已有研究结果相似[4]。在整个贮藏期间,PAW 喷淋和浸泡处理的菌落总数均始终低于对照组,而清水浸泡和喷淋处理与对照组相比无显著差异(P>0.05)。两种PAW 处理的杀菌效果存在差异的原因是两者处理时PAW 中的活性物质与生菜表面微生物的作用方式不同,导致对微生物细胞膜造成不同程度的破坏,最终表现出不同的灭活效果。
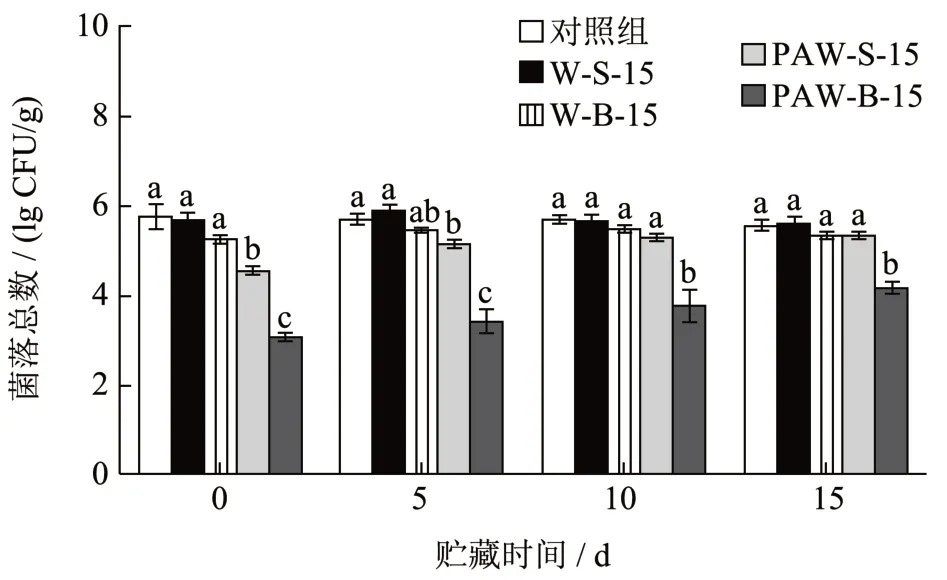
图2 贮藏期间生菜的菌落总数变化Fig.2 Changes in microbial loads on lettuce during storage
2.2 失重率分析
失重率可以反映生菜水分的散失状况[16]。如图3 所示,所有处理组的失重率均随贮藏时间增加而上升。对于浸泡处理,PAW 浸泡处理组的失重率上升速率较清水浸泡处理组快,在第15 天时已高出15%,这可能是因为PAW 浸泡较清水浸泡处理更容易造成生菜细胞结构的破坏,水分更容易从内部迁移至创口而被蒸发[17];而对比PAW 喷淋处理组和清水喷淋处理组,两者的失重率在贮藏期间均无显著差异(P>0.05),这说明PAW 喷淋处理对生菜细胞的破坏较小。此外,PAW 浸泡处理的失重率比喷淋处理的失重率大,这可能是由于前者与生菜的接触更充分,对细胞结构的破坏程度也更大;而清水浸泡的失重率比清水喷洒的失重率小,推测主要是因为清水不会对细胞造成破坏,且在浸泡过程中生菜与水分充分接触,使水分子能够在细胞中更好地保存。

图3 贮藏期间生菜的失重率变化Fig.3 Changes in weight loss rate of lettuce during storage
2.3 颜色分析
颜色是重要的外观品质指标[18]。由图4 可知,两类PAW 处理后生菜的L*值在贮藏期间大多数情况下显著高于清水处理组和对照组,推测是由于PAW 水中的多种活性物质能够钝化生菜的多酚氧化酶[19],但本研究中的L*值在不同处理组之间的数值差距不大。李海蓝等[17]也发现PAW 处理后可显著提高鲜切青椒的亮度(P<0.05)。对于a*和b*数值,贮藏后期(10 和15 d)的不同处理组之间不存在明显差异;而对于PAW 处理后(0 d)和贮藏前期(5 d)的生菜,PAW 浸泡处理组与CK 组的a*和b*数值相似,两个清水处理组和PAW 喷淋处理组的a*和b*数值则低于PAW 浸泡处理组与CK 组,但不同处理组之间的数值差距不大,马晓艳等[20]的研究结果也显示PAW 处理后黄花菜的a*值与对照组相比数值差距不大。上述结果表明,PAW 处理不会对生菜色泽产生明显影响,可以维持较好的外观品质。
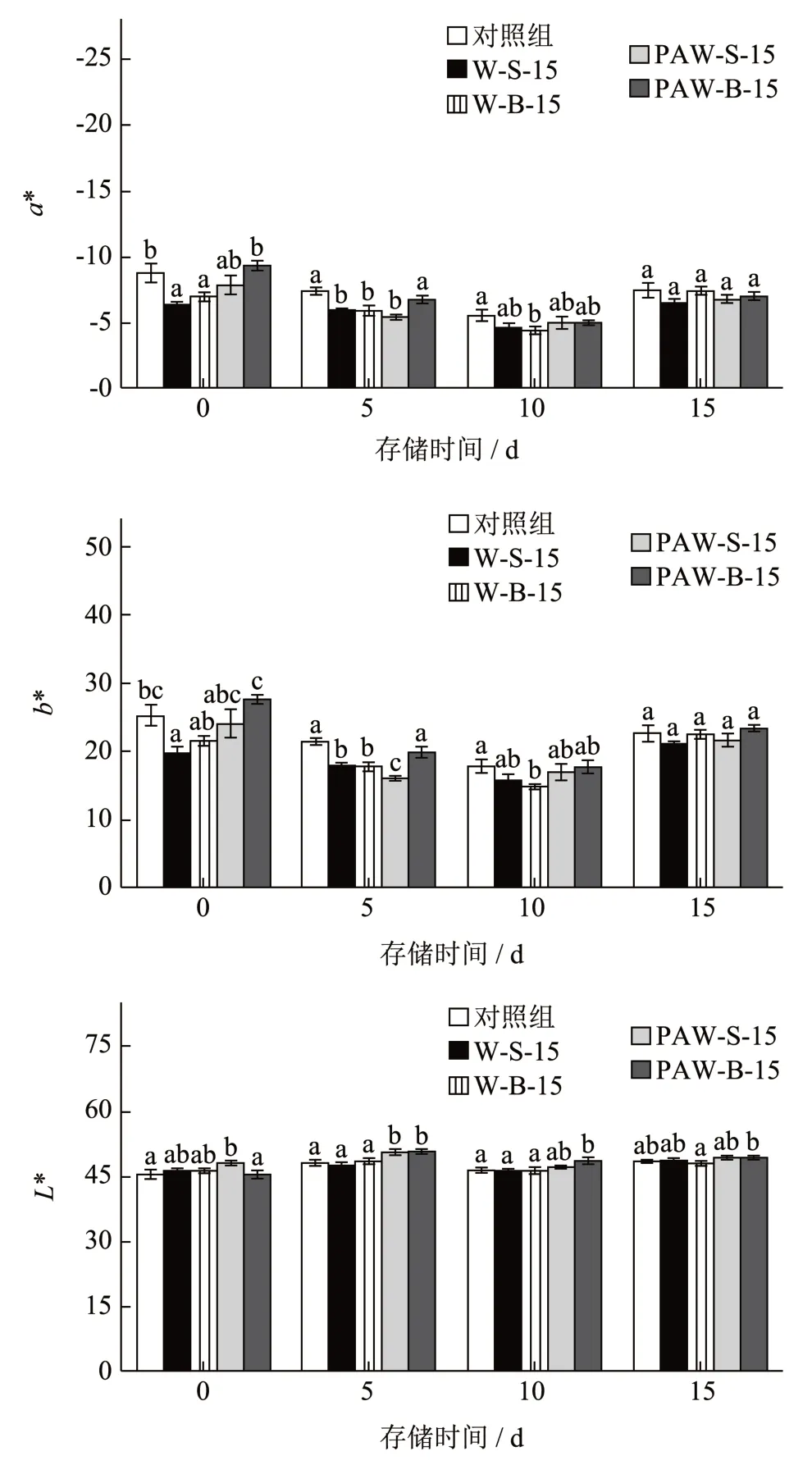
图4 贮藏期间生菜的颜色变化Fig.4 Changes in color of lettuce during storage
2.4 叶绿素分析
叶绿素是生菜的主要呈色物质,是评判生菜品质的关键指标之一[21]。为了研究PAW 处理对生菜叶绿素的影响,我们采用了分光光度计法对其进行了测定。图5 表明,清水浸泡处理能够较好维持贮藏期间生菜的叶绿素含量,而其他处理组的叶绿素含量均随贮藏时间增加而下降,其中PAW 浸泡处理组的叶绿素含量在贮藏末期显著降低(P<0.05),这可能是由于PAW 浸泡处理时生菜与大量活性氧和活性氮的接触面积增加,在一定程度上促进了色素氧化,加快了叶绿素降解[22]。与不同处理组在贮藏后期的颜色不存在明显差异不同,不同处理组在贮藏后期的叶绿素含量存在一定的差异,这可能是由于叶绿素变化主要是因为叶绿素a 含量改变所引起的,从而不一定会影响样本颜色[23,24]。

图5 贮藏期间生菜的叶绿素含量变化Fig.5 Changes in chlorophyll content of lettuce during storage
2.5 代谢组分析
2.5.1 样本质控分析
对不同混样质控样本(Quality Control,QC)质谱检测分析的总离子流图(Total Ions Current,TIC)进行叠加后的结果如图6 所示。代谢物检测总离子流曲线具有高度重叠性,即峰强度和保留时间一致,表明在不同时间检测同一样品时,质谱的信号稳定,测定数据具有可靠性和重复性。

图6 QC 样本质谱检测TIC 重叠图Fig.6 Overlapping total ion current (TIC) chromatographs of QC samples
2.5.2 代谢物的多变量分析
对代谢组数据进行PCA 计算,结果如图7 所示。PC1 和PC2 贡献率分别为25.64%和19.05%。PAW 喷淋处理组、PAW 浸泡处理组和质量控制(QC)之间的样本可以分开,表明两个PAW 处理组具有不同的代谢物特征。同时,PAW-S-15 组、PAW-B-15 组和QC 的组内样本聚在一起,表明实验结果具有较好的重复性和可靠性。

图7 PCA 得分图Fig.7 PCA score plot of PC1 versus PC2
对每种代谢物峰面积进行l g 转换,并进行HCA 计算,分别研究对照组与PAW 喷淋处理组和PAW 浸泡处理组的差异代谢物。图8 显示,对照组中含量较高的代谢物主要集中在图的中部和上部,而PAW 喷淋处理组和PAW 浸泡处理组中含量较高的代谢物分别集中在中下部和中上部。PCA 和HCA 结果表明3 个处理组的代谢产物谱之间存在差异。

图8 HCA 分析Fig.8 Hierarchical clustering analysis
2.5.3 代谢物OPLS-DA结果
通过OPLS-DA 模型对各处理组中样品的代谢物含量进行了比较。图9 分别显示了对照组与PAW 浸泡处理组间的差异(R2X=0.61,R2Y=0.99,Q2=0.71),对照组与PAW-S-15 组间的差异(R2X=0.51,R2Y=0.99,Q2=0.80), 以及PAW 浸泡处理组与PAW 喷淋处理组间的差异(R2X=0.57,R2Y=0.99,Q2=0.85)。所有比较组的Q2都高于0.7,说明所构建的模型合适且稳定。

图9 OPLS-DA 模型Q2 值Fig.9 Q2 value of OPLS-DA model
2.5.4 差异代谢物筛选
为了分析PAW 浸泡和喷淋处理对生菜代谢的影响,选择PAW 喷淋和浸泡处理后贮藏第5 天的生菜进行广泛靶向目标代谢组学分析,结果如图10 所示。在PAW 喷淋和浸泡处理组中分别检测到713 种和702 种代谢产物。选取实验组和对照组中FC≥2 和FC≤0.5 的代谢物,并进一步选取VIP≥1 的代谢物,发现PAW 喷淋处理组与对照组相比共有34 种差异代谢物,包括黄酮、脂质、酚酸类等,其中17 种代谢物上调,17 种代谢物下调;PAW 浸泡处理组与对照组相比共有45 种差异代谢物,包括核苷酸及其衍生物、黄酮、脂质等,其中35 种代谢物上调,10 种代谢物下调。两种处理方式对生菜代谢产生不同效果可能是因为不同的处理方式会引起生菜出现不同程度的氧化应激,最终激活出不同次生代谢产物的合成。

图10 生菜差异代谢火山图Fig.10 Differential metabolism volcano map of lettuce
进一步根据VIP ≥1 且差异倍数变化≥2.0(↑↑上调)或差异倍数变化≥1.5(↑增加)以及VIP≥1 且差异倍数变化≤0.5(↓↓下调)或差异倍数变化≤0.7(↓降低)的原则对上调和下调的代谢物进行筛选,结果如表1 所示。

表1 两种PAW处理后生菜共有的差异代谢物主要变化趋势Table 1 Major trends of the shared differential metabolites in lettuce after two PAW treatments
在上调趋势中,共有2 种上调形式。第1 种是PAW 喷淋和浸泡处理组较对照组均上调,包括脂质的游离脂肪酸、甘油酯和属于黄酮的黄酮醇,说明不论是用喷淋还是浸泡处理,这些代谢物含量均会上调。第2 种是代谢物含量的上调形式与PAW处理方式有关,即PAW 喷淋处理组的代谢物含量高于对照组,而PAW 浸泡处理组的代谢物含量又高于PAW 喷淋处理组,如属于脂质的棕榈酸、石榴酸(9Z,11E,13Z-十八碳三烯酸)、9,10,11-三羟基-12-十八碳烯酸等,属于生物碱的油酰单乙醇胺、咖啡酰胆碱-5-O-葡萄糖苷、咖啡酰胆碱-4-O-葡萄糖苷*,属于酚酸类的2,6-二叔丁基苯酚、反式-5-O-对香豆酰莽草酸,有机酸里的磷酸烯醇式丙酮酸以及一些其它类酚类物质。
在下调趋势中,共有2 种下调形式。第1 种是PAW 喷淋和浸泡处理组较对照组均下调,包括属于脂质的十七烷酸、黄酮里的槲皮素-3-O-半乳糖苷(金丝桃苷)、其它类的4′-O-葡萄糖基-5-O-甲基阿米醇。第2 种是PAW 喷淋处理组的代谢物含量低于对照组,而PAW 浸泡处理组较PAW 喷淋处理组进一步下调,包括黄酮里的芹菜素-7-O-(6′′-乙酰)葡萄糖苷和山奈酚-3-O-葡萄糖醛酸苷-7-O-葡萄糖苷,以及属于有机酸的(-)-茉莉酰-l-异亮氨酸。
综上,PAW 处理后的差异代谢物主要为黄酮、脂质、生物碱、酚酸、有机酸等,其中生物碱具有良好的生理活性,有益于人体健康[25];而黄酮是影响果蔬色泽、风味、营养价值的重要物质[26],说明PAW 处理对生菜的营养价值和风味品质有一定的影响。这可能是由于在杀菌处理过程中,PAW 的氧化作用使生菜的代谢功能发生了改变[26-28]。
由差异代谢物检测结果可知,PAW 喷淋处理组与对照组相比只引起了槲皮素-3-O-半乳糖苷(金丝桃苷),一种黄酮类物质含量的下降,而PAW 浸泡处理组与对照组相比却造成了表儿茶素、芹菜素-7,4′-二甲醚、槲皮素-3-O-半乳糖苷(金丝桃苷)、芹菜素-7-O-(6′′-乙酰)葡萄糖苷以及山奈酚-3-O-葡萄糖醛酸苷-7-O-葡萄糖苷共五种黄酮类物质含量的下降,其中表儿茶素和芹菜素-7-O-(6′′-乙酰)葡萄糖苷分别降低了98.03%和99.83%,说明PAW喷淋处理组的生菜与对照组相比保留了含量更多的黄酮类物质,因此能够发挥更强有力的抗氧化作用[19]。这可能是由于PAW 喷淋处理更有利于导致生菜中酚类物质(如黄酮类物质)的合成,从而提高了处理后生菜的综合抗氧化能力[29]。
由表1 可知,PAW 喷淋和浸泡处理组与对照组相比都提高了9-羟基-13-氧代-10-十八碳烯酸和单酰甘油酯(18:4)两种脂质含量。除此之外,差异代谢物检测结果还显示,PAW 浸泡处理组与对照组相比引起了包括石榴酸(9Z,11E,13Z-十八碳三烯酸)、11-十八碳烯酸、9,10,11-三羟基-12-十八碳烯酸等在内的其他7 种脂质含量的上升,说明PAW浸泡处理组的生菜与对照组相比膜脂代谢活跃,生菜的细胞膜在一定程度上丧失了完整性[30]。
2.5.5 差异代谢物KEGG分类和差异代谢物富集分析
分别将PAW 喷淋和浸泡处理组中的34 和45 种差异代谢物映射到KEGG 数据库,查看途径信息,结果如图11 所示。大多数代谢产物都映射为“代谢”途径。进一步开展KEGG 途径富集分析,分别研究PAW 喷淋和浸泡处理组与对照组之间的代谢途径的差异,发现酪氨酸代谢和谷胱甘肽代谢的代谢物在PAW 喷淋处理后有显著差异(P<0.05),而嘧啶代谢和嘌呤代谢的代谢物在PAW 浸泡处理后有显著差异(P<0.05)。

图11 差异代谢物KEGG 分类和富集分析Fig.11 KEGG classification and enrichment analysis of differential metabolites
3 结论
本文研究了PAW 喷淋和浸泡两种处理方式对生菜采后贮藏期间微生物、生理品质及代谢的影响。其中两种PAW 处理方法都能显著降低生菜表面菌落总数(分别下降2.82 和1.54 lg CFU/g,P<0.05),但在贮藏后期,PAW 浸泡处理后生菜的失重率较清水处理组高出15%,叶绿素含量显著降低,而PAW喷淋处理对生菜失重率和叶绿素含量没有造成明显影响。代谢组分析结果表明,PAW 喷淋处理组的生菜与对照组相比保留了含量更多的黄酮类物质,有助于生菜维持更好的营养价值,而PAW 浸泡处理组的生菜与对照组相比膜脂代谢活跃,会在一定程度上影响生菜细胞膜的完整性。因此,相比于PAW浸泡,PAW 喷淋处理更有利于生菜采后保鲜。PAW喷淋和浸泡处理后生菜微生物和代谢存在差异的原因主要是两者在液体接触样品表面的面积、力度和时间以及处理后液体挥发等方面均存在差异。本实验结果可为生菜采后保质减损与提质增效提供技术支撑。后续工作中将进一步研究整个贮藏期间生菜的代谢物变化情况,并与其相关品质进行关联分析;同时也将研究PAW 处理后对生菜表面微生物群落和代谢的影响,以进一步解析其抑菌机制。
