固定化脂肪酶ANL-MARE催化酸解合成1-油酸-2-棕榈酸-3-亚油酸甘油三酯
2024-04-03康梦何家强冯孔龙黄早成李一峰苗建银符姜燕朱泽榕刘果曹庸
康梦,何家强,冯孔龙,黄早成,李一峰,苗建银,符姜燕,朱泽榕,刘果,曹庸
(1.华南农业大学食品学院,广东省功能食品活性物重点实验室,广东广州 510642)
(2.广东惠尔泰生物科技有限公司,广东广州 510642)
(3.广东美味鲜调味食品有限公司,广东中山 528437)
母乳是婴儿生长发育的理想营养素。乳脂肪占母乳中所含能量的45%~55%,富含多不饱和脂肪酸和必需脂肪酸以及功能性脂质,对机体的发育和健康至关重要[1]。1,3-二不饱和脂肪酸-2-棕榈酸甘油三酯(1,3-Di-Unsaturated Fatty Acyl-2-Palmitoylglycerols,UPU)是母乳脂质的主要存在形式,不饱和脂肪酸主要在甘油骨架的立体定向位置(Stereospecific Numbering,SN)的1 和3 位酯化,而饱和脂肪酸棕榈酸(Palmitic Acid,PA)(约60%~70%)酯化在sn-2 位[2],这种结构的甘油三酯(Triacylglycerol,TAG)可以增强婴幼儿对脂质和矿物质的消化和吸收、促进骨骼发育和肠道健康、改善血清和肝脏的甘油三酯和胆固醇水平促进脂质代谢减少脂质积累[3,4],对促进婴幼儿生长发育具有重要作用[5]。其中,1-油酸-2-棕榈酸-3-亚油酸甘油三酯(1-Oleoyl-2-Palmitoyl-3-Linoleoylglycerol,OPL)和1,3-二油酸-2-棕榈酸甘油三酯(1,3-Dioleoyl-2-Palmitoylglycerol,OPO)是母乳中天然存在的两种主要UPU 结构脂,其含量因不同国家和地区的饮食习惯而异。OPL 是亚洲母乳中最丰富的脂质,尤其是在中国母乳中(17.85%~33.02%)[6]。因此,OPL 在婴儿的成长中也发挥重要作用[7]。然而,由于母乳喂养不足或缺乏,以及牛乳和植物油来源的婴儿配方奶粉中几乎不含OPL[8,9],且其脂质结构大多为饱和脂肪酸占据在sn-1,3 位,长期摄入影响脂质和矿物质的吸收利用,不利于婴幼儿生长发育,还易导致便秘[5]。因此,人乳替代脂OPL 的合成具有重要意义,这对制备和开发一种与中国人乳脂肪酸结构和分布类似的人乳脂替代品具有重要应用前景。
近年来,结构脂质的酶法制备由于其反应条件温和、催化效率高、环保等优点受到广泛关注,其制备方法分为酯化法、酸解法、转酯化法等[7]。酶促酸解法反应温和、工艺简单,提供了一种将所需的脂肪酸合并到TAG 的特定位置有用的方法,是获得富含特殊脂肪酸的TAG 最直接的方式[10]。目前,国外企业的人乳脂替代脂OPO 几乎占据了我国婴幼儿产品的全部市场,而OPL 生产工艺仍处在研究阶段。OPL 的制备以酶促酸解法为主,主要以棕榈硬脂与油酸(Oleic Acid,OA)、亚油酸(Linoleic Acid,LA)或者富含OA 和LA 的植物油为原料在固定化脂肪酶的催化作用下合成[7,11]。Wang 等[12]采用酸解法以棕榈硬脂与OA、LA(摩尔比1:7:7)为底物原料,添加10% NS40086 脂肪酶,60 ℃反应4 h,获得产物中含47.93% OPL,sn-2 PA 相对含量为87.90%。姚书一等[13]以PPP 和富含OA 和LA的橡胶籽油为底物(摩尔比为1:7),添加10%的Novozym 40086 在55 ℃反应12 h,获得OPL 相对含量为42.35%。然而,UPU 结构脂规模化生产受限于商业化脂肪酶存在的技术壁垒。进口商业脂肪酶的高成本以及富含sn-2 PA 油脂底物来源的缺乏,限制了国内人乳替代脂的产业化,导致进口OPO和OPL 产品价格居高不下[14]。本研究团队前期研究出具有高催化效率、高稳定性的固定化脂肪酶,可替代国外商业酶制剂,已成功应用于高酸价大豆油的脱酸和单甘油酯、甘油二酯的生物合成[15,16]。
本研究首先制备和表征固定化酶ANL-MARE作为生物催化剂,以溶剂分提法富集得到的三棕榈酸甘油三酯(Tripalmitin,PPP)以及脂肪酸(OA、LA)作为原料,酶促酸解法制备富含OPL 的结构脂,以期为促进高值化人乳脂替代脂OPL 的酶法制备工业发展和实现低成本产业化提供理论参考。
1 材料与方法
1.1 材料与试剂
58 ℃棕榈硬脂,购自益海嘉里广州粮油有限公司;LA、OA 均为分析纯,购自上海罗恩试剂公司;胰脂肪酶(USP 级,具有sn-1,3 特异性)、37 种脂肪酸甲酯混合标准品,色谱纯,购自上海Sigma-Aldrich 公司;PPP、OPL 标准品均为色谱纯,购自瑞典Larodan 公司;固定化脂肪酶NS40086(来源于Aspergillus oryzae,固定在丙烯酸树脂)和Lipozyme 435(来源于Candida Antarctica,固定在丙烯酸树脂)购自丹麦诺维信公司;色谱级乙腈、异丙醇、甲醇、正己烷,均购自欧森巴克化学公司;薄层色谱硅胶板(10 cm×20 cm),购自广州卯林仪器公司;脂肪酶Aspergillus nigerlipase(ANL)、大孔丙烯酸树脂,由广东省功能食品活性物重点实验室提供。
1.2 主要仪器与设备
SEDEX 80 型蒸发光散射检测器(Evaporative Light Scattering Detector,ELSD),法国SEDEX 公司;LC-10A 型液相色谱仪(LC),日本岛津;HP 6890-5973 型气相色谱质谱联用仪(GC-MS)、DBWAX 毛细管柱,均来自美国安捷伦公司;Dionex Acclaim C30 色谱硅胶柱,美国Thermo Scientific 公司;R204B3 型旋转蒸发仪,上海申生科技有限公司;N-EVAP 型氮吹仪,美国organomation 公司。
1.3 实验方法
本研究采用酶促酸解法合成OPL,以PPP、OA和LA 作为反应底物,采用sn-1,3 位特异性脂肪酶ANL-MARE 酶促酸解法制备OPL,工艺路线如图1。
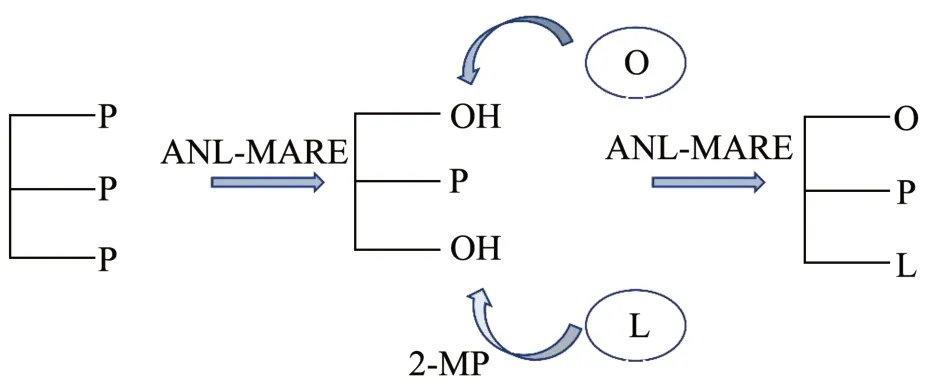
图1 固定化酶ANL-MARE 酶促酸解法合成OPL 工艺路线Fig.1 Process route for the synthesis of OPL using immobilized enzyme ANL-MARE enzymatic acidolysis
具体地,首先,采用溶剂法从58 ℃的棕榈硬脂中分提富集PPP,作为后续工艺中sn-2 PA 的供体来源。随后,加入OA 和LA 在sn-1,3 位特异性的固定化脂肪酶ANL-MARE 作用下取代PPP 中sn-1,3 位脂肪酸,获得OPL。
1.3.1 ANL-MARE脂肪酶的固定化及表征
1.3.1.1 脂肪酶的固定化
根据Feng 等[16]的方法略有修改,取适量脂肪酶ANL 分散于20 mmol/L 磷酸盐缓冲溶液(pH 值5.6)中,4 ℃,10 000g条件下离心10 min,取上清液,制成0.50 mg/mL 的脂肪酶液。称取适量经过缓冲盐溶液润洗的大孔丙烯酸树脂,分散于脂肪酶液中,并以150 r/min 的速度连续搅拌6 h,使脂肪酶和树脂充分接触。最后,缓冲溶液漂洗固定化脂肪酶表面残留的脂肪酶,并在45 ℃真空干燥5 h。
1.3.1.2 蛋白质吸附率的测定
蛋白质含量测定:采用BCA 法测定蛋白质含量。固定化酶蛋白质吸附率的计算公式如下:
式中:
A——蛋白质吸附率(PL),%;
X1——固定化吸附前脂肪酶液中的蛋白量,mg;
X2——固定化吸附后固定化酶滤液及洗涤液中的残余蛋白量,mg。
1.3.1.3 固定化酶酶活力检测
参照GB/T 23535-2009《脂肪酶制剂》进行,计算酶的比活力。简言之,50 mL 三角瓶中加入4 mL 质量分数 4%的聚乙烯醇-橄榄油乳化液(V/V)和5 mL 0.025 mol/L 磷酸缓冲液(pH 值7.5),然后加入适量的脂肪酶,37 ℃反应15 min 后,加入15 mL 体积分数95%乙醇溶液(V/V)终止反应,用0.05 mol/L NaOH 溶液滴定,以酚酞为指示剂,同时做空白组。
1.3.1.4 固定化酶的表征
根据Liu 等[17]的方法,采用傅里叶变换红外光谱(Fourier Transform Infrared Spectroscopy, FT-IR)分析ANL-MARE 脂肪酶固定化前后的官能团变化,以分析脂肪酶在树脂上固定化的程度。
1.3.2 PPP的分提富集
采用溶剂分提法从58 ℃棕榈硬脂中富集PPP[18]。首先将棕榈硬脂充分溶解,将丙酮以5 mL/g 的比例与棕榈硬脂混合,在38 ℃静置4 h,待PPP 析出后迅速抽滤,随后将所得硬脂在70 ℃旋转蒸发脱去溶剂,获得高纯PPP 产物。分提产物LC-ELSD 检测PPP 含量,GC-MS 检测脂肪酸。
1.3.3 OPL的酶促酸解合成
1.3.3.1 OPL的酶促酸解单因素试验
根据前期研究基础,优化影响酶促酸解反应的几个关键影响因素。将分提富集得到的PPP 与OA和LA 按一定摩尔比(OA 与LA 摩尔比为1:0.5、1:0.75、1:1、1:1.25、1:1.5;PPP 与总脂肪酸的底物摩尔比为1:8、1:10、1:12、1:14、1:16)添加至烧瓶中,于60 ℃混合溶解。再向体系中加入一定质量分数的固定化酶ANL-MARE(底物总质量的6%、8%、10%、12%、14%),在一定水浴温度下(50、55、60、65、70 ℃),150 r/min 反应一定时间(1、2、4、6、8、10 h)。反应结束后,过滤除酶,获得酶促合成产物,分离产物中TAG。单因素试验以OPL 占总TAG 的相对含量和sn-2 PA 占总PA 的质量分数(sn-2 PA,相对含量)为指标,评价OPL 的含量和产物中酰基转移的现象。反应重复进行3次。具体反应参数如下:
(1)考察OA 与LA 摩尔比对合成OPL 的影响:PPP 与脂肪酸底物摩尔比1:12,反应温度为60 ℃,反应时间为6 h,脂肪酶ANL-MARE 添加量为底物总质量的12%,OA 与LA 摩尔比为1:0.5、1:0.75、1:1、1:1.25、1:1.5。
(2)考察底物摩尔比对合成OPL 的影响:OA与LA 摩尔比1:0.75,脂肪酶ANL-MARE 添加量为底物总质量的12%,反应温度为60 ℃,反应时间为6 h,PPP 与脂肪酸底物摩尔比为1:8、1:10、1:12、1:14、1:16。
(3)考察脂肪酶ANL-MARE 添加量对合成OPL 的影响:底物摩尔比1:12,OA 与LA 摩尔比1:0.75,反应温度60 ℃,反应时间6 h,脂肪酶ANL-MARE 添加量为底物总质量的6%、8%、10%、12%、14%。
(4)考察反应温度对合成OPL 的影响:底物摩尔比1:12,OA 与LA 摩尔比1:0.75,反应时间为6 h,脂肪酶ANL-MARE 添加量为底物总质量的12%,反应温度为50、55、60、65、70 ℃。
(5)考察反应时间对合成OPL 的影响:底物摩尔比1:12,OA 与LA 摩尔比1:0.75,反应温度为60 ℃,脂肪酶ANL-MARE 添加量为底物总质量的12%,反应时间为1、2、4、6、8、10 h。
1.3.3.2 OPL酶促酸解合成的响应面试验优化
基于单因素试验结果,进行响应面优化分析,选择对OPL 相对含量和sn-2 PA 相对含量有显著影响的3 个因素:ANL-MARE 脂肪酶添加量(A)、PPP 与脂肪酸的底物摩尔比(B)、OA 与LA 摩尔比(C),进行3 因素3 水平的响应面分析实验,对OPL 酶法合成的工艺进行优化。实验采用Box-Behnken 设计,中心实验次数为3 次,各个因素的水平如表1。

表1 Box-Behnken试验设计因素水平Table 1 The factors and levels of Box-Behnken test
1.3.4 酶促酸解产物中TAG的分离
参照高亮等[19]的方法,将正己烷与酶促酸解产物以10 mL/g 的比例混合,再加入游离脂肪酸1.5 倍摩尔当量的0.5 mol/L KOH-CH3CH2OH 溶液(30%,V/V),充分混匀、静置分层,吸取上层含有TAG 的正己烷相,45 ℃旋转蒸发回收溶剂得到TAG。
1.3.5 产物TAG分析
脂质组成分析采用LC-ELSD 进行。方法如下:空气作为雾化气;ELSD 检测器温度为50 ℃,载气压力3.5 bar,增益为6,色谱柱为Dionex Acclaim®C30(250 mm×4.6 mm,5 µm);以乙腈和异丙醇进行二元梯度洗脱,洗脱程序如表2,流速1 mL/min,柱温30 ℃。油脂样品溶解于正己烷(10 mg/mL),进样量20 µL。TAG 利用标准品进行定性,采用峰面积归一化法计算OPL 占总TAG 的相对含量。

表2 LC洗脱程序Table 2 LC elution procedure
1.3.6 脂肪酸组成分析
将获得的TAG 甲酯化,采用GC-MS 检测分析总脂肪酸组成。
GC 条件:采用DB-WAX 毛细管柱(60 m×0.25 mm×0.25 μm);检测器温度250 ℃,进样口温度250 ℃,载气为氦气,流速1.0 mL/min,分流比1:20,进样1 μL。升温程序:首先在50 ℃下保持1 min,然后以22.5 ℃/min 的速率升温至175 ℃,最后以4 ℃/min 的速率升温至230 ℃,并保持20 min。
MS 分析条件:EI 电离源能量为70 eV,离子源和传输线温度分别为230 ℃和150 ℃。扫描范围30~500m/z,溶剂延迟6 min。脂肪酸的定性分析根据标准品和谱库(NIST.08)进行,定量分析采用峰面积归一化法。
1.3.7 sn-2脂肪酸组成分析
在分离得到的TAG 产物中加入1 mL 1 mol/L Tris-HCl 缓冲液(pH 值8.0),0.25 mL 0.05%胆酸钠(m/V),0.1 mL 2.2% CaCl2(m/V),20 mg 胰脂肪酶。混合物在40 ℃剧烈摇晃3 min,然后加入1 mL 6 mol/L HCl 和2 mL 乙醚,离心。乙醚用无水硫酸钠干燥,氮气蒸发至200 μL。水解产物在薄层硅胶色谱板上分离,展开溶剂为正己烷/乙醚/乙酸(50:50:1,V/V/V)。将sn-2 单甘油酯的条带刮掉,甲酯化,并进行如上1.3.6 所述GC-MS 方法分析。sn-2 PA 相对含量按下式计算:
式中:
B——2 位棕榈酸(sn-2 PA)占总棕榈酸的质量分数,%;
C——2 位棕榈酸含量,%;
D——棕榈酸含量,%。
1.3.8 数据分析
试验重复3 次,所有数据采用平均值±标准误差表示。单因素方差分析采用SPSS 26 进行,差异性分析采Duncan 多重范围检验法。响应面试验分析采用软件Design-Expert.V 8.0.6。图片绘制采用软件Origin 2018。
2 结果与讨论
2.1 固定化酶ANL-MARE的制备和表征
采用FT-IR 分析脂肪酶ANL-MARE 固定化前后的树脂,如图2 所示,总体而言,在ANLMARE 固定前后,树脂具有相似的特征吸收峰,这表明酶固定化后树脂的二级结构未受到破坏。其中,酶固定化后的树脂在3 448、2 927、2 855.09、1 733 和1 152 cm-1波长处峰面积增加。随着固定化酶ANL 在树脂上含量的增加,吸收峰3 448 cm-1附近显示出的强吸收峰为-OH 和酶特有的-NH-产生的伸缩振动[20]。2 927、2 855.09 cm-1吸收峰为-CH2或-CH3伸缩振动峰[21],表明ANL 与树脂成功相连接。吸收峰1 733 cm-1是-C=O- 伸缩振动峰,1 152 cm-1为C-N 的伸缩振动峰,与之前Michael等[22]的研究结果相似,以上结果证实了ANL 可能通过酰胺键和氢键作用成功与树脂结合。

图2 ANL-MARE 固定化前后的红外光谱变化Fig.2 The infrared spectral changes before and after immobilization of ANL-MARE
对固定化酶ANL-MARE 的蛋白载量与酶活性分析如表3 所示,固定化酶ANL-MARE 载量为13.97 mg/g,蛋白质吸附率高达92.37%,表明固定化效率较高。脂肪酶装载量和酶的吸附效率取决于树脂的比表面积和疏水性[23]。本研究中的树脂对ANL 吸附性能高于先前ANL 在壳聚糖包裹的MP-64 树脂上具有83.79%蛋白质吸附率的报道[24]。ANL-MARE 的比活力达79.52 U/mg,高于先前研究报道的ANL 在微孔ZIF-8 材料上制备的固定化酶的酶活力[25]。综上,固定化酶ANL-MARE 酶活力良好,可用于后续酶催化反应。

表3 固定化酶ANL-MARE的蛋白含量及酶活性Table 3 Protein content and enzymatic activity of immobilized enzyme ANL-MARE
2.2 PPP的富集及分析
先前研究报道,58℃棕榈硬脂中含有丰富的PPP[26,27]。PPP 是合成2-棕榈酸酯的良好底物来源,因此,获得大量的PPP 作为反应底物,是酶法合成OPL 的关键步骤。本试验采用溶剂法对棕榈硬脂中PPP 进行分提富集,利用PPP 在丙酮中的溶解度低于其他不饱和脂肪酸TAG 的性质,在溶剂中析出结晶,从而达到分离的目的。结果如图3,经过分提,产物中PPP 相对含量从分提前的42.84%提高到94.43%。对分提产物的脂肪酸组成进一步分析(表4),产物中总PA 和sn-2 PA 相对含量分别为92.80%和90.03%,相比富集PPP 之前分别提高了21.42%和27.17%。与先前Wang 等[28]、高亮等[19]采用溶剂法富集分提PPP 的研究结果相似。以上结果表明,分提产物中TAG 主要为PPP,此分提工艺可以有效富集棕榈硬脂中PPP,可以作为后续OPL 的酶法合成的良好底物来源。

表4 PPP分提富集前后的脂肪酸和sn-2脂肪酸组成(%)Table 4 Fatty acid and sn-2 fatty acid composition of palm stearin after fractionation
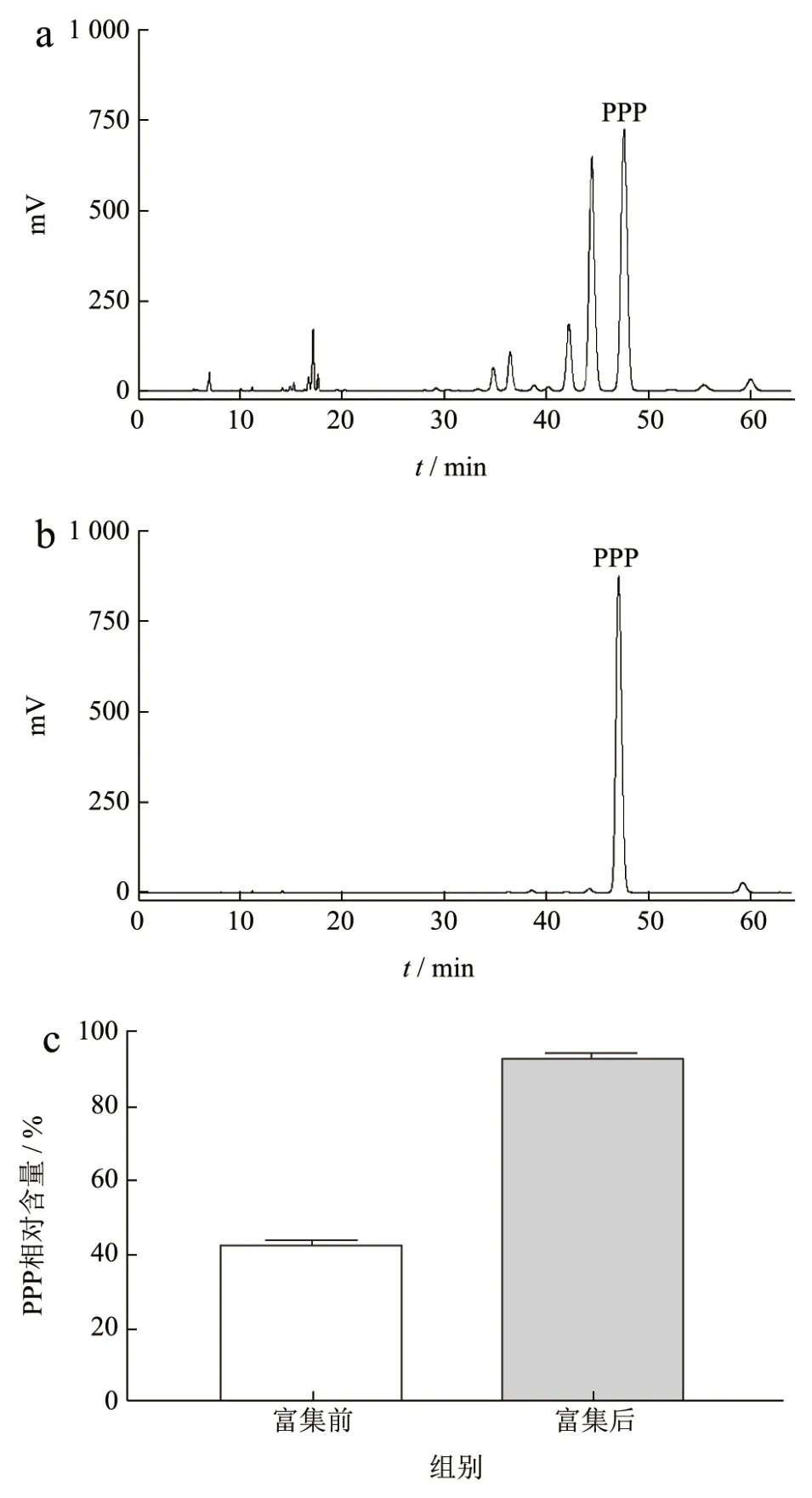
图3 PPP 的富集及LC-ELSD 液相分析Fig.3 Enrichment of PPP and LC-ELSD liquid phase analysis
2.3 酶促酸解法合成OPL的单因素优化
2.3.1 OA与LA摩尔比对合成OPL的影响
单因素试验考察各反应因素对OPL 占总TAG的相对含量以及sn-2 PA 相对含量的影响。酶法合成反应结束,采用碱法脱除产物中过量的脂肪酸以分离TAG,获得脱酸后产物中的TAG 得率可达90.40%,因此本研究采用碱法脱酸分离获得TAG。sn-1,3 位特性脂肪酶催化合成OPL 时,脂肪酸酰基供体OA 和LA 的比例是影响产物脂质结构的主要因素[28],试验首先考察底物中OA 与LA 摩尔比对酶法酸解合成OPL 的影响。如图4 所示,OA 与LA 摩尔比为1:0.75 时,OPL 和sn-2-PA 相对含量显著增加,OPL 从34.90% 显著增加至46.43%(P<0.05),sn-2 PA 相对含量达68.08%。OA 与LA 摩尔比为1:0.75~1:1.5 之间,OPL 相对含量呈下降趋势,且各摩尔比下产物sn-2-PA 相对含量没有显著差异(P>0.05)。以上结果可解释为当总脂肪酸的含量一定时,OA 与LA 比率越高会增加OA的插入率,易导致产物中OPO 含量增加,而OA 与LA 比率较低时,则易生成大量的LPL 脂质[29],两种情况均会使产物中OPL 得率降低。因此,选择OA 与LA 摩尔比为1:0.75 较为适宜。

图4 OA 与LA 摩尔比对酶促酸解法合成OPL 的影响Fig.4 Effect of OA/ LA molar ratio on the synthesis of OPL by enzymatic acidolysis
2.3.2 底物摩尔比对合成OPL的影响考察底物PPP 与脂肪酸酰基供体的摩尔比对酶法酸解合成OPL 的影响。如图5a 所示,PPP 与脂肪酸摩尔比为1:8~1:14 时,OPL 相对含量和sn-2 PA相对含量显著升高(P<0.05)。当继续增加摩尔比至1:16 时,合成OPL 相对含量没有显著变化,且sn-2 PA 相对含量降低,可能是酰基发生位移所致。在可逆反应中,高底物摩尔比可以增加酶与底物的碰撞频率[30],增加底物中游离脂肪酸的量可以提高酰基(脂肪酸)在sn-1,3 位的插入率。然而过多的脂肪酸可能会增加反应体系的酸度和粘性,从而抑制脂肪酶的活性,降低传质速率,这一结果与Michael 等[22]研究结果相类似。同时底物中更多的脂肪酸易增加后续脂肪酸脱除的难度。综上所述,选择摩尔比1:14 较为合适。

图5 不同反应因素对酶促酸解法合成OPL 的影响Fig.5 Effect of different reaction factorson the synthesis of OPL by enzymatic acidolysis
2.3.3 脂肪酶ANL-MARE添加量对合成OPL的影响考察脂肪酶添加量对酶法酸解合成OPL 的影响,如图5b 示,ANL-MARE 用量6%~12%,随着酶量的增加,OPL 相对含量显著增加(P<0.05)。然而,继续增加到14%加酶量与12%相比,合成OPL 相对含量没有显著差异(P>0.05)。sn-2 PA相对含量随酶量的增加呈现出先增加后趋于平衡,甚至在加酶量为14%时具有降低的趋势。以上结果解释为,在底物量一定的情况下,加入更多的脂肪酶,增加了底物与酶活性中心的接触,OPL 生成量显著提高。当反应趋于平衡时,继续增加脂肪酶对OPL产率的提高作用较小,而sn-2 PA 相对含量的下降可能由于过高的加酶量,反应过程中出现酰基位移所致[31]。因此,综合考虑,选择脂肪酶添加量为12%。
2.3.4 反应温度对合成OPL的影响
考察反应温度对酶法酸解合成OPL 的影响。由图5c 可知,在50~60 ℃之间,OPL 相对含量以及sn-2 PA 相对含量没有显著差异(P>0.05),随着温度增加至65 ℃,sn-2 PA 相对含量显著降低(P<0.05),在70 ℃时,OPL 相对含量和sn-2 PA 相对含量均显著降低(P<0.05)。前期研究发现,固定化酶ANL-MARE 的最适温度区间在40~60 ℃[15,16],这可能解释了本研究50~60 ℃对合成OPL 相对含量差异不大的原因。由于采用低于50 ℃温度无法充分溶解反应底物PPP,同时高温会产生更多的能耗,因此,选择50 ℃作为后续实验条件。
2.3.5 反应时间对合成OPL的影响
考察反应时间对酶法酸解合成OPL 的影响,如图5d。反应时间1~4 h 内,OPL 相对含量和sn-2 PA 相对含量显著升高(P<0.05),4~6 h 达到平衡,OPL相对含量和sn-2 PA 相对含量差异不显著(P>0.05)。反应8 h 时sn-2 PA 相对含量有所降低(P<0.05),这可能由于反应时间延长,分子发生酰基位移所致,这与Wang 等[12]的结果一致。因此,综合考虑选择反应时间为4 h。
2.4 酶促酸解法合成OPL响应面结果及分析
基于单因素试验结果,考察ANL-MARE 酶添加量(A)、PPP 与脂肪酸的底物摩尔比(B)、OA与LA 摩尔比(C)3 个因素,以OPL 相对含量(Y1),sn-2 PA 相对含量(Y2)为响应值,建立3 因素3 水平试验设计,具体设计和结果见表5,对实验数据进行多元回归拟合,得到二次多项回归方程:

表5 OPL酶法合成Box-Behnken试验设计及结果Table 5 Box-Behnken experimental design and results
根据方差分析结果可知(表6),回归模型的F值较高(F=32.69),P值极低(P<0.000 1),此回归模型呈极显著水平。该模型的决定系数(R2=0.976 8)和校正决定系数(=0.946 9)较为理想,说明该模型的实验误差较低且拟合程度良好。此外,失拟项F值(F=2.33)和P值(P=0.215 6)表明失拟项不显著,则该模型的稳定性较好,可用于OPL 的合成条件进行预测。根据表中各因素的F值和P值可知,一次项A、C 对结果影响极显著(P<0.01)、B 对结果影响显著(P<0.05),二次项A2、B2和C2的作用均呈极显著(P<0.01),交互项AB、AC、BC 对结果没有显著影响(P>0.05)。各因素对合成OPL 相对含量的影响顺序为:A>C>B,即加酶量>OA 与LA 摩尔比>底物摩尔比。

表6 OPL相对含量响应面结果方差分析Table 6 Variance analysis of response surface results fortherelativecontent ofOPL
由表7 方差分析结果可知,回归模型的F值较高(F=64.46),P值极低(P<0.000 1),此回归模型呈极显著水平。该模型的决定系数(R2=0.988 1)和校正决定系数(=0.972 7)较为理想,说明该模型的实验误差较低且拟合程度良好。此外,失拟项F 值(F=3.72)和P值(P=0.118 5)表明失拟项不显著,则该模型的稳定性较好,可用于OPL 的合成条件进行预测。根据表中各因素的F值和P值可知,一次项A、B 对结果影响极显著(P<0.01)、C 对结果影响不显著(P>0.05);交互项BC 对结果影响极显著(P<0.01),AB 对结果影响显著(P<0.05),AC对结果没有显著影响(P>0.05)。二次项A2、B2和C2的作用均呈极显著(P<0.01)。各因素对产物中sn-2 PA 相对含量的影响顺序为:A>B >C,即加酶量>底物摩尔比>OA 与LA 摩尔比。

表7 sn-2 PA相对含量响应面结果方差分析Table 7 Variance analysis of response surface results for therelative content of sn-2 PA
响应曲面可以更好地将各因素之间的交互作用可视化,如图6 所示,交互作用AB、AC、BC 的曲线弯曲,等高曲线呈椭圆形。交互作用对sn-2 PA相对含量的影响如图7 所示,BC 交互作用曲面最陡,且等高线密集,表明BC 交互作用对sn-2 PA 相对含量的影响最为显著,由图分析交互作用大小分别为:BC>AB>AC。


图6 加酶量、底物摩尔比和脂肪酸摩尔比的交互作用对OPL 相对含量的响应面图Fig.6 Response surface of the interaction of enzyme load,substrate ratio and fatty acids molar ratio on the relative content of OPL

图7 加酶量、底物摩尔比和脂肪酸摩尔比的交互作用对sn-2 PA 相对含量的响应面图Fig.7 Response surface of the interaction of enzyme load,substrate ratio and fatty acids molar ratio on the relative content of sn-2 PA
通过回归模型预测,得到合成OPL 最适工艺为:PPP 与脂肪酸的摩尔比1:14.27,脂肪酶添加量12.70%,OA 与LA 摩尔比为1:0.76,在此条件下的合成OPL 相对含量的预测值为48.24%,sn-2 PA 相对含量为72.76%。在此条件下进行3 次验证试验得到合成OPL 平均含量为47.93%,sn-2 PA 相对含量为71.69%,与模型预测值相近,表明响应面工艺模型拟合度较好,可用于OPL 酶法合成的指导。
2.5 固定化酶ANL-MARE与商业酶催化合成OPL的比较
目前广泛用于脂质修饰的商业化的sn-1,3 特异性固定化脂肪酶NS40086 和Lipozyme 435 在相似反应条件下,具有较好的催化活性。因此,在优化的反应条件下,试验将ANL-MARE 催化合成OPL的催化活性与商业酶NS40086 和Lipozyme 435 进行比较,结果如图8 所示。3 种脂肪酶催化反应中OPL 相对含量和sn-2 PA 相对含量随着反应时间的增加而增加,并在4 h 后趋于稳定。其中,ANL-MARE和NS40086 合成OPL 相对含量以及sn-2 PA 相对含量没有显著差异(P>0.05),sn-2 PA 相对含量均显著高于Lipozyme 435 反应所得(P<0.05)。且Lipozyme 435 在4 h 时OPL 相对含量甚至有所下降,说明反应过程中可能存在酰基位移。这些结果说明ANL-MARE 的催化活性和sn-1,3 特异性明显高于Lipozyme 435,并可达到与NS40086 催化合成OPL能力相当,其合成OPL 的相对含量高于先前高亮等[32]的研究采用NS40086 一步法催化合成42.07%OPL 的报道。综上所述,固定化酶ANL-MARE 具有较优的催化合成OPL 的活性。
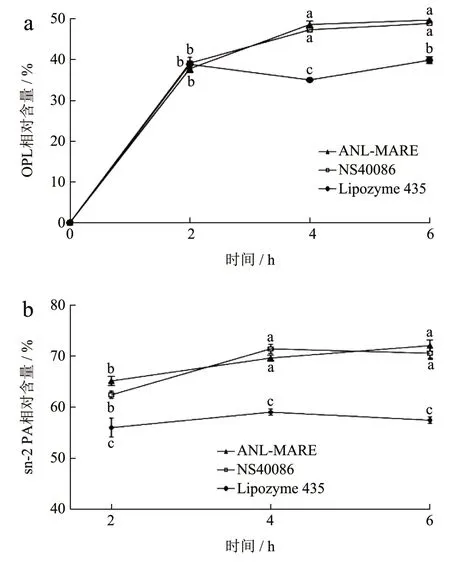
图8 固定化酶ANL-MARE 与商业酶催化合成OPL 的比较Fig.8 Comparison of immobilized enzyme ANL-MARE with commercial enzymes in catalytic synthesis of OPL
3 结论
本文制备和表征了固定化脂肪酶ANL-MARE,在无溶剂体系中,催化底物PPP、OA 和LA 合成OPL,通过单因素和响应面优化获得最优工艺:PPP 与脂肪酸的摩尔比1:14.27,ANL-MARE 脂肪酶添加量12.70%,OA 与LA 摩尔比为1:0.76,50 ℃下反应4 h。在此条件下的合成OPL 相对含量为47.93%,sn-2 PA 相对含量为71.69%。与商业固定化酶相比,ANL-MARE 作为催化合成OPL 的生物催化剂时,具有较优的催化活性和sn-1,3 位特异性。本研究提供了酶法酸解合成OPL 的新工艺,为人乳脂替代品的产业化制备奠定了理论基础。
