作物中叶酸合成及生物强化研究进展
2024-04-03马云王虹
马云 王虹


摘要 叶酸是四氢叶酸及其一碳单位取代衍生物的统称,对植物生长发育和人类健康发挥着至关重要的作用。人体本身不具备合成叶酸的能力,因此必须从膳食中获取。利用生物强化提高作物中叶酸含量是一种有效解决全球性叶酸缺乏的方法。介绍了叶酸的结构与功能、生物合成途径、叶酸的提取与检测方法,并重点阐述了不同作物中叶酸生物强化的现状,对全球叶酸强化做出展望。
关键词 作物;叶酸;生物合成;生物强化
中图分类号 Q 945 文献标识码 A 文章编号 0517-6611(2024)06-0010-07
doi:10.3969/j.issn.0517-6611.2024.06.003
开放科学(资源服务)标识码(OSID):
Research Progress on Folate Biosynthesis and Biofortification in Crops
MA Yun,WANG Hong
(State Key Laboratory of North China Crop Improvement and Regulation/Hebei Sub-center of National Maize Improvement Center of China/College of Agronomy, Hebei Agricultural University, Baoding, Hebei 071000)
Abstract Folate is a collective term for tetrahydrofolate (THF) and its derivatives substituted with one carbon unit, playing a crucial role in plant growth and human health. The human body cannot synthesize folate itself, so it must be obtained from the diet. Improving folate content in plants through biofortification is an effective method to address the global folate deficiency problem. This review introduced the structure, functions, the biosynthesis pathways, and the extraction and detection methods of folate. Moreover, it focused on the current status of folate biofortification in different crops, and prospected for global folate biofortfication.
Key words Crops;Folate;Biosynthesis;Biofortification
叶酸(folates)化学名为蝶酰谷氨酸(pteroylglutamic acid,PGA),又名维生素B9,是一种水溶性B族维生素,为四氢叶酸(tetrahydrofolate,THF)及其一碳衍生物的统称。叶酸作为一碳单位的供体和受体,参与着许多重要的生物化学反应,如甲基化循环、核苷酸与氨基酸的合成等,是人体生命活动所必需的微量营养物质[1]。植物和微生物自身可以从头合成叶酸,然而人类和其他高等哺乳动物因缺乏完整的叶酸合成系统,故需要通过膳食摄取叶酸。医学研究表明,成年人每天的叶酸建议摄入量为400 μg,孕妇则建议每天摄入600 μg叶酸才能有效防止胎儿先天性畸形[2]。但目前大部分地区人口的叶酸摄入量达不到这一标准,叶酸缺乏成为影响发达国家和发展中国家的全球性健康问题之一[3]。药剂补充和作物叶酸强化是目前解决叶酸缺乏问题的两种有效途径,前者对于偏远和贫穷地区的发展中国家来说难以实现。因此,通过对作物叶酸合成代谢途径的调控来提高作物中叶酸含量,成为解决叶酸摄入不足的新兴选择[4]。该研究综述了叶酸的结构与功能、叶酸的生物合成途径、叶酸的提取与检测技术及不同作物叶酸生物强化研究进展,并对解决叶酸缺乏问题进行展望。
1 叶酸的功能
1.1 叶酸缺乏与人类疾病
维持体内一定的叶酸水平对人类健康非常重要。人体叶酸缺乏可能诱发神经管缺陷、心血管疾病、癌症和其他出生缺陷等重要疾病[5],但产生疾病的生化原理和发育机制還尚不清楚。
神经管缺陷(neural tube defects,NTDs)是全球常见的胎儿畸形之一,其中脊柱裂和无脑畸形最为严重[6]。NTDs在全球孕妇中的发病率为0.5%~2.0%,我国是神经管畸形的高发区。我国2001—2004年NTDs发病率达0.11%[7],在一些不发达国家的农村地区,新生儿NTDs比例可达到4.80%[8]。据一项全球性新生儿出生缺陷报告显示,世界上每年有30万名新生儿患NTDs[9]。若孕妇孕前每天服用400 μg叶酸,可降低70%的NTDs发生率[10]。另外,叶酸的缺乏还会引起一系列神经认知退行性疾病,如阿尔茨海默病和其他形式的智能障碍综合征。Ramos等[11]指出红细胞的叶酸水平与人的认知能力直接相关且与老年痴呆的发生率呈负相关,而叶酸可以通过改善甲硫氨酸代谢产物、外周血炎症因子水平及DNA甲基化途径来改善认知功能。
研究发现,血浆的同型半胱氨酸是导致心梗和心血管疾病的危险因素[12],人体叶酸缺乏可能导致甲硫氨酸的生成受阻,进而引起血浆同型半胱氨酸浓度升高;当增加叶酸后甲硫氨酸循环又可继续进行,使血浆同型半胱氨酸浓度降低[13]。
大量研究都证实了叶酸与大多数疾病包括癌症密切相关,Choi[14]和潘慧颖等[15]发现叶酸缺乏和叶酸依赖性酶的多态性可能引起卵巢功能受损和直肠癌等癌症风险上升。
研究表明,叶酸缺乏也会对视觉系统和骨骼肌细胞产生影响,造成营养性视弱和骨骼肌发育障碍等疾病[16]。同时有研究发现,巨成红细胞贫血的疾病机制与叶酸缺乏有关[6]。因此,叶酸对于人体的生长发育是不可或缺的。
1.2 叶酸在植物中的作用
四氢叶酸(tetrahydrofolic,THF)及其衍生物作为一碳单位的供体和受体,是参与C1转移反应的重要辅酶,参与了生物体内许多重要的生命过程,如在嘌呤、胸苷酸、氨基酸及蛋白质的合成及甲基化循环等过程中叶酸均发挥重要作用[17]。在植物中,叶酸的一碳单位衍生物参与蝶啶和胸苷酸的形成以合成DNA;同时也通过参与丝氨酸、甘氨酸的相互转化以在光呼吸中发挥重要作用[18];另外,Pribat等[19]通过研究揭示了四氢蝶呤或10-甲酰四氢叶酸(10-formyltetrahydrofolate,10-F-THF)与芳香族氨基酸代谢之间新的联系。研究发现,叶酸通过S-腺苷甲硫氨酸与甲基化过程相联系实现甲基化循环[20],并通过甲基化循环为甜菜碱的生成提供一碳基团。此外,叶酸合成的中间代谢产物对氨基苯甲酸(p-aminobenzoate,p-ABA)的前体物分支酸可通过苯丙氨酸参与木质素的合成[21]。因此,在植物体中,叶酸对于
光呼吸以及木质素、甜菜碱、叶绿素的生物合成也发挥着重要的作用。
此外,叶酸在植物体内的新功能陆续被揭示。Lin等[22] 、Malhotra等[23]发现叶酸分子中的蝶啶环及叶酸衍生物在依赖叶酸的光裂合酶和隐花色素辅酶作用下起光能捕获天然色素的作用。Webb等[24]研究发现,植物体内叶酸衍生物的含量及分布状况会对整个植物的甲基化循环和叶绿素合成产生影响。Storozhenko等[25]发现,叶酸含量还与氧化逆境耐受性之间可能存在某种关系。
综上所述,叶酸在植物的生长发育过程中发挥着不可替代的作用,但关于叶酸在植物体内的深入研究仍需进一步挖掘。
2 叶酸的结构与生物合成途径
2.1 叶酸的化学结构
叶酸分子由蝶啶、对氨基苯甲酸和一个单(多)谷氨酸尾(Glu)3部分组成。蝶啶与p-ABA由一个亚甲基相连,p-ABA又通过γ肽键与一个或多个L型谷氨酸相连。理论上,叶酸分子有150多种存在形式[26],但目前在动植物组织中仅发现不到50种[27]。不同氧化水平的一碳单位(甲基、甲酰基、亚甲基等)可以在叶酸代谢相关酶的作用下连接到蝶啶的N5或p-ABA的N10位置,形成不同形式的叶酸衍生物。不同一碳取代基也可经酶促反应相互转化,用于各种代谢反应的C1基团供体[28],在不同的代谢途径中发挥不同的功能。蝶啶环有完全氧化、部分氧化及完全还原3种形式,所对应叶酸形式分别为蝶酰谷氨酸、二氢叶酸(dihydrofolate,DHF)和四氢叶酸[27]。叶酸的化学结构见图1。
2.2 叶酸的合成途径
2.2.1 叶酸的合成。
叶酸存在于植物细胞的线粒体、细胞质、液泡和质体中,其合成代谢途径极其保守。植物和微生物中叶酸的合成途径类似,蝶啶环和对氨基苯甲酸先分别在其细胞质和质体中合成,随后二者进入线粒体,与谷氨酸组成形成完整的叶酸分子,具体的叶酸合成途径如图2所示。
在植物中,蝶啶在细胞质内以尿苷三磷酸(GTP)为底物,在GTP环化水解酶I(GCHI)的作用下生成二氢新蝶呤三磷酸(DHN-P3),DHN-P3在三磷酸二氢新蝶呤焦磷酸水解酶(DHNTP)的作用下生成二氢新蝶呤一磷酸(DHN-P),再经非特异性磷酸酶去磷酸化后生成二氢新蝶呤(DHN)。DHN经二氢新蝶呤醛缩酶(DHNA)催化生成6-羟甲基二氢蝶呤(HMDHP)并进入线粒体。接着,进入线粒体的HMDHP在HMDHP焦磷酸激酶(HPPK)的催化下生成6-羟基二氢蝶呤焦磷酸(HMDHP-P2)。对氨基苯甲酸(p-ABA)的合成是在质体中以分支酸(Chorismate)为底物开始,通过氨基酸脱氧分支酸合成酶(ADCS)催化形成氨基酸脱氧分支酸(ADC),再经氨基酸脱氧核苷酸裂解酶(ADCL)催化形成p-ABA进入线粒体。HMDHP-P2和p-ABA在二氢蝶酸合成酶(DHPS)的作用下生成二氢蝶酸(DHP)。DHP与谷氨酸(Glu)在线粒体内的二氢叶酸合成酶(DHFS)的作用下生成二氢叶酸(DHF),最后,DHF在二氢叶酸还原酶(DHFR)的作用下被还原成单谷氨酸尾的四氢叶酸(THF)[29]。
2.2.2 葉酸的多聚谷氨酸化。
线粒体内合成的THF被转运至其他细胞器中,由叶酰多聚谷氨酸合成酶(FPGS)催化更多的谷氨酸残基逐一连接到叶酸中谷氨酸的γ位,形成具有多谷氨酸尾的THF。在模式植物拟南芥中,FPGS有3种异构体,分别位于细胞的细胞质、线粒体和叶绿体3个细胞器中行使加尾功能[30]。
自然形式的叶酸主要以多聚谷氨酸形式存在,叶酸的谷氨酸链长度在1~14,其随着叶酸所处细胞或细胞器的不同而不同。单谷氨酸叶酸是叶酸转运体所偏爱的形式,多谷氨酸叶酸则是参与一碳代谢的叶酸依赖型酶所偏爱的形式[31]。多尾形式的叶酸倾向于与蛋白质结合,稳定了叶酸的状态,同时可以降低多谷氨酸叶酸被γ-谷氨酰水解酶(GGH)水解的速率[32]。在植物中,谷氨酸尾长度越长,与其结合的酶的活性就越高,如甲硫氨酸合成酶、甘氨酸脱羧酶、丝氨酸羟甲基转移酶等[27]。同时也有研究表明,多聚谷氨酸形式对叶酸的区室化和依赖叶酸的代谢过程如光呼吸、泛酸和蛋氨酸的合成十分重要[33]。多聚谷氨酸链的长度变化可能存在着一定的生理作用,但其在不同生物中存在变化的原因还尚不明确[34]。
3 叶酸的测定
3.1 植物中叶酸的提取方法
植物性食品原料中叶酸含量较低,且受植物种类、收获季节、种植气候及采后处理等因素的影响[35]。由于叶酸极不稳定,易在光、热和氧气中降解,因此试验操作均应在暗光下进行,提取与测定过程中的玻璃仪器应为棕色,并在提取液中加入抗氧化剂。另外,由于叶酸被埋在基质中而不利于提取,且许多生物材料含有内源性共轭酶和能够引起各种形式的叶酸衍生物相互转化及分布变化的酶,进而影响了叶酸测定[36],因此研究植物叶酸的提取与测定具有一定的挑战性。
目前,提取叶酸的方法主要有化学法和酶解法。化学法是利用叶酸在中性或碱性溶液中溶解度高和稳定性强的特性,常采用热偏磷酸浸提法进行提取[37],如小米中叶酸的提取[38]。化学法的优点是操作简单、条件易控制且成本较低。酶解法则是利用叶酸轭合酶、蛋白酶和淀粉酶等联合处理样品,使与蛋白质、淀粉等相结合的叶酸充分水解出来[39]。叶晓利等[40]通过单因素和响应面法优化化學法磷酸盐溶液提取玉米叶酸的最佳条件为温度42 ℃、料液比1∶11.7(g∶mL)、活性炭用量1.2 g、提取时间7.3 h,且各因素对玉米籽粒中叶酸提取的影响为温度>料液比>时间。王博伦等[41]发现了一种利用酶解法优化玉米中5-甲基四氢叶酸(5-methyl-tetrahydrofolate,5-M-THF)的提取方法,评价了高效液相色谱法(HPLC)测定玉米中5-M-THF含量的准确性。结果表明,优化最佳提取参数为叶酸提取液pH为6.5,蛋白酶、α-淀粉酶、大鼠血清的添加量分别为0.028、12.000、14.000 μL/mL,固相萃取净化柱收集洗脱液2.5 mL,样品加标平均回收率为104.57%。优化后的HPLC条件适用于测定玉米中5-M-THF与总叶酸含量。另外,郭文柱[42]指出,三酶法包括了多谷氨酸尾的水解,若提取的目标化合物为多谷氨酸叶酸,二酶法(蛋白酶、α-淀粉酶)效果更佳,并发现玉米籽粒加入0.48~0.72 U/mg的α-淀粉酶,加入0.002 1~0.002 8 U/mg的蛋白酶效果最优。但是有一些学者仅仅用叶酸轭合酶处理谷物样品,其得到的结果却比与用3种酶处理的偏高,这可能是因为谷物的三酶处理导致叶酸的损失,由于萃取液的不稳定性和不良峰形的影响,不能准确测定出叶酸的含量[43]。
3.2 叶酸的检测方法
各种天然食品中存在的不同形式叶酸的分析和检测技术取得一定进展。检测叶酸的方法主要有:微生物法、高效液相色谱法、液相色谱串联质谱法、荧光法和电化学法等。测定食品中叶酸含量的标准方法为微生物法,通常所用的微生物有鼠李糖乳杆菌Lactobacillus rhamnosus(ATCC 7469)及粪链球菌Streptococcus faecalis(ATCC8043)。国家标准(GB 5009.211—2014)中选用的微生物为鼠李糖乳杆菌[28]。微生物法适用范围较广,但局限于样品中总叶酸含量的测定,无法单独测定不同叶酸衍生物的含量。HPLC弥补了这一缺点,基于不同叶酸衍生物与色谱柱亲和能力的差异,利用流动相对目标物进行梯度洗脱,可将样品中THF、5-M-THF、5-F-THF(5-Formyltetrahydrofolate)、10-F-THF、DHF等分离,进而测定不同形式叶酸的含量[36,44]。液相色谱串联质谱技术(liquid chromatograph mass spectrometer,LC-MS)测定食品中叶酸的方法近年也开始迅速发展,其优点是能同时快速地测定出数种不同叶酸形式及不同尾数谷氨酸形式的叶酸含量[36],且与HPLC相比,LC-MS具有更高的特异性、灵敏性和稳定性,但质谱在定量准确性方面低于HPLC,且设备及日常维护费用较高。另外,研究者们利用电化学法和荧光法可测定出食品或复合维生素制剂中叶酸的含量[45-46],但相对来说测定叶酸的形式较为单一[47]。综上可知,每种测定方法的应用各不相同,主要根据检测叶酸样品的种类来决定。
4 作物中叶酸强化的研究进展
强化作物中叶酸含量一般从两种途径出发,一是提高作物食用部分叶酸的生物利用率及减少叶酸降解,如改变食品加工方式,研究发现微生物发酵后的谷物与浸泡过的豆类食品中叶酸含量显著增加[48-50]。二是提高食物中叶酸的水平。近几十年来,通过植物育种、基因工程、代谢工程等手段鉴定叶酸积累关键调控基因以及优良等位变异,进而实现作物叶酸生物强化成为一种解决叶酸缺乏现状的重要途径。
4.1 基因工程
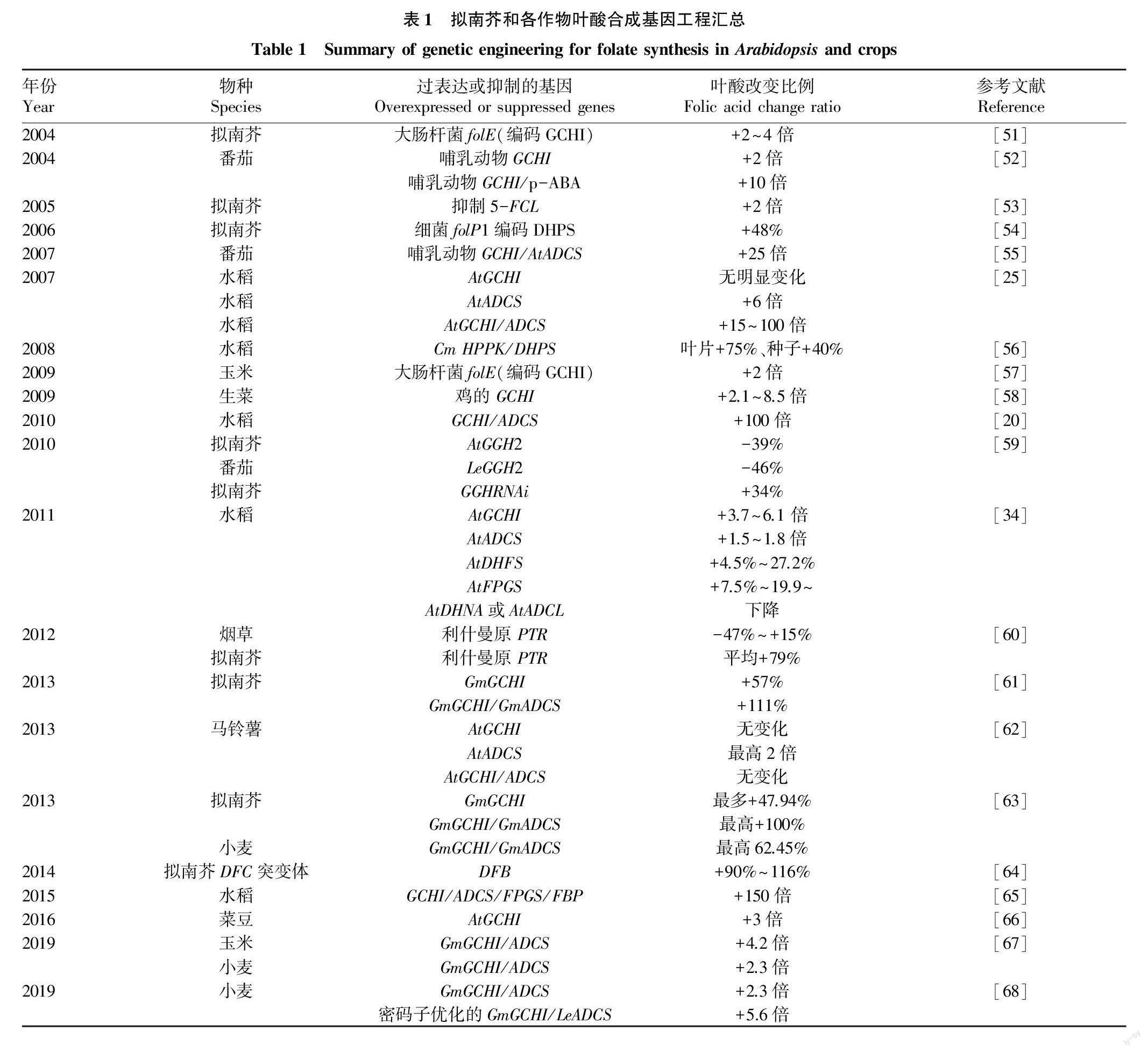
在利用基因工程加强叶酸生物合成方面,可通过提高叶酸合成支路中关键酶的基因转录水平来增加叶酸含量,也可通过降低GGH的活性来减少叶酸的降解。GCHI和ADCS是叶酸合成通路中2种重要的酶。研究表明,同时过表达GCHI和ADCS会比单独过表达其中1个基因对提升叶酸含量的效应更高[25]。只有当两者共同表达,使蝶啶和p-ABA含量同时增加,才能使叶酸含量显著增加。其他叶酸合成途径的酶也会引起叶酸含量的改变,拟南芥和各作物的叶酸代谢基因工程研究汇总结果见表1。
4.1.1 水稻。
水稻是我国及世界重要的粮食作物,但其米粒尤其是经蒸煮加工后的大米叶酸含量极低,不能满足人体的叶酸需求。在水稻的叶酸生物强化研究中,Storozhenko等[25]研究发现,仅表达AtGCHI的水稻株系中蝶啶含量提高25倍但叶酸含量未发现提高,仅过表达AtADCS的水稻株系p-ABA含量提高49倍且叶酸含量提高6倍,同时过表达AtGCHI和AtADCS的水稻株系中叶酸含量达到野生型对照的100倍,说明通过过表达ADCS提高p-ABA含量对于叶酸含量的提升至关重要。Blancquaert等[20]的研究也支持该结果。Gillies等[56]在水稻中过表达小麦TaHPPK/TaDHPS,发现株系叶片叶酸含量增加75%,籽粒叶酸增加40%。董薇[34]研究发现,过表达AtGCHI、AtADCS、AtDHFS和AtFPGS,叶酸含量分别增加3.7~6.1倍、1.5~1.8倍、14.5%~27.2%和7.5%~19.9%,但转AtDHNA或AtADCL的转基因水稻株系中叶酸含量下降。Blancquaert等[65]研究发现,在过表达OsGCHI和OsADCS的转基因水稻中同时过表达线粒体和细胞质定位的AtFPGS和牛来源的FBP,可以获得比野生型叶酸含量高出150倍的水稻株系,这是因为叶酸与FBP形成的化合物可以提高转基因水稻中四氢叶酸的稳定性[69]。
4.1.2 玉米。
玉米作为世界主要粮食作物之一,其叶酸合成相关基因和生物强化仍处于起步阶段且相关研究十分有限。已有的研究中,在玉米中过表达编码GCHI的大肠杆菌folE基因使得玉米籽粒叶酸含量增加了2倍[57],联合过表达大豆来源的GmGCHI/GmADCS使得叶酸含量增加了4.2倍。同时,连通[70]研究发现,在蛋白序列上,玉米籽粒中叶酸合成相关基因的转录水平与叶酸含量积累水平之间无明显相关性,表明玉米籽粒发育过程中的叶酸积累较为复杂,其调控机制仍需进一步探究。
4.1.3 番茄。
De La Carza等[52]研究发现,将哺乳动物小鼠的GCHI转入番茄中,蝶啶和叶酸的含量分别提高了140倍和2倍,将小鼠GCHI转入番茄中并施加外源性p-ABA,叶酸含量提高了10倍。接着,将番茄中的GCHI和ADCS基因过表达后,发现叶酸含量增加了25倍,这表明只有同时提高蝶啶和p-ABA的含量才能使叶酸含量增加。另外,也有研究证实,将番茄液泡中的LeGGH的含量提高3倍,可使叶酸含量下降46%[59]。
4.1.4 拟南芥和烟草。
在拟南芥的叶酸生物强化相关研究中,人们发现不同来源的GCHI和ADCS使蝶啶和p-ABA含量以不同的倍数增加。如Hanson等[51]将大肠杆菌中的GCHI编码基因folE转入拟南芥,其蝶啶和叶酸的含量分别增加了1 250倍和2~4倍;而姚琳[61]将大豆来源的GmGCHI和联合GmGCHI/GmADCS分别在拟南芥中过表达,结果发现叶酸的含量分别增加了57%和111%,这与汪冉冉[63]的试验结果类似。Akhtar等[59]在拟南芥将GGH的表达量提高3倍,使得叶酸含量减少39%,而通过RNAi减少GGH表达,会使多聚谷氨酸尾增加,导致拟南芥中叶酸含量增加34%。
除叶酸合成途径中GCHI、ADCS和GGH 3种主要的酶外,有学者在模式植物中展开了对其他酶如5-FCL、DHPS、PTR1的研究。5-FCL是合成叶酸主要形式5-F-THF的重要酶之一,但5-F-THF会抑制其他叶酸依赖性酶的合成。Goyer等[53]通过抑制拟南芥中5-FCL使得其叶酸含量增加了2倍。梁业红等[54]利用过表达细菌来源的DHPS使得叶酸含量提高45%,证实了DHPS在叶酸合成途径中的调控作用。鹿晔等[60]通过利用组成型启动子驱动依赖NADPH的利什曼原来源PTR1在拟南芥和烟草中进行过表达,发现转基因PTR1的拟南芥5-F-THF含量增加,转基因PTR1的烟草中5-M-THF含量增加。除此之外,陈金凤等[64]为了研究叶酰聚谷氨酸合成酶DFB对其同工酶DFC的弥补作用,在拟南芥DFC突变体中过表达AtDFB,使得叶酸增加了90%~116%,进而验证了DFB对DFC缺失的弥补作用。
4.1.5 其他物种。
在小麦中,研究发现分别过表达大豆来源的GmGCHI/GmADCS,可使叶酸含量提高62%~230%,但过表达密码子优化的GmGCH/GmADCS可使小麦叶酸含量提高5.6倍[63]。在生菜和菜豆中,分别过表达鸡和拟南芥来源的GCHI,使叶酸含量分别增加2.1~8.5倍和3.0倍,但在过表达AtGCHI和过表达AtGCHI/ADCS的马铃薯中叶酸含量无显著变化[58,62,66]。因此,在不同的植物中过表达相同的叶酸合成代谢酶,叶酸的含量变化存在差异。
在转录水平,马贵芳等[71]根据转录组分析结果揭示了ADCS、DHFR2 和GGH基因是谷穗叶酸积累的关键基因。张玖漪等[72]发现,在菠菜中除 SoGCHI、SoADCS和SoGGH外,大部分叶酸合成代谢途径相关基因的表达量与菠菜叶酸总含量没有明显的规律性。在黄瓜中,周琪等[73]发现CsFPGS、CsHPPK/CsDHPS、CsDHNA和CsADCS是影响黄瓜果实叶酸含量变化的关键基因,GCHI和ADCS是调控叶酸合成限速步骤的关键酶基因且功能相对保守。
综上所述,同时过表达GCHI基因和ADCS基因会使叶酸含量显著增加,但在相同作物中过表达不同来源的2个基因或在不同作物中过表达相同来源的2个基因结果导致叶酸增加比例不同,说明在不同植物中相同的酶可能发挥作用程度不同。另外,过表达HPPK、DHPS、DHFS、FPGS、DFB、GGHRNAi基因也会使作物中叶酸含量呈不同比例增加,但过表达GGH会使叶酸含量下降。这说明提高叶酸合成途径中相关酶的编码基因的表达或降低叶酸降解相关酶的编码基因的表达对叶酸含量的提高存在着巨大潜力。因此,虽然已成功运用一些工程策略来提高叶酸含量,但不同作物中叶酸的代谢途径较为复杂,未来仍需对其进行更深入的研究。
4.2 利用自然变异
由于公众对于利用基因工程技术来提高叶酸含量的接受度相对较低,有研究者开始通过现代育种手段来改善农作物中微量元素的含量。分子育种技术是生物强化的一种行之有效的途径,利用分子育种可以创制微量营养素强化作物,进而改善人们部分营养素缺乏现状。
通过育种手段进行叶酸生物强化的前提是叶酸含量在目标物种中存在着足够大的表型变异,进而可从群体中找到影响表型的数量性状位点。董薇[34]通过QTL定位在重组自交系群体和回交群体中鉴定出3个与水稻叶酸含量相关的QTL(qFC-3a、qFC-3b和qFC-3c),贡献率分别为7.8%、11.1%~15.8%和24.8%。Shahid[74]对524份对不同种质糙米中叶酸含量进行了全基因组关联分析,针对5-M-THF、5-F-THF、THF和总叶酸4种成分含量性状确定了16个显著关联SNP,并初步确定了16个叶酸含量候选基因。郭文柱[42]利用全基因组关联分析和候选基因关联分析发现了玉米籽粒中与5-F-THF含量变异显著关联基因ZmGFT1,并在该基因上发现2个显著SNP位点,可以解释5-F-THF含量变异的27.6%。接着对GFT1基因进行扩增重测序分析和表达分析发现了4个位于该基因5′UTR显著关联的InDel功能位点,并通过构建分离群体定位QTL与该基因的遗传变异互相印证。潘广磊等[75]通过对玉米GFT1基因的功能SNP位点分析发现,该位点存在3种类型的等位基因变异,即GGG、CAA、GAA,基因型为GGG的玉米中籽粒叶酸含量显著高于基因型为GAA的玉米。根据功能SNP位点开发的CAPS标记GFT1-2,能准确鉴定GFT1的基因型。同时赵桐等[76]也通过五引物扩增受阻突变体系(penta-primer amplification refractory mutation system,PARMS)识别到GGG基因型玉米材料的平均叶酸含量显著高于GAA和CAA 2種基因型。
目前,在作物中利用全基因组关联分析或QTL定位来寻找与叶酸性状相关联的位点的研究还相对较少,未来可以通过该途径寻找相应的变异位点,并进行进一步研究,为培育高叶酸作物品种打下分子基础。
5 展望
随着生活水平的提高,人们越来越重视叶酸缺乏的问题,叶酸生物强化也成为一个研究热点。目前,对植物体内叶酸的合成代谢途径已基本阐述清楚,然而,叶酸合成代谢的调控机理方面的研究还鲜有报道。研究者们已经在水稻和番茄等作物中通过基因工程手段提高叶酸含量,但此方法在其他作物中的应用仍待进一步研究。首先,后续研究可从转录水平、翻译水平和代谢水平3个层次对不同作物的不同组织器官进行分析,这将有助于准确找到叶酸生物强化的突破点。其次,应加强对现有植物种质资源的挖掘,通过关联分析和连锁分析,挖掘植物中调控叶酸的新基因,结合分子标记辅助育种,将优良等位变异快速导入具有其他优良农艺性状的亲本中,缩短育种周期、提高育种效率。最后,可利用动物饲喂试验测试叶酸生物强化的效果,阐明叶酸生物强化育种与人类健康的具体关系,明确不同叶酸衍生物对人体健康的影响,上述问题的回答将对人类的营养健康产生积极的影响。
参考文献
[1] GORELOVA V,DE LEPELEIRE J,VAN DAELE J,et al.Dihydrofolate reductase/thymidylate synthase fine-tunes the folate status and controls redox homeostasis in plants[J].The plant cell,2017,29(11):2831-2853.
[2] FATHE K,PERSON M D,FINNELL R H.The application of a chemical determination of N-homocysteinylation levels in developing mouse embryos:Implication for folate responsive birth defects[J].The journal of nutritional biochemistry,2015,26(4):312-318.
[3] BLANCQUAERT D,DE STEUR H,GELLYNCK X,et al.Present and future of folate biofortification of crop plants[J].Journal of experimental botany,2014,65(4):895-906.
[4] NOOR R A,ABIOYE A I,ULENGA N,et al.Large-scale wheat flour folic acid fortification program increases plasma folate levels among women of reproductive age in urban tanzania[J].PLoS One,2017,12(8):1-16.
[5] PAPAKOSTAS G I,CASSIELLO C F,IOVIENO N.Folates and S-adenosylmethionine for major depressive disorder[J].The Canadian journal of psychiatry,2012,57(7):406-413.
[6] SESHADRI S,BEISER A,SELHUB J,et al.Plasma homocysteine as a risk factor for dementia and Alzheimers disease[J].The New England journal of medicine,2002,346(7):476-483.
[7] 鄭庆鸣.全国神经管缺陷发生现状及空间分布影响因素分析[D].成都:四川大学,2006.
[8] BERRY R J,LI Z.Folic acid alone prevents neural tube defects:Evidence from the China study[J].Epidemiology,2002,13(1):114-116.
[9] CHRISTIANSON A,HOWSON C,MODELL C.March of dimes global report on birth defects:The hidden toll of dying and disabled children[R].White Plains:March of Dimes Birth Defects Foundation,2006.
[10] WALD N.Prevention of neural tube defects:Results of The Medical Research Council Vitamin Study.MRC Vitamin Study Research Group[J].Lancet,1991,338(8760):131-137.
[11] RAMOS M I,ALLEN L H,MUNGAS D M,et al.Low folate status is associated with impaired cognitive function and dementia in the Sacramento Area Latino Study on Aging[J].American journal of clinical nutrition,2005,82(6):1346-1352.
[12] WALD N J,WATT H C,LAW M R,et al.Homocysteine and ischemic heart disease:Results of a prospective study with implications regarding prevention[J].Archives of internal medicine,1998,158(8):862-867.
[13] 李丹,吴坤.叶酸和同型半胱氨酸对血管病的影响及其机制[J].疾病控制杂志,2006,10(3):299-302.
[14] CHOI S W,MASON J B.Folate and carcinogenesis:An integrated scheme[J].Journal of nutrition,2000,130(2):129-132.
[15] 潘慧颖,赖东梅.叶酸代谢影响卵巢功能的研究进展[J].上海交通大学学报(医学版),2017,37(6):854-858.
[16] SIJILMASSI O.Folic acid deficiency and vision:A review[J].Graefes archive for clinical & experimental ophthalmology,2019,257(8):1573-1580.
[17] 李莎,姜凌,王崇英,等.叶酸在植物体内功能的研究进展[J].植物学报,2012,47(5):525-533.
[18] RBEILL F,JABRIN S,BLIGNY R,et al.Methionine catabolism in Arabidopsis cells is initiated by a gamma-cleavage process and leads to S-methylcysteine and isoleucine syntheses[J].Proceedings of the national academy of sciences,2006,103(42):15687-15692.
[19] PRIBAT A,NOIRIEL A,MORSE A M,et al.Nonflowering plants possess a unique folate-dependent phenylalanine hydroxylase that is localized in chloroplasts[J].The plant cell,2010,22(10):3410-3422.
[20] BLANCQUAERT D,STOROZHENKO S,LOIZEAU K,et al.Folates and folic acid:From fundamental research toward sustainable health[J].Critical reviews in plant sciences,2010,29(1):14-35.
[21] DOUCE R,BOURGUIGNON J,NEUBURGER M,et al.The glycine decarboxylase system:A fascinating complex[J].Trends in plant science,2001,6(4):167-176.
[22] LIN C T,TODO T.The cryptochromes[J].Genome biology,2005,6(5):1-9.
[23] MALHOTRA K,KIM S T,BATSCHAUER A,et al.Putative blue-light photoreceptors from Arabidopsis thaliana and Sinapis alba with a high degree of sequence homology to DNA photolyase contain the two photolyase cofactors but lack DNA repair activity[J].Biochemistry,1995,34(20):6892-6899.
[24] WEBB M E,SMITH A G.Chlorophyll and folate:Intimate link revealed by drug treatment[J].The new phytologist,2009,182(1):3-5.
[25] STOROZHENKO S,BROUWER V D,VOLCKAERT M,et al.Folate fortification of rice by metabolic engineering[J].Nature biotechnology,2007,25(11):1277-1279.
[26] GOLDMAN I D.The characteristics of the membrane transport of amethopterin and the naturally occurring folates[J].Annals of the New York academy of sciences,1971,186:400-422.
[27] 劉丰源.高叶酸甜玉米种质资源筛选及其产品开发[D].广州:华南理工大学,2018.
[28] 任文芳,杨润强,顾振新,等.植物源食品中叶酸的生物合成与调控及其提取与检测技术研究进展[J].食品工业科技,2018,39(9):335-341.
[29] STROBBE S,VAN DER STRAETEN D.Folate biofortification in food crops[J].Current opinion in biotechnology,2017,44:202-211.
[30] WALLER J C,AKHTAR T A,LARA-NU'EZ A,et al.Developmental and feedforward control of the expression of folate biosynthesis genes in tomato fruit[J].Molecular plant,2010,3(1):66-77.
[31] ORSOMANDO G,DE LA GARZA R D,GREEN B J,et al.Plant γ-glutamyl hydrolases and folate polyglutamates:Characterization,compartmentation,and co-occurrence in vacuoles[J].Journal of biological chemistry,2005,280(32):28877-28884.
[32] WANG Y,NIMEC Z,RYAN T J,et al.The properties of the secreted γ-glutamyl hydrolases from H35 hepatoma cells[J].Biochim Biophys Acta,1993,1164(3):227-235.
[33] MEHRSHAHI P,GONZALEZ-JORGE S,AKHTAR T A,et al.Functional analysis of folate polyglutamylation and its essential role in plant metabolism and development[J].The plant journal,2010,64(2):267-279.
[34] 董薇.水稻籽粒叶酸含量QTL分析及生物强化[D].北京:中国农业科学院,2011.
[35] ARCOT J,SHRESTHA A.Folate:Methods of analysis[J].Trends in food science & technology,2005,16(6/7):253-266.
[36] TYAGI K,UPADHYAYA P,SARMA S,et al.High performance liquid chromatography coupled to mass spectrometry for profiling and quantitative analysis of folate monoglutamates in tomato[J].Food chemistry,2015,179:76-84.
[37] DOHERTY R F,BEECHER G R.A method for the analysis of natural and synthetic folate in foods[J].Journal of agricultural & food chemistry,2003,51(2):354-361.
[38] 邵丽华,王莉,白文文,等.小米叶酸提取与测定方法的研究[J].食品工业科技,2013,34(18):253-256,261.
[39] ZHANG H X,JHA A B,SILVA D D,et al.Improved folate monoglutamate extraction and application to folate quantification from wild lentil seeds by ultra-performance liquid chromatography-selective reaction monitoring mass spectrometry[J].Journal of chromatography B,2019,1121:39-47.
[40] 葉晓利,康文怀,李巧玲,等.响应面法优化玉米叶酸提取工艺的研究[J].河南工业大学学报(自然科学版),2019,40(4):64-70.
[41] 王博伦,顾丰颖,张帆,等.玉米中5-甲基四氢叶酸提取方法的优化及高效液相色谱法定量分析[J].食品科学,2020,41(18):196-202.
[42] 郭文柱.成熟玉米籽粒中5-甲酰四氢叶酸代谢关键基因的发掘及功能分析[D].武汉:华中农业大学,2019.
[43] HEFNI M,WITTHFT C M.Effect of germination and subsequent oven-drying on folate content in different wheat and rye cultivars[J].Journal of cereal science,2012,56(2):374-378.
[44] JASTREBOVA J,AXELSSON M,STRANDLER H S,et al.Stability of dietary 5-formyl-tetrahydrofolate and its determination by HPLC:A pilot study on impact of pH,temperature and antioxidants on analytical results[J].European food research & technology,2013,237(5):747-754.
[45] 郭健,李敏,孟妍,等.荧光分光光度法测定食品中叶酸的含量[J].中国公共卫生,2003,19(10):1259.
[46] 杜学萍.电化学传感器在叶酸及三聚氰胺检测中的应用研究[D].开封:河南大学,2014.
[47] KUCEKI M,DE OLIVEIRA F M,SEGATELLI M G,et al.Selective and sensitive voltammetric determination of folic acid using graphite/restricted access molecularly imprinted poly(methacrylic acid)/SiO2 composite[J].Journal of electroanalytical chemistry,2018,818:223-230.
[48] HEFNI M,WITTHFT C M.Folate content in processed legume foods commonly consumed in Egypt[J].LWT-food science and technology,2014,57(1):337-343.
[49] KATINA K,LAITILA A,JUVONEN R,et al.Bran fermentation as a means to enhance technological properties and bioactivity of rye[J].Food microbiology,2007,24(2):175-186.
[50] MO H Z,KARILUOTO S,PIIRONEN V,et al.Effect of soybean processing on content and bioaccessibility of folate,vitamin B12 and isoflavones in tofu and tempe[J].Food chemistry,2013,141(3):2418-2425.
[51] HANSON A D,GREGORY J F.Synthesis and turnover of folates in plants[J].Current opinion in plant biology,2002,5(3):244-249.
[52] DE LA GARZA R D,QUINLIVAN E P,KLAUS S M,et al.Folate biofortification in tomatoes by engineering the pteridine branch of folate synthesis[J].Proceedings of the national academy of sciences of the United States of America,2004,101(38):13720-13725.
[53] GOYER A,COLLAKOVA E,DE LA GARZA R D,et al.5-Formyltetrahydrofolate is an inhibitory but well tolerated metabolite in Arabidopsis leaves[J].Journal of biological chemistry,2005,280(28):26137-26142.
[54] 梁業红,ARNAUD B,范云六.异源表达细菌二氢喋呤合成酶基因提高拟南芥叶酸含量的研究[J].作物学报,2006,32(2):164-168.
[55] DE LA GARZA R I D,GREGORY J F 3rd,HANSON A D.Folate biofortification of tomato fruit[J].Proceedings of the national academy of sciences of the United States of America,2007,104(10):4218-4222.
[56] GILLIES S A,MCINTOSH S R,HENRY R J.A cereal crop with enhanced folate:Rice transgenic for wheat[R].2008.
[57] NAQVI S,ZHU C F,FARRE G,et al.Transgenic multivitamin corn through biofortification of endosperm with three vitamins representing three distinct metabolic pathways[J].Proceedings of the national academy of sciences of the United States of America,2009,106(19):7762-7767.
[58] NUNES A C,KALKMANN D C,ARAGO F J L.Folate biofortification of lettuce by expression of a codon optimized chicken GTP cyclohydrolase I gene[J].Transgenic research,2009,18(5):661-667.
[59] AKHTAR T A,ORSOMANDO G,MEHRSHAHI P,et al.A central role for gamma-glutamyl hydrolases in plant folate homeostasis[J].The plant journal,2010,64(2):256-266.
[60] 鹿晔,刘晓宁,姜凌,等.过表达蝶呤还原酶PTR1基因促进植物叶酸合成的研究[J].中国农业科技导报,2012,14(5):49-56.
[61] 姚琳.大豆GmGCHI和GmADCS基因共表达对拟南芥叶酸含量的影响[D].武汉:华中农业大学,2013.
[62] BLANCQUAERT D,VAN DAELE J,STOROZHENKO S,et al.Rice folate enhancement through metabolic engineering has an impact on rice seed metabolism,but does not affect the expression of the endogenous folate biosynthesis genes[J].Plant molecular biology,2013,83(4/5):329-349.
[63] 汪冉冉.过量表达GCHI和ADCS基因对提高植物叶酸含量的研究[D].兰州:兰州大学,2013.
[64] 陈金凤,孟红岩,张春义,等.过表达叶酰聚谷氨酸合成酶对低氮胁迫下叶酸突变体的影响[J].贵州农业科学,2014,42(5):7-11.
[65] BLANCQUAERT D,VAN DAELE J,STROBBE S,et al.Improving folate(vitamin B9)stability in biofortified rice through metabolic engineering[J].Nature biotechnology,2015,33(10):1076-1078.
[66] RAMREZ RIVERA N G,GARCA-SALINAS C,ARAGO F J L,et al.Metabolic engineering of folate and its precursors in Mexican common bean(Phaseolus vulgaris L.)[J].Plant biotechnology journal,2016,14(10):2021-2032.
[67] LIANG Q J,WANG K,LIU X N,et al.Improved folate accumulation in genetically modified maize and wheat[J].Journal of experimental botany,2019,70(5):1539-1551.
[68] BISMA RIAZ.利用基因工程途径强化小麦叶酸和花青素含量的研究[D].北京:中国农业科学院,2019.
[69] JONES M L,NIXON P F.Tetrahydrofolates are greatly stabilized by binding to bovine milk folate-binding protein[J].Journal of nutrition,2002,132(9):2690-2694.
[70] 连通.玉米叶酸代谢基因的生物信息和时空表达模式分析[D].北京:中国农业科学院,2016.
[71] 马贵芳,满夏夏,张益娟,等.谷子穗发育期转录组与叶酸代谢谱联合分析[J].作物学报,2021,47(5):826-846.
[72] 张玖漪,蔡晓锋,徐晨曦,等.菠菜叶酸合成代谢途径基因鉴定及表达谱分析[J].上海师范大学学报(自然科学版),2020,49(6):637-649.
[73] 周琪,刘小萍,薄凯亮,等.黄瓜叶酸合成关键基因克隆与分析[J].中国农业科学,2020,53(18):3764-3777.
[74] SHAHID MEHMOOD.谷物叶酸分析方法与水稻叶酸代谢遗传基础研究[D].北京:中國农业科学院,2021.
[75] 潘广磊,关媛,党冬冬,等.甜、糯玉米高叶酸基因型的CAPS标记开发[J].分子植物育种,2021,19(9):2970-2976.
[76] 赵桐,何欢,周德龙,等.基于PARMS标记辅助选择鲜食玉米高叶酸种质[J].分子植物育种,2022,20(23):7834-7840.
