牦牛胃溶菌酶抗小鼠腹泻的研究
2024-04-02杨杜基袁小迪张雨寒孙鸿炜刘益丽袁国荣江明锋
杨杜基 袁小迪 李 飙 张雨寒 孙鸿炜 刘益丽 袁国荣 江明锋*
(1.西南民族大学畜牧兽医学院,成都 610041;2.茂县科学技术和农业畜牧局,茂县 623200)
溶菌酶是由亚历山大·弗莱明发现的一种具有溶解细菌能力的酶[1],广泛存在于牛、羊、鹿等反刍动物和食叶猴以及麝雉的胃中,不过与大多数单胃动物不同,在反刍动物胃中表达的溶菌酶主要发挥消化酶的作用[2-4],主要功能是破坏瘤胃微生物发酵产生的大量菌体的细胞壁,释放其中的菌体蛋白供反刍动物消化吸收。与通常的溶菌酶不同,反刍动物的胃溶菌酶主要由皱胃分泌,为了适应皱胃中富含胃酸和胃蛋白酶的特殊环境,该酶通过适应性进化增加了对胃中酸性环境的适应和对胃蛋白酶的抗性[5]。研究表明,与普通溶菌酶相比,反刍动物胃溶菌酶氨基酸序列中发现6个氨基酸替换,即14号位赖氨酸/谷氨酸(Lys/Glu14)、21号位赖氨酸/谷氨酸(Lys/Glu21)、50号位谷氨酸(Glu50)、75号位天冬酰胺(Asp75)、87号位天冬酰胺(Asn87)、126号位赖氨酸/谷氨酸(Lys/Glu126)。此外,与非胃溶菌酶相比,其氨基酸序列中精氨酸(Arg)、天冬氨酸(Asp)、天冬酰胺(Asn)和谷氨酰胺(Gln)残基的数量较少且结构中不存在天冬氨酸-脯氨酸(Asp-Pro)键;这些进化适应使得反刍动物胃溶菌酶能抵抗胃中的酸性环境并发挥活性[5]。与单胃动物相比,反刍动物拥有更多溶菌酶基因,且在皱胃中高水平表达并发挥消化酶功能[6-11],使反刍动物能够利用植物材料作为食物来源[12]。
家畜的细菌性腹泻损害家畜胃肠消化和营养吸收功能,进而降低养殖业的效益。临床上发生腹泻后常采用抗生素进行治疗。此外,在家畜养殖业中为预防腹泻提高养殖效益,常在饲粮中添加抗生素以提高动物抵抗力。但抗生素滥用引起了严重的抗生素残留和微生物耐药性问题,甚至出现超级细菌[13]。2020年农业农村部颁布第194号公告,饲料生产企业停止生产含有促生长类药物饲料添加剂(中药类除外)的商品饲料,我国正式迎来饲料无抗时代。但“禁抗、减抗、限抗”政策给养殖业带来了挑战。因此,寻找饲用抗生素替代品,成为当前研究热点[14]。反刍动物胃溶菌酶有抗胃蛋白酶、抗胰蛋白酶、耐高温、适应胃酸环境等特点,从而避免了普通溶菌酶进入动物消化道后,在胃蛋白酶的作用下快速降解无法到达肠道发挥作用的缺点。因此,反刍动物胃溶菌酶具备替代饲料抗生素作为新一代抗腹泻饲料添加剂的潜力。目前市场上已经将普通溶菌酶作为饲料添加剂进行销售,据报道饲粮添加溶菌酶可显著提高断奶仔猪血浆总蛋白以及球蛋白含量,提高仔猪免疫力,有效提高仔猪的生长性能[15]。但普通溶菌酶会在胃中被降解,因此不能过胃入肠发挥抗腹泻功能。本课题组前期研究表明,从反刍动物皱胃黏膜中提取胃溶菌酶成本较高,获取量极低,难以在生产中得到应用。因此,通过基因工程技术大量生产溶菌酶是反刍动物胃溶菌酶产业化的必由之路,这将为我国饲料禁抗后提高家畜养殖效益作出贡献。
此前研究发现,高原反刍动物胃溶菌酶比非高原溶菌酶表现出更强的酶活,且该酶对pH、温度、胃蛋白酶和胰蛋白酶以及环境因素的耐受性更强[6];几种高原反刍动物胃溶菌酶均可过胃入肠发挥杀菌抗腹泻作用。此外,高原反刍动物胃溶菌酶还具备较好的抗胰蛋白酶和抗高温能力,能适应饲料加工过程中的加温加压过程[16]。溶菌酶对动物机体无毒、无残留,能杀死肠道致病菌,增强肠道抵抗力,防治动物腹泻,促进动物消化和营养吸收。Harpold和Brierley在毕赤酵母中成功表达黄牛胃溶菌酶C2,发酵液中重组溶菌酶浓度最高超过550 mg/L,在连续培养中重组溶菌酶浓度达到350 mg/L[17]。因此,用基因工程菌株生产反刍动物胃溶菌酶并将其作为饲料添加剂可应用于畜禽生产领域。
本研究使用致病性大肠杆菌O111感染昆明小鼠,建立小鼠腹泻模型,用纯化的牦牛胃溶菌酶和重组表达的牦牛胃溶菌酶对攻毒小鼠进行治疗;对牦牛胃溶菌酶对小鼠腹泻的治疗效果进行评价,以期为牦牛胃溶菌酶作为饲料添加剂奠定基础。同时进一步考虑将其应用到家畜细菌性腹泻疾病治疗领域,促进家畜养殖业的发展,该酶在饲料抗生素替代领域有着及其重要的价值和广阔的应用前景。
1 材料与方法
1.1 试验材料
麦洼牦牛皱胃黏膜、藏黄牛皱胃黏膜采集自四川省阿坝藏族羌族自治州茂县;麦洼牦牛胃溶菌酶基因(GenBank: KR186168.1)为本实验室克隆;PichiaPinkTM毕赤酵母表达系统菌株、pPinkɑ-HC表达载体购自Thermo Fisher公司。
1.2 牦牛胃溶菌酶的分离纯化
皱胃黏膜匀浆的制备:称取适当重量的牦牛和藏黄牛的皱胃黏膜放入匀浆器匀浆处理;匀浆液离心灭菌处理后用冰醋酸调节pH至4,再用氨水(10 mmol/L醋酸铵溶液,pH=6)进行粗纯化。将SP Sepharose HP柱安装于快速蛋白液相色谱仪(AKTA)上,用0.25 μm过滤器过滤粗纯液,收集流穿液,用起始缓冲液平衡液(pH=5.8的10 mmol/L醋酸铵)以1 mL/min的流速平衡分离柱,直到基线及电导稳定。用洗脱缓冲液(300 mmol/L醋酸铵,pH=8,含1 mmol/L NaCl)以1 mL/min的流速进行洗脱,收集含有胃溶菌酶的溶液。
1.3 重组胃溶菌酶的真核表达
牦牛胃溶菌酶基因(LYZ-1a)从pPICZαA-sLYZ质粒中扩增,将牦牛胃溶菌酶基因序列(LYZ-1a)送往上海生工生物公司合成。合成的牦牛胃溶菌酶基因序列(LYZ-1a)大小为444 bp。按表1的酶切体系用StuI和KpnI对扩增出的LYZ-Y-1a片段和pPinkα-HC vector进行双酶切,回收酶切后的LYZ-Y-1a基因片段和pPinkα-HC载体片段。连接回收后的LYZ-Y-1a基因片段和pPinkα-HC载体片段,得到重组质粒pPinkα-HC-LYZ-Y-1a。重组质粒pPinkα-HC-LYZ-Y-1a转化大肠杆菌并扩增提取,用AflⅡ线性化重组质粒,转化酵母菌感受态细胞,得到表达牦牛胃溶菌酶的重组酵母菌基因工程菌。鉴定正确的单克隆菌株进行小规模诱导培养,诱导表达96 h后,收集上清液,经过TCA沉淀再进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。
1.4 胃溶菌酶抗小鼠腹泻研究
选用健康、同龄、无特定病原体(SPF)级昆明小鼠作为试验鼠。正常饲粮饲养3 d后,随机挑选10只小鼠分为腹泻模型组和对照组,每组5只,接种大肠杆菌前禁食12 h,对照组注射300 μL生理盐水,腹泻模型组注射300 μL的致病性大肠杆菌O111悬液(浓度3.6×108CFU/mL)建立腹泻模型。
腹泻模型建成后,另取30只SPF级雄性昆明小鼠随机分为6组,每组5只,分为对照组(DZ组)、腹泻模型组(FX组)、抗生素治疗组(KSS组)、重组牦牛胃溶菌酶组(RYSL组)、牦牛胃溶菌酶组(YSL组)、溶菌酶产品(酶活性为50 U/mg)治疗组(AKY组)。饲喂4 d后进行攻毒,DZ组腹腔注射300 μL的无菌生理盐水,其余各组均注射300 μL的大肠杆菌O111悬液(浓度3.6×108CFU/mL)。攻毒24 h后,DZ组小鼠灌服200 μL的生理盐水;腹泻模型组小鼠灌服200 μL生理盐水;KSS组小鼠灌服200 μL的氨苄西林钠生理盐水溶液(浓度为50 g/L);RYSL组小鼠灌服200 μL的重组牦牛胃溶菌酶溶液(浓度为15 000 U/mL);YSL组小鼠灌服200 μL的分离纯化牦牛胃溶菌酶溶液(浓度为15 000 U/mL);AKY组小鼠灌服200 μL的溶菌酶添加剂(浓度为15 000 U/mL)。以上各组每隔12 h给药1次,记录小鼠的采食量、体重和腹泻情况,同时对试验小鼠进行血常规分析、病理学解剖、观察肠道组织的变化情况,同时对肠道微生物进行Alpha和Beta多样性分析。
1.5 血常规检测
试验第4天时,灌胃结束以后,按照分组对每只小鼠摘眼球采血(试验操作符合动物伦理),用乙二胺四乙酸(EDTA)抗凝管收集全血,测定白细胞数、淋巴细胞数和中性粒细胞数。
1.6 肠道组织切片制作及病理检测
试验第4天时,采血后所有小鼠颈椎脱臼致死、剖检(试验操作符合动物伦理),取十二指肠相同部位(2 cm)于4%多聚甲醛溶液中固定。1)脱水:75%酒精3 h,85%酒精1 h,95%酒精1 h 20 min,100%酒精Ⅰ25 min,100%酒精Ⅱ20 min,100%酒精Ⅲ 20 min。2)透明处理:100%酒精和二甲苯混合(比例1∶1)20 min,二甲苯Ⅰ15 min,二甲苯Ⅱ15 min。3)浸蜡:石蜡Ⅰ1 h,石蜡Ⅱ2 h,石蜡Ⅲ3 h。4)送里来医学生物中心进行石蜡包埋,切片,苏木精-伊红(HE)染色,光学显微镜下观察。
1.7 小鼠肠道菌群检测及16S rRNA多样性分析
小鼠颈椎脱位处死后,用无菌设备取出肠道内容物,称取0.2 g肠道内容物放入无菌离心管中,放置超低温冰箱。所获得的小鼠肠道微生物分组编号后送往美吉生物公司检测,包括16S rRNA的PCR扩增。
1.8 统计与分析
本试验所有的数据均采用SPSS 20.0统计软件进行分析,所有的计量资料均服从正态分布。统计分析过程中的正态分布资料的2个独立样本采用t检验分析,单一数据采用卡方分析,多个独立样本采用方差分析,组间方差齐采用LSD检验,方差不齐采用Kruskal-Wallis H检验。P<0.05为差异显著。
2 结果与分析
2.1 牦牛胃溶菌酶的分离纯化
牦牛皱胃黏膜经匀浆粗纯化后,用阳离子交换柱SP-Sepharose HP分步洗脱,测定洗脱后蛋白溶液的吸光度(图1-a)。根据洗脱峰分步收集蛋白洗脱液,并测定溶菌酶活性。结果表明,目标蛋白出现在洗脱波峰对应的收集管中(图1-a箭头标记处)。将分离纯化的牦牛胃溶菌酶进行SDS-PAGE分析(图1-b),泳道1和2中只显示1条蛋白条带,与Marker分子质量比较,推断出牦牛和藏黄牛胃溶菌酶的分子质量均约为15 ku。阳性克隆发酵上清接入BMMY培养基中进行表达,发酵上清液经TCA浓缩、SDS-PAGE电泳后,SDS-PAGE电泳结果(图1-c)显示,诱导表达后的牦牛胃溶菌酶分子质量大小约15.6ku。对所提取的重组质粒pPinkα-HC-LYZ-Y-1a用Kpn Ⅰ进行双酶切,重组质粒pPinkα-HC-LYZ-Y-1a用Afl Ⅱ线性化后进行琼脂糖凝胶电泳。结果(图1-d)显示,重组质粒发现大小约444 bp的酶切后产物,与理论大小相符。
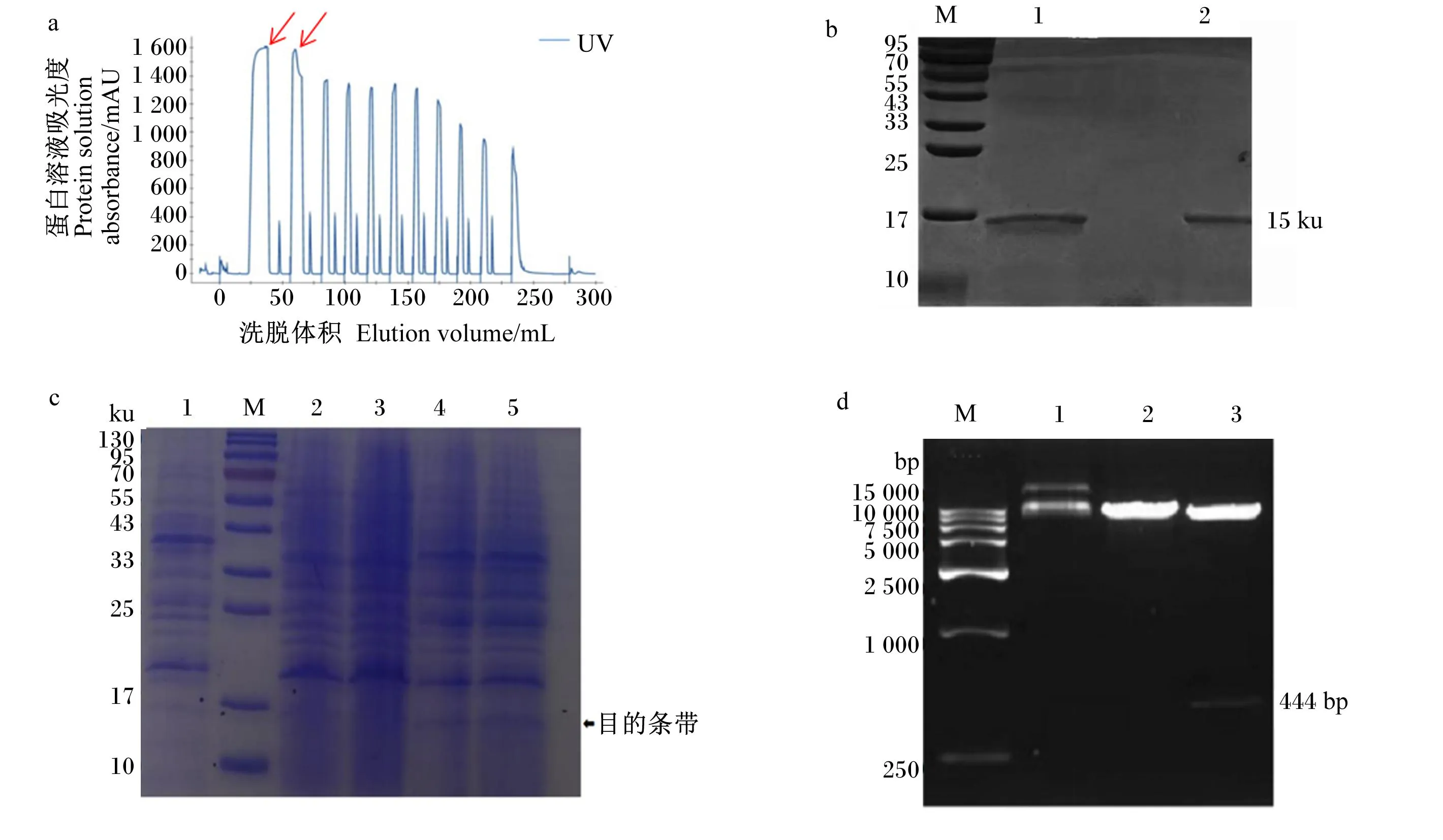
a:牦牛胃溶菌酶SP-Sepharose HP柱层析洗脱图 ;b:牦牛胃溶菌酶分离纯化SDS-PAGE分析; c: 阳性克隆发酵上清SDS-PAGE图; d: 重组质粒pPinkα-HC-LYZ-Y-1a的单/双酶切验证。a: elution diagram of yak stomachlysozyme SP-Sepharose HP column chromatography division; b: SDS-PAGE analysis of yak stomachlysozyme isolation and purification; c: SDS-PAGE map of the positive clone fermentation supernatant; d: recombinant plasmid pPinkα-HC-LYZ- Y-1a single/double enzyme digestion verification.
2.2 小鼠采食量的测定
由表2可知,试验开始前3天小鼠处于静养去应激阶段,小鼠自由采食。试验开始除DZ组外其余各组均腹腔注射致病性大肠杆菌O111攻毒并开始测定采食量,第2天,FX组和AKY组采食量显著低于DZ组(P<0.05),其余各组均无显著差异(P>0.05)。第3天,FX组和AKY组采食量显著低于DZ组(P<0.05),其余各组均无显著差异(P>0.05)。第4天,FX组采食量极显著低于DZ组(P<0.01),AKY组采食量与对照组相比差异显著(P<0.05),其余各组均无显著差异(P>0.05)。

表2 小鼠采食量
2.3 小鼠体重变化
攻毒后给药治疗3 d,各组小鼠的体重变化由表3可知,DZ组小鼠的体重每日增加。与DZ组相比,FX组小鼠体重呈下降趋势,在第7天体重差异显著(P<0.05);与FX组相比,KSS组、RYSL组、YSL组的小鼠体重在第4天攻毒后均出现明显的下降趋势,第6天治疗后体重明显呈上升趋势,均具有一定的治疗效果。而AKY组体重呈缓慢下降趋势,在第7天体重与DZ组相比显著降低(P<0.05),治疗效果不如其他组明显。
2.4 小鼠血常规变化
由表4可知,与DZ组相比,FX组白细胞数、淋巴细胞数和中性粒细胞数均有极显著升高(P<0.01);AKY组白细胞数极显著升高(P<0.01),淋巴细胞数显著升高(P<0.05),其余各组血常规数据均无显著差异(P>0.05)。

表4 小鼠血常规分析
2.5 小鼠肠道组织病理变化情况
观察到DZ组小鼠肠绒毛结构完整,绒毛长度、隐窝深度和肠壁厚度均为正常(图2-A);YSL组肠绒毛长度较DZ组有所增长且厚度增加,隐窝深度变深,肠壁增厚(图2-B);与FX组相比,RYSL组肠绒毛有所恢复,但不如前2组小鼠绒毛整齐,小肠绒毛有轻微的断裂现象,治疗效果较显著(图2-C);FX组可观察到肠绒毛出现萎缩,肠腔内存有脱落的肠绒毛部分,杯状细胞增多,隐窝较浅,肠壁厚度变薄,肠绒毛和肠腺有出血(图2-D);FX组肠壁增厚明显,肠绒毛厚度和长度较DZ组有明显增加,隐窝深度变深(图2-E);AKY组肠绒毛出现萎缩并有脱落情况出现,有少量杯状细胞,肠绒毛有少量出血且长度变短,隐窝深度变浅,肠壁厚度明显变薄(图2-F)

A:对照组;B:牦牛胃溶菌酶组;C:重组牦牛胃溶菌酶组;D:腹泻模型组;E:抗生素治疗组;F:溶菌酶产品治疗组。
2.6 小鼠肠道菌群的分析
2.6.1 Alpha多样性分析
由表5可知,与DZ组相比,FX组小鼠的Sobs指数和Chao指数均有所增高且有显著差异(P<0.05),Ace指数极显著增加(P<0.01),Simpson指数有所减小且差异显著(P<0.05);YSL组和RYSL组的Simpson指数显著增加(P<0.05)。
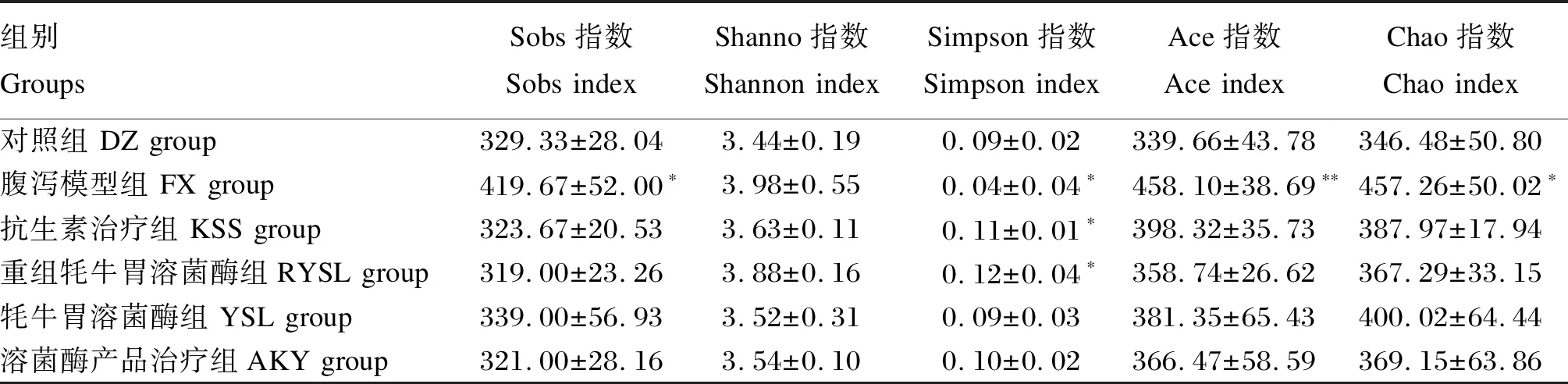
表5 小鼠肠道菌群Alpha分析
通过主坐标分析(PCoA)和非度量多维尺度分析(NMDS)可以比较各组小鼠肠道菌群群落结构的差异。由PCoA图(图3-A)可知,FX组和AKY组的菌群结构与DZ组存在明显差异,其余各组小鼠的肠道菌群结构接近于DZ组。NMDS图(图3-B)也表明,FX组和AKY组的菌群结构与DZ组有明显差异,使用牦牛胃溶菌酶和重组牦牛胃溶菌酶以及抗生素进行治疗会对腹泻小鼠肠道的菌群结构产生明显的影响。

A:主坐标分析图;B:非度量多维尺度分析图。A:principal co-ordinates analysis diagram; B:non-metric multidimensional scaling-analysis diagram.
2.6.2 小鼠肠道菌群门水平分析
由表6可知,小鼠肠道菌群的优势门有:厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)、变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)、弯曲杆菌门(Campilobacterota)、硫杆菌门(Desulfobacterota)、其他细菌门类,相对丰度平均值分别为65.34%、25.83%、4.36%、2.16%、1.18%、0.53%、0.60%。
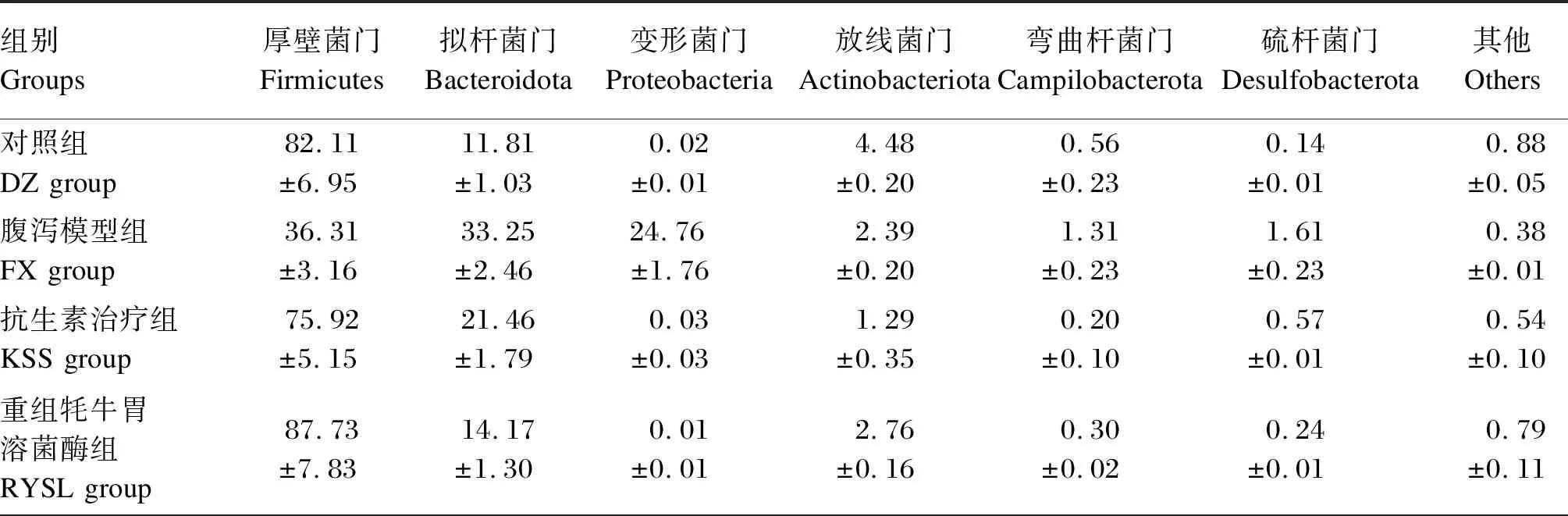
表6 小鼠肠道菌群门水平的相对丰度
通过序列比对获得各组小鼠肠道菌群相对丰度较高的前5个菌门,各组小鼠肠道菌群的门水平聚类分析热图如图4所示。结合图4和表6可知,与DZ组相比,FX组的变形菌门和弯曲杆菌门相对丰度显著增加(P<0.05),厚壁菌门、拟杆菌门和放线菌门的相对丰度显著降低(P<0.05)。与DZ组相比,AKY组变形菌门、拟杆菌门和弯曲杆菌门相对丰度显著增加(P<0.05),厚壁菌门和放线菌门相对丰度显著降低(P<0.05),RYSL组和YSL组的厚壁菌门和拟杆菌门相对丰度有所增加,但差异不显著(P>0.05)。
2.6.3 小鼠肠道菌群属水平分析
图5显示了小鼠肠道菌群相对丰度较高的20个菌属,其中有6个菌属的相对丰度大于1%。这6个相对丰度较高的菌属分别为未分类的穆里杆菌科(norank_f_Muribaculaceae)、穆里杆菌科(Muribaculaceae)、埃希氏-志贺氏菌属(Escherichia-shigella)、拟普雷沃氏菌属(Allopervotella)、拉氏杆菌科(Lachnospiraceae)和罗氏菌属(Roseburia)。各组小鼠肠道菌群属水平聚类分析热图如图7所示,与DZ组相比,FX组的埃希氏-志贺氏菌属和穆里杆菌科相对丰度显著增加(P<0.05),乳杆菌属(Lactobacillus)、拟普雷沃氏菌属和拉氏杆菌科的相对丰度显著降低(P<0.05)。与DZ组相比,AKY组埃希氏-志贺氏菌属和穆里杆菌科相对丰度显著增加(P<0.05),乳杆菌属、罗氏菌属和拉氏杆菌科相对丰度显著降低(P<0.05)。
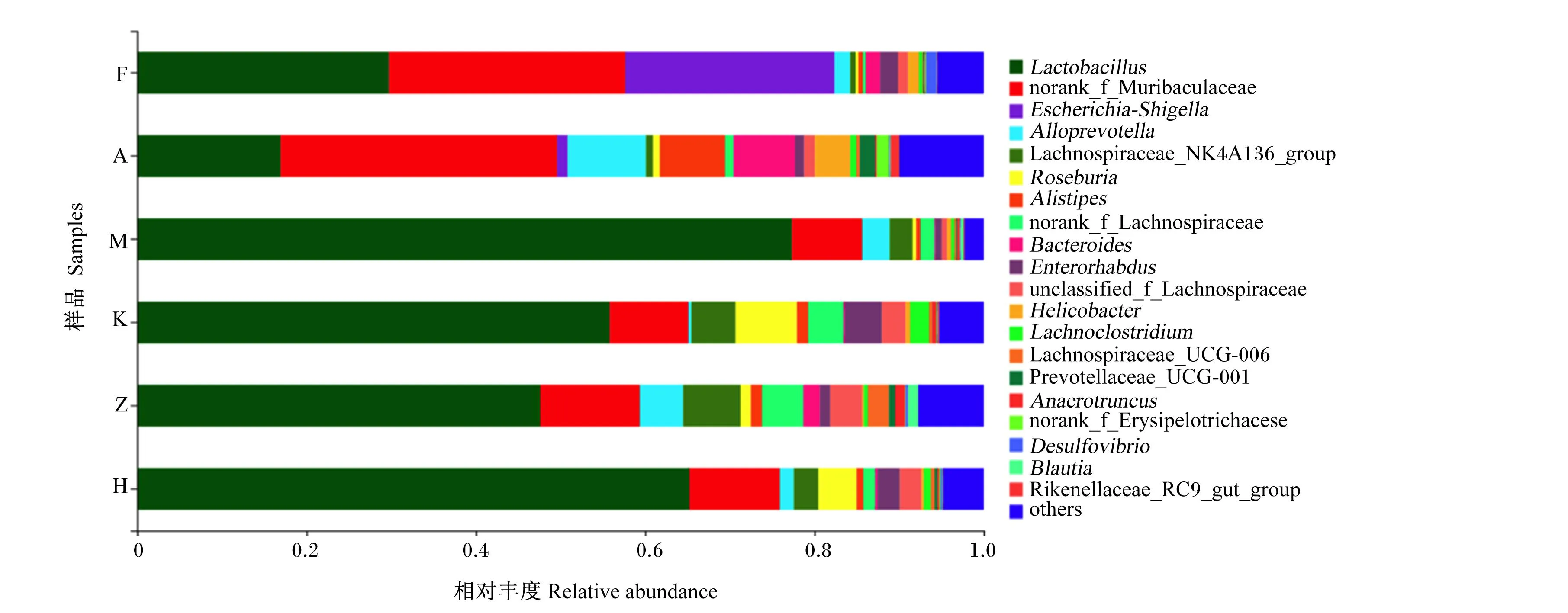
Lactobacillus:乳杆菌属;norank_f_Muribaculaceae:未分类的穆里杆菌科;Escherichia-Shigella:埃希氏-志贺氏菌属;Alloprevotella:拟普雷沃氏菌属;Lachnospiraceae_NK4A136_group:拉氏杆菌科NK4A136群;Roseburia:罗氏菌属;Alistipes:另枝菌属;norank_f_Lachnospiraceae:未分类的拉氏杆菌科,Bacteroides:拟杆菌属;Enterorhabdus:肠杆菌属;unclassified_f_Lachnospiraceae:未鉴别的的拉氏杆菌科;Helicobacter:螺杆菌属;Lachnoclostridium:拉克氏梭菌属;Lachnospiraceae_UCG-006:毛螺菌科UCG-006;Prevotellaceae_UCG-001:普雷沃氏菌科UCG-001; Anaerotruncus:厌氧菌属;Desulfovibrio:脱硫弧菌属;Blautia:经黏液真杆菌属;Rikenellaceae_RC9_gut_group:理研菌科RC9肠道群;others:其他。
与DZ组相比,RYSL组和YSL组的乳杆菌属相对丰度有所增加,但差异不显著(P>0.05)。
3 讨 论
家畜腹泻是一种常见疾病,影响家畜健康及生长。在犊牛腹泻中发现的常见病原体包括隐孢子虫、轮状病毒、冠状病毒、沙门氏菌、黏附和黏附大肠杆菌(EHEC、EPEC、STEC)和F5 (K99)大肠杆菌[18]。在家畜养殖业中长期大量使用抗生素不但使动物产生耐药性而且抗生素残留还可能对人类的健康存在威胁,因此迫切需要开发抗生素替代品。有研究表明,溶菌酶作为天然的抗菌物质,可以作为抗生素替代物治疗动物腹泻[19]。引起成年反刍动物感染性肠炎的病原有细菌、病毒和寄生虫。感染性肠炎最常见的临床症状为腹泻[20]。本研究中建立的小鼠腹泻模型,发现腹泻小鼠肠道菌群结构发生改变,牦牛胃溶菌酶给药能减轻小鼠腹泻症状,可能是牦牛胃溶菌酶通过调节肠道菌群结构及增强肠道免疫改善了肠道健康。
PichiaPinkTM毕赤酵母表达系统使通过颜色选择转化的菌落变得容易。未转化的PichiaPinkTM菌株会形成粉色菌落。当在不含腺嘌呤的平板上生长时,转化的PichiaPinkTM菌株会形成白色菌落。PichiaPinkTM酵母表达系统基于的酵母菌是毕赤酵母。毕赤酵母的优点包括快速生长、明确的遗传背景、简单的培养基配方和易于处理[21]。其表达的产物糖基化程度低、蛋白质活性高,更适合于高等生物基因的大量表达[22]。
肠道微生物群对宿主的健康具有重要作用[23],与宿主的免疫、代谢、消化、吸收和对疾病的易感性都密切相关。瘤胃中发酵产生的微生物在皱胃中被溶菌酶分解,以暴露前胃发酵形成的菌体蛋白,这些被分解的菌体蛋白在肠道内被吸收。在反刍动物中,防御性溶菌酶已转化为消化酶,以消化复胃中通过发酵产生的微生物蛋白,并将菌体蛋白作为营养提供给反刍动物[24]。目前关于重组牦牛胃溶菌酶治疗腹泻疾病及改善动物肠道菌群的研究较少,而重组鸡蛋清溶菌酶和重组人溶菌酶相关研究较多。研究表明,重组牦牛溶菌酶可改变肠道微生物菌群,改善动物的胃肠道健康[25-26]。因此,对重组牦牛胃溶菌酶研究和开发具有巨大的价值。本课题组在3种青藏高原反刍动物胃溶菌酶催化性能的比较研究中表明,重组牦牛胃溶菌酶(rysLYZ)比鸡和人溶菌酶更能抵抗胰蛋白酶失活,牛、牦牛和绵羊分别保留了其初始溶菌酶活性的29%、59%和96%,鸡和人的溶菌酶分别保留了初始活性的7%和6%[6]。这表明反刍动物溶菌酶比鸡和人溶菌酶更能抵抗胰蛋白酶失活。与普通溶菌酶相比,反刍动物胃溶菌酶的这一特性使得其更具有代替抗生素治疗家畜细菌性腹泻的潜力。牦牛胃溶菌酶具有抗菌活性,对金黄色葡萄球菌具有裂解活性[23]。
本研究对重组牦牛胃溶菌酶抗腹泻能力进行研究,以小鼠为试验对象,通过大肠杆菌O111建立腹泻模型。研究不同治疗方案对小鼠肠道组织形态、血液生化指标以及微生物丰度和多样性的影响。结果表明,大肠杆菌O111攻毒24 h后,除DZ组小鼠外,其他各组小鼠精神状态消沉,采食量减少,体重有所减轻;从肠道组织病理切片来看,腹泻模型组小鼠肠壁明显变薄,小肠组织排列紊乱,绒毛断裂严重,绒毛上皮细胞肿胀,肠上皮细胞损伤并且绒毛长度降低;从血常规检测结果来看,FX组小鼠白细胞数与DZ组相比差异极显著;Alpha多样性分析和Beta多样性分析表明,腹泻小鼠肠道菌群相对丰度和多样性均降低,在RUSL组和YSL组治疗后,Shannon、Chao和ACE指数均比DZ组高,表明肠道微生物的物种丰度增加,菌群丰度显著恢复。其中,牦牛胃溶菌酶变化最为明显。PCoA也进一步显示,各组肠道菌群具有较高的稳定性,且在菌群结构上具有显著差异。本试验研究了肠道菌群在门、属水平上的分布,在RYSL组和YSL组治疗后厚壁菌门相对丰度比FX组明显增加;RYSL组和YSL组与FX组比较,变形菌门相对丰度减少,变形菌门被认为是肠道菌群失调的标志[27],肠道中大量的变形菌门反映了发育迟缓或肠道菌群结构不稳定;通过灌喂牦牛胃溶菌酶和重组牦牛胃溶菌酶改变了小鼠肠道菌群的属结构。通过研究属水平的聚类分析热图,本研究发现,在属水平上,腹泻小鼠肠道内菌群与对DZ相比埃希氏-志贺氏菌属相对丰度有明显的增高,乳杆菌属相对丰度明显降低,这也能表明致病性大肠杆菌在腹泻小鼠肠道内的大量繁殖影响到肠道内有益菌的丰富度。RYSL和YSL组小鼠肠道内的埃希氏-志贺氏菌属已经不是优势属类,而且其小鼠肠道内的乳杆菌属相比DZ组有所增加,表明溶菌酶不仅可以杀灭和抑制肠道内致病性大肠杆菌的生长,还能促进肠道内益生菌群的繁殖。这表明灌服重组牦牛胃溶菌酶和牦牛胃溶菌酶对小鼠腹泻有明确的治疗的效果。
4 结 论
灌服重组牦牛胃溶菌酶和牦牛胃溶菌酶对由大肠杆菌菌株引起的小鼠腹泻有明确的防治效果。同时,通过研究肠道内绒毛长度和菌群丰富度可以看出重组牦牛胃溶菌酶和牦牛胃溶菌酶还有促进肠道修复损伤、增加肠道内益生菌数目的作用,因此,本试验认为重组牦牛胃溶菌酶或通过生化方法提取的原酶具有作为家畜抗腹泻饲料添加剂的潜力。
