桑叶低聚糖对大口黑鲈生长性能以及肠道消化酶活性、免疫功能和菌群的影响
2024-04-02钟文豪黎尔纳李庆荣邢东旭邹宇晓廖森泰周东来
钟文豪 黎尔纳 李庆荣 邢东旭 杨 琼 邹宇晓 廖森泰 周东来*
(1.广东省农业科学院蚕业与农产品加工研究所,广东省农产品加工重点实验室,广州 510610;2.广东海洋大学食品科技学院,湛江 524088;3.广东省特种水产功能饲料工程技术研究中心,佛山 528211)
大口黑鲈(Micropterussalmoides),俗名加州鲈鱼,隶属鲈形目(Perciformes)、太阳鱼科(Centrarchidae)、黑鲈属(Micropterus)。大口黑鲈生长迅速、肉质鲜美、营养价值高,是我国重要的淡水经济鱼类。根据《中国渔业统计年鉴2023》统计数据,2022年我国大口黑鲈年产量为80.25万t,产值超过200亿元。大口黑鲈为肉食性鱼类,以摄食活饵料鱼为主,且目前已经实现全程配合饲料养殖,然而,配合饲料在膨化制粒过程中添加的淀粉会对大口黑鲈的肠道造成损伤,导致肠道免疫力和抗氧化能力下降[1]。此外,随着养殖规模的扩大和养殖密度的不断增加,大量抗生素和化学品等被用于预防和治疗疾病,在防治病原菌的同时也降低了大口黑鲈肠道菌群中有益微生物的活性,对其营养吸收能力和免疫能力造成影响[2]。维持正常的肠道生理功能对于鱼类的健康和生长十分重要。研究表明,在饲料中添加适量的功能性添加剂,如益生元、益生菌或者植物提取物等,可以改善水产动物的肠道健康[3-5]。其中,益生元在水产中的应用研究成为行业研究热点。
目前,可用作饲料添加剂的益生元主要是由果糖、半乳糖、葡萄糖或木糖等单糖单元合成的低聚糖[6],如商品化的低聚果糖[7]、低聚半乳糖[8]和低聚异麦芽糖[9]等,它们能够改善水产养殖动物的健康,促进生长和提高免疫力等。不过,对植物来源的功能性低聚糖研究较少。
桑叶低聚糖(mulberry leaf oligosaccharides,MLO)是由桑叶多糖通过酶解得到,其主要由甘露糖、葡萄糖和半乳糖组成,分子质量小于3 000 u[10]。研究表明,MLO比桑叶多糖具有更高的益生活性和抗氧化能力[11]。MLO可以顺利通过消化系统到达结肠而不被降解[12],其在促进益生菌生长、提高益生菌产短链脂肪酸能力方面具有很强的活性[11]。截至目前,MLO作为饲料添加剂在大口黑鲈中的应用研究未见报道。因此,本研究旨在探究饲料中添加不同水平MLO对大口黑鲈生长性能、消化酶活性以及肠道组织形态、免疫功能和菌群的影响,为MLO在大口黑鲈配合饲料中的合理应用提供依据。
1 材料与方法
1.1 MLO的制备
本试验采用多糖含量为70%(采用苯酚硫酸法[13]测定)的桑叶多糖提取物,并参考本实验室前期Hu等[11]建立的酶解法来制备MLO,具体方法如下:首先将桑叶多糖提取物进行酶解反应,酶解条件为添加1 500 U/mL β-葡聚糖酶,酶解温度51 ℃,酶解时间4 h;然后将酶解后的水解物置于沸水浴中10 min使β-葡聚糖酶变性失活,于4 000 r/min离心10 min去沉淀,得到上清液;最后将上清液进行冷冻干燥,得到MLO。
1.2 试验设计
试验选择平均初始体重为(26.89±1.16) g的大口黑鲈幼鱼450尾,随机分成3组,每组3个重复,分配到9个直径为75 cm的养殖桶中(养殖水体为350 L),每桶50尾。对照组饲喂基础饲料,试验组分别饲喂在基础饲料的基础上添加0.5%和1.0% MLO的试验饲料。试验期80 d。
1.3 试验饲料
采用加州鲈鱼商品化配合饲料作为基础饲料,通过拌料的方式制备获得含有0.5%和1.0%MLO的试验饲料。具体的制备方法如下:分别称取5和10 g MLO干粉,分别加入到50 g无菌水中,充分搅拌溶解,然后将得到的MLO溶液分别用喷壶均匀喷洒到1 kg基础饲料上,对照组饲料喷洒50 g无菌水。将喷洒混合均匀的饲料分别在烘箱中50 ℃加热1 h烘干水分,得到含0.5%和1.0% MLO的试验饲料,将制备好的饲料分装后储存于4 ℃冰箱备用。基础饲料营养水平见表1。

表1 基础饲料营养水平(风干基础)
1.4 饲养管理
试验所用大口黑鲈为市售,试验鱼先在广东省农业科学院蚕业与农产品加工研究所室内循环水养殖系统中暂养2周,暂养期间每天用基础饲料饲喂。室内循环水养殖系统由微滤系统、生化反应系统、蛋白质分离器、紫外消毒装置和养殖桶组成,养殖水源为经过消毒、曝气后的自来水,循环养殖系统总水体为10 m3,水流量为20 m3/h。正式试验前,停料24 h,按照试验设计准备试验鱼。试验期间,每天投喂2次(09:00和16:30各1次),投喂量为鱼体重的2%~4%,将投喂0.5 h后未摄食完的饲料捞出,烘干水分后称重,准确记录每天饲料采食量和试验鱼死亡情况。试验过程中,每周换水3次,每次换水量为每个养殖桶水量的1/4,养殖期间水温为22.4~29.4 ℃,溶氧量≥5.0 mg/L,亚硝酸盐含量≤0.05 mg/L,氨态氮含量≤0.2 mg/L,pH为7.0~8.2,自然光照周期。
1.5 样品采集
试验结束后,禁食24 h,从每个养殖桶随机选取9尾鱼,用MS-222麻醉后分别测量体长、体重,然后进行解剖,取内脏、肝脏并称重,记录体重、体长、内脏和肝脏重量,用于计算终末体重、肥满度(CF)、脏体比(VSI)和肝体比(HSI)。
从每个养殖桶随机选取3尾鱼进行解剖,分离肠道,去除表面脂肪,取长度约1 cm的中肠,用3%多聚甲醛固定液固定,另取部分中肠,用液氮速冻后于-80 ℃保存,用于消化酶活性测定。
从每个养殖桶随机选取3尾鱼,用MS-222麻醉后使用焦碳酸二乙酯(DEPC)预处理过的无菌无酶解剖工具于冰上迅速解剖并分离出肠道,剪取中肠(与上述用于切片制作的肠道片段相同位置)约50 mg的组织迅速放入1.5 mL无菌无酶离心管中,液氮速冻后于-80 ℃保存备用,用于肠道各基因相对表达量的测定。另从每个养殖桶中随机选取2尾鱼,解剖后取全肠装入15 mL无菌离心管中,置于液氮中速冻后于-80 ℃保存,用于肠道微生物16S rDNA测序。
1.6 指标测定
1.6.1 生长性能
生长性能相关指标计算公式如下:
增重率(WGR,%)=100×(终末体重-初始体重)/初始体重;特定生长率(SGR,%/d)=100×(ln终末体重-ln初始体重)/饲养天数;摄食率(FR,%/d)=100×摄食量(FI)/[(初始体重+终末体重)/2]/饲养天数;FI(g/尾)=摄食饲料总量/[(初始尾数+终末尾数)/2];饲料系数(FCR)=摄食饲料总量/(终末体重-初始体重);CF(g/cm3)=100×体重(g)/体长3(cm3);HSI(%)=100×肝脏重量(g)/体重(g);VSI(%)=100×内脏重量(g)/体重(g)。
1.6.2 消化酶活性
将储存在-80 ℃的肠道组织在冰上解冻,准确称取组织重量,按重量(g)∶体积(mL)=1∶9的比例,加入9倍体积的生理盐水,冰水浴条件下机械匀浆,在4 ℃、2 500 r/min条件下离心10 min,取上清液,采用试剂盒(南京建成生物工程研究所)测定肠道α-淀粉酶(AMS)、脂肪酶(LPS)和胰蛋白酶(TRY)活性,具体方法参照试剂盒说明书进行。
1.6.3 肠道组织形态
肠道组织在3%多聚甲醛固定液中固定24 h后,将固定好的肠道组织进行石蜡包埋,制作石蜡切片,切片厚度为6 μm,用苏木素-伊红(HE)染色。采用全景切片数字扫描仪(PANNORAMIC-1000,3DHISTECH)对切片进行扫描拍照,利用CaseViewer 2.2软件(3DHISTECH)截取切片组织照片,然后使用Image-Pro Plus 6.0(Media Cybemetics)分析软件分别测量肠绒毛高度、绒毛宽度和肌层厚度,每个切片分别测量6组数值。
1.6.4 肠道菌群
肠道菌群测序由广州基迪奥生物科技有限公司进行。从大口黑鲈肠道中提取基因组DNA后,采用带有测序接头(barcode)的特异引物扩增16S rRNA的目标区域,并使用AMPure XP Beads对扩增产物进行纯化;采用ABI StepOnePlus实时荧光定量PCR(qRT-PCR)仪(Life Technologies,美国)进行定量分析,并使用Illumina NovaSeq 6000测序平台进行测序,测序模式选择PE250;测序结束后得到raw reads,使用FASTP软件和FLASH软件对raw reads进行过滤和拼接,得到clean tag,对clean tag进行聚类,去除聚类处理,得到有效数据effective tag;在effective tag数据的基础上聚类得到操作分类单元(OTU)。基于之前数据的处理,根据OTU的结果,对其进行物种注释;同时,对OTU进行丰度、指示物种分析、alpha多样性分析和在门和属的水平分布上进行群落结构分析。
1.6.5 肠道RNA提取和qRT-PCR
参照RNA Easy Fast动物组织总RNA提取试剂盒(TIANGEN)说明书从肠道组织样品中提取总RNA,利用琼脂糖凝胶电泳法检测总RNA完整性,并使用NanoDrop 2000分光光度计(Thermo Fisher Scientific,美国)检测总RNA浓度和纯度,并适当稀释至1 000 ng/μL。参照FastKing RT Kit反转录试剂盒(TIANGEN)说明书进行反转录制备cDNA模板。
根据NCBI已知白细胞介素-8(IL-8)、白细胞介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)、核因子-κB(NF-κB)、转化生长因子-β(TGF-β)、β-肌动蛋白(β-actin)序列使用Premier 5.0软件设计引物,由生工生物工程(上海)股份有限公司合成,引物信息见表2。qRT-PCR反应体系为10.0 μL,包括5.0 μL 2×ChamQ SYBR qPCR Master Mix、0.3 μL PCR正向引物(10 μmol/L)、0.3 μL PCR反向引物(10 μmol/L)、1.0 μL cDNA模板和3.4 μL双蒸水。qRT-PCR定量仪器为Bio-Rad MiniOptionTM实时荧光定量PCR仪(Bio-Rad,美国)。PCR反应条件为95 ℃预变性3 min,95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s,40个循环,之后形成熔解曲线。所有qRT-PCR进行3次重复,以β-肌动蛋白为内参基因,使用2-△△Ct方法计算目标基因的mRNA相对表达量。

表2 引物信息
1.7 数据统计分析
试验数据采用SPSS 26.0软件进行单因素方差分析(one-way ANOVA),并用Duncan氏法进行组间显著差异性的多重比较检验,试验结果采用平均值±标准差(mean±SE)形式表示,P<0.05表示差异显著。肠道菌群相关数据分析均在Omicsmart云平台(www.omicsmart.com)上进行。
2 结果与分析
2.1 饲料中添加MLO对大口黑鲈生长性能的影响
由表3可知,与对照组相比,饲料中添加0.5%和1.0% MLO显著降低大口黑鲈FCR和VSI(P<0.05),饲料中添加1.0% MLO显著降低HSI(P<0.05);饲料中添加MLO对终末体重、WGR、SGR、FR、FI和CF均无显著影响(P>0.05)。
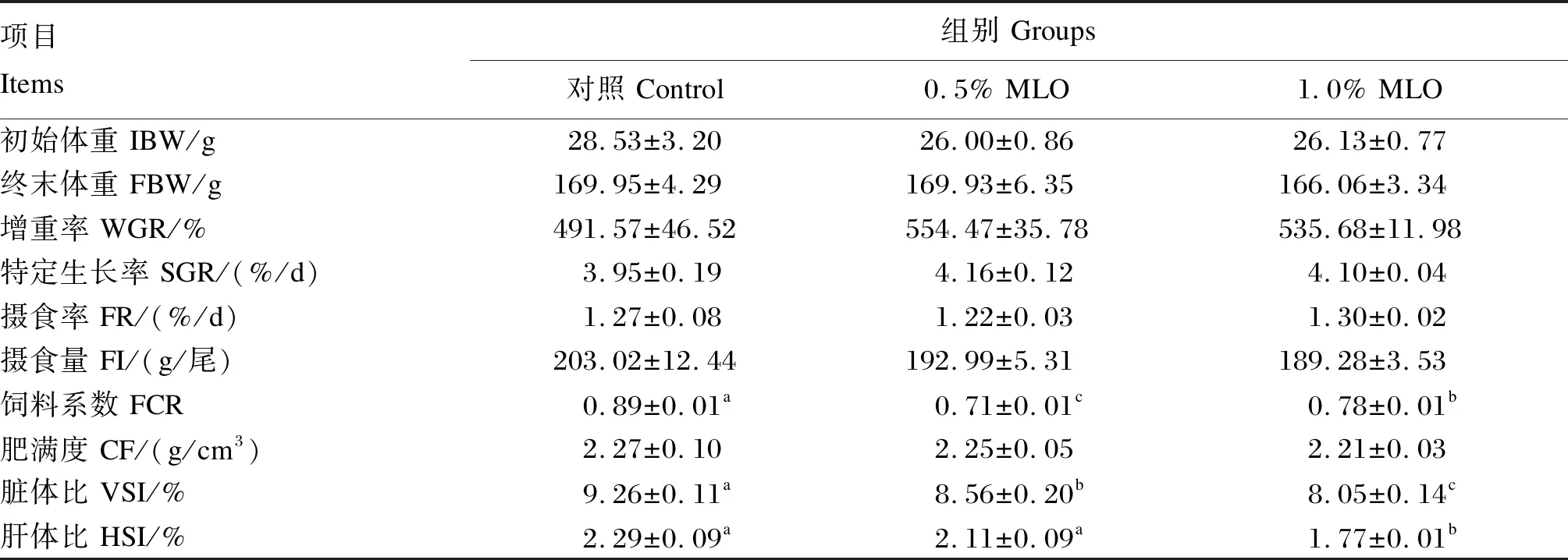
表3 饲料中添加MLO对大口黑鲈生长性能的影响
2.2 饲料中添加MLO对大口黑鲈肠道消化酶活性的影响
由表4可知,与对照组相比,饲料中添加0.5%和1.0% MLO显著提高大口黑鲈肠道α-淀粉酶、脂肪酶和胰蛋白酶活性(P<0.05),说明饲料中添加MLO能够显著提高大口黑鲈肠道消化酶活性。

表4 饲料中添加MLO对大口黑鲈肠道消化酶活性的影响
2.3 饲料中添加MLO对大口黑鲈肠道组织形态的影响
如图1所示,各组大口黑鲈肠道组织结构完整,排列有序,无混乱、脱落现象。由表5可知,各组之间肠道绒毛高度、绒毛宽度和肌层厚度均无显著差异(P>0.05),但试验组肠道绒毛高度、绒毛宽度和肌层厚度相对于对照组均有所提高。

ML:肌层 muscularis;D:黏膜皱襞 duplicature;SM:黏膜下层 submucosa;GC:杯状细胞 goblet cell。
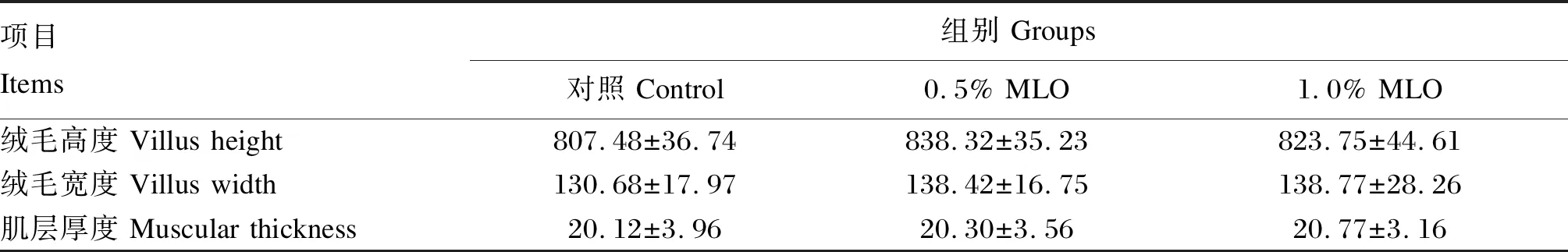
表5 饲料中添加MLO对大口黑鲈肠道组织形态的影响
2.4 饲料中添加MLO对大口黑鲈肠道菌群的影响
如图2所示,对获得的有效数据进行统计分析,共得到1 481个OTU,其中各组共有OTU有181个。大口黑鲈肠道菌群alpha多样性分析结果见表6,与对照组相比,试验组Sobs指数、ACE指数和Chao1指数显著降低(P<0.05);0.5% MLO组Simpson指数显著高于对照组和1.0% MLO组(P<0.05),而各组间Shannon指数无显著差异(P>0.05)。
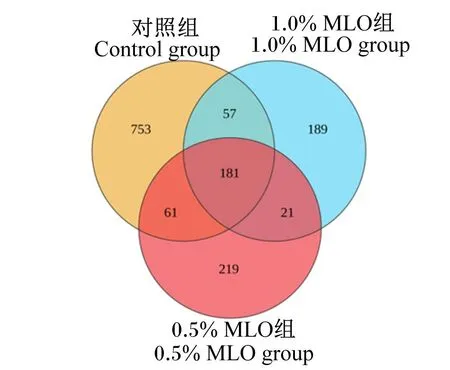
图2 大口黑鲈肠道菌群OTU维恩图
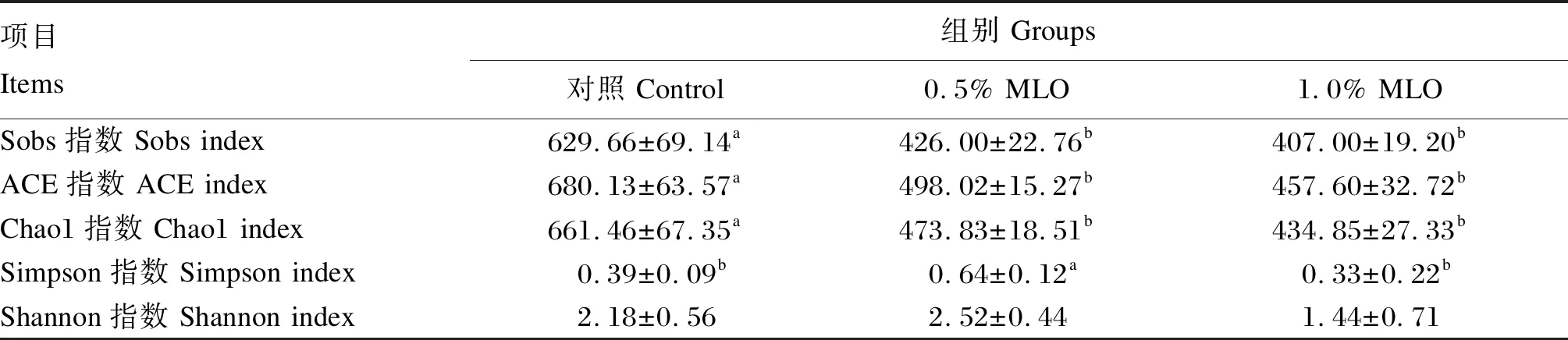
表6 大口黑鲈肠道菌群alpha多样性分析
如图3所示,在门水平上,在大口黑鲈肠道中检测出的微生物主要有10个门,其中优势菌门主要为厚壁菌门(Firmicutes,71.80%~82.15%)、变形菌门(Proteobacteria,6.16%~77.04%)、拟杆菌门(Bacteroidota,0.61%~4.43%)和梭杆菌门(Fusobacteriota,0.20%~3.45%)。与对照组相比,试验组大口黑鲈肠道厚壁菌门相对丰度显著降低(P<0.05),肠道变形菌门、梭杆菌门和拟杆菌门相对丰度显著提高(P<0.05)。对照组、0.5% MLO组和1.0% MLO组厚壁菌门/拟杆菌门值分别为18.55、59.49和34.10;且与对照组相比,试验组厚壁菌门/拟杆菌门值显著提高(P<0.05)。
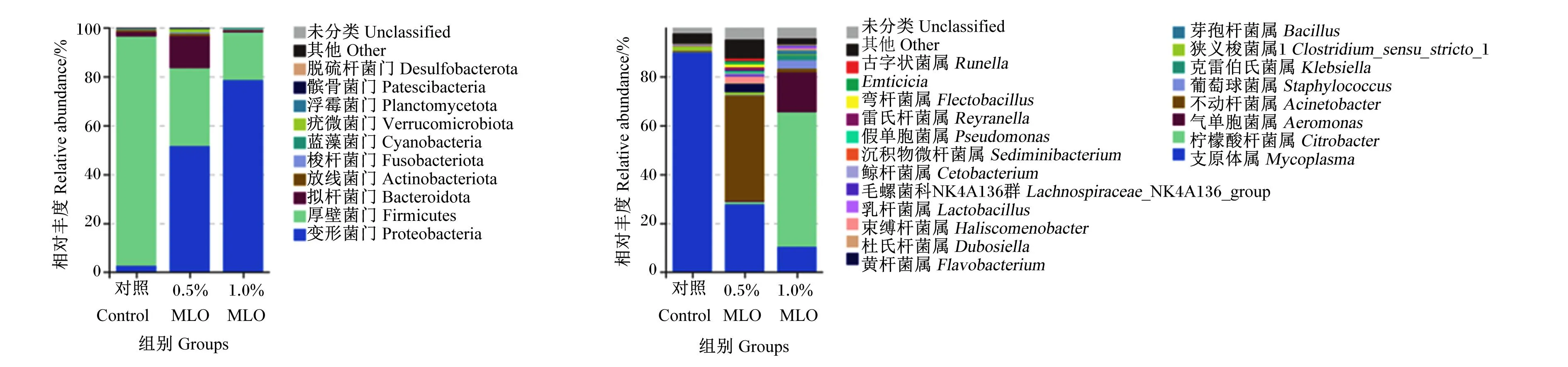
图3 大口黑鲈肠道菌群在门和属水平上的相对丰度
在属水平上,从大口黑鲈肠道中检测出22个属的微生物。其中,相对丰度>1%的菌属对照组组有5个,0.5% MLO组有3个,1.0% MLO组有7个。与对照组相比,试验组大口黑鲈肠道支原体属(Mycoplasma)相对丰度显著降低(P<0.05),肠道不动杆菌属(Acinetobacter)、乳杆菌属(Lactobacillus)和芽孢杆菌属(Bacillus)相对丰度显著提高(P<0.05)。
2.5 饲料中添加MLO对大口黑鲈肠道免疫相关基因表达的影响
如图4所示,与对照组相比,试验组大口黑鲈肠道IL-8、NF-κB和TNF-αmRNA相对表达量显著降低(P<0.05),肠道IL-10和TGF-βmRNA相对表达量显著提高(P<0.05)。

数据柱形标注不同小写字母表示差异显著(P<0.05)。
3 讨 论
3.1 饲料中添加MLO对大口黑鲈生长性能的影响
目前,低聚糖在水产养殖中被广泛应用,且普遍能够提高水产动物生长性能。Lin等[14]研究发现,在饲料中添加0.25%的黄芪多糖(APS)和0.25%的壳聚糖(COS)可以显著提高大口黑鲈的WGR和SGR,降低FCR。Torrecillas等[15]研究指出,用添加4 g/kg甘露聚糖(MOS)的饲料喂食欧洲舌齿鲈(Dicentrarchuslabrax)能够显著提高其WGR和SGR。此外,Wu等[7]研究表明,喂食含有4 g/kg低聚果糖(FOS)饲料的团头鲂(Megalobramaamblycephala),其终末体重和SGR显著提高,同时FCR显著降低。同样,本试验结果表明,经过80 d的养殖试验,饲料中添加0.5%和1.0%的MLO能够显著降低大口黑鲈的FCR,而WGR和SGR与对照组相比均有所提高,这可能是由于MLO提高了大口黑鲈肠道消化酶活性,从而促进了营养物质的消化吸收。研究表明,肝脏损伤通常伴随着肝脏重量和HSI的提高[16]。大口黑鲈作为肉食性鱼类对饲料中淀粉不耐受,糖原在肝脏积累后会导致肝脏异常增大从而影响肝脏功能[17]。本研究发现,饲料中添加1.0% MLO显著降低了大口黑鲈的HSI。这可能是由于MLO具有降糖作用,减少了糖原在肝脏的积累,从而改善了肝脏健康。
3.2 饲料中添加MLO对大口黑鲈肠道消化酶活性的影响
水生动物的生长主要取决于肠道对各种营养物质的消化、吸收和利用,一般通过测定肠道消化酶活性来评估水生动物的消化水平[18]。Hoseinifar等[19]研究发现,饲料中添加0.5%和1.0%的短链低聚果糖能够显著提高鲤鱼(Cyprinuscarpio)肠道消化酶活性,包括α-淀粉酶和脂肪酶。另一项研究表明,饲料中添加低聚木糖能够显著提高银鲫(Carassiusauratusgibelio)肠道蛋白酶和淀粉酶活性[20]。本研究中,饲料中添加MLO显著提高了大口黑鲈肠道α-淀粉酶、脂肪酶和胰蛋白酶活性。前期研究发现,MLO能够调节糖脂代谢紊乱小鼠的肠道菌群,促进肠道益生菌产生短链脂肪酸[10]。因此,笔者推测可能是MLO进入大口黑鲈肠道后改善了肠道菌群,促进了短链脂肪酸的生成,从而提高了肠道消化酶活性。
3.3 饲料中添加MLO对大口黑鲈肠道组织形态的影响
肠道是鱼类主要的消化器官,肠道结构的完整性直接影响鱼类的消化吸收和生长发育。鱼类肠道对于外部环境的变化比较敏感,易受饲料成分等因素的影响,且易造成生理性损伤[21-23]。研究表明,饲料中添加1%的低聚半乳糖和低聚果糖能够显著提高美国红鱼(Sciaenopsocellatus)的幽门盲肠、近端肠和中肠的绒毛高度[22]。另一项研究报道,饲料中添加低聚甘露聚糖能够显著提高白鲷(DiplodussargusL.)的绒毛高度[23]。本研究中,与对照组相比,饲料中添加MLO对大口黑鲈肠道绒毛高度、绒毛宽度和肌层厚度没有显著影响,但试验组绒毛高度、绒毛宽度和肌层厚度相对于对照组均有所提高,说明MLO对大口黑鲈肠道健康有一定的改善作用。
3.4 饲料中添加MLO对大口黑鲈肠道菌群的影响
肠道也是鱼类的重要免疫器官,肠道微生物群落结构在宿主营养吸收和健康方面发挥着重要作用[24]。本研究发现,大口黑鲈肠道中最主要的4个菌门为厚壁菌门、变形菌门、梭杆菌门和拟杆菌门,这与其他关于大口黑鲈的研究结果[25-26]一致。郭明瑜[27]研究表明,饲料中添加β-葡聚糖对大口黑鲈肠道菌群α多样性指标无显著影响,但各项指标有降低趋势。本研究发现,与对照组相比,试验组大口黑鲈肠道菌群的Sobs指数、ACE指数和Chao1指数均显著降低,说明MLO的添加降低了大口黑鲈肠道菌群的丰富度。进一步分析发现,饲料中添加MLO显著降低了支原体属相对丰度。而支原体属是人类和动物的常见病原体,它们会诱导肠道炎症反应[28-29]。结果表明,饲料中添加MLO在一定程度上降低了大口黑鲈肠道炎症反应发生的风险。研究表明,厚壁菌门/拟杆菌门值反映了宿主的营养物质运输和利用的能力[30]。本研究发现,与对照组相比,试验组厚壁菌门/拟杆菌门值显著提高,说明试验组大口黑鲈对营养物质的运输和利用能力增强。不动杆菌属对宿主的生长发育、抗病能力具有一定的促进作用[31-32];而乳杆菌属作为一种益生菌,能够代谢生成一些有机酸,生成多种消化酶,促进宿主生长发育[33];芽孢杆菌属对宿主生长、免疫力有积极作用,能促进肠道菌群平衡[34]。本研究中,与对照组相比,试验组肠道不动杆菌属、乳杆菌属和芽孢杆菌属相对丰度均有所提高。这些结果提示,MLO可能是通过提高肠道有益菌属的相对丰度,从而促进大口黑鲈的生长。
3.5 饲料中添加MLO对大口黑鲈肠道免疫相关基因表达的影响
鱼的免疫状态与炎症密切相关,并受炎性细胞因子的调节。鱼类细胞因子可分为抗炎因子(如IL-10和TGF-β等)和促炎因子(如IL-8、NF-κB和TNF-α等),它们在免疫反应中具有重要作用,NF-κB途径通常与炎症反应和免疫活动有关,可诱导大量炎症因子,包括TNF-α和IL-8[35]。前期研究表明,MLO能够显著降低糖脂代谢紊乱小鼠血清TNF-α含量[10]。本研究中,饲料中添加MLO可以显著降低大口黑鲈肠道中促炎因子(IL-8、NF-κB和TNF-α)的mRNA相对表达量,并显著提高抗炎因子(IL-10和TGF-β)的mRNA相对表达量,表明MLO可能通过调节NF-κB途径来降低炎症反应,增强大口黑鲈的免疫功能。
4 结 论
饲料中添加MLO能够降低大口黑鲈FCR、VSI和HSI,提高肠道消化酶活性,并调节肠道菌群,改善肠道益生菌相对丰度,增强其免疫功能。
