不同精粗比饲粮中添加凝结芽孢杆菌对绵羊羔羊瘤胃发酵和免疫功能的影响
2024-04-02王兴岗郝小燕张暄梓张建新
王兴岗 郝小燕 张暄梓 张建新
(山西农业大学动物科学学院,太谷 030801)
近几年,随着我国畜牧业不断发展,肉羊养殖逐渐由千家万户小规模散养向规模化、舍饲养殖转变,但随着舍饲、半舍饲养殖肉羊数量的增多,饲养过程中饲粮搭配不合理、营养不均衡问题凸显,导致肉羊生产效率不高,营养代谢疾病频发,致使养殖经济效益偏低。研究发现,饲喂不同精粗比饲粮对断奶羔羊瘤胃发育具有不同的影响,随着精饲料比例的增加,瘤胃乳头长度和宽度有增加趋势,但瘤胃乳头密度显著降低;饲粮精粗比的变化使角化层和肌肉层产生显著差异,粗饲料具有粗糙性和研磨性,粗纤维含量高的饲粮对瘤胃具有物理刺激作用,一定程度上能够增加瘤胃蠕动,同时促进肌层发育,且适量的粗饲料对瘤胃角化层的消磨及死亡上皮细胞的清除有积极作用[1]。虽然粗饲料有利于维持瘤胃正常pH、促进瘤胃发酵和营养物质的消化吸收,但粗饲料过多会使反刍动物营养不良而影响发育[2];此外,粗饲料在瘤胃中刺激乙酸发酵,使氢气产量增加,促进甲烷(CH4)产生[3]。提高饲粮中精饲料比例可以促进丙酸发酵,使氢气利用增加,CH4产量降低,但高精料比例通常会引起瘤胃酸中毒,降低饲料消化率。因此,适宜的饲粮精粗比对提高瘤胃发酵、维持瘤胃稳态及降低CH4排放具有重要意义。
益生菌又称益生素,是绿色的微生物饲料添加剂[4],具有调节反刍动物胃肠道菌群、促进营养物质消化吸收等功能,因而受到了越来越多的研究工作者的关注。芽孢杆菌是目前最常用的益生菌[5],一是因为芽孢杆菌的孢子能在极端环境条件下生存,二是因为芽孢杆菌拥有耐热、耐冷、耐酸的特性[6]。凝结芽孢杆菌(Bacilluscoagulans,BC)是一种革兰氏阳性、兼性厌氧、非致病性、形成芽孢和产生乳酸的芽孢杆菌[7]。凝结芽孢杆菌的孢子具有较强的抗性、恢复性和稳定性,可在胃的酸性环境中被激活,并在肠道中开始萌发和增殖;此外,凝结芽孢杆菌的孢子能适应肠道内的低氧环境,在肠道中发挥乳酸菌的作用[8]。值得指出的是,除非维持长期给药,否则凝结芽孢杆菌缺乏黏附肠上皮细胞的能力,凝结芽孢杆菌将在4~5 d完全消除[9],由于这一特性,凝结芽孢杆菌可能需要长期补饲,以发挥益生菌的作用。凝结芽孢杆菌在体内被激活后可以帮助消化碳水化合物和蛋白质[10]。凝结芽孢杆菌通过产生氨基酸和维生素,分泌α-淀粉酶、木聚糖酶、蛋白酶和脂质酶,提高生长性能,提高饲料消化率[11]。此外,凝结芽孢杆菌还可以治疗腹泻,提高机体免疫力[12-13]。
本课题组关于不同精粗比饲粮中添加凝结芽孢杆菌对绵羊羔羊生长性能和消化代谢的影响的研究显示,精粗比为70∶30的高精料饲粮中添加BC可提高绵羊羔羊对饲粮中部分营养物质的消化吸收,有效提高总能表观消化率,进而促进羔羊生长[14]。在此基础上,本研究对不同精粗比饲粮中添加BC对绵羊羔羊瘤胃发酵和免疫功能的影响进行研究,以期为BC在羔羊生产中的应用提供科学依据。
1 材料与方法
1.1 试验动物与试验设计
试验采用2×2双因素完全随机设计,2个因素分别为精粗比[40∶60(低精料)、70∶30(高精料)]和BC[不添加和添加1.0×1010CFU/kg BC]。选取48只体重[(24.8±1.3) kg]相近的4月龄杜泊×小尾寒羊F1代公羔,随机分为4组,分别饲喂低精料饲粮(LD组)、添加BC的低精料饲粮(LD+BC组)、高精料饲粮(HD组)、添加BC的高精料饲粮(HD+BC组),每组12只,每只羊采取单栏(0.8 m×2.0 m)饲养。试验共计70 d,其中预试期10 d,正试期60 d。参照NY/T 816—2021《肉羊营养需要量》来配制精粗比分别为40∶60(低精料)、70∶30(高精料)的基础饲粮,其组成及营养水平见表1。分别在高精料饲粮和低精料饲粮中按照1.0×1010CFU/kg的剂量添加BC,配制添加BC的高精料饲粮和低精料饲粮。
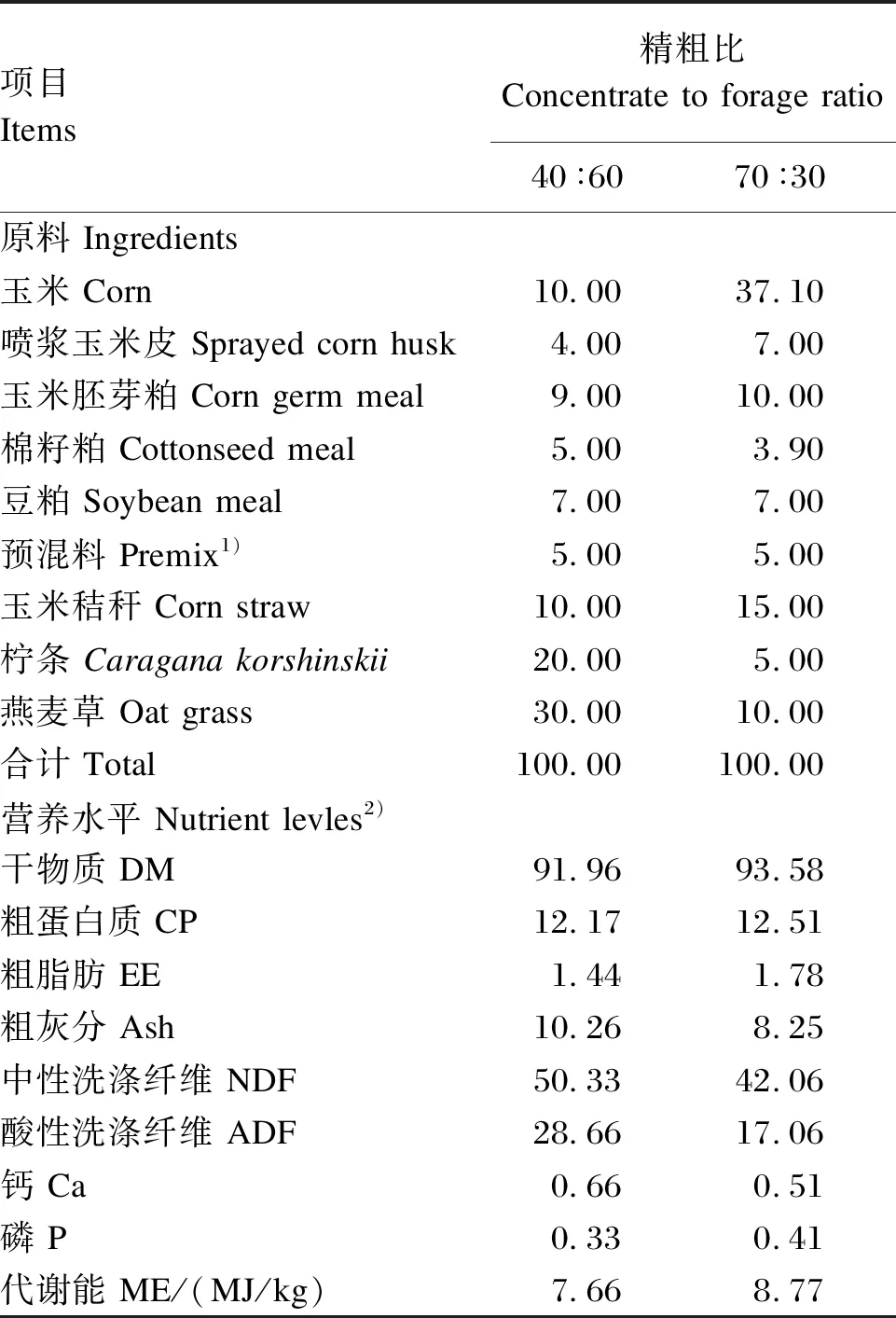
表1 基础饲粮组成及营养水平(风干基础)
1.2 饲养管理
预试期前对试验羊舍进行彻底清洁、消毒和灭虫处理;同时,对试验羊做好各项准备工作,对所有试验羊剃毛和体内、体外各2次驱虫。预试期对试验羊进行编号和称重,进行随机分组。正试期间,将BC提前与少量饲粮混合后饲喂,待羔羊采食完全后再将全部的饲粮倒入槽内,且保证第2天有料剩余,所有羊均为自由采食和自由饮水,保持羊舍通风、温度和清洁卫生。羔羊每天分为2次饲喂,分别在07:00和17:00饲喂。每天07:00前收集前1天的剩料,并称重记录。
1.3 测定指标与测定方法
1.3.1 饲粮中常规营养成分含量的测定
饲粮中干物质(DM)、粗蛋白质(CP)、粗灰分(Ash)、粗脂肪(EE)含量参照AOAC(2012)[16]中方法进行测定;参照Van Soest等[17]的方法对饲粮中中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)含量进行测定;饲粮中钙和磷含量分别参照 GB/T 6436—2018、GB/T 6437—2018进行测定。
1.3.2 瘤胃液收集、处理、指标测定
正试期结束当天晨饲后3 h,采用口腔胃管采集所有试验羊瘤胃液,弃掉黏液,经4层纱布过滤后立即测定其pH,随后分装,置于-20 ℃保存。瘤胃液pH使用便携式pH仪(PHS-3C,上海仪电科学仪器股份有限公司)进行测定。
瘤胃液中挥发性脂肪酸(volatile fatty acids,VFA),包括乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸的浓度使用气相色谱仪(Agilent 7890B,美国)进行测定。瘤胃液经10 000 r/min离心10 min,取1 mL上清液样品到1.5 mL离心管中再加入0.2 mL的偏磷酸巴豆酸混合溶液-20 ℃冰箱保存,测定前解冻,之后12 000 r/min离心5 min,取上清液用10 μL微量进样器瞬时注入色谱仪,进样量为2.0 μL进行测定[18]。色谱条件:进样温度220 ℃,分流5,分流比6;恒流0.8 mL/min;柱温设置初始温度为70 ℃;检测器温度220 ℃;尾吹40 mL/min,氢气35 mL/min,空气350 mL/min。
瘤胃液中果胶酶、β-葡萄糖苷酶、木聚糖酶、羧甲基纤维素酶及淀粉酶活性参考Agarwal等[19]的方法测定,蛋白酶活性使用南京建成生物工程研究所生产的试剂盒测定,氨态氮(ammonia nitrogen,NH3-N)浓度使用分光光度计(UV1100,上海天美科学仪器有限公司)测定。
应用镐珠法提取瘤胃液微生物DNA[20],采用珠磨CTAB法从瘤胃液中提取总微生物DNA。将提取的风干DNA加入50 μL TE缓冲液中充分溶解DNA。随后,通过Nano Drop 200分光光度计测量DNA的浓度和质量。目的微生物引物由北京华大基因科技有限公司提供,引物序列如表2所示。采用10倍连续稀释法建立目的微生物标准曲线。使用TaKaRa公司的SYBR®Primic Ex TaqTM(Tli RNaseH Plus)试剂盒采用实时荧光定量PCR检测目的微生物的相对数量。Real-time PCR反应体系为:2 μL DNA模板、10.0 μL SYBR®Primic Ex TaqTM(Tli RNaseH Plus)、0.4 μL PCR正向引物(10 μmol/L)、0.4 μL PCR反向引物(10 μmol/L)、7.2 μL无核酸酶水。PCR条件如下:50 ℃ 2 min、95 ℃ 2 min,1个循环;95 ℃ 15 s、60 ℃ 1 min,40个循环,进行引物退火和产物延伸。

表2 引物序列
1.3.3 血液样品收集、处理、指标测定
在正试期第30天和第60天晨饲前对所有试验羊空腹采血,经颈动脉采取10 mL血液,于37 ℃水浴锅内倾斜30°静置30 min,3 000×g离心10 min,将上清液分装到3个1.5 mL离心管内,置于-20 ℃超低温冰箱保存。
采用比色法利用酶标仪(Infinite F50,Tecan,瑞士)测定血清免疫指标,具体测定指标包括免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、免疫球蛋白G(IgG)、白细胞介素-2(IL-2)、白细胞介素-4(IL-4)、白细胞介素-6(IL-6)、白细胞介素-8(IL-8)、白细胞介素-10(IL-10)、γ-干扰素(IFN-γ)、前列腺素E2(PGE2)、肿瘤坏死因子-α(TNF-α)含量和环氧合酶-2(COX-2)活性,测定所用试剂盒购于上海酶联生物科技有限公司。
1.4 数据处理与统计分析
利用Excel 2010软件将试验数据进行初步整理,然后使用SPSS 22.0统计软件的双因素方差分析(two-way ANOVA)程序对2个因素以及二者的交互作用进行分析,之后对4组数据进行单因素方差分析(one-way ANOVA),并采用Duncan氏法进行组间多重比较。结果以平均值±标准差表示,P<0.01表示差异极显著,P<0.05表示差异显著,0.05≤P<0.10表示差异有显著趋势。
2 结果与分析
2.1 不同精粗比饲粮中添加BC对羔羊瘤胃发酵参数的影响
由表3可知,24只饲喂高精料饲粮的羔羊瘤胃内pH,氨态氮、乙酸、异丁酸浓度与乙丙比值显著低于24只饲喂低精料饲粮的羔羊(P<0.05),丙酸、戊酸和总挥发性脂肪酸(TVFA)浓度则显著高于24只饲喂低精料饲粮的羔羊(P<0.05);24只饲喂添加BC饲粮的羔羊瘤胃内丙酸浓度显著高于24只饲喂未添加BC饲粮的羔羊(P<0.05)。在羔羊瘤胃发酵参数方面,饲粮精粗比和BC之间不存在显著的交互作用(P>0.05)。

表3 不同精粗比饲粮中添加BC对羔羊瘤胃发酵参数的影响
2.2 不同精粗比饲粮中添加BC对羔羊瘤胃微生物酶活性的影响
由表4可知,24只饲喂高精料饲粮的羔羊瘤胃内淀粉酶和蛋白酶活性显著高于24只饲喂低精料饲粮的羔羊(P<0.05),木聚糖酶活性则显著低于24只饲喂低精料饲粮的羔羊(P<0.05);24只饲喂添加BC饲粮的羔羊瘤胃内淀粉酶活性显著高于24只饲喂未添加BC饲粮的羔羊(P<0.05)。在羔羊瘤胃微生物酶活性方面,饲粮精粗比和BC之间不存在显著的交互作用(P>0.05)。

表4 不同精粗比饲粮中添加BC对羔羊瘤胃微生物酶活性的影响
2.3 不同精粗比饲粮中添加BC对羔羊瘤胃功能微生物的影响
由表5可知,24只饲喂高精料饲粮的羔羊瘤胃内总菌、栖瘤胃普雷沃氏菌、嗜淀粉瘤胃杆菌的数量显著高于24只饲喂低精料饲粮的羔羊(P<0.05),黄色瘤胃球菌、产琥珀酸丝状杆菌、溶纤维丁酸弧菌和原虫的数量显著低于24只饲喂低精料饲粮的羔羊(P<0.05);24只饲喂添加BC饲粮的羔羊瘤胃内嗜淀粉瘤胃杆菌、栖瘤胃普雷沃氏菌和溶纤维丁酸弧菌的数量显著高于24只饲喂未添加BC饲粮的羔羊(P<0.05)。在羔羊瘤胃功能微生物方面,饲粮精粗比和BC之间不存在显著的交互作用(P>0.05)。
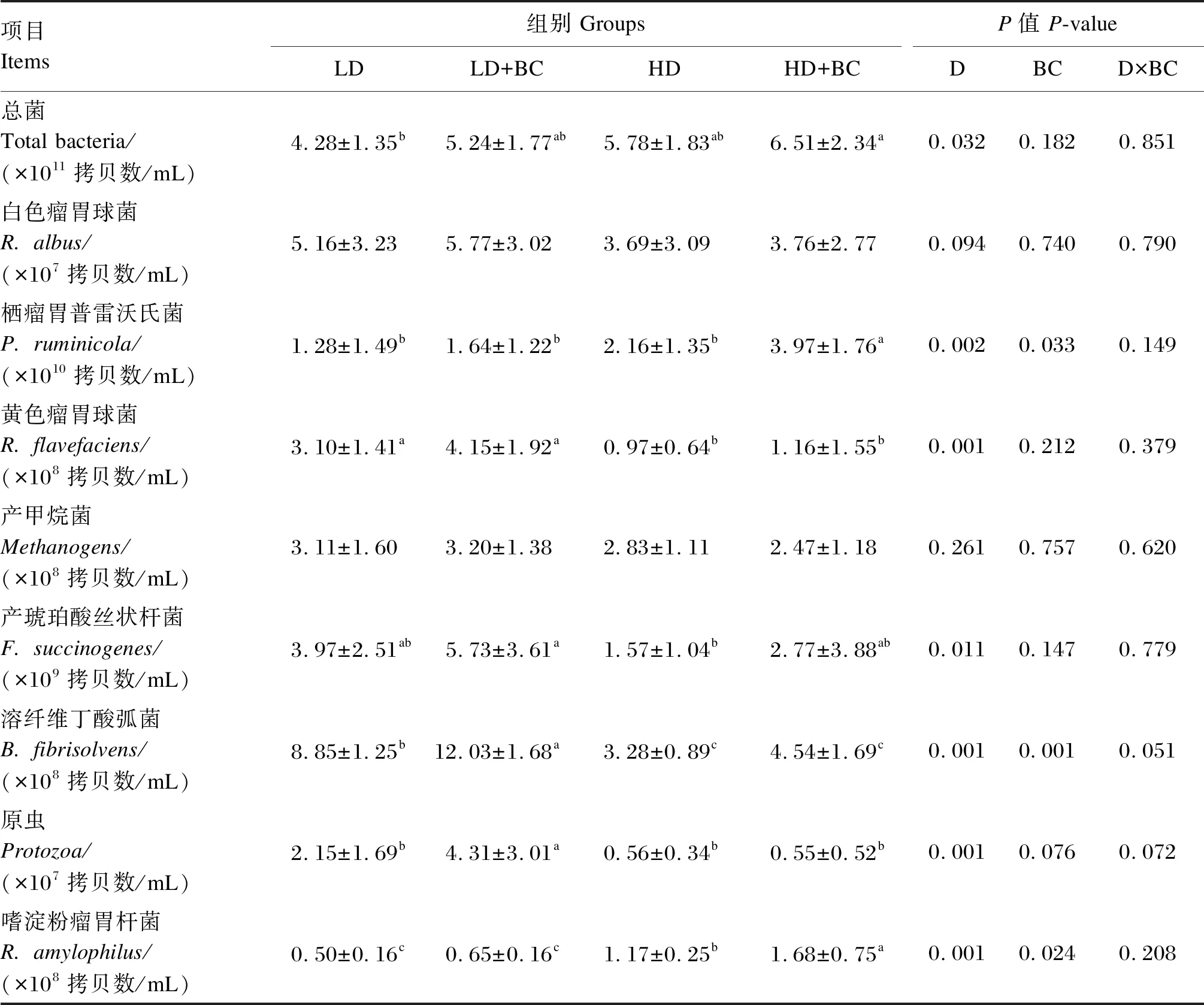
表5 不同精粗比饲粮中添加BC对羔羊瘤胃功能微生物的影响
2.4 不同精粗比饲粮中添加BC对羔羊血清免疫指标的影响
由表6可知,24只饲喂高精料饲粮的羔羊血清中IgG含量显著低于24只饲喂低精料饲粮的羔羊(P<0.05);24只饲喂添加BC饲粮的羔羊血清中IL-4含量显著高于24只饲喂未添加BC饲粮的羔羊(P<0.05)。在羔羊养血清免疫指标方面,饲粮精粗比和BC在血清中IL-4含量上存在显著的交互作用(P<0.05)。
3 讨 论
3.1 不同精粗比饲粮中添加BC对羔羊瘤胃发酵的影响
反刍动物瘤胃内pH主要是由瘤胃中VFA和乳酸浓度决定的,饲粮精粗比较低时,结构性碳水化合物含量较高,结构性碳水化合物在瘤胃中发酵缓慢,因此VFA产量低,进而瘤胃内pH较高;但随着饲粮精粗比升高,反刍动物采食大量易发酵的碳水化合物(主要是淀粉)并在瘤胃中快速发酵产生大量VFA堆积在瘤胃内,导致瘤胃内pH降低;当饲粮精粗比继续上升,瘤胃内VFA会积累过量引起瘤胃内pH显著下降,就会促使乳酸产生菌增多,进而导致乳酸产量的增加,乳酸浓度升高会进一步降低瘤胃内pH[26]。瘤胃中VFA主要包括乙酸、丙酸和丁酸,是反刍动物的主要能量来源[27]。本试验中,瘤胃内pH、乙酸浓度和乙丙比值随饲粮精粗比的升高而降低,丙酸和TVFA浓度随精粗比升高而升高。这与Giger-Reverdin等[28]研究结果一致,提高饲粮中精料水平,瘤胃中TVFA、丙酸浓度增加,而乙酸浓度降低。瘤胃内NH3-N是营养物质中含氮物质的降解产物,同时也是瘤胃微生物合成菌体蛋白的主要氮源,NH3-N的浓度可以反映出瘤胃功能微生物消化含氮物质的效率及对其摄取利用的情况,是体现瘤胃内营养物质消化利用的重要指标。本试验中,瘤胃液中NH3-N浓度随饲粮精粗比的升高而降低,可能饲粮精料水平的提高使得瘤胃微生物数量增加,提高了NH3-N的利用率。结合本课题组关于不同精粗比饲粮中添加BC对绵羊羔羊生长性能和消化代谢的影响所得结果[14],最终表明提高饲粮精粗比可以促进瘤胃发酵,提高饲粮利用率,促进绵羊羔羊生长。
BC可分泌多种促进营养物质消化的酶[29],各种消化酶能够促进瘤胃微生物发酵[30-31],进而促进各种营养物质消化,而瘤胃微生物发酵将生成VFA,从而降低瘤胃液pH;同时,BC还能产生L-乳酸,L-乳酸能够促进瘤胃乳酸分解菌发酵产生丙酸,而L-乳酸和丙酸生成的增多都会降低瘤胃内pH。本试验结果发现,在饲粮中添加BC可以显著提高瘤胃液丙酸浓度,同时还有降低pH和乙丙比值的趋势,并且在高精料饲粮中添加BC时瘤胃液中丙酸的增加量高于在低精料饲粮中添加BC。本试验结果结合生长性能结果[14]可知,在不同精粗比的饲粮中添加BC均可以降低瘤胃液pH,同时促进瘤胃发酵,进而促进羔羊生长。
3.2 不同精粗比饲粮中添加BC对羔羊瘤胃微生物酶活性和功能微生物的影响
反刍动物的瘤胃相当于一个密闭的发酵罐,其中生存着细菌、真菌和原虫等微生物,它的厌氧环境为各种微生物提供赖以生存和繁殖的条件。饲粮精粗比会影响瘤胃内微生物的数量和种类,而微生物的数量和种类是影响瘤胃内消化酶活性的主要因素[32]。粗纤维在瘤胃内的消化是通过瘤胃微生物分泌的多种纤维素分解酶进行的,主要为木聚糖酶,木聚糖酶活性也可以体现瘤胃纤维分解菌的数量和活力[33]。白色瘤胃球菌、黄色瘤胃球菌、产琥珀酸丝状杆菌和溶纤维丁酸弧菌是反刍动物瘤胃中主要的纤维分解菌,能够分泌多种纤维分解酶,有效地分解饲粮中纤维物质。杨宏波等[34]的研究发现,饲喂低精料饲粮的犊牛瘤胃内纤维降解菌和真菌的相对表达量显著高于饲喂高精料饲粮的犊牛。本试验中,饲喂低精料饲粮的羔羊瘤胃内黄色瘤胃球菌、产琥珀酸丝状杆菌和溶纤维丁酸弧菌的数量显著高于饲喂高精料饲粮的羔羊,这与前人的研究结果[34-35]相一致。同时,本试验显示,饲喂低精料饲粮的羔羊瘤胃内木聚糖酶活性显著高于饲喂高精料饲粮的羔羊,这与张春梅等[36]的研究结果相一致。溶纤维丁酸弧菌和栖瘤胃普雷沃氏菌能够分泌蛋白质分解酶,特别是栖瘤胃普雷沃氏菌,对植物中蛋白质降解具有重要作用[37]。Tajima等[38]利用实时定量的方法研究了在饲粮的转化过程中瘤胃细菌菌群的变化规律,结果表明,在饲粮从干草转变成谷物后普雷沃氏菌属的丰度大幅度的提升,这与本试验的结果相一致。同时,本试验中饲喂低精料饲粮的羔羊瘤胃内蛋白酶活性显著低于饲喂高精料饲粮的羔羊,这也相互印证了饲喂高精料饲粮可以增加羔羊瘤胃内蛋白质分解菌数量和蛋白酶活性,进而促进蛋白质消化。嗜淀粉瘤胃杆菌利用α-葡萄糖作为能量来源,对瘤胃内淀粉物质的分解吸收起重要作用。当饲喂高精料饲粮时,瘤胃中降解淀粉和产酸的菌属的相对丰度会显著增加,提高饲粮中淀粉的降解速率,生成大量乳酸和VFA,导致瘤胃内pH下降[39],这与本试验结果相一致。淀粉酶活性与饲粮中淀粉含量直接相关,瘤胃内淀粉酶的活性能反映瘤胃中淀粉分解菌的数量和活力。汪晓娟等[40]的研究发现,饲喂低NDF饲粮的羔羊瘤胃中淀粉酶和蛋白酶活性显著高于饲喂高NDF饲粮的羔羊。饲粮的NDF含量与饲粮的精粗比密切相关,随着精粗比的升高,NDF含量逐渐降低。本试验结果也表明,饲喂低精料饲粮的羔羊瘤胃内淀粉酶和蛋白酶活性显著低于饲喂高精料饲粮的羔羊。
乳酸产生菌和乳酸利用菌可以控制绵羊瘤胃内乳酸的浓度,而BC常常以孢子的状态存在,当其进入动物肠道后,可以在短时间内复苏过来,消耗肠道中的氧气以及减弱氧化还原电势,创造出低氧或无氧的环境,可以使其他有益菌如乳酸菌、双歧杆菌和肠道球菌等更好地在肠道中生长和繁殖,抑制有害需氧菌的生长,从而调节胃肠道微生物平衡,利于营养物质的吸收,提高饲料利用率[41]。李晓斌等[42]通过对3~6月龄的伊犁马补喂复合益生菌(枯草芽孢杆菌和植物乳杆菌)发现,复合益生菌可以促进马后肠道纤维降解菌和淀粉分解菌的增殖。谢明欣等[43]的试验结果显示,给绵羊饲喂复合益生菌能显著提高瘤胃内乳酸利用菌(嗜淀粉瘤胃球菌和溶纤维丁酸弧菌)的数量,有利于饲粮中纤维素的利用和降低乳酸的累积。本试验结果也表明,补饲BC后羔羊瘤胃内嗜淀粉瘤胃球菌和溶纤维丁酸弧菌的数量显著增多,并且瘤胃内淀粉酶的活性增加,这也能反映淀粉分解菌数量的增多。本试验结果并结合生长性能数据[14]可知,饲粮中添加BC能够增加瘤胃内部分微生物的数量,促进营养物质消化吸收,提高羔羊的生长性能。
3.3 不同精粗比饲粮中添加BC对羔羊免疫功能的影响
饲粮精粗比对反刍动物瘤胃酸碱平衡具有极其重要的影响,动物采食高精料饲粮后瘤胃内VFA浓度升高,pH下降,产乳酸菌大量繁殖并产生乳酸,少量乳酸通过瘤胃壁上皮细胞进入血液被吸收氧化,当乳酸产量过多时会导致乳酸代谢障碍,使得瘤胃pH迅速降低,进而引发亚急性或急性瘤胃酸中毒,血清脂多糖(LPS)增多引起炎症反应,激活免疫系统,各项免疫指标随之变化。细胞因子是由多种组织细胞合成和分泌的具有广泛生物学活性的小分子多肽或糖蛋白,具有抗菌、抗病毒、抗外毒素等生物学功能,在机体免疫反应和炎症反应中起着关键作用[44]。赵正伟等[45]的研究发现,饲粮精粗比适宜对滩羊的生长性能、免疫功能都具有促进作用,饲粮精粗比过高反而会影响其机体的免疫功能。本试验结果表明,饲喂高精料饲粮的羔羊血清中IgG含量下降,这与赵正伟等[45]的研究结果相一致。Zhou等[46]研究发现,给奶牛饲喂高精料饲粮,其乳动脉内促炎细胞因子含量升高,原因是高精料饲粮诱发亚急性瘤胃酸中毒,使得LPS从消化道进入血液循环,导致LPS浓度增加。常广军[47]的研究发现,长期饲喂精粗比为6∶4的饲粮导致山羊发生亚急性瘤胃酸中毒,提高LPS在肝脏的蓄积,外周血液中促炎细胞因子TNF-α、白细胞介素-1β(IL-1β)的含量显著升高,IL-6含量有增高的趋势。但本试验结果没有发现饲喂高精料饲粮对羔羊炎症因子方面的影响,这可能与羔羊品种和试验环境不同有关。
BC可以调节免疫系统,刺激消化道微生物群的快速恢复并具有抗病毒活性[48];BC还可以通过调节细胞因子增强吞噬细胞的吞噬功能,增强T淋巴细胞、B淋巴细胞和自然杀伤(NK)细胞的活性,并增加IgA、IgG和IgM的表达[49]。IL-4能刺激活化B淋巴细胞和T淋巴细胞增殖,在调节体液免疫和适应性免疫中起关键作用;IL-8能吸引和激活中性粒细胞,中性粒细胞与IL-8接触后发生形态变化,定向游走到反应部位并释放一系列活性产物,这些作用可导致机体局部的炎症反应,达到杀菌和细胞损伤的目的。BC能使机体减少IL-8和增加IL-10分泌而发挥免疫调控作用,BC还可以调节免疫系统以抵抗由LPS引起的炎症[50]。BC通过促进B淋巴细胞增殖,增强免疫球蛋白的分泌能力,提高机体的体液免疫水平;通过提高效应T淋巴细胞数量,增强巨噬细胞的活性,诱导细胞因子IL-4、IL-6、IL-10和IFN-γ的分泌,提高机体的细胞免疫水平[51]。本试验结果发现,在饲粮中添加BC可以显著提高血清中IL-4含量,并且主要是在高精料饲喂条件下添加BC使羔羊血清中IL-4含量显著提高;同时,在饲粮中添加BC有降低血清中IL-8含量的趋势,并且在高精料饲喂条件下添加BC羔羊血清中IL-8含量降低的更多。这说明饲喂高精料饲粮对羔羊造成了一定的病理伤害,而BC能在羔羊受到病理伤害时提高机体的免疫力。
4 结 论
综上所述,在不同精粗比饲粮中添加BC均可以促进瘤胃发酵,有效提高羔羊对饲粮的消化吸收,同时还可以提高机体的炎症应答水平,进而促进羔羊健康生长,且在高精料饲喂条件下添加BC效果更好。因此,BC可以作为一种新型的益生菌制剂应用于羔羊生产中,在精粗比为70∶30的高精料饲粮中添加BC效果更优。
