不同蛋白源代乳粉对羔羊生长、消化、瘤胃发酵参数和菌群结构的影响
2024-04-02王紫薇梁鸽鸽鲁昌明张永根谢小来扈光辉路允龙
■ 王紫薇 梁鸽鸽 鲁昌明 张 旭 张永根 谢小来 扈光辉* 路允龙
(1.东北农业大学动物科学技术学院,黑龙江 哈尔滨 150030;2.黑龙江绿能生态牧业有限公司,黑龙江 齐齐哈尔 162400)
我国养羊业生产已经逐渐由传统养殖方式转变为集约化养殖方式,代乳粉已被推荐用来代替羊奶饲喂羔羊,以解决母羊母乳不足和产羔间期长的问题[1]。目前,代乳粉中蛋白质来源主要有两种:一种是乳源蛋白(如乳清、脱脂奶粉等)[2],另一种是植物源蛋白(如大豆、小麦蛋白等)[3]。乳源蛋白因其营养均衡、消化吸收快和利用率高,一直是代乳粉中主要的蛋白质源[4]。与乳源蛋白相比,植物源蛋白因其消化率和溶解度较低,氨基酸结构较差,且含有抗营养因子[4],目前还没有被普遍应用[5]。目前,国内外关于不同蛋白源对羔羊生长性能影响的研究已经超过30 年[6]。但鲜有关于用多种植物蛋白组合的代乳粉进行高水平乳蛋白替代(以粗蛋白计,替代>50%乳源蛋白)用于羔羊上的报道。因此,试验以全乳源蛋白为对照,旨在探究以12%豆粕粉+8%小麦蛋白粉+30%膨化大米粉等植物蛋白源替代乳蛋白配制的植物源蛋白代乳粉,对羔羊生长、消化性能、瘤胃发酵参数和瘤胃菌群结构的影响,为开发经济的乳源蛋白替代品提供依据和参考。
1 材料与方法
1.1 试验时间和地点
试验于2022 年1 月—2022 年4 月在黑龙江绿能生态牧业有限公司(东经123.32°、北纬46.19°)进行。
1.2 试验设计
选择40 只3 日龄健康、体重相近[(3.55±0.54) kg]的萨能奶山羊公羔羊,饲喂乳源蛋白代乳粉至22 日龄,随机分为两组,对照组为乳源蛋白代乳粉(MD)组,试验组为植物源蛋白代乳粉(PD)组,每组各20只。
1.3 饲养管理
全部试验羔羊3 日龄内,采用人工饲喂初乳;3 日龄后训饲乳源蛋白代乳粉(某公司提供)至22 日龄,随机分组。PD 组在22~24 日龄逐渐过渡为植物源蛋白代乳粉(某公司提供)。羔羊7 日龄时训饲开食料和干草,正式试验期间,单栏单圈,羔羊可以自由采食开食料和干草,自由饮水。两种不同蛋白源代乳粉、开食料和干草的组成及营养水平分别见表1、表2。羔羊代乳粉饲喂量参考乔国华等[7]方案并做适当调整。代乳粉具体饲喂量为:羔羊4~24 日龄100 g/d,每天分4次(06:00、12:00、18:00、22:00);羔羊25~44 日龄150 g/d,45~64 日龄200 g/d,每天分3 次(08:00、16:00、22:00)。试验期内,保证羔羊生长所需温湿度和通风,定期称重、免疫、更换垫草、羊圈消毒。每天记录采食量并观察羔羊的健康情况。试验正试期40 d,在试验结束前5 d 进行消化试验。

表1 代乳粉组成及营养水平(干物质基础)
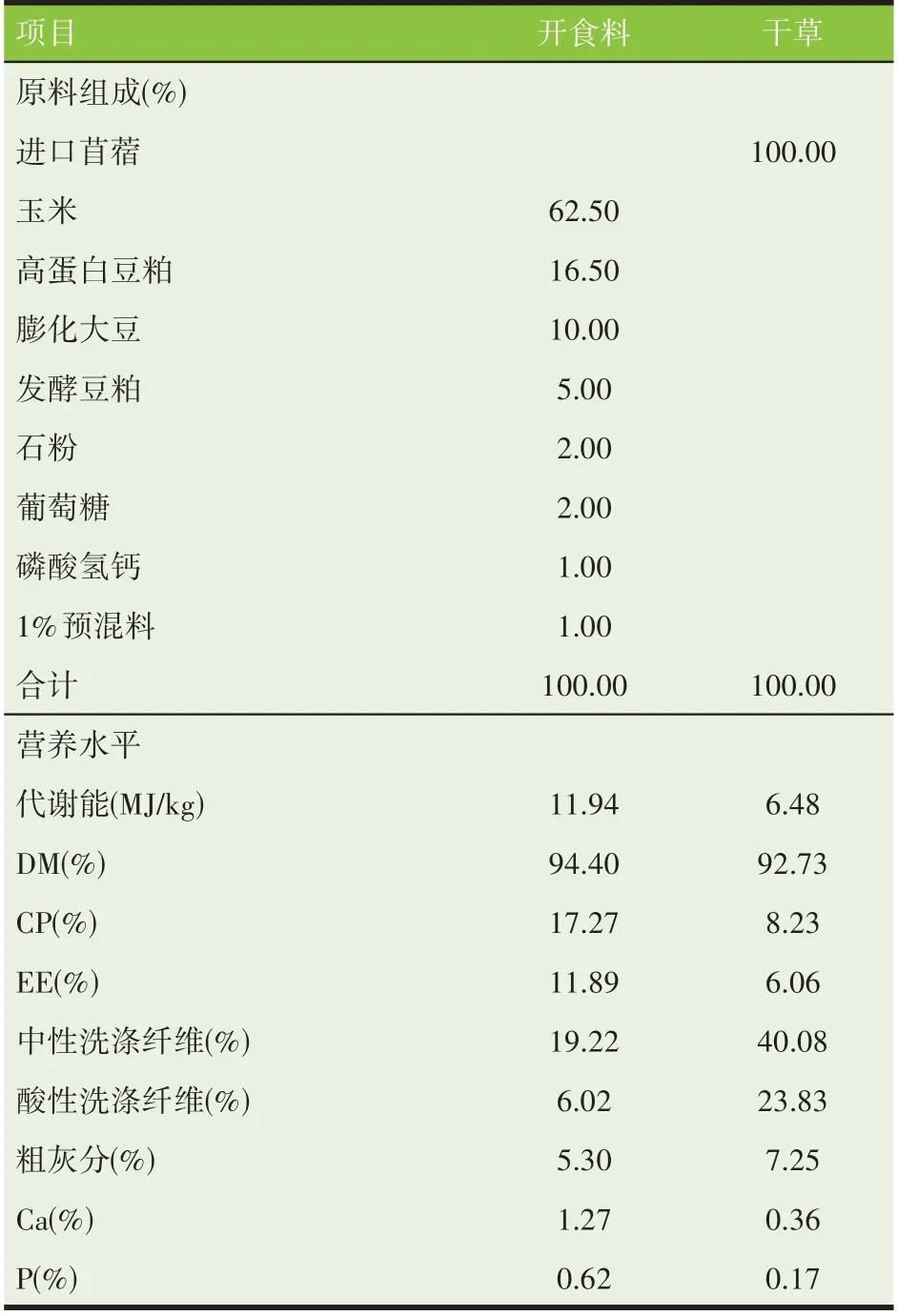
表2 开食料和干草组成及营养水平(干物质基础)
1.4 样品的采集与指标测定
1.4.1 生长试验
分别在羔羊第25、45、65 日龄晨饲前称重,准确记录羔羊正式试验期间的代乳粉采食量、精粗料采食量,并计算羔羊平均日增重(ADG)、开食料干物质采食量、干物质采食量(DMI)和料重比(F/G)等。DMI包括羔羊所采食的代乳粉、开食料和干草总的干物质。
1.4.2 消化试验
试验结束前5 d 采取全收粪法收集粪样,鲜粪经硫酸固氮后保存于-20 ℃备用。65 ℃烘干至恒重,粉碎过筛,测定代乳粉、开食料、干草及粪样中的养分(DM、CP、EE、中性洗涤纤维、酸性洗涤纤维、Ca、P)含量,参照张丽英[8]方法进行养分表观消化率测定。
某营养成分表观消化率(%)=(食入某营养成分含量-粪中某营养成分含量)/食入某营养成分含量×100
1.4.3 瘤胃内容物采集
试验结束后,每组随机选取6 只羔羊,停食16 h、停水8 h 后进行颈静脉放血屠宰、解剖、取出瘤胃。滤去瘤胃中食糜,测定并记录每只已宰羔羊的瘤胃液pH,将滤液分装在冻存管后放液氮罐速冻后转入-20 ℃冰箱保存。测定氨态氮(NH3-N)和挥发性脂肪酸(VFA)浓度,测定方法参考李闯[9]方法进行。
瘤胃液中细菌16S rDNA 基因高通量测序分析由杭州联川生物技术股份有限公司完成。采用CTAB法提取每个瘤胃样品中微生物总DNA,DNA 质量经检测合格后,将瘤胃液样品进行16S rDNA V3~V4 区域的扩增、测序,以及分析。
1.5 数据统计与分析
生长性能、消化性能、瘤胃发酵参数和细菌相对丰度等数据利用SPSS 26.0 软件进行独立样本t检验,结果用“平均值和标准误(SEM)”表示,P<0.05 为差异显著,P>0.05表示差异不显著。
羔羊瘤胃样品经测序获得的原始数据用 SMRT Link 软件(V6.0)处理获得原始序列,对所得到的特征序列和丰度进行物种分类和物种分类注释,然后进行Alpha多样性和Beta多样性分析。
2 结果与分析
2.1 不同蛋白源代乳粉对羔羊生长发育的影响
由表3 可见,两组羔羊正式试验初始体重相近,试验结束时,PD 组羔羊的终末体重、ADG、开食料干物质采食量和DMI 显著低于MD 组(P<0.05),但是两组羔羊F/G无显著差异(P>0.05)。
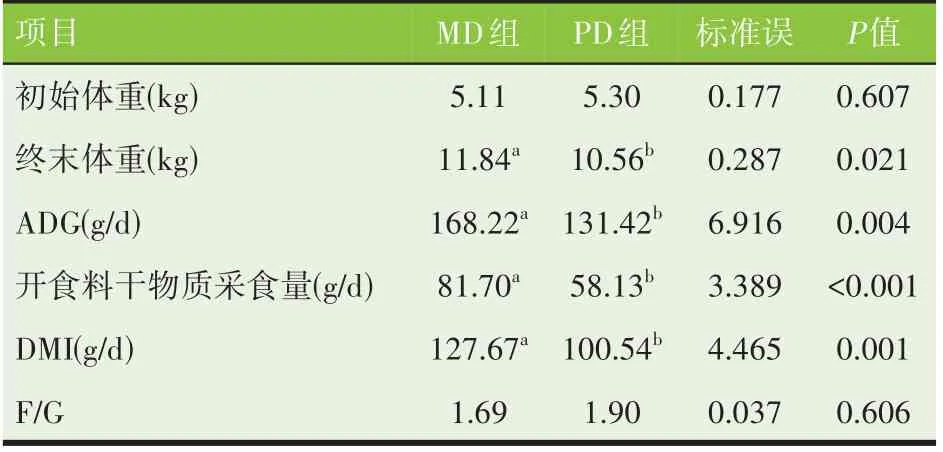
表3 不同蛋白源代乳粉对羔羊生长性能的影响
2.2 不同蛋白源代乳粉对羔羊饲粮养分表观消化率的影响
由表4 可见,PD 组羔羊饲粮的CP、EE、Ca 和P 的表观消化率均显著低于MD组(P<0.05),DM表观消化率有降低的趋势,但差异不显著(P>0.05)。

表4 不同蛋白源代乳粉对羔羊养分表观消化率的影响(%)
2.3 不同蛋白源代乳粉对羔羊瘤胃发酵参数的影响
由表5可见,PD组羔羊瘤胃中NH3-N、、异戊酸浓度显著高于MD 组(P<0.05),但两组间羔羊瘤胃液pH、总挥发性脂肪酸(TVFA)和乙酸浓度、乙丙比值差异不显著(P>0.05)。

表5 不同蛋白源代乳粉对羔羊瘤胃发酵参数的影响
2.4 不同蛋白源代乳粉对羔羊瘤胃微生物区系的影响
2.4.1 瘤胃微生物测序
由表6可见,12个羔羊瘤胃内容物DNA样品共产生885 384 条测序个数,平均每个样品产生73 782 条有效测序个数,有效数据和原始数据之比为83.84%~92.70%,有效数据中数据质量≥Q20 占96.21%~97.89%,有效数据中数据质量≥Q30 占90.19%~94.09%,有效数据中GC 含量占53.84%~54.77%。说明该测序结果足以反映两组羔羊瘤胃样品的实际情况。

表6 瘤胃微生物测序结果
2.4.2 瘤胃微生物操作分类单位(OTU)数量
通过对12 个羔羊瘤胃液样品进行16S rDNA 测序分析瘤胃微生物OTU 数量,结果如图1 所示,12 个样品共产生4 371 个OTU、其中688 个为两组共有,MD 组特有的OTU 数量为2 358 个,PD 组特有的OTU数量为1 325 个,PD 组与MD 组相比,差异OTU 数量为3 683个。
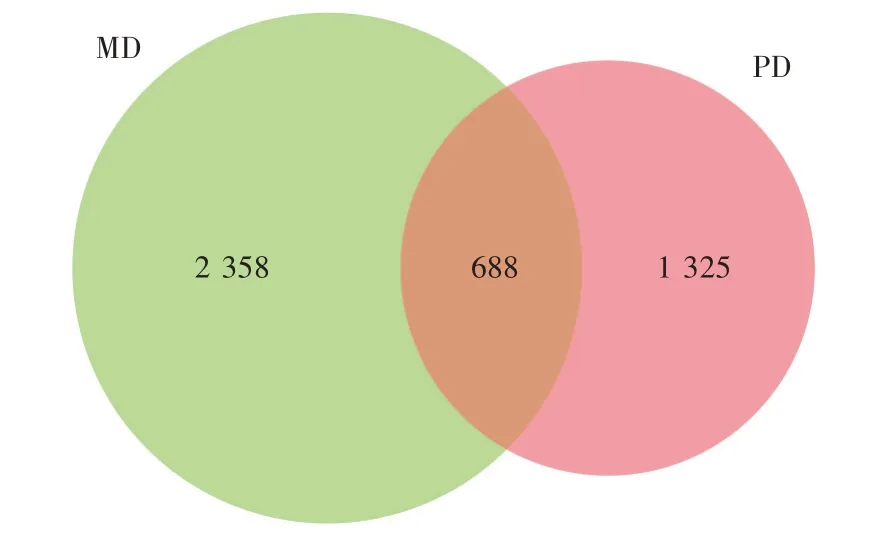
图1 瘤胃菌群韦恩图
2.4.3 Alpha多样性分析
如图2 所示,红线和蓝线分别代表MD 组和PD组,每组羔羊有6 个瘤胃样品,横坐标代表随机抽取的序列数,纵坐标分别代表抽取相同序列数时各样本中OTU 指数和Shannon 指数大小。随着测序数的增加,当样品测序深度达到10 000时,Shannon指数已趋于平缓,说明当前测序量满足样品菌群多样性分析。由表7 可知,两组羔羊瘤胃区系微生物覆盖率均为100%,说明样品足以反映其瘤胃菌群情况;与MD 组相比,PD 组羔羊瘤胃中Chao1 指数、OTU 数量、Shannon 指数、Evenness 指数以及Simpson 指数显著降低(P<0.05)。

图2 瘤胃细菌OTU稀释曲线(A)和Shannon稀释曲线(B)

表7 Alpha多样性指数
2.4.4 Beta多样性分析
主坐标分析(PCoA)如图3 所示。第一主成分(PCoA1)和第二主成分(PCoA2)分别表示分离样品为30.01%、19.31%的方差,PD 组和MD 组羔羊瘤胃菌群明显分离,表明两组羔羊瘤胃微生物间结构差异显著(P<0.05)。
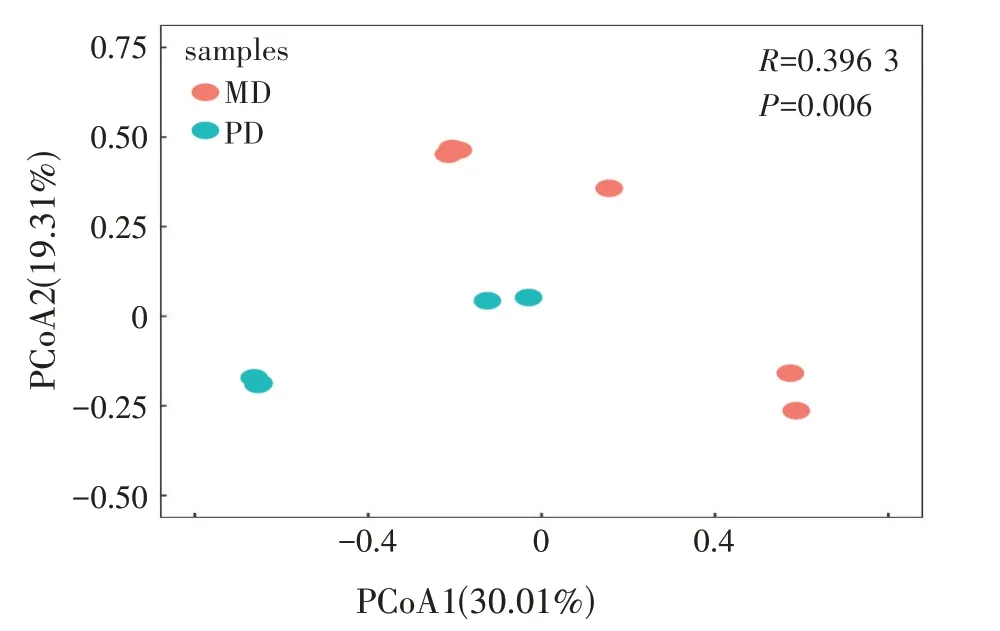
图3 基于Unweighted Unifrac距离的PCoA
2.4.5 瘤胃微生物丰富度分析
门水平上,结果如表8 所示。两组羔羊瘤胃液中的优势菌门均是厚壁菌门、拟杆菌门和变形菌门;其中,厚壁菌门和拟杆菌门是MD 组和PD 组羔羊瘤胃中最丰富的菌门。与MD 组相比,PD 组羔羊瘤胃中厚壁菌门相对丰度和厚壁菌门/拟杆菌门(F/B)值显著降低(P<0.05);拟杆菌门的相对丰度显著提高(P<0.05);与MD 组相比,PD 组羔羊瘤胃中放线菌门的相对丰度显著降低(P<0.05);髌骨菌门的相对丰度显著增加(P<0.05);脱硫杆菌门的相对丰度显著降低(P<0.05);组内其他菌门无显著差异(P>0.05)。属水平上,结果如表9 所示。MD 组羔羊瘤胃中优势菌属为克里斯滕森氏菌科R-7 群、未分类鼠杆菌科和UCG-002;PD 组羔羊瘤胃中优势菌属为未分类鼠杆菌科、普雷沃氏菌属和克里斯滕森氏菌科R-7 群。与MD 组相比,PD 组羔羊瘤胃中克里斯滕森氏菌科R-7 群、UCG-002 和未分类厚壁菌门属的相对丰度显著降低(P<0.05);未分类鼠杆菌科、普雷沃氏菌属、未分类梭菌属_UCG-014 的相对丰度显著提高(P<0.05),组间其他菌属丰度无显著差异(P>0.05)。

表8 门水平相对丰度(丰度TOP10)(%)

表9 属水平相对丰度(丰度TOP 10)(%)
3 讨论
3.1 不同蛋白源代乳粉对羔羊生长性能的影响
多项研究表明,以植物源蛋白部分替代全乳蛋白配制代乳粉时,因代乳粉中蛋白质的来源、替代比例、加工工艺等不同,对哺乳期反刍动物生长性能的影响也不同[10-11]。本试验中豆粕粉和膨化大米粉的加工方式为膨化工艺(生产公司数据表明膨化大米粉中几乎不含有抗营养因子)。刘华[12]试验结果表明,谷物膨化加工可提高谷物内淀粉的消化率,减少抗营养因子的产生。本试验中,以12% 豆粕粉+8%小麦蛋白粉+30%膨化大米粉为植物源蛋白替代乳源蛋白饲喂25~64 日龄羔羊时,PD 组羔羊的ADG、DMI 分别显著低于MD 组,但两组间羔羊F/G 无显著差异。究其原因,可能与植物蛋白的加工工艺相关,豆粕粉、小麦蛋白粉和膨化大米粉未经有效地加工处理,影响了羔羊的生长性能。
3.2 不同蛋白源代乳粉对羔羊消化性能的影响
哺乳期反刍动物的消化系统发育不良,无法消化大量碳水化合物、脂肪和蛋白质[13]。本试验中,植物源蛋白代乳粉组羔羊的CP、EE、Ca、P 表观消化率显著低于乳源蛋白代乳粉组。可见,与乳源蛋白相比,植物源蛋白代乳粉影响了羔羊消化性能。大量研究表明,乳蛋白易被吸收;用植物源蛋白代乳粉会导致皱胃中凝乳形成受损,增加皱胃排空率,进而降低蛋白质和脂肪的消化率;植物源蛋白中的大豆蛋白可以诱导胆汁酸升高,降低脂肪的可用性;与酪蛋白不同,磷酸化较少的大豆蛋白也会诱导磷酸钙沉积物的积累,减少矿物质的利用[16-20];与试验结果一致。
3.3 不同蛋白源代乳粉对羔羊瘤胃发酵参数的影响
反刍动物瘤胃液pH 是反映瘤胃发酵状况的重要指标[21]。本试验两组羔羊瘤胃pH 均在正常范围内(5.5~7.5)[9],且差异不显著,这与黄开武[21]所配制的代乳粉饲喂21~63 日龄的犊牛,各组犊牛瘤胃液pH 均在正常范围且无明显差异的结果一致。说明不同蛋白源代乳粉不会导致羔羊瘤胃pH异常。
瘤胃NH3-N 浓度可以粗略反映饲粮中蛋白质降解与微生物蛋白合成速率之间的关系[22-23]。在本试验中,两组羔羊瘤胃NH3-N 浓度均在合理浓度范围(5.0~30.0 mg/dL)[23-24],但是PD 组羔羊NH3-N 浓度显著高于MD 组。这与之前研究,全乳源蛋白和多种植物源蛋白组合配制的代乳粉对犊牛瘤胃中NH3-N 浓度无明显影响的结果不一致[21],可能受代乳粉中蛋白质来源、加工工艺和替代乳比例等影响。本试验结果表明植物源蛋白代乳粉可能会影响羔羊瘤胃中微生物蛋白的合成效率。
VFAs 是反刍动物瘤胃内碳水化合物发酵的主要产物,在促进瘤胃乳头发育、瘤胃微生物对终产物的消化吸收和利用方面至关重要[25]。本试验中,PD 组显著提高了羔羊瘤胃总挥发酸中异戊酸的比例。异戊酸是瘤胃内纤维分解菌生长繁殖所必需的因子[21],对于植物纤维素的降解至关重要。综上所述,植物源蛋白代乳粉可以促进羔羊瘤胃发酵,是否能够促进其瘤胃的发育,还需进一步研究。
3.4 不同蛋白源代乳粉对羔羊瘤胃微生物区系的影响
3.4.1 瘤胃微生物多样性分析
瘤胃及其微生物生态系统对反刍动物的整体营养和健康起着核心作用,其中细菌是瘤胃中最具优势和多样性的微生物群落[26]。MD 组和PD 组特有细菌数分别为2 358 个、1 325 个,而共有细菌数仅688 个,说明不同蛋白源代乳粉条件下的羔羊瘤胃中细菌种类存在差异。本试验中两组羔羊微生物覆盖率相同,但PD 组的OTU 数量、Shannon 指数、Simpson 指数、Chao1 指数和Evenness 指数均显著低于MD 组,说明PD 组瘤胃细菌的多样性和丰富度相对较低。PCoA图显示,两组羔羊瘤胃样品完全分离,表明两组羔羊瘤胃微生物群落结构存在显著差异。综上所述,植物源蛋白代乳粉可以改变羔羊瘤胃菌群的结构、影响菌群的多样性和丰富度。
3.4.2 瘤胃微生物丰富度分析
饲粮是影响反刍动物瘤胃菌群的主要因素[27],微生物群可以通过从饲粮中提取能量来影响宿主的脂肪沉积,其效率取决于群落组成[28]。本试验中,厚壁菌门、拟杆菌门和变形菌门是MD 组和PD 组羔羊瘤胃中的优势菌门;PD 组羔羊瘤胃中拟杆菌门的丰度显著高于MD 组,而厚壁菌门的丰度和F/B值显著低于MD 组。综上所述,不同蛋白源代乳粉不会改变羔羊瘤胃的优势菌门的核心地位和有害菌门的丰度;而PD 组羔羊瘤胃F/B 值显著降低,这与本试验发现PD 组羔羊的生长性能低于MD 组的结果相符合。
在属水平上,鼠杆菌科作为一种有益菌,在调节炎症和维持肠道稳定方面具有重要作用[28]。拟杆菌门与机体生长发育以及机体内碳水化合物、多糖等物质的代谢有关[30]。研究中,未分类鼠杆菌科是PD 组相对丰度最高的菌属,与MD 组相比,组间差异显著,说明植物源蛋白代乳粉在一定程度上可以维持羔羊的健康和肠道稳态。PD 组普雷沃氏菌属丰度居次高,为10.53%,显著高于MD 组5.59%,这与以往研究发现,普雷沃氏菌属占反刍动物瘤胃菌群总菌属的42%~60%的结果不同[31],该结果的差异可能是由于羔羊所采食饲粮的差异所致。普雷沃氏菌属可以降解蛋白质、淀粉和木聚糖等营养物质,可以提高饲料利用率[32]。PD 组羔羊瘤胃克里斯滕森氏菌科R-7群、未分类厚壁菌门属以及瘤胃球菌属UCG-002 丰度均显著低于MD 组,而未分类梭状芽孢杆菌_UCG-014 丰度显著高于MD 组。克里斯滕森氏菌科R-7 群可以通过增加乳头宽度、上皮和角质层厚度来促进瘤胃发育[33];瘤胃球菌是瘤胃中主要的纤维降解细菌,其丰度的变化可显著改变瘤胃营养物质的消化和利用[32,34];未分类梭菌属_UCG-014 是种有益菌,可维持肠道环境的稳定[35]。此结果的出现,与本研究发现的植物源蛋白代乳粉饲喂的羔羊,其生长性能和消化性能低于乳源蛋白的结果相符,至于植物源蛋白代乳粉是否有利于羔羊瘤胃的发育,还需进一步研究。
4 结论
与全乳源蛋白代乳粉相比,以植物源蛋白替代乳蛋白配制的代乳粉会降低羔羊的生长消化性能,此外,植物源蛋白代乳粉可以改变羔羊瘤胃发酵参数和瘤胃菌群结构,提高了羔羊瘤胃中异戊酸和NH3-N的浓度,促进蛋白质和淀粉降解菌的富集,有利于羔羊瘤胃的发酵,但是否能促进羔羊瘤胃发育还需进一步探究。
