针刺损伤后修复中的淋巴样结构
2024-04-02陈丹丹于宁刘然孟繁伟
陈丹丹,于宁,刘然,孟繁伟∗
(1. 山东中医药高等专科学校解剖教研室,山东烟台 264100;2. 山东中医药高等专科学校口腔教研室,山东烟台 264100)
外伤性脊髓损伤(spinal cord injury,SCI)是一种严重的创伤性中枢神经系统(central nervous system,CNS)疾病,可导致患者感觉障碍和运动功能永久性丧失,给患者及家属造成沉重的打击。 脊髓损伤后坏死的神经组织会产生大量的包括脂类在内的废物,而这些物质的及时清除对于脊髓损伤后的修复、重建很重要[1]。 脂类的运输通常是通过内皮细胞间隙较大的毛细淋巴管[2],而非中枢神经系统中的连续型毛细血管[3]。 传统观念认为CNS 缺乏淋巴管,但是随着技术的发展,陆续有研究证实脑脊膜淋巴管在小鼠[4-7]、大鼠[8]和人[9]等中均存在,同时,在维系内环境稳态、脑脊液循环稳定以及控制包括免疫细胞在内的大分子物质进出中枢神经系统方面发挥重要作用[6]。
据报道,小鼠淋巴管的发育大约在胚胎期第9.5 天开始,主要来源于前主静脉静脉内皮细胞的亚群[10]。 后者表达SOX18(SRY-related box-18),SOX18 通过与其启动子结合来激活同源异型盒基因转录因子1(prospero-related homeobox 1,prox-1)转录。 prox-1 被认为是淋巴管分化的“关键调节因子”,在驱动淋巴管生成及其维持方面发挥重要作用[11]。 胚胎期第10.0 天,血管内皮生长因子3(vascular endothelial growth factor 3,vegf3)诱导血管内皮生长因子受体3(vascular endothelial growth factor receptor 3,vegfr3)阳性淋巴管内皮祖细胞从静脉出芽,静脉内皮细胞亚群从静脉分离并开始表达淋巴管内皮透明质酸受体1 (lymphatic vessel endothelial hyaluronic acid receptor 1, lyve-1)[12]。lyve-1 促进平足蛋白(podoplanin)在静脉内皮细胞亚群中均匀表达。 lyve-1 和podoplanin 是淋巴管生成的关键介质[13]。 vegf3 通过与vegfr3 的结合启动淋巴管的发芽和原始淋巴囊的形成,使得淋巴管内皮细胞(lymphatic endothelial cells,LECs)从静脉中分离并增殖发育成淋巴管。 淋巴管的发育形成在小鼠胚胎期第14.5 天完成。 因此,prox-1、lyve-1、podoplanin 和vegfr3 被广泛用作LECs 标记物以检测各种情况下的淋巴管生成[14-15]。 ANTILA 等[16]对出生后小鼠脑膜淋巴管的发育进行了详细的研究,发现小鼠脑膜淋巴管首先出现在颅骨和椎管基底部的椎间孔周围,然后沿着血管、脑神经和脊神经萌芽到脑脊膜周围的各个部位,且具备可塑性和再生潜力。 脊髓损伤后,脊膜部位的淋巴管出现广泛重塑[7-8]。 但是脊髓内部是否存在淋巴管以及脊髓损伤修复的过程中是否有淋巴管参与均未见报道。
本课题组前期研究发现穿透性颅脑损伤后,受损的小鼠脑组织中检测到LECs 标志物的表达,考虑LECs 在CNS 损伤中的表达可能与淋巴管促进损伤组织清除有关[17]。 本实验通过建立小鼠脊髓针刺损伤模型,运用免疫组织化学技术检测正常小鼠脊髓及针刺损伤后小鼠脊髓中LECs 标志物的表达情况,探讨正常成年小鼠脊髓是否分布有淋巴管样结构及其走行、分布特征;观察脊髓损伤处重建过程中有无新生淋巴管样结构的出现及其可能来源,以期为CNS 损伤后的临床修复治疗提供新的策略。
1 材料与方法
1.1 材料
1.1.1 实验动物
39 只4 周龄SPF 级雌性健康KM 小鼠,体重18~25 g,购于济南朋悦动物繁育有限公司【SCXK(鲁)2019 0003】。 饲养期间,自由饮食水,控制湿度40% ~60%,温度23 ~25 ℃,按昼夜各半循环照明,饲养于滨州医学院动物实验室【SYXK(鲁)2018-0029】。 所有操作符合山东中医药高等专科学校动物实验伦理学要求(2021-47)。
1.1.2 主要试剂与仪器
lyve-1 抗体(R&D Systerms,美国),CD34 抗体(武汉博士德生物工程有限公司,中国)、prox-1 抗体(武汉博士德生物工程有限公司,中国),podoplanin抗体(武汉博士德生物工程有限公司,中国),Alexa Fluor®488 IgG(武汉安特捷生物技术有限公司,中国),DAB 显色试剂盒(武汉博士德生物工程有限公司,中国)。 倒置荧光相差显微镜(Olympus IX51 +DP72,日本),组织包埋机(Leica HistoCore Arcadia,德国),烘片机(Leica HI1220,德国),展片机(Leica HI1220,德国),切片机(Kedee KD2258,中国)。
1.2 方法
1.2.1 动物造模
小鼠随机分为两组:正常组6 只和损伤组33只。 将损伤组小鼠随机分为术后1 d 组、术后3 d组、术后5 d 组、术后7 d 组和术后14 d 组,每组6只。 损伤组部分小鼠针刺损伤后死亡3 只,后随机补充样本。 造模前将KM 小鼠以1%戊巴比妥钠按50 mL/kg 剂量行腹腔注射麻醉后,取俯卧位,固定小鼠四肢,胸腰节段附近背部备皮、消毒。 正常组切开皮肤、不进行针刺损伤,损伤组小鼠显露棘上韧带,剪断T12 与L1 之间棘间韧带,使用直径0.45 mm 的26 号针灸针垂直刺入椎管,见小鼠下肢出现明显的肌肉抽搐,拔出针体,缝合棘上韧带、皮肤,关闭切口。
1.2.2 术后处理
术后,将小鼠置于37 ℃温箱复温苏醒,然后,饲养于23 ~25 ℃的室温环境,自由进食和饮水,每7 d 更换垫料。 分别在术后第1、3、5、7、14 天经1%戊巴比妥钠过量麻醉处死各组小鼠取脊髓标本。正常对照组小鼠只将背部皮肤切开,不做椎管内针刺处理。
1.2.3 脊髓组织取材
小鼠在相应时间点经1%戊巴比妥钠麻醉后,迅速打开胸腔,经左心室至升主动脉插管,首先用100 mL 生理盐水灌注,再用4%(pH =7.4,4 ℃)的多聚甲醛快速灌注,随后慢速灌注150 mL。 确定小鼠脊柱胸腰段交界处,切开皮肤,用眼科钳咬断椎板,暴露脊髓,在针刺部位上下5 mm 处剪断,将取下的脊髓置于4%多聚甲醛4 ℃固定24 h,进行脱水、透明、浸蜡、包埋。 在针刺点周围行连续组织切片,将5 μm 厚的纵切面标本黏附在玻片上。
1.2.4 脊髓组织免疫组织化学染色及定量分析
(1)HE 染色观察脊髓针刺损伤后病理过程:脊髓组织在多聚甲醛中固定24 h 后,修剪为约5 mm3的组织块,石蜡包埋切片,HE 染色,封片后,镜下观察、拍照。
(2)脊髓组织免疫组织化学染色:采用链霉亲和素-生物素-过氧化物酶复合(SABC)法进行免疫组织化学染色操作:切片常规脱蜡、入水,用PBS 漂洗3 次,每次5 min;37 ℃水浴箱胰酶法抗原修复10 min, PBS 漂洗3 次,每次5 min;10%的山羊血清封闭1 h。 孵育一抗:使用1% BSA 按比例稀释一抗,分别滴加CD34(1 ∶200)、prox-1(1 ∶100)、podoplanin(1 ∶100)和lyve-1(1 ∶100)到切片组织上将其覆盖,之后将切片放入湿盒中4 ℃孵育过夜。一抗孵育结束后,取出湿盒,在37 ℃水浴箱复温1 h, PBS 漂洗 3 次, 每次5 min,滴加生物素化二抗到切片组织上将其覆盖。 DAB 显色,苏木素复染,充分水化,光镜下观察。
(3)定量分析:每只小鼠在针刺点周围选取5 张切片,每张切片随机选取10 个高倍视野,拍照。应用Image-Pro Plus 6.0 进行prox-1 阳性表达的半定量分析,统计平均光密度值。
1.2.5 脊髓组织免疫荧光染色
根据组织免疫荧光染色步骤进行操作:切片常规脱蜡、入水,PBS 漂洗3 次,每次5 min;37 ℃水浴箱胰酶法抗原修复10 min,PBS 漂洗3 次,每次5 min; 10%的山羊血清封闭1 h。 孵育一抗:使用1% BSA 按比例稀释一抗,分别滴加CD34(1 ∶200)、prox-1(1 ∶100)、podoplanin(1 ∶100)和lyve-1(1 ∶100)到切片组织上将其覆盖,之后将切片放入湿盒中4 ℃孵育过夜。 一抗孵育结束后,取出湿盒,故在37 ℃水浴箱复温1 h,PBS 漂洗3 次,每次5 min,后续操作全程避光,滴加TRITC 或alexa fluor@488,37 ℃, 60 min,防淬灭封片剂封片,4 ℃,避光保存。暗室中荧光显微镜观察拍照。
1.3 统计学分析
所获的数据使用统计软件SPSS 22.0 进行分析,计量资料使用平均值± 标准差(±s)表示。 计量资料满足正态分布时,两组间比较采用独立样本t检验,三组及以上比较采用单因素方差分析。 若计量资料不满足正态分布,则用非参数检验进行分析。P<0.05 为差异具有统计学意义。
2 结果
2.1 脊髓针刺损伤小鼠模型
针刺脊髓损伤过程中,有3 只小鼠死亡,考虑由于针刺小鼠脊髓过深或定位不准确所致。 后改进实验措施:在T12 为中心,沿背部正中纵行切开皮肤2 cm,暴露椎骨,显露棘上韧带,剪断T12 与L1 之间棘间韧带,使用直径0.45 mm 的26 号针灸针垂直刺入椎管,见小鼠下肢出现明显的肌肉抽搐,拔出针体,缝合棘上韧带、皮肤,关闭切口。 改进后实验小鼠无死亡。
2.2 脊髓针刺损伤后病理过程
HE 染色显示正常组脊髓中灰质与白质分别分布于中央和外周,神经元大小形态正常,白质中神经纤维排列整齐,无断裂(图1A)。 损伤组针刺术后1 d,损伤处灰质可见明显的出血,周围组织结构紊乱,连续性出现中断(图1B)。 针刺术后3 d,损伤处可见神经纤维排列紊乱,相互之间出现大量不规则孔隙,并伴有炎性细胞浸润(图1C)。 针刺术后5 d, 损伤处被大量新生细胞逐渐替代,细胞间隙减少,排列无序(图1D)。 针刺术后7 d,损伤处间隙逐渐缩小,被肉芽组织逐渐替代(图1E)。 针刺术后14 d,损伤处被瘢痕组织替代(图1F)。
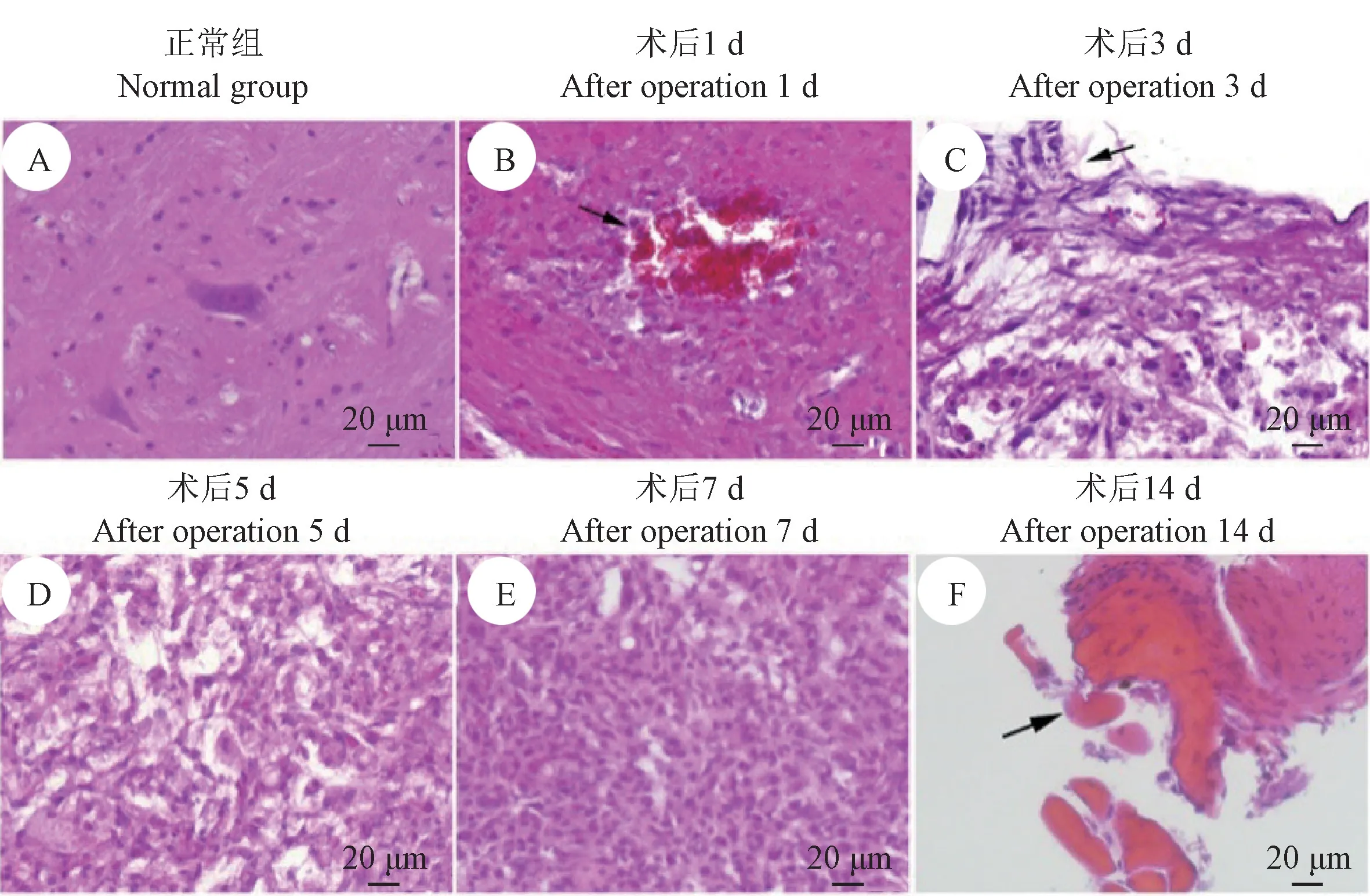
图1 脊髓HE 染色Figure 1 HE staining of spinal cord
2.3 脊髓针刺损伤前、后LECs 标记物的表达变化
2.3.1 脊髓针刺损伤前、后podoplanin 的表达变化
正常组小鼠脊髓中左右两侧均检测到典型的podoplanin 阳性淋巴管,其呈节段性分布,走行与脊髓长轴相垂直,分布于中央管与脊髓边缘之间(图2A)。 针刺术后1 d,损伤处均未发现LECs 特异性标识分子podoplanin 的阳性表达(图2B);针刺术后3 d,损伤处的肉芽组织中可检测到podoplanin 阳性表达细胞的分布(图2C);针刺术后5 d,损伤处的肉芽组织中检测到podoplanin 阳性表达细胞的分布(图2D),针刺术后7 d,肉芽组织中血管周围出现了典型的podoplanin 阳性淋巴管结构(图2E);针刺术后14 d,瘢痕处边缘仍有podoplanin 阳性细胞分布(图2F)。
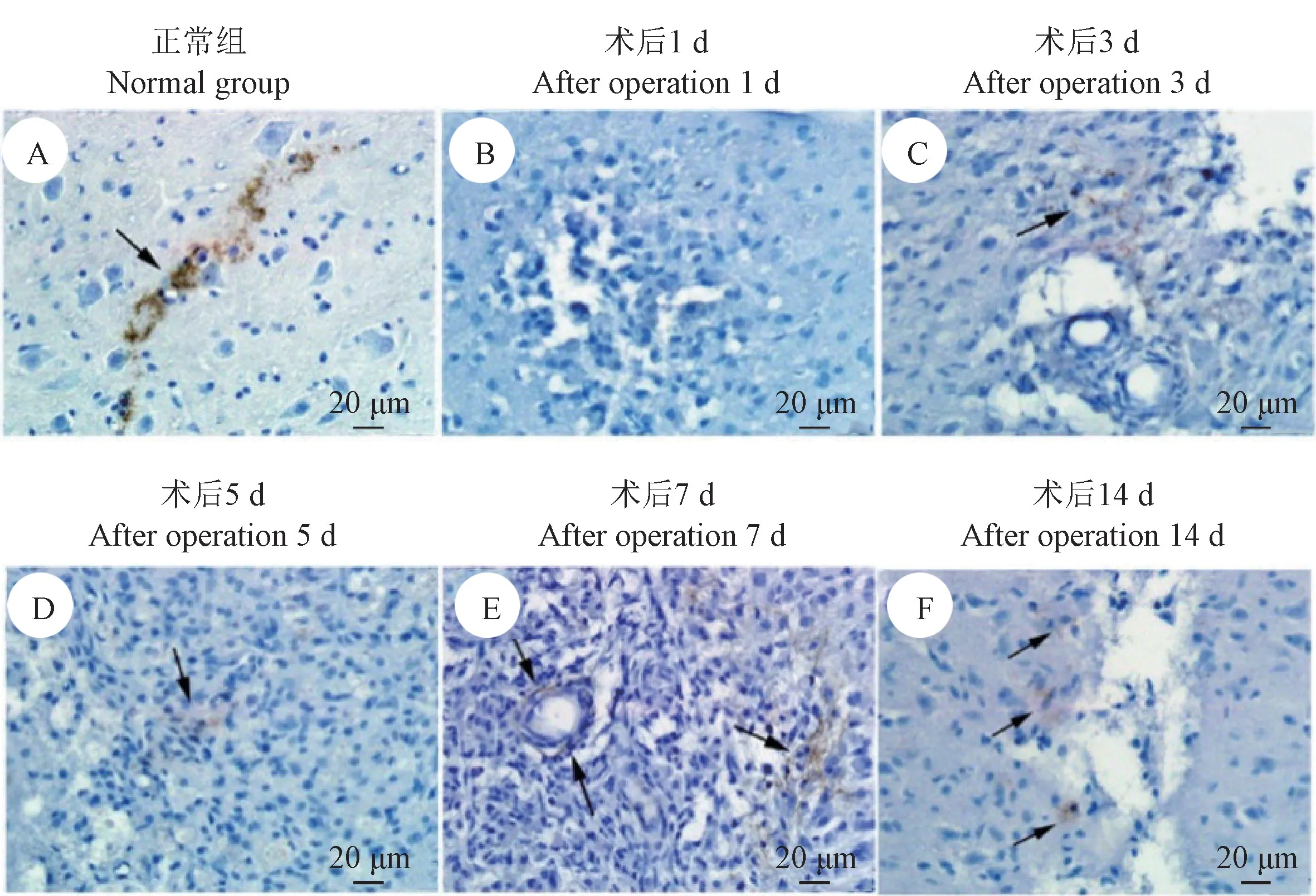
图2 各组脊髓免疫组织化学染色检测podoplanin 的表达Figure 2 Expression of podoplanin in each group of spinal cord measured by IHC
2.3.2 脊髓针刺损伤前、后lyve-1 的表达变化
正常组小鼠脊髓中左右两侧均检测到lyve-1 阳性淋巴管样结构,其呈节段性分布,走行与脊髓长轴相垂直,分布于中央管与脊髓边缘之间(图3A)。针刺术后1 d,损伤处均未发现LECs 特异性标识分子lyve-1 的阳性表达(图3B);针刺术后3 d,损伤处的肉芽组织中检测到lyve-1 阳性表达细胞的分布(图3C);针刺术后5 d,损伤处的肉芽组织中检测到lyve-1 阳性表达细胞的分布(图3D);针刺术后7 d,肉芽组织中血管周围出现lyve-1 阳性表达细胞(图3E);针刺术后14 d,瘢痕组织周围出现的典型的lyve-1 阳性淋巴管样结构(图3F)。

图3 各组脊髓免疫组织化学染色检测lyve-1 的表达Figure 3 Expression of lyve-1 in each group of spinal cord measured by IHC
2.3.3 脊髓针刺损伤前、后prox-1 的表达变化
正常组小鼠脊髓不表达prox-1(图4A)。 针刺术后1 d,损伤处出现大量prox-1 阳性表达细胞(图4B);针刺术后3 d,损伤处的肉芽组织中检测到prox-1 阳性细胞表达(图4C)。 针刺术后5 d,肉芽组织中可以看到prox-1 阳性细胞,部分prox-1 阳性细胞形成淋巴管结构(图4D)。 针刺术后7 d,肉芽组织中prox-1 阳性淋巴管状结构持续存在(图4E)。针刺术后14 d,瘢痕组织周围prox-1 阳性细胞基本消失(图4F)。 通过检测免疫组织化学平均光密度值发现,针刺术后1 d,prox-1 高表达。 针刺术后3 d, prox-1 表达下降。 针刺术后5 d,prox-1 表达继续下降。 针刺术后14 d,prox-1 不表达(图4G)。
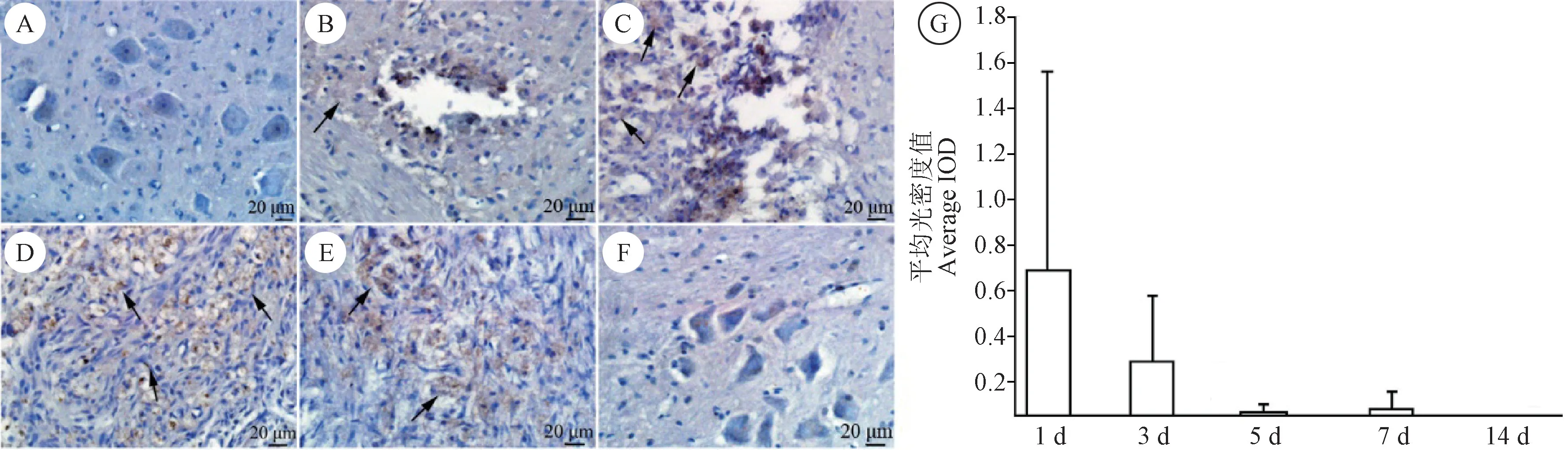
图4 各组脊髓免疫组织化学染色检测prox-1 的表达Figure 4 Expression of prox-1 in each group of spinal cord measured by IHC
2.4 脊髓损伤前、后血管分布的变化
正常组小鼠脊髓中血管内皮标记物CD34 阳性细胞很少表达(图5A)。 损伤组针刺后1 d,损伤处未见CD34 阳性细胞(图5B)。 针刺后3 d,损伤处开始出现CD34 免疫阳性反应物(图5C)。 针刺后5 d, 损伤处肉芽组织中可见到CD34 阳性细胞显著表达,广泛分布(图5D)。 针刺后7 d,损伤处可见到CD34 阳性细胞反应物的颜色变浅,数量仍然较多(图5E)。 针刺术后14 d,瘢痕组织处已无CD34阳性细胞检出(图5F)。
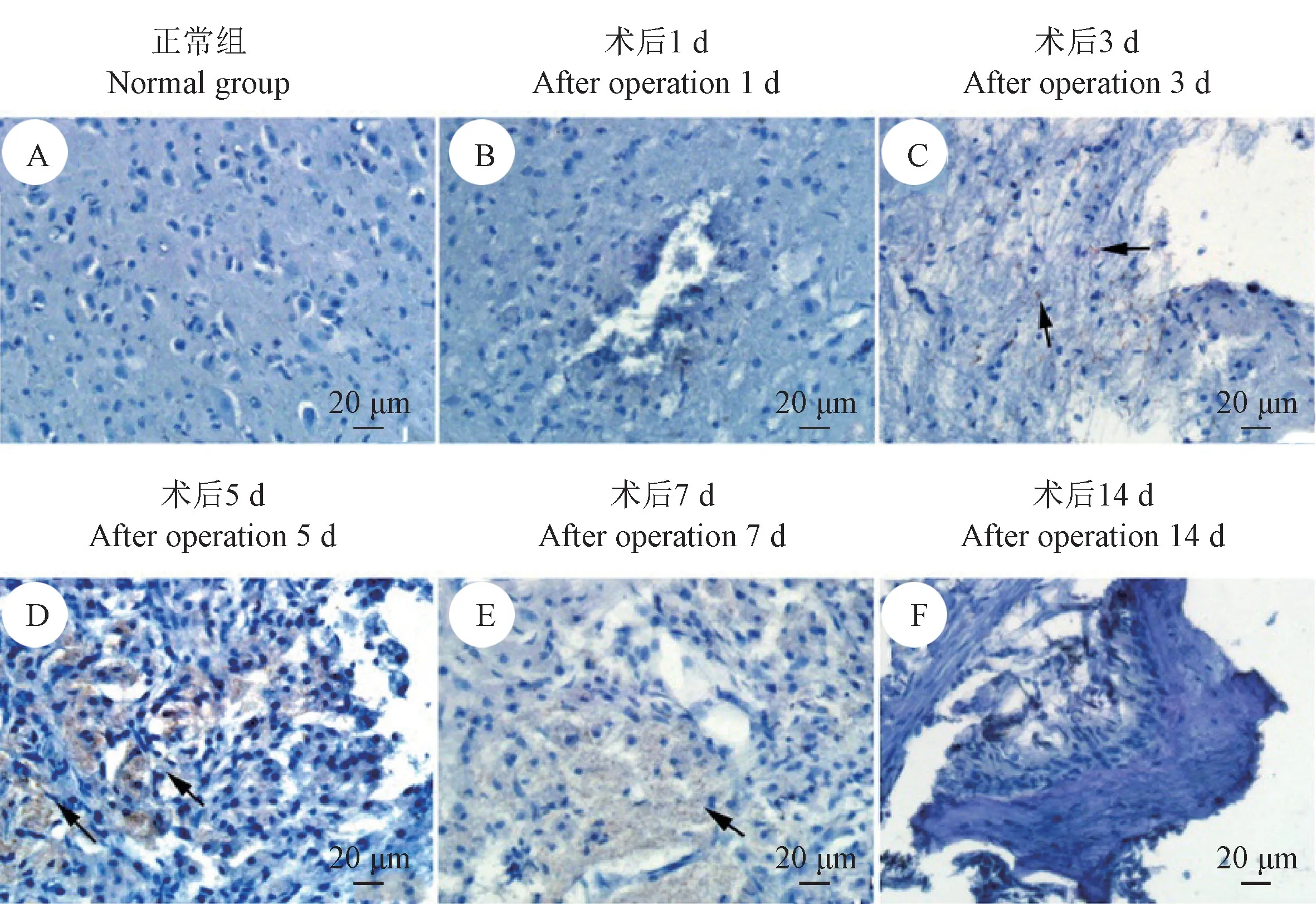
图5 各组脊髓免疫组织化学染色检测CD34 的表达Figure 5 Expression of CD34 in each group of spinal cord measured by IHC
2.5 免疫荧光双重染色结果
针刺后3 d,脊髓针刺损伤处出现的新生细胞部分共表达lyve-1/podoplanin、lyve-1/prox-1 和CD34/prox-1,且lyve-1/prox-1 共表达的新生细胞呈典型淋巴管状结构(图6)。
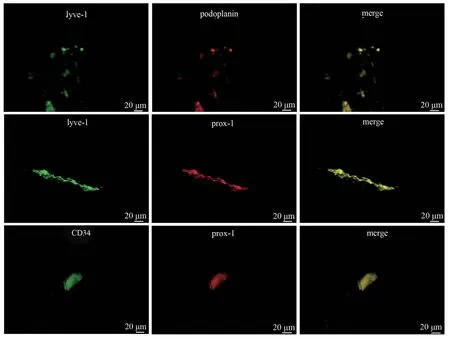
图6 损伤组术后3 d lyve-1/podoplanin、lyve-1/prox-1、CD34/prox-1 荧光双重染色结果Figure 6 Lyve-1/podoplanin, lyve-1/prox-1 and CD34/prox-1 on 3 d after spinal cord injury by immunofluorescence
3 讨论
淋巴管由淋巴管内皮细胞构成,外面附有薄层平滑肌及外膜。 淋巴管参与运输脂类、蛋白质、免疫细胞等的功能,在维持内环境稳态和免疫防御功能方面发挥重要的作用[18]。
目前已发现并常用的LECs 标志物有:vegfr3,应用最早最广泛[19];prox-1,被认为是淋巴管分化的主要调控基因,可以促使静脉分化为淋巴管[20-21];lyve-1,参与淋巴管系统的透明质酸代谢,是最具特征的淋巴内皮标记之一[22-23];podoplanin,主要表达于LECs[24-25]。 目前关于淋巴管尚未发现唯一的特异性标记物[26]。 因此,多个LEC 标记物常被联合应用以提高LECs 鉴定的特异性。 本研究同时使用prox1、lyve-1、podoplanin 进行淋巴管标记。
实验采用免疫组织化学技术检测正常小鼠脊髓中LECs 标志物prox1、lyve-1 和podoplanin 的表达情况,发现在正常小鼠脊髓中prox1 不表达,lyve-1和podoplanin 存在节段性阳性表达,分布于脊髓中央管与脊髓边缘之间,其走行与脊髓长轴相垂直,中央管两侧均存在且基本呈左右对称现象。 因此,推断在正常小鼠脊髓中可能存在淋巴管样结构,并执行特定的功能。 损伤之后的小鼠脊髓中观察不到lyve-1 和podoplanin 的阳性淋巴管样结构的存在。
在本次动物实验中,运用免疫组织化学技术检测针刺损伤后脊髓内相关LECs 标志物的表达,发现针刺后3 d,小鼠脊髓肉芽组织中prox1、lyve-1 和podoplanin 表达明显增加。 针刺后5 ~7 d,肉芽组织中出现典型的prox1 阳性淋巴管样结构。 针刺后7 d,出现典型的podoplanin 阳性淋巴管样结构,针刺后14 d,出现典型的lyve-1 阳性淋巴管样结构。针刺后3 d,lyve-1/podoplanin、lyve-1/prox-1 荧光双重染色结果进一步表明脊髓针刺损伤后组织修复过程中出现了新生LECs 标志物的阳性表达,并呈现典型的淋巴管样结构。 脊髓损伤势必会发生炎性反应,坏死的神经组织会产生大量的包括脂类在内的废物,而这些物质的及时清除对脊髓损伤后的重建很重要[1]。 脂类通常是通过内皮细胞间隙较大的毛细淋巴管运输[2,27]。 同时,炎症又可促进淋巴管内皮细胞的增殖、迁移和管道形成[28]。 淋巴管结构的出现往往意味着可以执行淋巴管功能。 这与之前研究的小鼠大脑贯通伤处组织修复重建过程出现了新生淋巴管[17]的结果相一致,提示CNS损伤修复过程中极可能出现了新生淋巴管,新生淋巴管可以清除坏死神经细胞的磷脂分解产物及炎症细胞,是损伤后重建的重要一环[29]。 针刺后14 d,lyve-1 和podoplanin 阳性反应物只在瘢痕组织周围存在,且表达明显减少,而瘢痕组织周围很少有阳性表达,说明新生淋巴管在损伤后的出现为一过性。 当损伤处被瘢痕组织替代后,新生的淋巴管失去了其作用,也就逐渐消失了。 因此,推断损伤后脊髓中新生淋巴管积极参与了神经组织的重建。CD34 为血管内皮细胞标志物。 为推测新生淋巴管样结构的可能来源,进行了CD34 与淋巴管内皮标记物的免疫荧光双染。 本实验证实正常脊髓组织中很少有细胞表达血管内皮细胞标志物CD34。 小鼠脊髓针刺损伤术后,损伤后3 ~5 d,损伤处可见CD34 阳性反应物逐渐增多,广泛分布;损伤后 7 d,CD34 阳性反应物的颜色变浅,数量仍然较多;损伤后14 d,瘢痕组织周围已无CD34 阳性细胞分布。免疫荧光双染证实损伤处的部分CD34 阳性细胞同时也表达prox1,推测新生淋巴管内皮细胞也可能来自于周围血管内皮细胞。 这与胚胎期淋巴管发育过程中,早期的淋巴管的内皮细胞是由静脉的血管内皮细胞分化而来[30]的结论相一致。 因此,可以推测,脊髓损伤处的新生淋巴管内皮细胞可能来源于两种途径,周围既存的淋巴管或血管内皮细胞,但尚不能明确两种路径的哪一种,或两者之间的比例,因此值得进一步探讨研究。
综上所述,正常小鼠脊髓中存在左右对称、节段性分布的淋巴管样结构,小鼠脊髓损伤后出现一过性新生淋巴管。 该结果证实了中枢神经淋巴管样结构的存在及可塑性,也为淋巴管在CNS 损伤修复中的作用提供了研究佐证。 同时表明,淋巴系统功能调节可能是中枢神经创伤性损伤后修复的临床治疗靶点之一。
