天津野生鲤与选育鲤的遗传多样性分析
2024-04-01刘肖莲宋立民戴媛媛吴会民
刘肖莲,郝 爽,李 楠,宋立民,杨 峻,马 林,戴媛媛,吴会民
( 天津市水产研究所,天津 300221)
引 言
鲤(Cyprinuscarpio)是我国一种重要的经济鱼类,广泛分布于长江、黄河、黑龙江等淡水水体中。州河鲤为仅分布于天津市蓟州区于桥水库的野生鲤,水库特殊的地理地貌和优越的水源环境使州河鲤形成了头小、后缘背部无明显隆起的独特外形和肉质紧实、咀嚼滑韧的口感,被称为金翅鲤、御膳鲤[1]。由于受水域污染、过度捕捞等人类活动影响,州河鲤种群资源量持续减少;同时库区周边池养鲤鱼随洪水潜入库内以及违法放生活动,使州河鲤种质纯度受到一定程度破坏[2]。通过分子标记对州河鲤种质资源进行评估,制定合理的选育计划,可以在生产上指导州河鲤的提纯复壮工作,有效的进行种质资源的保护与利用。
微卫星分子标记作为第二代遗传标记,与其他标记相比,具有多态性高、共显性、可稳定遗传、重复性好等优点,目前已广泛应用于水产动物的遗传多样性分析、增殖放流效果评估、亲子鉴定、指导亲本选配等方面[3-5]。白云等[6]对州河鲤等5种类型鲤鱼线粒体D-loop区及邻近区段进行测序发现,州河鲤的核苷酸多样性指数明显小于其他4种类型鲤鱼,遗传多样性水平较低。而目前尚未有基于核基因分子标记对州河鲤进行遗传多样性分析的相关报道。本研究以微卫星标记为技术手段,对州河鲤、潮白河群体以及人工选育品种“福瑞鲤2号”进行遗传多样性评估,以期为鲤的种质资源保护以及新品种创制提供理论依据。
1 材料与方法
1.1 试验材料
共采集2个野生鲤群体和1个选育群体,其中野生群体为州河鲤39尾,潮白河40尾,选育群体为中国水产科学研究院淡水渔业研究中心选育的福瑞鲤2号40尾。剪取尾鳍保存于100%无水乙醇中保存备用。采用海洋动物组织基因组DNA提取试剂盒进行基因组提取,用Nanodrop紫外分光光度计测量DNA浓度,并稀释至100 μg/mL作为工作液。
1.2 PCR扩增与检测
试验所用微卫星标记 为文献[7-8]报道的部分引物。微卫星引物5’端用FAM或HEX荧光染料进行修饰,并由生工生物工程(上海) 有限公司合成。PCR反应体系(总20 μL)为:2×Taq PCR Master Mix 10 μL、正反向引物(10 μmol/L)各0.5 μL、DNA模板100 ng、无菌水补足体积至20 μL。PCR反应程序为:94℃预变性5 min;94℃变性30 s,退火30 s,72℃延伸45 s,此过程循环35次;72℃延伸10 min。PCR产物委托生工生物工程(上海)有限公司进行毛细管凝胶电泳,利用GeneMapper 4.0 软件读取微卫星位点的等位基因条带大小。
1.3 数据分析
利用软件Popgene1.32计算各个群体的等位基因数(Na)、有效等位基因数(Ne)、期望杂合度(He)、观测杂合度(Ho)以及Nei’s遗传距离。利用在线软件Genepop检测Hardy-Weinberge平衡,并计算近交系数Fis。利用Arlequin3.1进行分子方差分析(AMOVA)并计算群体间遗传分化指数(Fst);各位点的多态信息含量(PIC)用软件PIC-CALC计算;根据Nei’s遗传距离,利用软件MEGA 5.0进行聚类树的构建。
2 结果与分析
2.1 位点多态性
部分位点的毛细血管电泳峰图如图1、图2所示,各位点的遗传多样性指数如表1所示,等位基因数Na在15~26之间;有效等位基因数Ne在5.094 1~10.825 4之间;期望杂合度He在0.807 2~0.911 6之间;观测杂合度Ho在0.439 7~0.913 8之间;多态信息含量PIC在0.788 0~0.900 7之间,均大于0.5,说明12个位点的多态性处于较高水平。
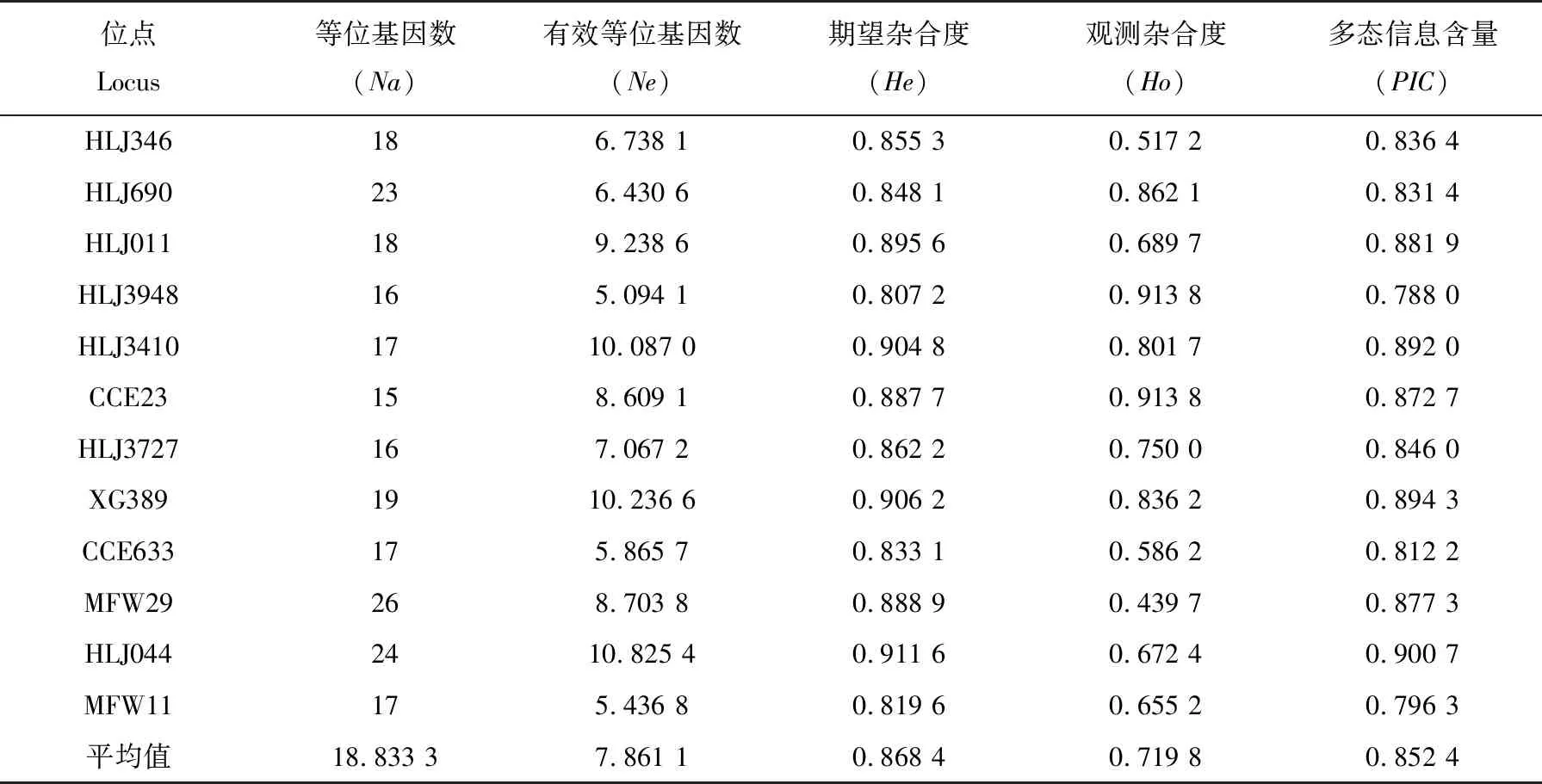
表1 12个微卫星位点在3个群体上的遗传特性

图1 位点CCE23在州河鲤群体中的扩增结果
图2 位点CCE633在潮白河群体中的扩增结果
2.2 群体多态性
3个群体的遗传多样性指数见表2。3个群体中,平均等位基因数最大的是潮白河群体(Na=16.166 7),最小的是福瑞鲤2号(Na=3.666 7)。在所有群体中平均观测杂合度最高的是潮白河群体(0.882 5),接下来的依次是州河鲤(0.691 1)、福瑞鲤2号(0.636 7)。3个群体的平均PIC值分别为:0.772 2(州河鲤)、0.872 7(潮白河群体)、0.573 2(福瑞鲤2号)。对3个群体所有位点进行哈迪温伯格平衡检测,发现州河鲤中有1个位点显著偏离哈迪温伯格平衡(P<0.05),有6个位点极显著偏离哈迪温伯格平衡(P<0.01);潮白河群体中有5个位点极显著偏离哈迪温伯格平衡(P<0.01);福瑞鲤2号有1个位点显著偏离哈迪温伯格平衡(P<0.05),有10个位点极显著偏离哈迪温伯格平衡(P<0.01),说明福瑞鲤2号群体在形成过程中受到较大的人工选择压力的影响。可以看出,野生群体的各项遗传学参数普遍高于选育群体。
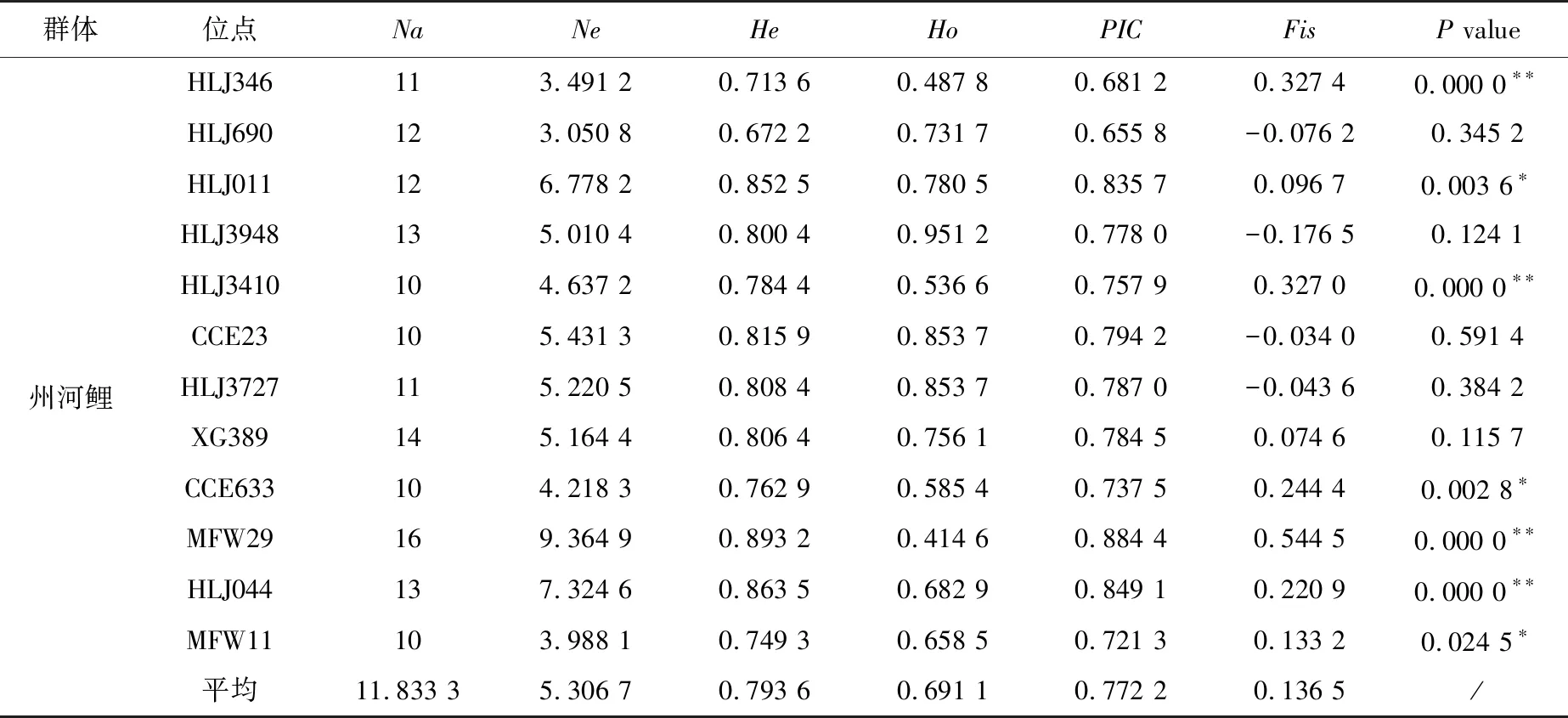
表2 3个群体在12个位点中的遗传多样性指数
2.3 群体间的遗传分化
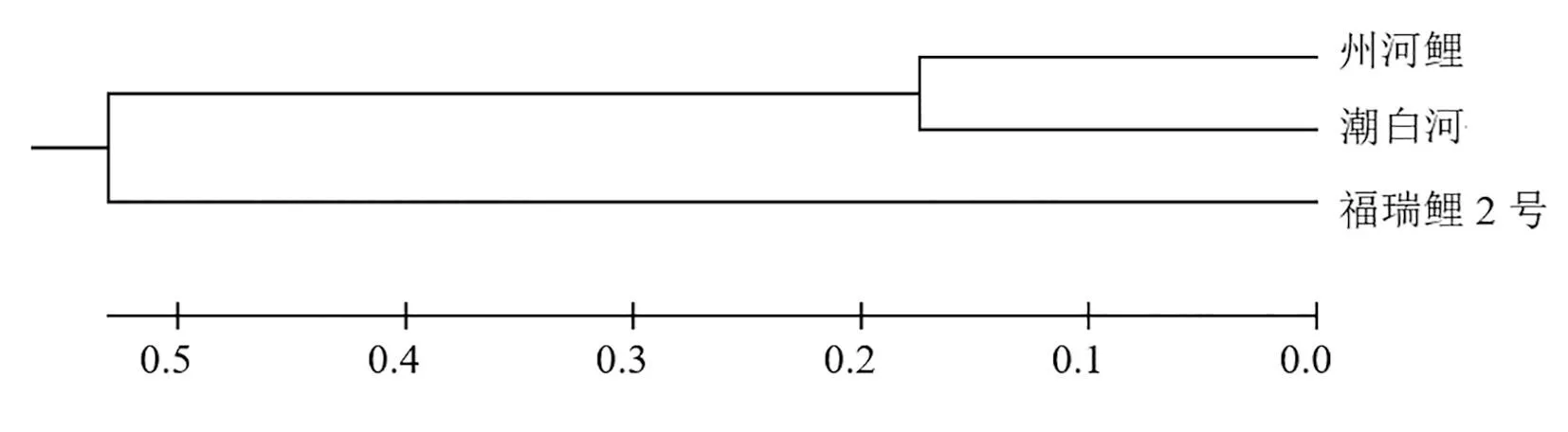
对3个群体的Fst值分别进行分析,结果见表3。遗传分化指数Fst<0.05表明群体间存在较小的遗传差异;0.05 表3 两两群体间的Fst值(对角线下)和Nei′s遗传距离(对角线上) 图3 基于Nei’s遗传距离构建的UPGMA聚类树 群体遗传变异的AMOVA分析结果显示,13.62%(P<0.01)的遗传变异来源于群体间,86.38%(P<0.01)的变异来源于群体内,说明遗传差异主要存在于个体间,个体间的遗传变异远大于群体之间的遗传变异(表4)。 本文选取12对微卫星引物对3个鲤群体进行了遗传多样性分析。12个位点扩增出的等位基因数在15~26之间,多态信息含量在0.788 0~0.900 7之间,平均多态信息含量为0.852 4,说明本文选取的微卫星位点的多态性较高,可用于鲤群体的遗传多样性分析。 群体的遗传多样性是育种工作的物质基础。遗传多样性水平越高,在生长、抗逆、抗病等方面就更有优势,育种过程中可获得的遗传进展就越大[10]。等位基因数(Na)、多态信息含量(PIC)是衡量等位基因片段多态性的重要指标,州河鲤、潮白河群体和福瑞鲤2号的平均等位基因数为11.833 3、16.166 7、3.666 7,说明野生群体州河鲤和潮白河群体具有丰富的育种潜力,而选育群体福瑞鲤2号在人工选育的进程中获得了较纯的种质。本试验中三个群体的平均PIC值分别为0.772 2、0.872 7、0.573 2,高于黄河鲤(0.468)[11]、广西野生鲤与建鲤(0.438 8)[12]、长江野鲤(0.528 7)[13],说明野生群体与选育群体均具有较高的遗传多样性。选育群体福瑞鲤2号的原始亲本除了黄河鲤、建鲤之外,还引入了黑龙江野鲤,因此在获得较纯的种质同时,也保留了较高的遗传多样性,这与董在杰等[14]的研究结果类似。哈迪温伯格平衡检验结果显示,州河鲤有7个位点、潮白河群体有5个位点、福瑞鲤2号有11个位点偏离哈迪温伯格平衡。根据哈迪温伯格定律,一个无限大的、随机交配的群体,在没有突变、没有选择和遗传漂变等因素干扰时,各等位基因的频率和基因型频率在遗传中稳定不变,即保持遗传平衡。本文中出现偏离哈迪温伯格平衡的位点,大多为He大于Ho,说明存在杂合子缺失,野生群体可能是由于过度捕捞、环境污染导致了某些等位基因的丢失;而选育群体偏离哈迪温伯格平衡则有可能是与育种过程中的定向选择有关。同时,无效等位基因的存在也可能是引起杂合子缺失的原因。 遗传分化指数(Fst)是衡量群体间遗传变异程度的参数之一,本实验中州河鲤与潮白河的Fst值为0.046 7,小于0.05,说明二者之间的遗传分化水平较低。福瑞鲤2号与州河鲤、潮白河鲤的Fst值分别为0.210 4、0.158 8,根据Wright[9]对Fst的划分,当0.15
3 讨论
