环状RNA调控卵巢癌及其化疗耐药的研究进展*
2024-04-01陈小英柯瑶刘夏苏宇婷王聪尹富强
陈小英,柯瑶,刘夏,苏宇婷,王聪,尹富强
(广西医科大学 1.基础医学院,2.长寿与老年相关疾病教育部重点实验室,3.生命科学研究院与区域性高发肿瘤早期防治研究教育部重点实验室,广西 南宁 530021)
卵巢癌是女性生殖系统第3大恶性肿瘤,据统计,2022年我国预计有57 090例卵巢癌新发病例和39 306例卵巢癌死亡病例,病死率在女性肿瘤中稳居第5位[1]。以铂类和紫杉烷类为主的化疗是卵巢癌术后治疗的主要手段,但多数晚期患者会不同程度地对化疗药物产生耐药,导致复发和死亡[2]。卵巢癌化疗耐药的机制十分复杂,至少包括编码基因和非编码RNA调控及肿瘤微环境变化,涉及多药耐药、上皮间充质转化(epithelial-mesenchymal transition,EMT)、细胞周期、凋亡、自噬和异常信号通路等[3-4]。因此,调控卵巢癌发生、发展的机制研究一直是基础和临床研究中的重点问题,并在卵巢癌治疗及耐药方面取得了一定进展,但至今仍未找到非常有效的途径以提高卵巢癌患者的生存率。
环状RNA(circular RNA,circRNA)是由信使RNA前体通过可变剪接形成的一类不具有5′-末端帽子和3′-末端poly(A)尾巴的单链共价闭合非编码RNA,不易被核糖核酸酶降解,在多种肿瘤中显著差异表达,可作为竞争性内源RNA(competing endogenous RNA,ceRNA)、与功能蛋白互作、翻译成多肽和蛋白质等方式影响卵巢癌及其他肿瘤的发生、发展,正迅速成为癌症的潜在早期分子诊断标志物和耐药治疗靶点[5]。因此,本文对已报道与卵巢癌及其耐药调控相关的62个circRNAs进行了系统综述,其中45个为肿瘤驱动因子,17个为肿瘤抑制因子,主要在细胞质中发挥癌基因作用;15个与顺铂和紫杉烷类化疗耐药显著相关,9个存在于体液中具有高效诊断价值,24个与预后相关,主要影响卵巢癌细胞的凋亡、EMT、细胞周期和自噬等过程;梳理并探讨了circRNA调控卵巢癌及其耐药的分子机制,以期为后续circRNA与卵巢癌及其耐药治疗的相关研究提供新思路。
1 circRNA的形成和功能机制
本文首先系统地对circRNA的形成和功能机制进行了梳理(见图1)。circRNA根据序列来源分为外显子circRNA(exonic circRNA,ecircRNA)、内含子circRNA(circular intronic RNA,ciRNA)及外显子-内含子circRNA(exon-intron circRNA,EIciRNA),其中ecircRNA包括单外显子circRNA和多外显子circRNA。与线性RNA相比,circRNA以外显子来源为主,通常定位于细胞质中,而内含子和外显子-内含子来源的circRNA通常定位于细胞核,且可定位于外泌体中,种类多,表达丰富,序列高度保守[5]。

图1 circRNA的形成机制和功能机制
1.1 circRNA形成机制
①内含子配对驱动环化:外显子两侧的内含子反向互补配对后可变剪接形成ecircRNA或EIciRNA(见图1A);②套索驱动环化:外显子跳跃使被跨越的区域形成环形RNA中间体,再通过套索剪接形成ecircRNA或EIciRNA(见图1B);③RNA结合蛋白(RNA binding proteins,RBPs)驱动环化:RNA结合蛋白的外显子侧翼与内含子紧密结合,可变剪接形成ecircRNA或EIciRNA(见图1C);④依赖剪接体两侧保守序列的内含子套索环化:保守序列由接近5′剪接位点富含7 nt-GU的元件和接近3′分支位点富含11 nt-C的元件构成,该位点通过脱支酶避免内含子套索物降解,形成ciRNA(见图1D)[6]。上述4种形成机制来源的circRNA中,内含子配对和套索驱动环化形成的circRNA是当前的研究热点。
1.2 circRNA功能机制
①充当ceRNA,具有微小RNA(microRNA,miRNA)反应元件(miRNA response elements,MREs)(见图1F);②与功能蛋白质相互作用,形成RNA蛋白质复合物(见图1H);③调控基因转录,ciRNA/ecircRNA结合RNA聚合酶Ⅱ(RNA Pol Ⅱ)/U1小核核糖核蛋白(U1 small nuclear ribonucleoproteins,U1 snRNP)(见图1E);④翻译成多肽和蛋白质,翻译机制可归类为内部核糖体进入位点(internal ribosome entry site,IRES)依赖性或非依赖性,N6-甲基腺苷(N6-methyladenosine,m6A)可充当IRES(见图1G)[5,7]。上述4大功能机制中,circRNA充当ceRNA是当前研究最多且最易在肿瘤发生、发展中发挥调控作用的功能机制。
2 circRNA 调控卵巢癌的发生、发展
基于对以往62个与卵巢癌调控相关的circRNAs系统分析,发现大多数circRNA在细胞质中发挥癌基因作用,主要通过调控细胞凋亡、EMT、细胞周期和自噬等方式影响卵巢癌增殖、迁移、侵袭和耐药等恶性生物学行为,最终导致不良预后,且少数存在于外泌体、血清和血浆中的circRNA具有高效的卵巢癌早期诊断价值。
在本文综述的62个circRNAs中[8-37,39-46](见图2),circ_0078607[8]、circ_0015326[9]和circ-PGAM1[10]等29个circRNAs通过调控细胞凋亡发挥其生物学功能,circ_0000554[11]、circ-LNPEP[12]和circ-FGFR3[13]等15个circRNAs则通过调控EMT影响细胞增殖、迁移和侵袭,circ-CELSR1[14]和circ-ATL2[15]等6个circRNAs可调控细胞周期,仅有circ-MUC16[16]和circ-RAB11FIP1[17]与卵巢癌自噬调控相关,且circ-HIPK2[18]、circ-NRIP1[19]和circ_0006404[20]等15个circRNAs与卵巢癌顺铂和紫杉烷类化疗耐药相关;此外,存在于外泌体中的circ-WHSC1[21]和circ-PUM1[22]等5个circRNAs和血清中的circ-ITGB6[23]和circ-MUC16[16]等3个circRNAs以及血浆中的circ-N4BP2L2[24]经受试者工作特征曲线分析发现,其均具有高度的诊断敏感性和特异性;24个circRNAs可作为卵巢癌预后的生物标志物,其中circularRNAS-7[25]和circ-UBAP2[26]等20个circRNAs与总体生存期(overall survival,OS)显著相关,circ-PVT1[27]和circ-SETDB1[28]等5个circRNAs与无进展生存期(progression-free survival,PFS)显著相关,circ-FBXO7[29]和circ-PTK2[30]等5个circRNAs与无复发生存期(relapse-free survival,RFS)显著相关,circ-Foxp1[31]与OS、RFS 和无病生存期(disease-free survival,DFS)显著相关。
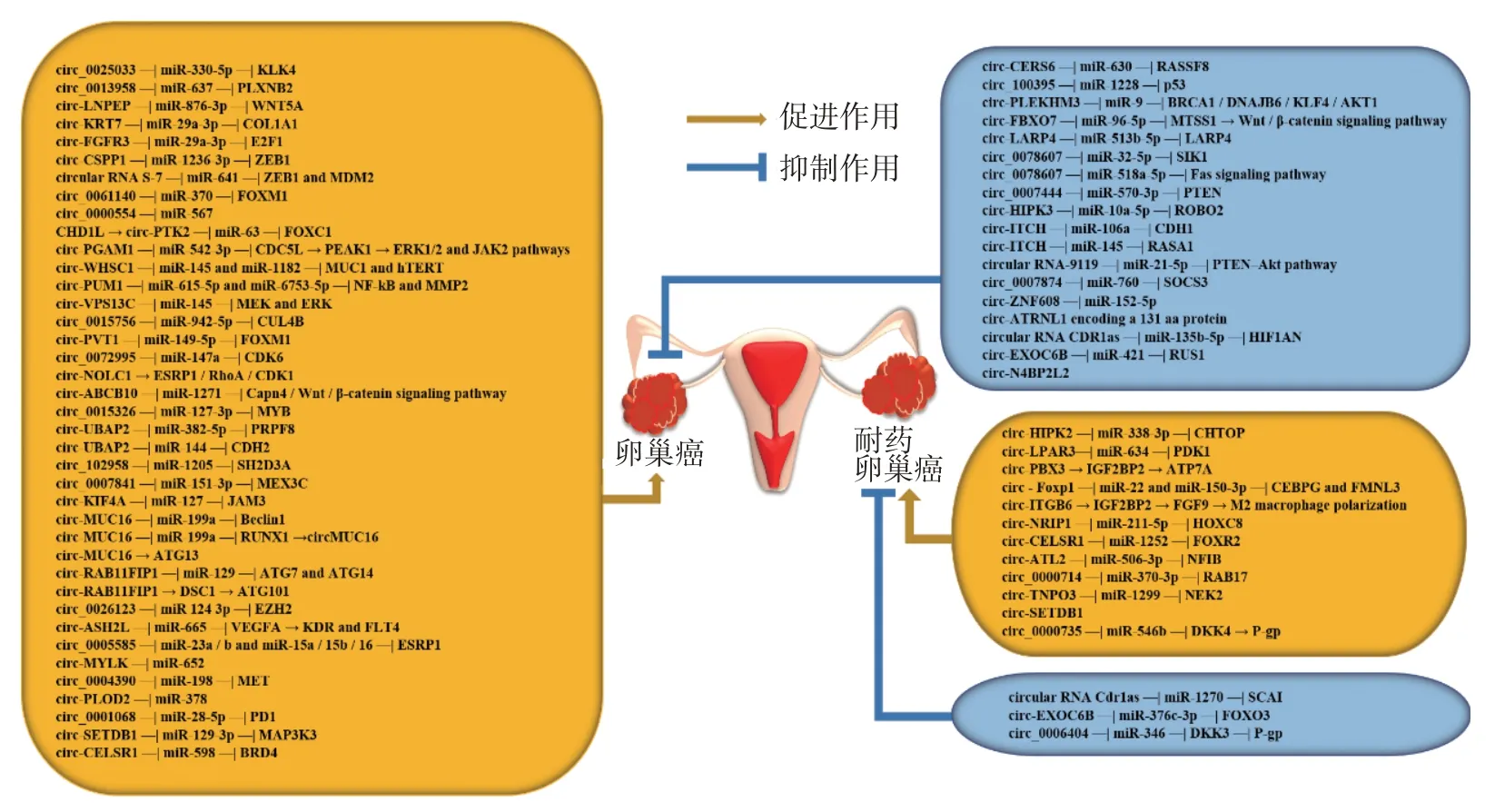
图2 62个circRNAs在卵巢癌和耐药卵巢癌中的作用机制
3 circRNA调控卵巢癌化疗耐药
3.1 circRNA调控卵巢癌顺铂耐药
顺铂是卵巢癌最有效的化疗药物之一,但耐药性很常见。本文中有6个circRNAs作为癌基因或抑癌基因参与调控卵巢癌顺铂耐药,且有望成为卵巢癌顺铂耐药的早期诊断和预后标志物(见图2)。circ-HIPK2[18]、circ-LPAR3[32]、circ-PBX3[33]、circ-Foxp1[31]和circ-ITGB6[23]均在卵巢癌顺铂耐药组织和/或细胞中高表达。敲低circ-HIPK2、circ-LPAR3可干扰相应的ceRNA调控轴,进而抑制卵巢癌顺铂耐药细胞的增殖、迁移、侵袭能力及细胞周期和糖酵解进程,并促进细胞凋亡;而circ-PBX3和circ-ITGB6可直接通过与功能蛋白结合促进卵巢癌细胞顺铂耐药,其中circ-ITGB6在顺铂耐药的卵巢癌患者血清中显著上调表达并与OS和RFS呈负相关;另外circ-Foxp1可通过作为活性蛋白和RNA载体的外泌体分泌到肿瘤微环境中促进卵巢癌顺铂耐药,且与卵巢癌患者的OS、RFS和DFS不良预后相关。与上述不同的是,circRNA Cdr1as是卵巢癌顺铂耐药的抑制因子,在顺铂耐药患者的血清外泌体、组织和细胞中低表达,体外过表达Cdr1as能显著抑制卵巢癌耐药细胞增殖和侵袭,促进细胞凋亡,且通过调控miR-1270/SCAI分子信号轴提高卵巢癌耐药细胞对顺铂的敏感性[34]。
3.2 circRNA调控卵巢癌紫杉醇耐药
紫杉醇是一种长期应用于卵巢癌临床治疗的一线化疗药物,患者对其产生耐药性仍是卵巢癌治疗失败的主要原因之一。本文中有7个circRNAs有望成为克服卵巢癌紫杉醇耐药性的潜在靶标(见图2)。circ-NRIP1[19]、circ-CELSR1[14]、circ-ATL2[15]、circ_0000714[35]和circ-TNPO3[36]在卵巢癌紫杉醇耐药组织和细胞中高表达,其中circ-TNPO3预警OS不良预后,干扰circRNAs表达可抑制细胞活力、克隆形成、迁移和侵袭能力,阻滞细胞周期G0/G1期,促进细胞凋亡,进而增强卵巢癌耐药细胞对紫杉醇的敏感性;而血清中的circ-SETDB1[28]在铂-紫杉烷联合化疗耐药和复发的高级别浆液性卵巢癌中显著上调表达,且其可有效诊断高级别浆液性卵巢癌和正常卵巢[受试者工作特征曲线下面积为(0.803±0.040)]、原发性化疗耐药和原发性化疗敏感的高级别浆液性卵巢癌[受试者工作特征曲线下面积为(0.811±0.064)],并与PFS呈负相关,是一种新型的生物标志物。此外,circ-EXOC6B可作为肿瘤抑制因子,介导miR-376c-3p/FOXO3轴提高体内外卵巢癌细胞对紫杉醇的敏感性,且其高表达与OS良性预后相关[37]。
3.3 circRNA调控卵巢癌多西紫杉醇耐药
多西紫杉醇是卵巢癌治疗的紫杉烷类化疗药物之一,其耐药机制与ABC超家族多药外排转运蛋白表达(如P-glycoprotein,P-gp/ABCB1)和抑制细胞凋亡等相关[38]。研究报道,circ_0000735[20]和circ_0006404[20]均通过调控P-gp表达影响卵巢癌对多西紫杉醇的敏感性,其中circ_0000735在卵巢癌多西紫杉醇耐药细胞系中上调表达,降低其表达水平可促进miR-546b和DKK4表达、抑制P-gp表达,导致细胞凋亡率升高和增殖能力下降;而circ_0006404则在耐药细胞系中低表达,干扰其表达可进一步促进其介导miR-346/DKK3/P-gp轴参与卵巢癌多西紫杉醇耐药(见图2)。
4 circRNA调控卵巢癌及其化疗耐药的分子机制
4.1 circRNA调控卵巢癌及其化疗耐药的主要分子机制
ceRNA包括长链非编码RNA、circRNA、伪基因和mRNA等,通过与miRNA竞争结合靶基因mRNA上的MREs发挥“miRNA海绵”作用,影响肿瘤的发生、发展[5]。本文综述的62个circRNAs中,除circ-NOLC1[39]、circ-ATRNL1[40]、circ-N4BP2L2[24]、circ-PBX3[33]和circ-ITGB6[23]外,其余circRNAs均通过ceRNA机制调控卵巢癌及其化疗耐药进展。
circ-UBAP2[26,41]、circ-KRT7[42]和circ-FGFR3[13]等作为ceRNA调控EMT、细胞周期和凋亡等,加剧卵巢癌细胞的恶性发展,其中circ-UBAP2充当miR-382-5p或miR-144的ceRNA,上调PRPF8或CDH2的表达,其高表达与卵巢癌患者TMN分期和5年生存率呈负相关,而circ-KRT7和circ-FGFR3是miR-29a-3p的海绵分子,且circ-FGFR3高表达与卵巢癌患者的低生存率和高复发率显著相关。此外,与卵巢癌化疗耐药相关的15个circRNAs中大部分依赖于ceRNA机制响应卵巢癌耐药,如circ_0000735[20]和circ_0006404[20]均通过ceRNA机制调控P-gp蛋白表达影响卵巢癌多西紫杉醇耐药。
4.2 circRNA与功能蛋白互作调控卵巢癌及其化疗耐药
circRNA除了充当miRNA海绵分子外,还可与功能蛋白质结合发挥其“支架”作用。本文综述的62个circRNAs中,有5个circRNAs与功能蛋白互作参与调控卵巢癌及其化疗耐药的进程(见图2)。在上皮性卵巢癌细胞质中高表达的circ-MUC16[16]和circ-RAB11FIP1[17]分别与自噬相关蛋白ATG13和DSC1蛋白直接结合,增加卵巢癌细胞中的自噬通量,进而加剧癌细胞增殖和侵袭;另外有研究报道,circ-NOLC1[39]可能通过结合ESRP1调节CDK1和RhoA表达,加剧上皮性卵巢癌细胞的恶性进展。而在顺铂耐药的卵巢癌细胞中,circ-PBX3[33]和circ-ITGB6[23]分别通过与RNA结合蛋白IGF2BP2相互作用,提高ATP7A mRNA和FGF9 mRNA的稳定性,诱导肿瘤相关巨噬细胞向M2表型极化,增强卵巢癌细胞的顺铂耐药性。
4.3 circRNA翻译成多肽和蛋白质调控卵巢癌
目前研究发现,具有开放阅读框(open reading frame,ORF)的circRNA可以翻译成致癌或抑制肿瘤活性的功能多肽和蛋白质影响肿瘤的发生、发展[5]。在该文综述的62个circRNAs中(见图2),仅有1篇文献报道circRNA的翻译功能与卵巢癌调控相关。circ-ATRNL1[40]主要定位于卵巢癌细胞质中,过表达circ-ATRNL1可抑制卵巢癌细胞增殖和侵袭能力,同时进一步通过生物信息学分析和实验验证发现,circ-ATRNL1包含1个编码131aa蛋白的IRES与1个ORF重叠启动翻译,提示circ-ATRNL1可能通过编码131aa蛋白发挥抑癌作用;不足的是,该研究尚未进一步通过实验验证和卵巢癌临床大样本评估131aa蛋白的抑癌作用。
5 circRNA调控卵巢癌进展的通路分析
为进一步从整体上了解circRNA调控卵巢癌进展的分子机制,该文对62个circRNAs中的54个靶基因(40个靶基因由作为肿瘤驱动因子circRNA所调控,而另外14个靶基因由作为肿瘤抑制因子circRNA所调控)进行了通路分析,共富集到106条通路(Q<0.05),聚类为5大类功能(即C1~C5)(见图3),其中C1和C3都是实体瘤相关的信号通路,包括膀胱癌、胰腺癌、子宫内膜癌和肾细胞癌等;C2包括有丝分裂原活化蛋白激酶等癌基因通路,C4为细胞自噬通路,C5包括癌症中程序性细胞死亡配体-1的表达及程序性细胞死亡受体-1检查点等免疫调控相关信号通路;此外,其他信号通路中还包含铁死亡等信号通路。上述结果提示circRNA可能主要通过调控上述信号通路特别是细胞自噬通路调控卵巢癌进展。
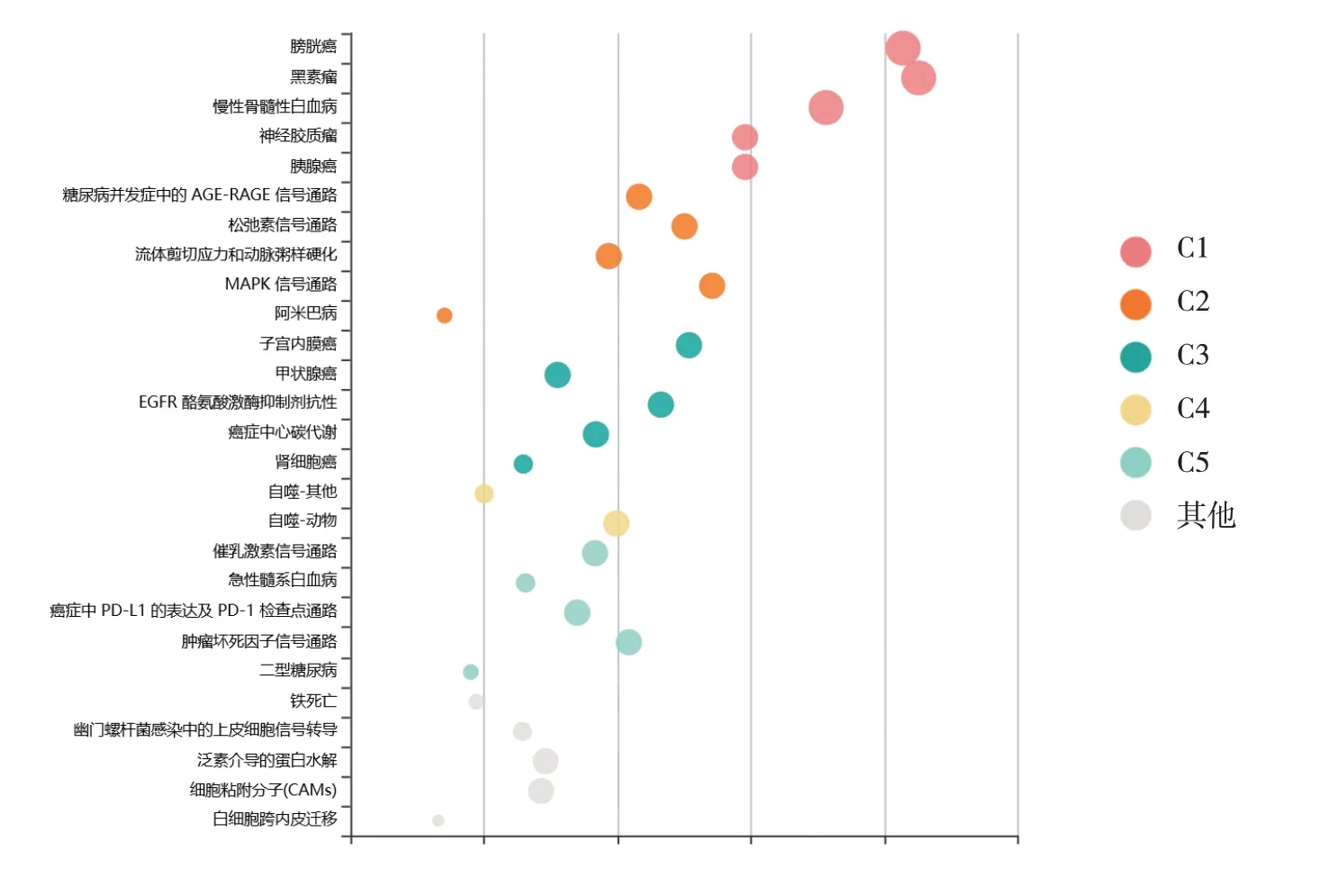
图3 通过KOBAS数据库对54个circRNAs靶基因进行通路富集和功能聚类分析
细胞自噬是指细胞内受损的蛋白质或细胞器被具有双层膜结构的自噬体包裹后进入溶酶体降解循环的过程,这种保守的细胞自我消化机制,对于机体发育和缓解多种环境压力至关重要。研究表明,自噬是一把双刃剑,抑制或促进自噬均可影响肿瘤细胞增殖、迁移、侵袭和耐药[47]。和上述通路富集结果相一致的是,在所综述的62个circRNAs中,circ-MUC16[16]和circ-RAB11FIP1[17]均通过与自噬相关蛋白结合或充当miRNA分子海绵促进自噬,进而加剧卵巢癌细胞迁移和侵袭等恶性行为。值得关注的是,经检索发现,circRNA通过介导自噬调控肿瘤的相关研究有限,其中调控卵巢癌的研究极少(3篇左右)。本文综述的5个circRNAs(circ-VPS13C[43]、circ-MUC16[16]、circ-RAB11FIP1[17]、circ_0007444[44]和circ-9119[45])的靶基因(ERK、Beclin-1、ATG7、ATG14、PTEN)又主要富集在自噬通路上。因此,自噬很可能成为circRNA调控卵巢癌及其他肿瘤进展的重要信号通路,值得进一步关注和深入研究。
6 总结与展望
本文系统综述了62个circRNAs在卵巢癌及其化疗耐药中的研究进展,发现circRNA主要基于ceRNA网络和与功能蛋白互作参与卵巢癌及其耐药调控,并主要与细胞增殖、迁移、侵袭、凋亡和周期相关,且通路富集结果表明可能和细胞自噬及铁死亡通路相关,但是否通过调控细胞自噬等信号通路影响卵巢癌耐药知之甚少,提示基于这些通路的circRNA研究有待深入探索。此外,circRNA调控卵巢癌顺铂和紫杉烷类化疗耐药的研究仍处于初级阶段,大部分研究仅限于细胞耐药功能研究,未针对化疗药物特有的耐药机制(如DNA损伤修复、微管-蛋白质相互作用、ABC超家族多药外排转运蛋白和自噬等)深入研究;同时尚未有研究报道circRNA参与调控卵巢癌卡铂耐药,因此,circRNA在卵巢癌耐药调控中的作用仍需进一步研究,且其是否参与卵巢癌卡铂耐药是卵巢癌化疗耐药调控值得揭示的科学问题。在诊断和预后标志物方面,部分circRNA与卵巢癌患者预后显著相关,且有限的研究表明体液中的circRNA具有更高效的诊断敏感性和特异性,提示体液circRNA在标志物和临床应用方面更具研究价值。
综上所述,circRNA在卵巢癌及其耐药调控方面取得了较大的进展,在卵巢癌诊断、治疗和预后方面均显示出越来越多的非凡潜力,值得进行全面而深入的探讨,以进一步提高妇女健康水平,服务医疗卫生事业发展。
