IL-35下调CD36表达减少巨噬细胞内脂质积累缓解动脉粥样硬化的机制研究*
2024-04-01李晟茅光耀葛若木李凯园朱莉
李晟,茅光耀,葛若木,李凯园,朱莉
(1.大连医科大学 研究生院,辽宁 大连 116044;2.泰州市人民医院,江苏 泰州 225300)
冠状动脉粥样硬化性心脏病(coronary heart disease,CHD)是一种由脂质引起的慢性炎症、纤维增生性疾病[1]。动脉粥样硬化(Atherosclerosis,AS)是CHD的发病基础,主要特征是血管内脂质的异常积聚和炎症反应的形成[2-3]。研究表明,人类白细胞分化抗原36(cluster of differentiation 36,CD36)、A类清道夫受体(scavenger receptor class A,SR-A)和凝素样氧化低密度脂蛋白受体1(low-density lipoprotein receptor-1,Lox-1)等清道夫受体介导巨噬细胞吞噬氧化低密度脂蛋白(oxidized low-density lipoprotein,oxLDL)功能异常,会导致泡沫细胞异常积聚,与AS病变密切相关[4-6]。
白细胞介素-35(Interleukin-35,IL-35)是由CD4+Foxp3+调节性T细胞分泌的异二聚体细胞因子,由EB病毒诱导基因3和p35 2个亚单位组成[7-8]。IL-35具有抗AS活性,CHD患者血清IL-35水平显著下降,并与Gensini积分和冠状动脉病变血管数呈负相关[9-11]。外源性IL-35可增加ApoE-/-小鼠Treg细胞水平,缩小AS斑块尺寸[12]。然而,IL-35对CD36、SR-A和Lox-1等清道夫受体表达的影响,以及脂质代谢的调节作用机制仍需进一步研究。本研究旨在分析CHD患者血清IL-35水平与血脂四项的相关性,分析IL-35对人髓系白血病单核细胞(human myeloid leukemia mononuclear cells,THP-1)源性巨噬细胞脂代谢的影响及对p38 MAPK信号通路的调控作用。
1 材料与方法
1.1 研究对象
选取2022年6月—2023年6月在泰州人民医院心内科就诊的疑似CHD患者。随机选取154例,根据冠状动脉造影结果分为CHD组(86例)和对照组(68例),收集性别、年龄、身高、吸烟史、血压、左室射血分数(left ventricular ejection fraction,LVEF)、肌酸激酶(creatine kinase,CK)、肌酸激酶同工酶(creatine kinase MB,CK-MB),总胆固醇(total cholesterol,TC)、甘油三酯(Triglyceride,TG)、血糖(Glucose,GLU)、低密度脂蛋白胆固醇(low density lipoprotein cholesterin,LDL-C)和高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)等指标。排除标准:①存在心肌病和瓣膜性心脏病;②患有急性或慢性传染病和自身免疫性疾病;③甲状腺功能亢进或减退;④肝肾功能不全,消化、血液系统疾病;⑤使用汀类药物治疗> 1周;⑥近期有手术或外伤史;⑦病历资料不完整。本研究经医院医学伦理委员会批准(批准号:KY202311401),所有研究对象签署知情同意书。
1.2 主要试剂和仪器
THP-1细胞(武汉普诺赛生命科技有限公司),特异性抗体(江苏亲科生物研究中心有限公司),胆固醇检测试剂盒、油红染色试剂盒(北京普利莱基因技术有限公司),NBD-胆固醇、IL-35、佛波酯(phorbol myristate acetate,PMA)(美国R&D公司),IL-35酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒(上海酶联生物科技有限公司)。荧光PCR仪(美国罗氏公司),酶标仪(美国BioTek公司)、荧光显微镜(德国徕卡公司)。
1.3 血液标本采集及IL-35测定
使用EDTA 2K抗凝管采集所有研究对象空腹状态静脉血,1 200 r/min离心10 min,吸取上清液于-80℃冰箱备用。按照试剂盒说明书进行操作测定IL-35水平。设置空白孔、标准品孔和样品孔,在450 nm波长处测定各孔的光密度(optical density,OD),用标准品浓度与OD值拟合直线方程,再将样品的OD值代入方程式,计算出样品浓度。
1.4 THP-1细胞制备及IL-35最适浓度的确定
THP-1细胞在含有10%胎牛血清和1%抗生素的RPMI 1640培养基中培养1周(37 ℃、5%二氧化碳CO2),100 nmol/L PMA处理THP-1细胞48 h,使其分化为巨噬细胞。取巨噬细胞分为4组:①对照组:5 μmol/L DMSO培养细胞7 d;②oxLDL组:5 μmol/L DMSO培养细胞7 d后,50 μg/mL oxLDL继续培养48 h;③低剂量组:20 ng/mL IL-35培养7 d后,50 μg/mL oxLDL继续培养48 h;④高剂量组:40 ng/mL IL-35培养7 d后,50 μg/mL oxLDL继续培养48 h。
按照试剂盒说明书步骤对各组细胞进行油红染色,测定各组细胞内TC、游离胆固醇(free cholesterol,FC)和胆固醇酯(cholesteryl ester,CE)水平。根据染色和测定结果确定IL-35最适实验浓度。
1.5 NBD-胆固醇评估细胞内胆固醇的摄取
实验组用IL-35进行预处理,以未加药组为对照组,于培养箱培养7 d,加入5 μmol/L NBD-胆固醇后2、4、6、8和10 h在免疫荧光显微镜下进行拍摄,荧光显微镜下观察细胞内NBD-胆固醇呈深绿色。使用RIPA裂解细胞并收集裂解液,在469和537 nm波长处测定荧光强度(fluorescence intensity,FI)定量评估两组NBD-胆固醇的摄取情况。
1.6 Western blotting检测CD36、SR-A、Lox-1、p38、p-p38蛋白的表达
IL-35组用IL-35预处理7 d;以未加药组为对照组;实验组用IL-35预处理7 d后加入50 μg/mL oxLDL共培养48 h;oxLDL组用5 μmol/L DMSO培养THP-1细胞7 d后,50 μg/mL oxLDL继续培养48 h;P79350组加入P79350预处理24 h后按实验组步骤处理。提取细胞蛋白,加入Loading Buffer,95 ℃金属浴变性5 min。采用SDS-PAGE电泳将蛋白分离,转移至PVDF膜上,5%脱脂牛奶密封2 h。4 ℃条件下一抗孵育过夜后与二抗在室温下孵育2 h,用化学发光法检测目的蛋白。使用Image J软件分析蛋白相对表达量。
1.7 实时荧光定量聚合酶链反应检测CD36、SRA和Lox-1 mRNA的表达
细胞分组同1.6。提取THP-1细胞总RNA,取500 ng逆转录为cDNA,实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRTPCR)反应体系:2 μL cDNA,正反向引物各1 μL(10 μm),SYBR green 10 μL,H2O 6 μL;反应条件:95 ℃预变性3 s,95 °C变性30 s,60 ℃退火1 min,共计40个循环,记录Ct值。采用2-ΔΔCT法计算CD36、SR-A和Lox-1 mRNA相对表达量。引物由湖南艾科瑞生物工程有限公司合成,引物序列见表1。

表1 引物序列
1.8 统计学方法
数据分析采用SPSS 25.0统计软件。计量资料以均数±标准差(±s)表示,比较用t检验或单因素方差分析或重复测量设计的方差分析,进一步两两比较用LSD-t检验;计数资料以构成比或率(%)表示,比较用χ2检验;相关性分析用Spearman法。P<0.05为差异有统计学意义。
2 结果
2.1 对照组与CHD组临床资料比较
对照组与CHD组的年龄、吸烟史、体质量指数(body mass index,BMI)、TG、HDL-C、CK、CK-MB、CRP水平比较,经χ2或t检验,差异均有统计学意义(P<0.05);CHD组年龄、TG、CK、CK-MB、CRP水平均高于对照(P<0.05),而HDL-C水平和BMI均低于对照组(P<0.05)。对照组与CHD组的性别构成、高血压、高脂血症、SBP、DBP、GLU、TC、LDL-C、LVEF比较,差异均无统计学意义(P>0.05)。见表2。
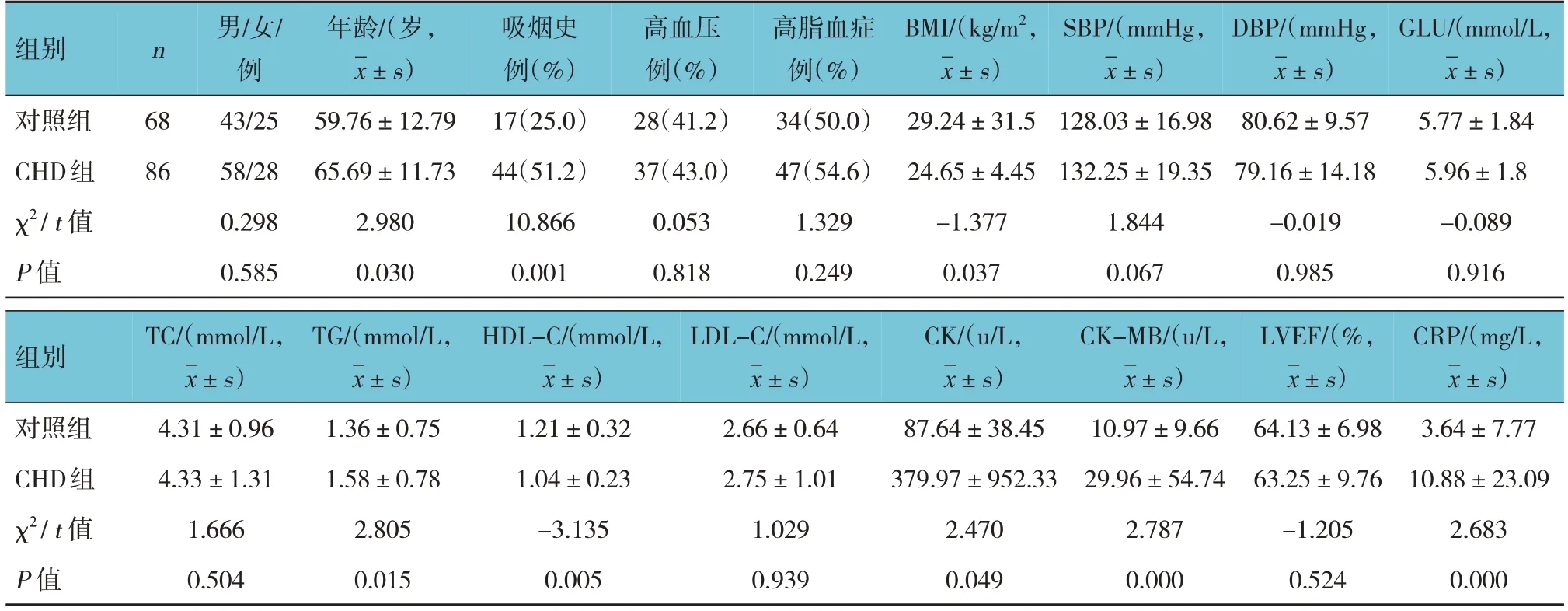
表2 对照组与CHD组临床资料比较
2.2 CHD组与对照组血清IL-35水平比较及与血脂四项的相关性
CHD组、对照组血清IL-35水平分别为(42.76±13.79)、(109.45±28.87)pg/mL,经t检验,差异有统计学意义(t=-17.805,P=0.000);CHD组血清IL-35水平低于对照组。
Spearman相关性分析结果表明,CHD患者血清IL-35水平与TC、LDL-C、TG均呈负相关(rs=-0.321、-0.218和-0.215,P=0.003、0.044和0.047),与HDL-C呈正相关(rs=0.322,P=0.003)。
2.3 各组油红染色结果和细胞内胆固醇水平比较
油红染色结果显示对照组THP-1细胞内无红染,oxLDL组细胞内脂滴增多,红染加重。低剂量组与oxLDL组比较,细胞内红染面积无显著变化。高剂量组与oxLDL组和低剂量组比较,细胞内脂滴明显减少,红染减轻。见图1。
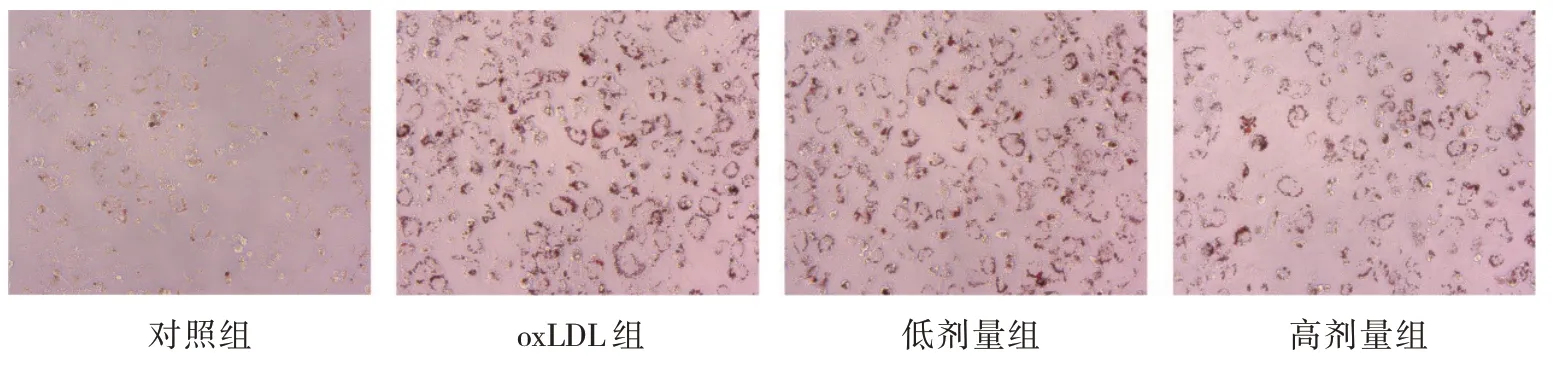
图1 各组THP-1细胞油红染色 (×200)
对照组、oxLDL组、低剂量组、高剂量组THP-1细胞内TC、FC、CE水平比较,经方差分析,差异均有统计学意义(P<0.05);与对照组比较,oxLDL组TC、FC、CE均升高(P<0.05);与低剂量组比较,高剂量组TC、FC、CE均降低(P<0.05)。40 ng/mL IL-35能有效减少泡沫细胞的形成和脂质的积聚,故将此浓度作为后续实验使用浓度。见表3。
表3 各组THP-1细胞内TC、FC、CE水平比较(μmol/mgrot,±s)
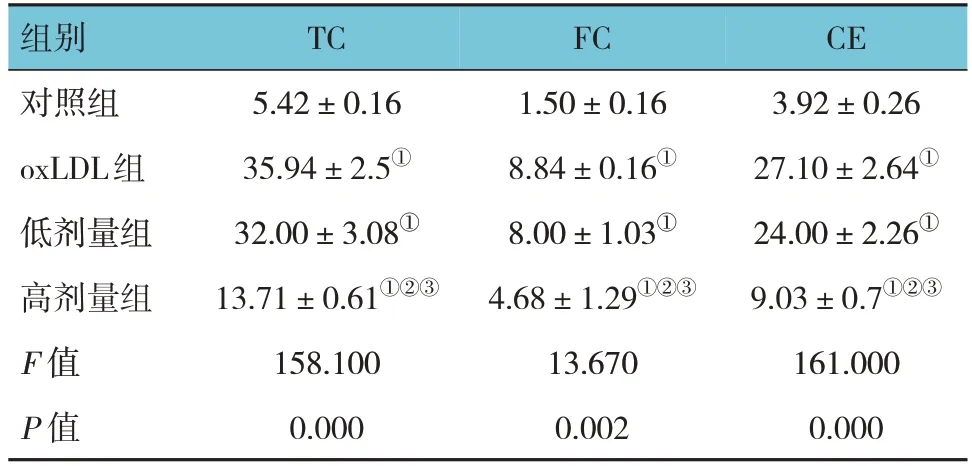
表3 各组THP-1细胞内TC、FC、CE水平比较(μmol/mgrot,±s)
注:①与对照组比较,P<0.05;②与oxLDL组比较,P<0.05;③与低剂量组比较,P<0.05。
CE 3.92±0.26 27.10±2.64①24.00±2.26①9.03±0.7①②③161.000 0.000组别对照组oxLDL组低剂量组高剂量组F 值P 值TC 5.42±0.16 35.94±2.5①32.00±3.08①13.71±0.61①②③158.100 0.000 FC 1.50±0.16 8.84±0.16①8.00±1.03①4.68±1.29①②③13.670 0.002
2.4 对照组与实验组THP-1细胞对NBD-胆固醇的摄取
实验组与对照组THP-1细胞内NBD-胆固醇随着时间增加逐渐增加。在各时间点,实验组与对照组比较,细胞内NBD-胆固醇含量均明显减少。见图2。
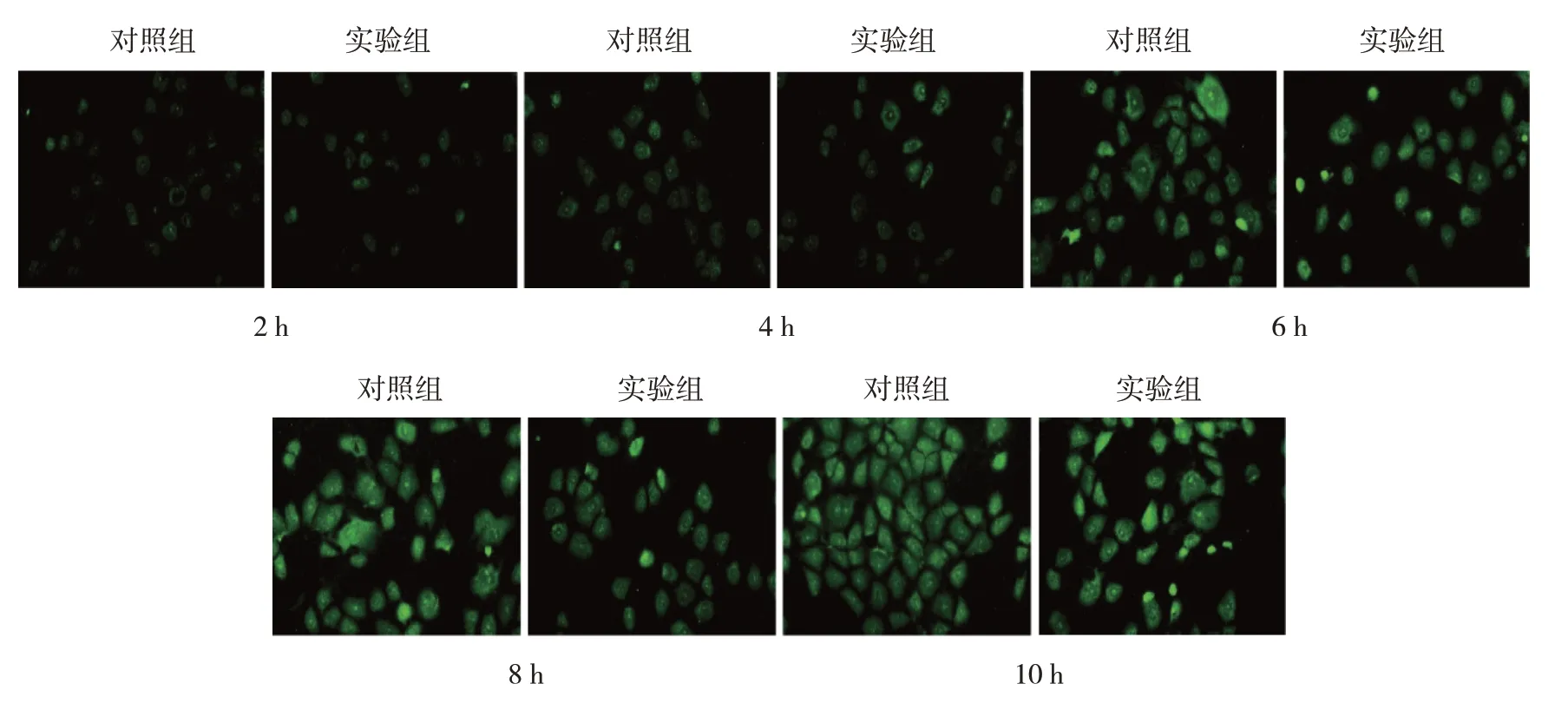
图2 对照组与实验组THP-1细胞对NBD-胆固醇的摄取 (×200)
对照组与实验组THP-1细胞2、4、6、8和10 h的FI比较,经重复测量设计的方差分析,结果:①不同时间点FI比较,差异有统计学意义(F=726.726,P=0.000);②实验组与对照组FI比较,差异有统计学意义(F=8.102,P=0.012),实验组FI较低;③两组FI变化趋势比较,差异有统计学意义(F=111.061,P=0.000)。见表4。
表4 对照组与实验组THP-1细胞不同时间点FI比较 (±s)
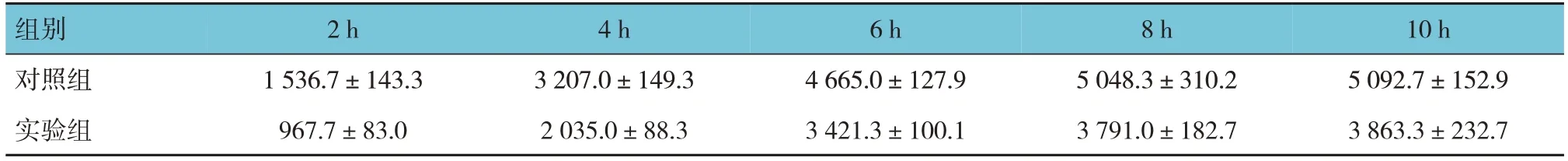
表4 对照组与实验组THP-1细胞不同时间点FI比较 (±s)
组别对照组实验组2 h 1 536.7±143.3 967.7±83.0 4 h 3 207.0±149.3 2 035.0±88.3 6 h 4 665.0±127.9 3 421.3±100.1 8 h 5 048.3±310.2 3 791.0±182.7 10 h 5 092.7±152.9 3 863.3±232.7
2.5 各组THP-1细胞CD36、SR-A和Lox-1蛋白相对表达量比较
对照组、IL-35组、oxLDL组、实验组THP-1细胞CD36、SR-A和Lox-1蛋白相对表达量比较,经方差分析,差异均有统计学意义(P<0.05);oxLDL组和实验组CD36、SR-A、Lox-1蛋白相对表达量均高于对照组和IL-35组(P<0.05),实验组CD36蛋白相对表达量低于oxLDL组(P<0.05)。见表5和图3。
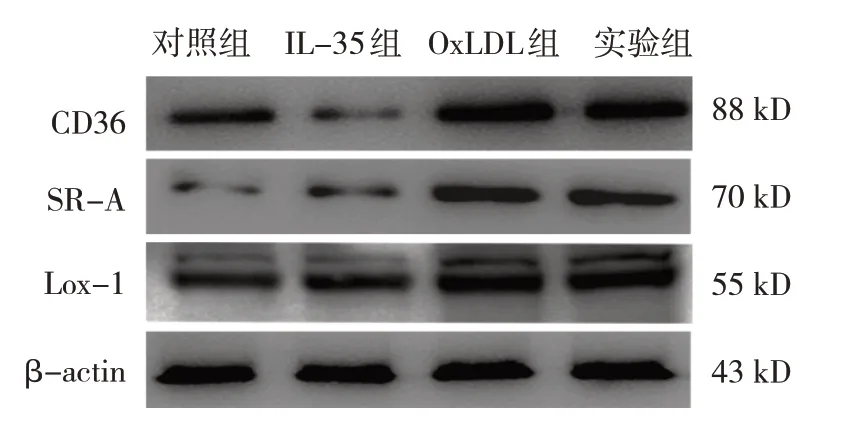
图3 各组THP-1细胞CD36、SR-A、Lox-1蛋白的表达量
表5 各组THP-1细胞CD36、SR-A和Lox-1蛋白相对表达量比较 (±s)
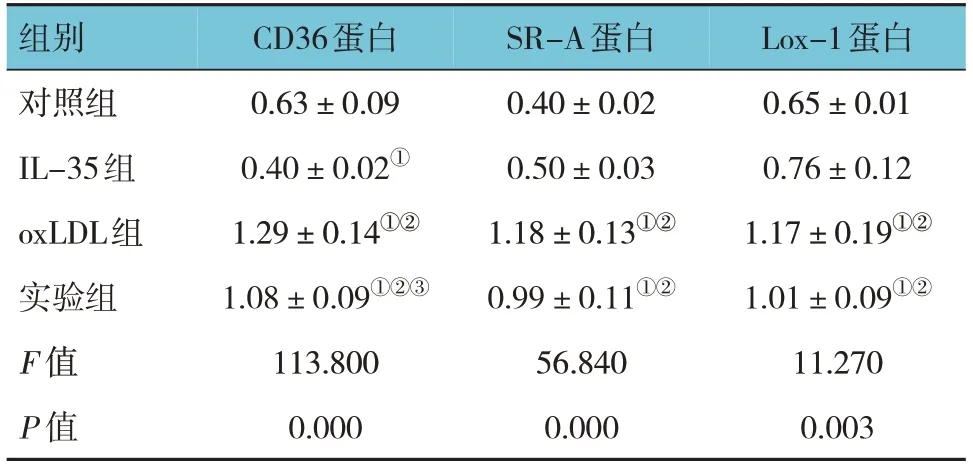
表5 各组THP-1细胞CD36、SR-A和Lox-1蛋白相对表达量比较 (±s)
注:①与对照组比较,P<0.05;②与IL-35组比较,P<0.05;③与oxLDL组比较,P<0.05。
Lox-1蛋白0.65±0.01 0.76±0.12 1.17±0.19①②1.01±0.09①②11.270 0.003组别对照组IL-35组oxLDL组实验组F 值P 值CD36蛋白0.63±0.09 0.40±0.02①1.29±0.14①②1.08±0.09①②③113.800 0.000 SR-A蛋白0.40±0.02 0.50±0.03 1.18±0.13①②0.99±0.11①②56.840 0.000
2.6 各组THP-1细胞CD36、SR-A和Lox-1 mRNA相对表达量比较
对照组、IL-35组、oxLDL组、实验组THP-1细胞CD36、SR-A和Lox-1 mRNA相对表达量比较,经方差分析,差异均有统计学意义(P<0.05);oxLDL组和实验组CD36、SR-A Lox-1 mRNA相对表达量均高于对照组和IL-35组(P<0.05),实验组CD36 mRNA相对表达量低于oxLDL组(P<0.05)。见表6。
表6 各组THP-1细胞CD36、SR-A、Lox-1 mRNA相对表达量比较 (±s)
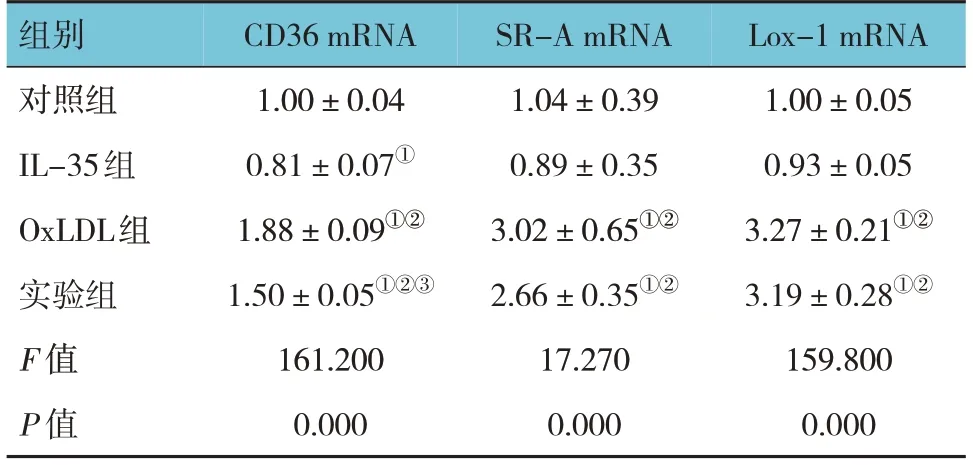
表6 各组THP-1细胞CD36、SR-A、Lox-1 mRNA相对表达量比较 (±s)
注:①与对照组比较,P<0.05;②与IL-35组比较,P<0.05;③与oxLDL组比较,P<0.05。
Lox-1 mRNA 1.00±0.05 0.93±0.05 3.27±0.21①②3.19±0.28①②159.800 0.000组别对照组IL-35组OxLDL组实验组F 值P 值CD36 mRNA 1.00±0.04 0.81±0.07①1.88±0.09①②1.50±0.05①②③161.200 0.000 SR-A mRNA 1.04±0.39 0.89±0.35 3.02±0.65①②2.66±0.35①②17.270 0.000
2.7 各组THP-1细胞p-p38/p38蛋白相对表达量比较
对照组、IL-35组、oxLDL组、实验组THP-1细胞p-p38/p38蛋白相对表达量分别为(0.23±0.06)、(0.23±0.07)、(1.48±0.2)、(0.91±0.11),经方差分析,差异有统计学意义(F=74.000,P=0.000);oxLDL组和实验组p-p38/p38蛋白相对表达量均高于对照组和IL-35组(P<0.05),实验组p-p38/p38蛋白相对表达量低于oxLDL组(P<0.05)。见图4。
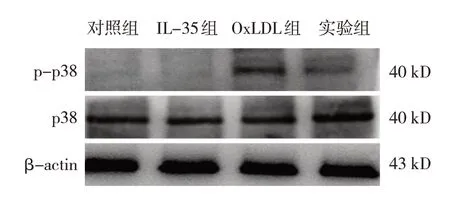
图4 各THP-1细胞p-p38/p38蛋白的表达
2.8 各组THP-1细胞CD36蛋白相对表达量比较
对照组、oxLDL组、实验组、P79350组THP-1细胞CD36蛋白相对表达量分别为(0.63±0.09)、(1.29±0.14)、(1.08±0.00)、(1.17±0.11),经方差分析,差异有统计学意义(F=35.090,P=0.000);oxLDL组、实验组、P79350组CD36蛋白相对表达量均高于对照组(P<0.05),oxLDL组和P79350组CD36蛋白相对表达量均高于实验组(P<0.05)。见图5。
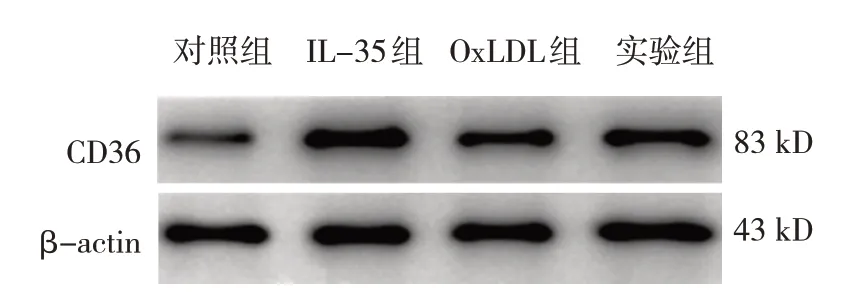
图5 各组THP-1细胞CD36蛋白的表达
3 讨论
AS是CHD患者最基本的病理变化,主要特点是动脉壁脂质的积累和炎症的发展。AS病变发展的早期阶段被称为“脂肪条纹”,其特征是泡沫细胞在细胞内积聚脂质[13-14],研究表明,白细胞介素-12(Interleukin-12,IL-12)家族因子与急性心肌梗死、主动脉夹层、心肌肥厚等多种心血管疾病密切相关[15-17],在AS的发生、发展过程和泡沫细胞的形成中发挥重要作用[18],IL-35为IL-12家族一员,可作为抗炎因子参与自身免疫性炎症疾病,如狼疮性肾炎、类风湿性关节炎和系统性红斑狼疮的发生、发展[19-21]。最近研究显示,IL-35高表达可以延缓动脉粥样硬化的发展,调节脂代谢相关蛋白基因或非编码RNA的表达[22-24]。本研究首先通过分析CHD患者血清IL-35水平与血脂四项的相关性,发现CHD患者血清IL-35水平与HDL-C呈正相关,与TC、TG,LDL-C均呈负相关。
本研究通过油红染色和THP-1内胆固醇检测明确IL-35对泡沫细胞的形成有抑制作用,同时发现40 ng/mL IL-35能有效抑制THP-1细胞内脂质积聚,故将40 ng/mL作为本实验的使用浓度。脂质的摄取是泡沫细胞形成的重要环节,THP-1细胞对脂质的摄取主要由清道夫受体CD36、SR-A和Lox-1介导。本研究通过NBD-胆固醇摄取实验来测定不同时间点实验组与对照组细胞FI,结果显示在相同时间点,实验组细胞FI明显低于对照组。Western blotting和qRT-PCR检测与脂质摄取相关的清道夫受体(CD36、SR-A和Lox-1)蛋白和mRNA的表达发现,IL-35显著降低了oxLDL诱导的CD36蛋白和mRNA表达,而SR-A和Lox-1的表达无显著变化,提示IL-35可能是通过下调清道夫受体CD36的表达来抑制THP-1细胞对脂质的摄取。
p38 MAPK信号传导在多种生物过程中起重要作用,例如炎症、细胞周期调节、细胞死亡、发育、分化和衰老[25-27]。既往研究表明p38 MAPK通路与AS、心脏重构、心肌肥大和纤维化密切相关,是心血管疾病的治疗靶点[28-30]。本研究发现oxLDL处理THP-1细胞48 h后,细胞p38总蛋白无显著变化,而p-p38/p38表达上调,而经IL-35预处理7 d后p-p38/p38表达下调,提示p38磷酸化水平被IL-35抑制。添加P79350作为p38 MPAK通路激动剂进行预处理后,P79350逆转了IL-35对oxLDL诱导的细胞所表现出的作用,CD36的表达显著升高。因此,推测IL-35可能使p38 MAPK信号通路失活,降低p38的磷酸化水平,从而抑制清道夫受体CD36的表达,最终抑制THP-1细胞对脂质的摄取和泡沫细胞的形成。
综上所述,本研究验证了CHD患者血清IL-35水平与血脂四项有相关性。体外实验验证IL-35通过下调清道夫受体CD36的表达从而减少THP-1细胞对脂质的积聚和泡沫细胞的形成,可能与IL-35下调p38 MAPK信号通路有关。本课题组仅在细胞水平验证IL-35对THP-1细胞的影响,IL-35在动物模型上是否存在相同的机制,仍需进一步探索。
