氧化苦参碱减轻糖尿病肾病小鼠肾组织炎症及纤维化反应的机制研究*
2024-04-01代云莉彭灿梁丹李志阳冯昭卫王一凡冯莉陈佳佳陈圣杰肖瑛
代云莉,彭灿,梁丹,李志阳,冯昭卫,王一凡,冯莉,陈佳佳,陈圣杰,肖瑛
(1.贵州省常见慢性疾病发病机制及药物研究重点实验室,贵州 贵阳 550025;2.宁波市临床病理诊断中心,浙江 宁波 315021;3.贵阳市第二人民医院 科研管理科,贵州 贵阳 550023)
糖尿病肾病(diabetic kidney disease,DKD)是糖尿病(diabetes mellitus,DM)常见微血管并发症[1]。近年来DKD被认为是一种慢性低度炎症性和自然免疫性疾病[2]。Toll样受体4(Toll-like receptors 4,TLR4)和含NOD样受体热蛋白结构域相关蛋白3(Nod-like receptor family pyrin domain containing 3,NLRP3)炎症小体作为病原模式识别受体在免疫应答和炎症反应中发挥重要作用[3-4]。有研究报道,糖尿病大鼠肾组织TLR4表达明显增多,伴随炎症因子的表达和细胞外基质的沉积,促进DKD的进展[5]。课题组前期研究表明糖尿病大鼠肾组织TLR4表达增多,促进了炎症因子的表达和细胞外基质的沉积[6]。有实验研究表明在糖尿病肾损伤及脂代谢异常中NLRP3介导的炎症反应发挥着重要作用[7-10],NLRP3炎症小体可通过诱导白细胞介素-1β(Interleukin-1β,IL-1β)和IL-18的分泌,将糖尿病肾脏中的代谢应激与促炎级联反应的激活联系起来[11],同源结构域相互作用蛋白激酶2(homeodomain interacting protein kinase 2,HIPK2)是一种丝氨酸/苏氨酸激酶,为肾纤维化的关键调节因子[12]。研究表明HIPK2不仅可以介导促纤维化通路,还可以介导炎症反应,在肾间质损伤及肾间质纤维化中发挥重要作用[13]。但在DKD中,HIPK2与TLR4信号及NLRP3炎症小体活化的相互作用未见报道。
氧化苦参碱(Oxymatrine,OMT)是一种从苦参根部分离的喹唑啉生物碱,具有抗炎症、抗纤维化、抗肿瘤活性,抑制iNOS表达和转化生长因子-β(transforming growth factor-β,TGF-β)/Smad通路。其可用于治疗病毒性肝炎、癌症、病毒性心肌炎、胃肠出血和皮肤疾病[14-16]。本课题组前期研究结果显示,OMT可下调糖尿病大鼠肾组织TLR4的表达,抑制炎症因子的表达和细胞外基质的沉积,延缓DN进展[6]。为进一步探究OMT对糖尿病肾病的保护作用及其可能机制,本研究通过观察糖尿病小鼠中肾组织TLR4、HIPK2和NLRP3的表达情况,以及给予OMT治疗后小鼠肾组织TLR4、HIPK2、NLRP3、纤维连接蛋白(Fibronectin)、上皮钙黏素(E-cadherin)及炎症信号因子的表达变化,初步探讨OMT对糖尿病肾病的保护作用及其可能机制,为寻找新的抗炎抗纤维化药物提供理论和实验基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康6周龄、SPF级db/db小鼠20只和同月龄同背景非转基因db/m小鼠10只,体重分别为(40±5)g、(20±20)g,雌雄不限,由南京大学-南京生物医药研究院提供[实验动物生产许可证号:SCXK(苏)2015-0001,实验动物使用许可证号:SYXK(黔)2018-001],本实验符合贵州医科大学动物论理审查委员会操作规范。
1.1.2 药物与试剂 OMT购自南京广润生物制品有限公司,免疫组织化学SP两步法检测试剂购自北京中杉金桥生物技术有限公司,血糖仪及血糖试纸购自美国强生制药有限公司,TRIzol™ Reagent购自美国Thermo Fisher Scientific公司,RIPA强裂解液和一抗稀释液购自苏州碧云天生物有限公司,BCA蛋白浓度测定试剂盒、BSA以及Tween-20购自北京索莱宝生物有限公司,蛋白酶磷酸酶抑制剂、30%丙烯酰胺、SDS、TEMED、APS、甘氨酸、DTT、Tris-碱、DGlucose、PMSF购自北京索莱宝生物有限公司,ECL发光试剂盒购自常州天地人和生物科技有限公司,脱脂奶粉购自内蒙古伊利实业集团股份有限公司,RevertAIdTMFirst Strand cDNA Synthesis Kit以及总RNA提取试剂盒购自美国Thermo Fisher Scientific公司,2×SuperReal PreMix Plus购自北京天根生物化学科技有限公司,小鼠抗HIPK2单克隆抗体购自美国Santa公司,小鼠抗TLR4单克隆抗体、兔抗Fibronetin多克隆抗体、小鼠抗E-cadherin单克隆抗体购自美国CST公司,小鼠抗β-actin抗体购自武汉普美克生物技术有限公司,Goat Anti-rabbit IgG/HRP、Goat Anti-Mouse IgG/HRP购自武汉普美克生物技术有限公司,酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒购自武汉Elabscience公司。全自动生化分析仪购自德国Bayer公司,高速低温离心机购自美国Beckman公司,电泳系统及电转移装置购自北京六一公司,凝胶成像系统购自美国Bio-Rad公司。
1.2 方法
1.2.1 动物模型复制及分组 小鼠均给予无菌饲料适应性喂养2周,自由饮纯净水,将db/db小鼠随机分为糖尿病组(DM组)、氧化苦参碱治疗组(OMT组),各10只;并设同月龄同背景非转基因db/m小鼠为对照组(NC组)。OMT组小鼠予以腹腔注射生理盐水溶解的氧化苦参碱120 mg/(kg·d)[14],给药8周后处死小鼠。
1.2.2 标本收集 处死小鼠前采集并记录小鼠24 h尿液,空腹6 h后乙醚麻醉后摘眼球取血,并开腹取两侧肾脏。肾组织部分用4 %中性甲醛固定进行石蜡切片,其余肾脏组织置于-80 ℃冰箱冷冻保存。
1.2.3 生化指标检测 按试剂盒说明书操作,用葡萄糖氧化酶法检测小鼠血糖,酶分析法检测血总胆固醇,双缩脲法测尿蛋白浓度,得到的尿蛋白浓度与24 h尿量乘积为24 h尿总蛋白量。
1.2.4 HE、Masson染色检测肾组织病变情况 将4%中性甲醛固定的肾脏组织做成3μm厚的石蜡切片,分别予以HE、Masson染色,光镜下观察肾脏组织形态及结构变化。
1.2.5 免疫组织化学染色检测肾组织HIPK2、TLR4、NLRP3表达和定位 采用免疫组织化学染色SP二步法,将肾组织石蜡切片进行脱蜡、水化、微波炉加热进行抗原修复、3%过氧化氢去离子水孵育,一抗孵育(HIPK2、TLR4、NLRP3均以1∶50浓度稀释)置于4 ℃冰箱过夜,应用DAB溶液显色,最后用自来水充分冲洗、复染、脱水、封片,光镜下观察并拍摄图片。
1.2.6 Western blotting检测肾组织HIPK2、TLR4、NLRP3、Fibronectin、E-cadherin蛋白表达 在-80 ℃冰箱内取肾脏组织0.08 g,加入500 μL组织蛋白裂解液进行组织匀浆。离心后,取上清液,按BCA试剂盒说明书检测小鼠肾组织蛋白浓度。加入5×的上样缓冲液,煮沸后经聚丙烯酰胺凝胶电泳分离蛋白;转膜,50 g/L脱脂牛奶封闭。TBST洗膜后,分别加入小鼠抗HIPK2单克隆抗体(1∶1 000),小鼠抗TLR4单克隆抗体(1∶1 000),兔抗Fibronetin多克隆抗体(1∶1 000),小鼠抗E-cadherin单克隆抗体(1∶1 000),小鼠抗β-actin抗体(1∶4 000),4 ℃孵育过夜。洗涤后,分别加入相应的Goat Anti-rabbit IgG/HRP或Goat Anti-Mouse IgG/HRP(1∶5 000),室温水平摇床上孵育1 h,用增强化学发光法显色,Bio-Rad凝胶成像系统曝光,经Image Lab 5.1软件处理并分析图像。
1.2.7 ELISA检测小鼠血清IL-1β和IL-18水平 将收集的小鼠血液置于低温高速离心机中,4 ℃、3 500 r/min离心3 min,取上层血清液,按ELISA试剂盒说明书检测血清IL-1β、IL-18水平。
1.3 统计学方法
数据分析采用SPSS 19.0统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析,进一步两两比较用LSD-t检验,采用Pearson法进行相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠一般资料比较
各组小鼠体重、血糖、24 h尿蛋白量、总胆固醇、甘油三酯水平比较,差异均有统计学意义(P<0.05)。DM组较NC组均升高(P<0.05),OMT组24 h尿蛋白量、总胆固醇、甘油三酯水平较DM组降低(P<0.05)。见表1。
表1 各组小鼠一般资料比较 (n=10,±s)
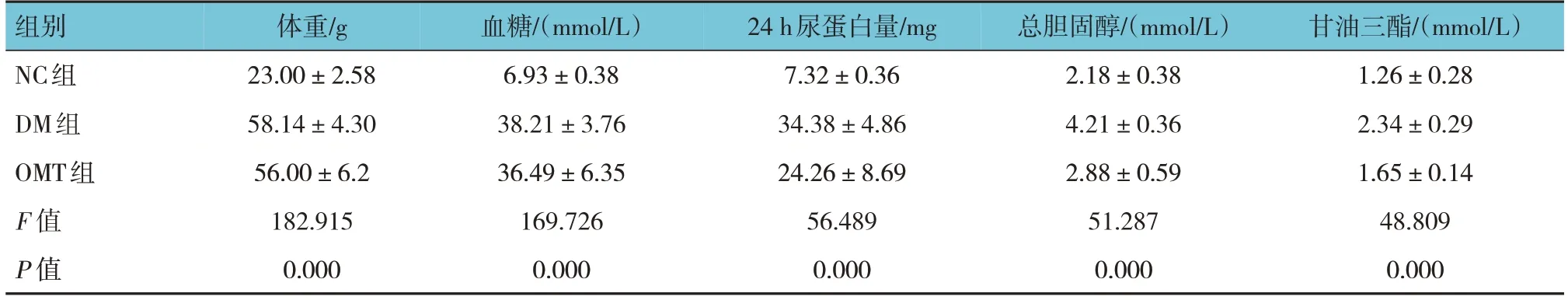
表1 各组小鼠一般资料比较 (n=10,±s)
组别NC组DM组OMT组F 值P 值体重/g 23.00±2.58 58.14±4.30 56.00±6.2 182.915 0.000血糖/(mmol/L)6.93±0.38 38.21±3.76 36.49±6.35 169.726 0.000 24 h尿蛋白量/mg 7.32±0.36 34.38±4.86 24.26±8.69 56.489 0.000总胆固醇/(mmol/L)2.18±0.38 4.21±0.36 2.88±0.59 51.287 0.000甘油三酯/(mmol/L)1.26±0.28 2.34±0.29 1.65±0.14 48.809 0.000
2.2 OMT处理可改善小鼠肾组织病变情况
HE染色可见,在NC组小鼠的肾组织中,肾小球结构清楚,轮廓清晰,肾小管上皮细胞排列整齐,DM组可见肾小球系膜区节段性增生,基底膜无明显增厚,大部分肾小管上皮细胞裂解,有空泡样变性,部分肾小管管腔内有透明管型,间质有大量淋巴细胞浸润及纤维组织增生,部分小动脉内膜纤维组织增生。与DM组相比,OMT组肾脏病变情况有不同程度的改善。Masson染色可见,与NC组相比,DM组肾小管间质中呈深蓝色的Masson染色阳性物质明显增多,而与DM组比较,OMT组可见肾小管间质中Masson染色阳性物质较DM组减少。见图1。
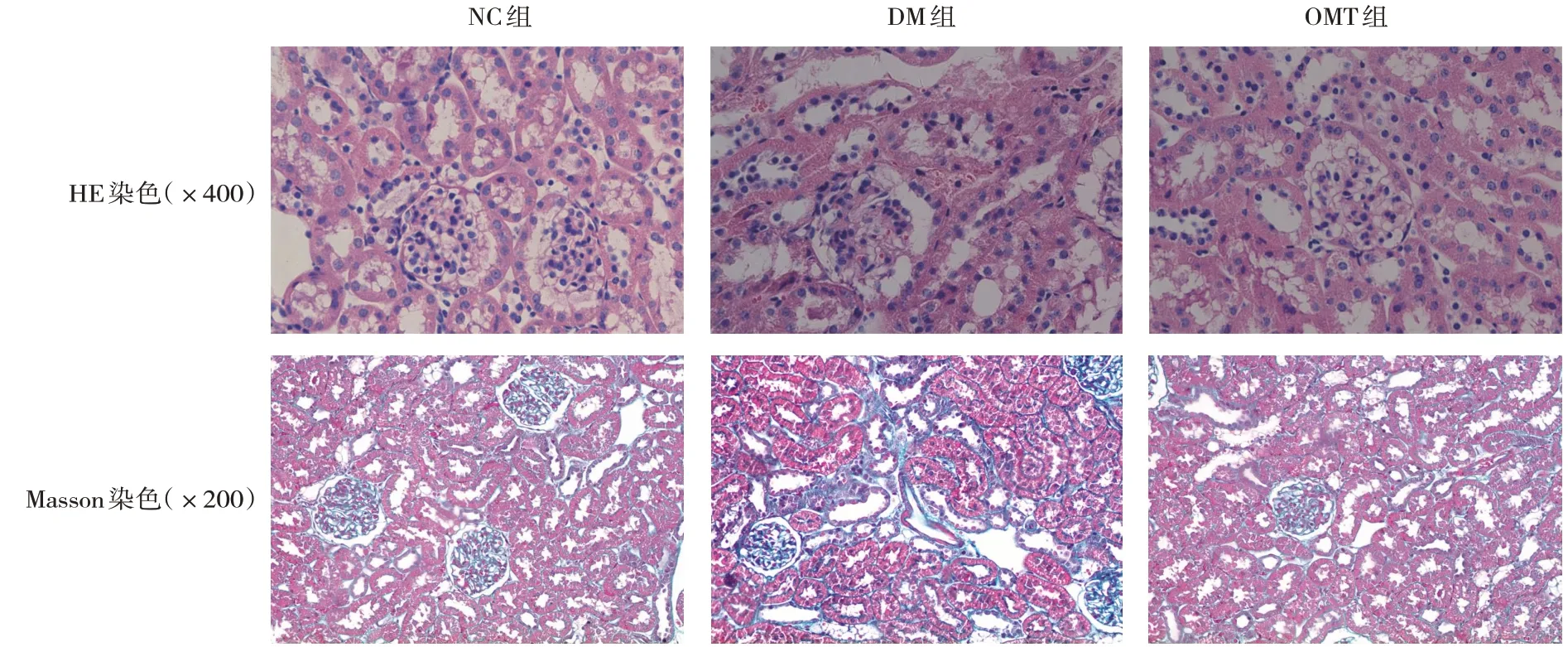
图1 各组小鼠肾组织的形态观察
2.3 OMT降低DM小鼠肾组织HIPK2、TLR4、NLRP3、Fibronectin,增加E-cadherin蛋白表达
各组小鼠TLR4、HIPK2、NLRP3、Fibronectin、Ecadherin蛋白相对表达量比较,差异均有统计学意义(P<0.05)。DM组TLR4、HIPK2、NLRP3、Fibronectin蛋白相对表达量较NC组上升(P<0.05),E-cadherin蛋白相对表达量较NC组下降(P<0.05);OMT组小鼠TLR4、HIPK2、NLRP3、Fibronectin蛋白相对表达量较DM组下降(P<0.05),E-cadherin蛋白相对表达量较DM组上升(P<0.05)。见表2和图2。
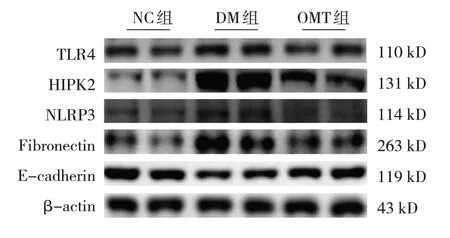
图2 各组小鼠肾组织中TLR4、HIPK2、NLRP3、Fibronectin、E-cadherin蛋白条带图
表2 各组小鼠TLR4、HIPK2、NLRP3、Fibronectin、E-cadherin蛋白相对表达量比较 (n=10,±s)
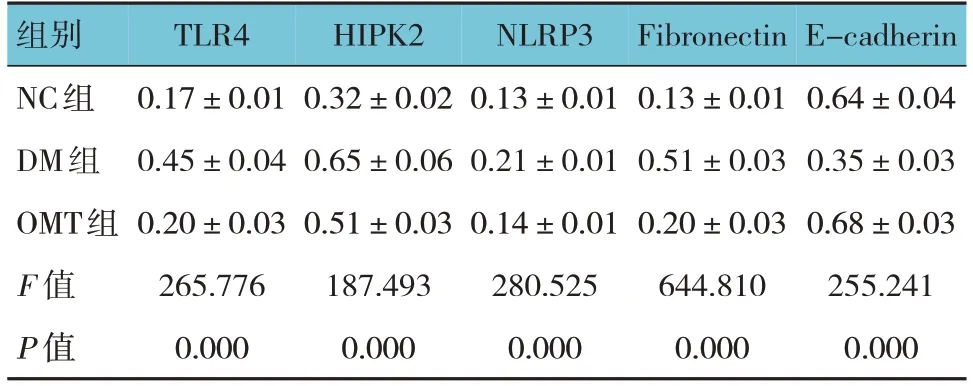
表2 各组小鼠TLR4、HIPK2、NLRP3、Fibronectin、E-cadherin蛋白相对表达量比较 (n=10,±s)
组别NC组DM组OMT组F 值P 值TLR4 0.17±0.01 0.45±0.04 0.20±0.03 265.776 0.000 HIPK2 0.32±0.02 0.65±0.06 0.51±0.03 187.493 0.000 NLRP3 0.13±0.01 0.21±0.01 0.14±0.01 280.525 0.000 Fibronectin 0.13±0.01 0.51±0.03 0.20±0.03 644.810 0.000 E-cadherin 0.64±0.04 0.35±0.03 0.68±0.03 255.241 0.000
2.4 OMT处理可减少DM小鼠肾组织TLR4、HIPK2、NLRP3的表达
免疫组织化学染色可见,NC组小鼠肾组织中,TLR4、HIPK2、NLRP3无明显棕黄染,表达减少;DM组可见TLR4、HIPK2、NLRP3棕黄染表达明显增多,主要表达在肾小管上皮细胞和部分肾小球;OMT组TLR4、HIPK2、NLRP3阳性染色较DM组明显减弱。见图3。

图3 各组小鼠肾组织TLR4、HIPK2、NLRP3表达 (免疫组织化学染色×200)
2.5 各组小鼠血清IL-1β、IL-18水平比较
各组小鼠血清IL-1β、IL-18水平比较,差异均有统计学意义(P<0.05)。DM组较NC组升高(P<0.05),OMT组较DM组降低(P<0.05)。见表3。
表3 各组小鼠血清中IL-1β、IL-18水平比较(n=10,pg/μL,±s)
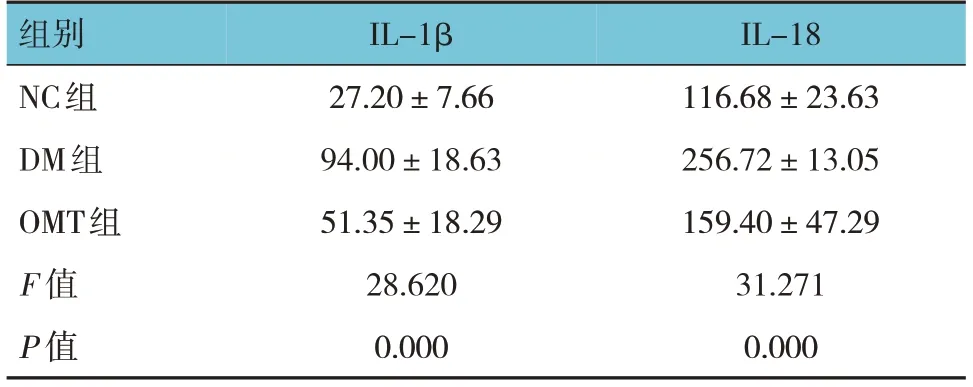
表3 各组小鼠血清中IL-1β、IL-18水平比较(n=10,pg/μL,±s)
组别NC组DM组OMT组F 值P 值IL-1β 27.20±7.66 94.00±18.63 51.35±18.29 28.620 0.000 IL-18 116.68±23.63 256.72±13.05 159.40±47.29 31.271 0.000
2.6 HIPK2与TLR4、NLRP3蛋白表达的相关性
Pearson相关性分析显示,DM组肾组织中HIPK2蛋白与TLR4、NLRP3蛋白表达均呈正相关(r=0.881和0.774,P=0.001和0.009)。OMT组HIPK2蛋白与TLR4、NLRP3蛋白表达均呈正相关(r=0.814和0.871,P=0.004和0.001)。
3 讨论
有研究表明db/db小鼠从4周龄起即可出现贪食、肥胖、多饮多尿,随着周龄的增加进而出现有明显的高血糖、高血脂等特征[17]。本研究中小鼠随着周龄的增加也出现了上述特征,经病理组织HE染色和Masson染色可见db/db小鼠肾小球系膜区发生节段性增生,基底膜无明显增厚,肾小管上皮细胞裂解有空泡样变性,间质有淋巴细胞浸润及纤维组织增生,部分小动脉内膜纤维组织增生,深蓝色的Masson染色阳性物质明显增多,ELISA检测显示db/db小鼠血清中的炎性介质IL-1β、IL-18水平明显增加,生化指标检测显示db/db小鼠体重、血糖、24 h尿蛋白量、总胆固醇、甘油三酯水平较NC组均明显升高;与db/db小鼠相比,OMT治疗后db/db小鼠肾脏病理改变有所改善,伴随24 h尿蛋白量、总胆固醇、甘油三酯水平降低,而体重和血糖水平无统计学差异,Masson染色阳性物质明显减少,炎性介质IL-1β与IL-18的含量明显降低,以上结果均提示db/db小鼠出现肾功能减退,糖尿病肾病模型复制成功,OMT可明显减轻db/db小鼠肾脏炎症反应及纤维化程度,改善肾功能,但其可能的作用机制不甚清楚。
研究发现,TLR4和NF-κB作为炎症反应激活通路中的重要调节因子,在糖尿病肾病发展过程中的表达水平上调以及过度激活可能是导致糖尿病肾损伤的重要机制之一[18]。而NAGAREDDY等[19]发现,在脂肪组织巨噬细胞中,通过TLR4/MyD88诱导IL-1β和NLRP3炎症小体的活化,抑制TLR4的配体或NLRP3-IL-1β信号轴可以减轻肥胖状态下脂肪组织的炎症反应和胰岛素抵抗。提示TLR4的信号传导与NLRP3之间存在信号串扰且共同参与了糖尿病肥胖状态的病理过程[20]。本研究结果中NC组小鼠肾组织中TLR4、NLRP3少量棕黄染,db/db小鼠在肾小管上皮细胞和部分肾小球中可见TLR4、NLRP3棕黄染表达明显增多,Western blotting结果显示,两者的水平明显增加,且伴随纤维化指标Fibronectin蛋白表达增多,EMT指标E-cadherin蛋白表达明显下降,以上结果提示db/db小鼠肾组织中TLR4、NLRP3炎症信号通路被激活,炎性介质产生增多,出现肾脏病理改变,上皮细胞表型标志物减少,促进了EMT过程,纤维结缔组织在肾组织中含量增加,加快纤维化进展。
HIPK2是一种功能多样的丝氨酸/苏氨酸激酶,可促凋亡、促纤维化、抑制肿瘤转移,参与DNA损伤应答及缺氧环境中抑制血管生成。有研究发现HIPK2能抑制TGF-β诱导的Smad3磷酸化,HIPK2缺失可抑制该通路的激活[21];也有研究证实TGF-β/Smad3信号通路的激活能促进NLRP3炎症小体的活化,而在小胶质细胞中,脂多糖可通过上调TLR4表达,激活小胶质细胞,促进NLRP3与Caspase-1活化,引起小鼠脑组织中炎性细胞因子高表达[22];非小细胞肺癌中,胡萝卜素B直接结合TLR4来激活NLRP3炎症小体,进一步导致Gasdermin D的N-和C-末端分离以执行焦性下垂[23]。以上研究提示HIPK2可能与TLR4、NLRP3共同参与糖尿病肾病的发病机制,但是否存在相关性,尚未见报道。本研究结果显示,与NC组相比,db/db小鼠肾小管上皮细胞和部分肾小球中HIPK2蛋白表达明显增加,相关性分析发现db/db小鼠HIPK2分别与TLR4和NLRP3呈正相关,揭示3者共同促进糖尿病肾病的肾功能减退,促炎信号的活化及肾脏纤维化的进程。
有学者研究发现,OMT可通过抑制TLR4或NLRP3炎症信号发挥作用[24-25]。本研究发现OMT组与DM组相比,HIPK2、TLR4、NLRP3的表达均明显降低,伴随炎症反应减弱、炎性介质释放减少,同时Ecadherin表达增加,Fibronectin沉积减少,OMT组HIPK2分别与TLR4和NLRP3也呈正相关。
综上所述,OMT可改善db/db小鼠血脂水平和肾功能,减少炎性介质的释放,逆转EMT过程,减轻肾脏纤维化进展,可能与下调HIPK2表达,进而抑制TLR4和NLRP3炎症信号通路有关,但是具体的调控机制还需要在体外应用多种手段干预进一步论证。
