匹多莫德对支原体感染小鼠肺功能损伤的影响及其机制研究*
2024-04-01王坤李嫣
王坤,李嫣
(苏州大学附属儿童医院 感染性疾病科,江苏 苏州 215000)
支原体是一种无细胞壁的病原体,可侵入呼吸道、泌尿生殖道和关节等部位,引起多种感染性疾病。支原体肺炎是支原体感染(mycoplasma pneumoniae infection,MPI)最常见的疾病之一,主要发生在儿童和青少年,占社区获得性肺炎的10%~40%,以发热、咳嗽、胸闷、呼吸困难等为主要临床特征,可伴有肺间质纤维化、肺泡蛋白沉积、肺水肿等肺功能损伤[1]。目前,抗生素是支原体肺炎的主要治疗手段,但由于支原体的耐药性和抗生素的副作用,整体疗效仍有待提升[2]。因此,迫切需要寻找新的治疗方法和药物防治支原体肺炎。匹多莫德是一种人工合成的免疫调节剂,可提高免疫力,预防或辅助治疗感染性疾病[3]。近年来有研究发现,匹多莫德联合连花清瘟可显著改善老年支气管肺炎患者肺功能,为治疗支原体肺炎提供了新的思路[4]。但匹多莫德治疗支原体肺炎的作用机制尚不清楚。本研究通过动物实验观察匹多莫德对MPI小鼠肺功能损伤的疗效及可能的机制,以期为临床提供新的药物选择和理论依据。
1 材料与方法
1.1 实验动物
50只SPF级雄性BALB/c小鼠,6~8周龄,体重18~22 g,购自北京维泰瑞技术服务发展有限公司。实验动物生产许可证号:SCXK(京)2019-0013,实验动物使用许可证号:SYXK(苏)2021-0065。小鼠在12 h光/暗周期、(22±2)℃恒温环境下饲养,自由进食饮水。实验前1周,小鼠进行适应性饲养。
1.2 药品与试剂
肺炎支原体标准菌株(上海舜冉生物科技有限公司),匹多莫德颗粒剂(浙江仙琚制药股份有限公司,生产批号:20030325),谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(北京百奥莱博科技有限公司),γ干扰素(Interferon-γ,IFN-γ)、白细胞介素-4(Interleukin-4,IL-4)试剂盒(上海信裕生物科技有限公司),兔抗小鼠核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)、血红素加氧酶-1(heme oxygenase-1,HO-1)一抗(美国R&D公司)。
1.3 仪器
GENios Pro酶标仪(瑞士Tecan公司),Pneupac Small Animal Ventilator小动物呼吸机(美国DRE Veterinary公司),Axio Scope.A1光学显微镜(德国蔡司公司),Gel SMART凝胶成像仪(北京大龙兴创实验仪器股份公司)。
1.4 方法
1.4.1 MPI模型的复制 支原体菌液置于PPLO培养基内,在37 ℃培养箱中培养12 h后达对数生长期,当培养液颜色由红变黄时进行连续传代,以变色最高稀释浓度为颜色改变单位(color change unit,CCU),CCU/mL为菌株浓度单位,用10倍梯度稀释法将菌液稀释为1×108CCU/mL备用。40只小鼠吸入乙醚麻醉后,经移液器滴入50 μL支原体菌液(1×108CCU/mL),滴入后将鼠头后仰使菌液随自主呼吸抵达下呼吸道,滴鼻持续3 d,期间观测小鼠日常活动及体重变化,末次滴鼻6 h后采集腹主动脉血。经颗粒凝集法判断,血清滴度≥1∶160表示存在支原体抗体,且出现嗜睡、蜷缩、竖毛、少动、拒食或少食,眼角出现分泌物等临床症状为模型复制成功[5]。
1.4.2 动物分组及给药 模型复制成功后,取40只MPI模型小鼠随机分为MPI组及实验A、B、C组,各10只;另外10只健康小鼠仅滴鼻同体积生理盐水设为正常组。气血检查后1 h,实验A、B、C组小鼠分别灌胃匹多莫德颗粒(终浓度100、200、400 mg/kg溶于生理盐水)[6]。正常组、MPI组小鼠灌胃等量生理盐水,1次/d,持续3 d。
1.4.3 小动物呼吸机检测肺功能 使用腹腔戊巴比妥钠深度麻醉小鼠,沿颈部切开皮肤、肌肉和筋膜,暴露甲状腺后小心分离周围组织,避免出血,用钳子隔开颈前肌露出气管,固定气管后在气管上切开约1 mm大小切口,沿气管向下插管,置于小动物呼吸机的密闭箱中,等待一段静息呼吸后,测量每分钟通气量(minute ventilation,MV)、潮气量(tidal volume,TV)、最大呼气量(maximum expiratory volume,MEV)[7]。
1.4.4 组织取材 肺功能检测完成后采集小鼠腹主动脉血,离心取血清保存于4 ℃条件下备用。采血后脊椎脱臼处死,沿胃下缘、小肠区上部横切口开腹,暴露腹腔中、上部结构,从剑突下剪破膈肌,使肺回缩,随后向两侧扩大破口,与腹壁切口靠近,将灌注针从心轴方向进针,刺入心尖3~4 mm,开始灌流后剪破右心耳,先以生理盐水40 mL快速冲洗血管,然后用含4%多聚甲醛的0.01 mol/L磷酸盐缓冲液20 mL灌注固定,先快后慢。灌注固定完成后,用解剖剪沿胸骨中线剪开胸壁,暴露肺部结构。用解剖镊和剪刀分别夹住和切断气管、支气管、肺动脉及肺静脉,取出整个肺部,用刀片单向切割成约3~4 mm厚的组织块,放入4%多聚甲醛中固定24 h,脱水、包埋、浸蜡、切片(厚度4 μm)备用。剩余肺组织投入液氮中冷冻保存备用。
1.4.5 血清氧化应激指标检测 取小鼠冷藏保存的部分主动脉血清,采用紫外分光光度法检测血清GSH-Px活性,细胞色素C还原法检测SOD活性,均严格按照试剂盒说明书进行操作[8]。
1.4.6 酶联免疫吸附试验检测血清免疫指标 取冷藏保存的部分主动脉血清,按照酶联免疫吸附试验试剂盒说明书进行操作,准备酶联免疫吸附板,将特异性抗IL-4或抗IFN-γ的单克隆抗体稀释后加入板孔中,包被在固相载体上,4 ℃过夜。去除多余的抗体,用磷酸盐缓冲液洗涤板孔,加入封闭液,室温孵育1 h,阻止非特异性结合。去除封闭液,加入标准品或待测血清样本,用不同浓度的标准品绘制标准曲线,将待测血清样本稀释到合适的范围,室温孵育2 h,使IL-4或IFN-γ与固相抗体结合。去除未结合的IL-4或IFN-γ,用磷酸盐缓冲液洗涤板孔,加入生物素标记的山羊抗小鼠IgG二抗,室温孵育1 h,使二抗与固相复合物结合。去除未结合的二抗,洗涤板孔,加入辣根过氧化物酶标记的亲和素,室温孵育30 min,使亲和素与生物素结合。去除未结合的亲和素,洗涤板孔,加入适当的底物,室温显色10~30 min,使底物在酶的作用下发生有色反应。加入终止液,停止反应,并使有色反应由蓝色变为黄色。用酶标仪在450 nm波长处读取各孔的吸光度(optical density,OD)值,并根据标准品的OD值和浓度绘制标准曲线,计算待检样本IL-4、IFN-γ水平[9]。
1.4.7 苏木精-伊红(hematoxylin-eosin,HE)染色观察肺组织病理变化 取肺组织切片放在玻璃载片上,用火焰加热使其贴合。置于二甲苯中脱蜡,5 min/次,重复2次。将载片转移到乙醇中脱脂,分别用100%、95%、70%乙醇各处理2次,3 min/次。冲洗载片,苏木精染色15 min。冲洗载片,0.5%盐酸乙醇溶液分化5 s。冲洗载片,Scott氏溶液蓝化1 min,伊红溶液染色10 min。冲洗载片,用95%乙醇去除多余的伊红染料,3 min/次,重复2次。将载片转移到100%乙醇中脱水,3 min/次,重复2次。将载片转移到二甲苯中透明化,5 min/次,重复2次。用玻璃盖片覆盖载片,封片胶固定,在显微镜下观察[10]。
1.4.8 Western blotting检测肺组织Nrf2、HO-1蛋白表达 取冷冻保存的肺组织,充分研磨、匀浆、裂解,10 000 r/min低温离心10 min,离心半径15 cm,取上清液定量蛋白。取少量样本蛋白,混合4倍量上样缓冲液,水浴加热变性蛋白,以20~30 μg/孔加载到凝胶槽中,加入预染色蛋白作为分子量标准,用恒压电源进行电泳分离。将分离好的蛋白从凝胶转移到聚氟乙烯膜上,用转印仪或半干法转印。将转印好的膜用5%牛奶在室温或4 ℃封闭1~2 h,防止非特异性结合。将封闭好的膜用含适当稀释比例的Nrf2或HO-1一抗溶液在4 ℃过夜或室温2 h孵育,使一抗与目标蛋白结合。将孵育好的膜用含Tween-20的TBST缓冲液洗涤3次,10 min/次,去除未结合的一抗。将洗涤好的膜用含适当稀释比例的荧光标记的二抗溶液室温孵育1 h,使二抗与一抗结合。重复上述洗涤步骤,去除未结合的二抗。用荧光成像仪扫描和分析洗涤好的膜,根据荧光信号的强度和分子量计算Nrf2、HO-1蛋白相对表达量[11]。
1.5 统计学方法
数据分析采用SPSS 23.0统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析,两两比较用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠肺功能指标比较
正常组、MPI组、实验A组、实验B组、实验C组MV、TV、MEV比较,经方差分析,差异均有统计学意义(F=17.626、15.133和20.238,均P=0.000)。与正常组比较,MPI组MV、TV、MEV减少(P<0.05);与MPI组比较,实验A、B、C组MV、TV、MEV增加(P<0.05);与实验A组比较,实验B、C组MV、TV、MEV增加(P<0.05);与实验B组比较,实验C组MV、TV、MEV增加(P<0.05)。见表1。
表1 各组小鼠肺功能指标比较 (n=10,±s)
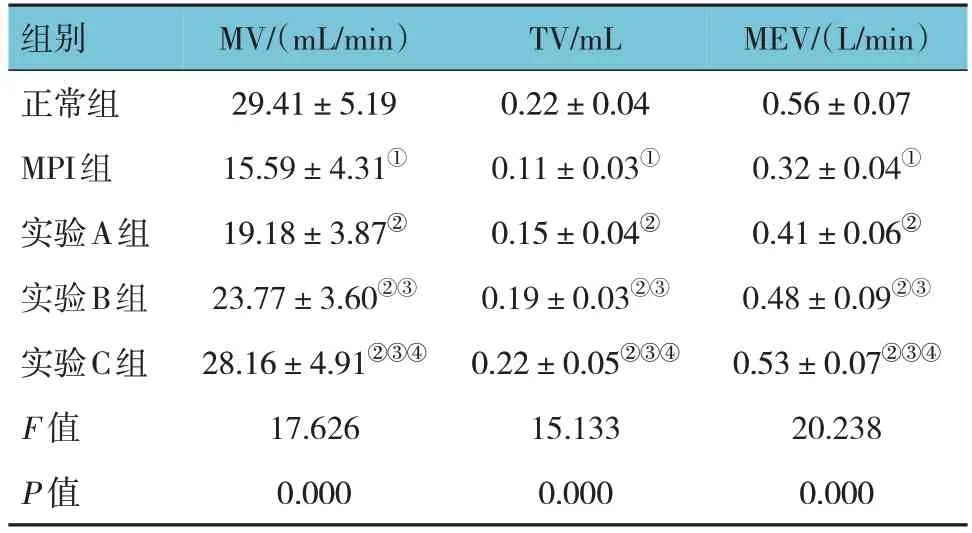
表1 各组小鼠肺功能指标比较 (n=10,±s)
注:①与正常组比较,P<0.05;②与MPI组比较,P<0.05;③与实验A组比较,P<0.05;④与实验B组比较,P<0.05。
MEV/(L/min)0.56±0.07 0.32±0.04①0.41±0.06②0.48±0.09②③0.53±0.07②③④20.238 0.000组别正常组MPI组实验A组实验B组实验C组F 值P 值MV/(mL/min)29.41±5.19 15.59±4.31①19.18±3.87②23.77±3.60②③28.16±4.91②③④17.626 0.000 TV/mL 0.22±0.04 0.11±0.03①0.15±0.04②0.19±0.03②③0.22±0.05②③④15.133 0.000
2.2 各组小鼠血清氧化应激指标比较
正常组、MPI组、实验A组、实验B组、实验C组血清GSH-Px、SOD活性比较,经方差分析,差异均有统计学意义(F=18.642和70.428,均P=0.000)。与正常组比较,MPI组血清GSH-Px、SOD活性降低(P<0.05);与MPI组比较,实验A、B、C组GSH-Px、SOD活性增强(P<0.05);与实验A组比较,实验B、C组GSH-Px、SOD活性增强(P<0.05);与实验B组比较,实验C组GSH-Px、SOD活性增强(P<0.05)。见表2。
表2 各组小鼠血清氧化应激指标比较 (n=10,±s)
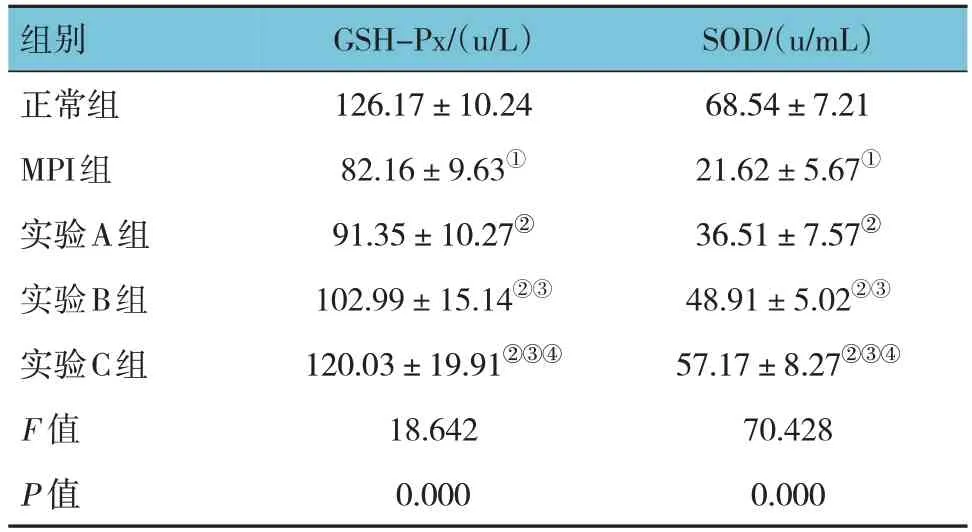
表2 各组小鼠血清氧化应激指标比较 (n=10,±s)
注:①与正常组比较,P<0.05;②与MPI组比较,P<0.05;③与实验A组比较,P<0.05;④与实验B组比较,P<0.05。
SOD/(u/mL)68.54±7.21 21.62±5.67①36.51±7.57②48.91±5.02②③57.17±8.27②③④70.428 0.000组别正常组MPI组实验A组实验B组实验C组F 值P 值GSH-Px/(u/L)126.17±10.24 82.16±9.63①91.35±10.27②102.99±15.14②③120.03±19.91②③④18.642 0.000
2.3 各组小鼠血清免疫指标比较
正常组、MPI组、实验A组、实验B组、实验C组血清IFN-γ、IL-4水平比较,经方差分析,差异均有统计学意义(F=26.663和31.635,均P=0.000)。与正常组比较,MPI组血清IFN-γ水平降低,IL-4水平升高(P<0.05);与MPI组比较,实验A、B、C组IFN-γ水平升高,IL-4水平降低(P<0.05);与实验A组比较,实验B、C组IFN-γ水平升高,IL-4水平降低(P<0.05);与实验B组比较,实验C组IFN-γ水平升高,IL-4水平降低(P<0.05)。见表3。
表3 各组小鼠血清免疫指标比较 (n=10,±s)

表3 各组小鼠血清免疫指标比较 (n=10,±s)
注:①与正常组比较,P<0.05;②与MPI组比较,P<0.05;③与实验A组比较,P<0.05;④与实验B组比较,P<0.05。
IL-4/(ng/L)33.98±6.37 75.46±12.71①67.27±8.90②56.45±9.16②③48.16±7.10②③④31.635 0.000组别正常组MPI组实验A组实验B组实验C组F 值P 值IFN-γ/(ng/mL)71.69±9.40 39.43±4.55①47.52±7.13②58.38±7.42②③63.12±9.45②③④26.663 0.000
2.4 各组小鼠肺组织病理变化
HE染色结果显示,正常组小鼠肺组织结构完整,肺泡状态正常。MPI组小鼠肺组织结构受损严重,肺泡壁断裂变形,组织间隙肿胀,毛细血管扩张充血,可见大量炎症细胞浸润。实验A、B、C组小鼠肺泡壁恢复连接,组织结构成形,炎症细胞浸润减少,间隙肿胀程度变小;实验C组较实验A、B组改善更显著,呈剂量依赖性。见图1。
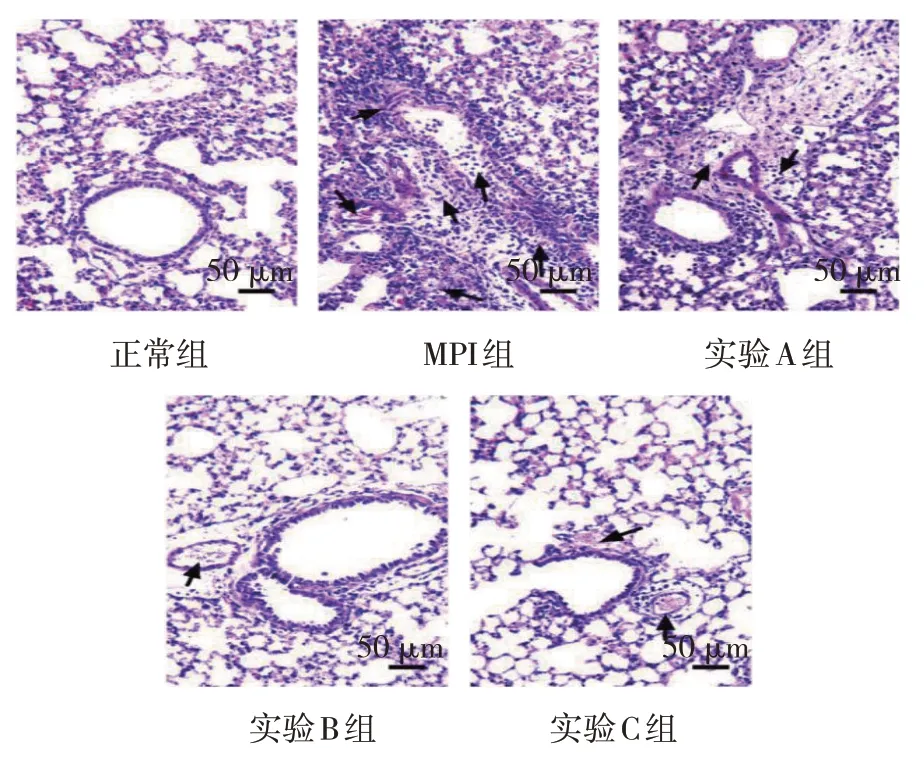
图1 各组小鼠肺组织病理变化 (HE染色×200)
2.5 各组小鼠肺组织Nrf2、HO-1蛋白相对表达量比较
正常组、MPI组、实验A组、实验B组、实验C组肺组织Nrf2、HO-1蛋白相对表达量比较,经方差分析,差异均有统计学意义(F=186.820和123.063,均P=0.000)。与正常组比较,MPI组肺组织Nrf2、HO-1蛋白相对表达量降低(P<0.05);与MPI组比较,实验A、B、C组肺组织Nrf2、HO-1蛋白相对表达量升高(P<0.05);与实验A组比较,实验B、C组肺组织Nrf2、HO-1蛋白相对表达量升高(P<0.05);与实验B组比较,实验C组肺组织Nrf2、HO-1蛋白相对表达量升高(P<0.05)。见表4和图2。

图2 各组小鼠肺组织Nrf2、HO-1蛋白表达
表4 各组小鼠肺组织Nrf2、HO-1蛋白相对表达量比较(n=10,±s)

表4 各组小鼠肺组织Nrf2、HO-1蛋白相对表达量比较(n=10,±s)
注:①与正常组比较,P<0.05;②与MPI组比较,P<0.05;③与实验A组比较,P<0.05;④与实验B组比较,P<0.05。
HO-1 0.46±0.04 0.04±0.01①0.21±0.03②0.28±0.07②③0.40±0.06②③④123.063 0.000组别正常组MPI组实验A组实验B组实验C组F 值P 值Nrf2 0.92±0.15 0.08±0.02①0.24±0.03②0.47±0.05②③0.76±0.08②③④186.820 0.000
3 讨论
支原体肺炎是一种由肺炎支原体引起的急性呼吸道感染伴肺炎,其主要危险因素包括与患者密切接触、秋冬季节、儿童和青年年龄段、人群密集环境、免疫力低下及合并其他呼吸道感染等[12-13]。支原体肺炎发病机制涉及支原体对宿主细胞直接损伤、宿主对支原体的免疫反应,以及支原体与其他微生物的共同作用[14-16]。作为一种无细胞壁的病原体,肺炎支原体可抵抗细胞壁靶向性抗生素,并可改变自身大小和形状以适应周围环境,从而增加耐药性和免疫逃避能力,治疗难度高[17]。尽管已经有许多药物和治疗方法用于支原体肺炎,但是疗效仍不理想,因此迫切需要寻找新的治疗策略。
Th1/Th2平衡是指机体在应对不同类型的病原体时,产生适当比例的Th1、Th2细胞,以发挥最佳的免疫效应,IFN-γ、IL-4分别是两者的代表性因子,广泛参与支原体肺炎发生、发展[18-19]。本研究结果显示,与MPI组比较,实验A、B、C组MV、TV、MEV均增加,IL-4水平降低,GSH-Px、SOD活性、IFN-γ水平均升高,提示匹多莫德可改善MPI小鼠肺功能、氧化应激及免疫功能。匹多莫德是一种由2个L-丙氨酸和1个D-苯丙氨酸组成的二肽类化合物,常用于治疗有细胞介导免疫抑制证据的肺部及泌尿道感染,其可刺激和调节细胞因子的产生和释放,从而增强非特异性自然免疫、体液免疫和细胞免疫等相关免疫反应,增强巨噬细胞、中性粒细胞的抗感染能力,促使辅助性/抑制性T细胞比值恢复正常[20-21]。XU等[22]研究认为,辅助匹多莫德治疗支原体肺炎可改善患者的炎症反应和肺功能,增强免疫功能。
Nrf2/HO-1信号通路是机体内一条重要的细胞保护通路,参与调节氧化应激、炎症和凋亡等多个生物学过程。Nrf2是该信号通路的核心转录因子,具有还原敏感性,可维持细胞内氧化还原稳态,在受到氧化应激或亲电性物质的刺激时,从细胞质中解离出来,转移至HO-1[23-24]。HO-1是一种血红素加氧酶,可将血红素降解为一氧化碳CO、胆红素和游离铁,从而发挥抗氧化、抗炎、抗凋亡和稳定血管的作用[25]。在MPI中,Nrf2/HO-1信号通路也起着重要作用。Nrf2和HO-1蛋白在肺组织中主要由Ⅱ型肺泡细胞分泌,Ⅱ型肺泡细胞是一种位于肺泡拐角处的立方形或球形细胞,具有合成、分泌肺表面活性物质的功能。Nrf2和HO-1蛋白可以保护肺泡细胞免受氧化应激和炎症反应损伤,对预防和治疗急性肺损伤等疾病有重要意义。支原体肺炎感染可导致肺组织产生大量的活性氧自由基,造成氧化应激损伤,Nrf2/HO-1通路可调节细胞内抗氧化酶和抗氧化物质的表达,清除活性氧自由基,维持氧化还原平衡,减轻氧化应激反应。支原体肺炎感染可激活细胞膜上的Toll样受体4,启动核转录因子κB信号通路,释放炎症因子,引发炎症反应,而Nrf2/HO-1通路可以抑制该信号通路的激活,减少炎症因子的表达,从而抑制炎症反应。支原体肺炎感染可通过黏附、入侵、毒素等方式直接损伤肺泡上皮细胞,导致肺泡水肿和气体交换障碍。Nrf2/HO-1通路可通过增加CO的生成,改善微循环,增加血流灌注,保护肺泡上皮细胞。有学者发现,Nrf2/HO-1信号通路活性在支原体肺炎中被抑制,激活该通路可有效减轻小鼠肺部炎症反应,促进细胞增殖并抑制其凋亡[26]。本研究结果显示,MPI小鼠经不同剂量匹多莫德干预后,肺组织Nrf2、HO-1蛋白相对表达量均升高,提示匹多莫德可能通过调节Nrf2/HO-1信号通路发挥对MPI小鼠的治疗作用。
综上所述,匹多莫德可能通过调节Nrf2/HO-1信号通路改善MPI小鼠肺功能及免疫功能,减轻氧化应激损伤。本研究仍存在一定不足及局限性,如研究中使用的小鼠数量较少,导致结果的可信度和推广性受到限制,且由于小鼠和人类在生理和基因上存在一定差异,实验结果可能不完全适用于人类,无法完全模拟临床情况。未来研究应增加样本量,以提高实验的统计学能力和结果的可靠性,并逐步进行临床随机对照试验,进一步观察匹多莫德对MPI的影响。
