三仁汤对肝纤维化模型大鼠血清炎症因子及血小板衍生生长因子的影响※
2024-03-30隆卫阳李墨辞吴同玉
隆卫阳 李墨辞 吴同玉,2▲
肝纤维化的主要致病因素有病毒性肝炎(如慢性乙型肝炎和慢性丙型肝炎)、非酒精性脂肪性肝病、饮酒、自身免疫性肝炎等。在各种病因的持续刺激下,肝细胞中以Ⅰ型胶原纤维为主导的细胞外基质在肝实质中过度沉积,导致肝纤维化[1]。肝纤维化可出现在大多数慢性肝病中,肝纤维化的过程中通过细胞因子加剧了机体的炎症反应,从而肝内微循环失调,而肝纤维化长时间持续,有可能会发展成为肝硬化[2]。有研究[3]指出,肝纤维化与肝病进展相关,肝纤维化是影响肝病预后和肝细胞癌(HCC)风险的关键因素。
肝纤维化的发生、发展是一个复杂的病理过程,其中的关键环节是肝星状细胞(HSC)的激活[4]。HSC的活化与促炎或促纤维化因子等密切相关[5]。梁文杰等[6]认为,Kupffer 细胞、肝细胞可直接激活HSC,释放转化生长因子(TGF)、血小板衍生生长因子(PDGF)等促纤维化因子,以及释放肿瘤坏死因子-α(TNF-α)、白介素(IL)等炎性因子,参与肝纤维化的发生、发展过程。目前,西医治疗肝纤维化虽可减轻肝脏炎症,但效果欠佳,而中医药抗肝纤维化已取得不错的成效[7]。
为进一步研究中药的作用机制,笔者以化学性损伤(腹腔注射0.5%二甲基亚硝胺溶液1.6 mL/kg,每周连续2 d,共持续4 w)建立肝纤维化大鼠模型,并以具有明显抑制肝纤维化作用的药物秋水仙碱[8]作为对照,探讨三仁汤对肝纤维化模型大鼠炎症因子及血小板衍生生长因子的影响,以此为临床应用三仁汤防治肝纤维化提供实验依据。
1 材料
1.1 动物由上海斯莱克动物有限责任公司提供,为无特定病原体的SPF 级Wistar 大鼠,6 w 龄,雄性,体质量(200±20) g,共48 只,许可证号为SCXK(泸)2018-0006。实验开始前已通过福建中医药大学伦理委员会审核,批准文号:FJTCM IACUC 2021010。所有大鼠饲养于福建中医药大学实验动物研究中心,许可证号为SYXK(闽)2019-0007。
1.2 药品三仁汤药物组成:杏仁15 g,白蔻仁6 g,薏苡仁18 g,法半夏15 g,滑石18 g,通草6 g,淡竹叶6 g,厚朴6 g。按现代药理学方法,用8 倍中药质量的蒸馏水浸泡中药30 min,武火煮沸后文火再煎约40 min,连续2次后去滓合并。根据人与大鼠的剂量换算公式(大鼠以每只200 g 体质量计算),水浴加热蒸发浓缩为4.1 g·kg-1、8.2 g·kg-1以及16.4 g·kg-1三个浓度,配好后于4 ℃冰箱保存。云南昊邦制药有限公司生产的秋水仙碱片(国药准字H5302798,批号:200614/1)。上海罗恩试剂科技有限公司生产的二甲基亚硝胺(DMN),RO 51263,规格:5 mL。
1.3 试剂苏木素-伊红(HE)染色试剂盒(厂家:珠海贝索BASO;批号:BA4025);MASSON 染色试剂盒(厂家:珠海贝索BASO;批号:BA4079);IL-1β ELISA试剂盒(货号:EK0393;批号:11517741011);PDGFBB ELISA 试 剂 盒( 货 号:EK1698;批 号:123817921011);IL-10 ELISA 试剂盒(货号:EK0418;批号:13817591011);TNF-α ELISA 试剂盒(货号:EK0526;批号:24017791011);IL-6 ELISA 试剂盒(货号:EK0412;批号:1331790101)。ELISA 试剂盒生产厂家均为武汉博士德生物工程有限公司。
1.4 仪器恒温箱(型号:DNP-9052,上海精宏试验设备有限公司);洗板机(型号:PW-812,深圳市汇松科技发展有限公司);高速离心机(型号:SH01D,上海知信实验仪器技术有限公司);漩涡混合器(批号:XH-C,江苏大唐医疗器械有限公司);酶标仪(型号:Tecan Infinite F50,瑞士);组织包埋机(型号:Leica EG1150H,德国);半自动切片机(型号:Leica RM2245, 德国)。
2 方法
2.1 分组、造模及给药适应性喂养1 w,确定无明显异常后将大鼠随机分为空白对照组、模型组、秋水仙碱组(给药剂量为1.0×10-4g·kg-1)以及三仁汤低、中、高剂量组(给药剂量分别为4.1 g·kg-1、8.2 g·kg-1、16.4 g·kg-1),每组8只。
根据文献[9]查询与前期预实验结果,造模方式采用每周一、二以1.6 mL·kg-1的剂量腹腔注射0.5%DMN 来建立大鼠肝纤维化模型,并自造模开始的同时,除空白组及模型组每日1 次给予灌服体积0.1 mL·kg-1的生理盐水外,其余组别大鼠予相应药物每日1次灌胃给药干预,三仁汤低、中、高剂量组以及秋水仙碱组按上述体积灌服对应浓度药物,以上造模及药物干预持续时间均为4 w。若中途有大鼠出现形体消瘦伴有出血、体温降低等明显不适则停止干预,观察大鼠后续情况,若情况不见好转,可考虑处死以解除痛苦。
2.2 指标检测干预4 w后,大鼠禁食不禁水12 h,第2 d 将大鼠称重。用超纯水配置20%乌拉坦,以0.06 mL·kg-1剂量腹腔注射麻醉,采集腹主动脉血,室温放置下2 h后,4500 r/min离心15 min,吸取上层血清,用ELISA 法测定肝脏炎症指标(TNF-α、IL-1β、IL-6、IL-10)以及PDGF-BB 水平。摘取大鼠肝脏后,称重并记录,后切取固定部位保存于EP 管中,进行HE染色、Masson染色:流水冲洗、梯度脱水、二甲苯透明、浸蜡、包埋、切片、脱蜡、水化、染色、脱水、透明、封片等操作。
2.3 统计学方法使用SPSS 23.0 统计软件进行分析,数据以均数±标准差(±s)表示,多样本均数比较本用One-Way ANOVA检验,组间比较若方差齐用LSD检验,若方差不齐用Games-Howell检验。P<0.05表示有统计学差异。
3 结果
3.1 肝纤维化大鼠肝重、体质量、肝体比结果与正常组比较,模型组大鼠肝重、体质量、肝体比均明显降低,具有统计学差异(P<0.001)。与模型组比较,三仁汤中、低剂量组及秋水仙碱组大鼠的肝重显著升高(P<0.001 或P<0.01);秋水仙碱组及三仁汤低、中、高剂量组大鼠的体质量与模型组比较,无统计学差异(P>0.05);秋水仙碱组及三仁汤中、低剂量组大鼠的肝体比与模型组比较,具有统计学差异(P<0.001或P<0.01或P<0.05)。秋水仙碱组及三仁汤中、高剂量组大鼠的肝体比与正常组相当,无统计学差异(P>0.05)。见表1。
表1 各组大鼠肝重、体质量、肝体比比较(± s)

表1 各组大鼠肝重、体质量、肝体比比较(± s)
注:与正常组比较,*P<0.05,**P<0.01,***P<0.001;与模型组比较,△P<0.05,△△P<0.01,△△△P<0.001
肝体比(%)0.025±0.001△△△0.016±0.001***0.025±0.001△△△0.021±0.001*△0.023±0.001△△0.020±0.002组别正常组模型组秋水仙碱组三仁汤低剂量组三仁汤中剂量组三仁汤高剂量组肝重(g)7.941±0.142△△△3.479±0.100***5.351±0.387***△△△4.644±0.303***△△5.171±0.272***△△△4.249±0.411***体质量(g)314.813±7.956△△△213.660±1.701***214.833±5.807***221.586±4.220***225.660±3.871***210.400±6.739***
3.2 肝组织染色结果
3.2.1HE 染色结果 正常组大鼠肝细胞以中央静脉为中心,呈放射状排列,结构形态正常,无肝细胞坏死、纤维增生以及炎性浸润;模型组大鼠肝细胞索结构紊乱,肝窦界限模糊,大量炎症细胞浸润,肝细胞结构被破坏,并形成大量纤维结缔组织;秋水仙碱组及三仁汤低、中、高剂量组大鼠肝脏炎症浸润较模型组呈现不同程度减少,肝细胞结构形态相对正常,肝细胞变性坏死减轻,肝纤维结缔组织减少。见图1。
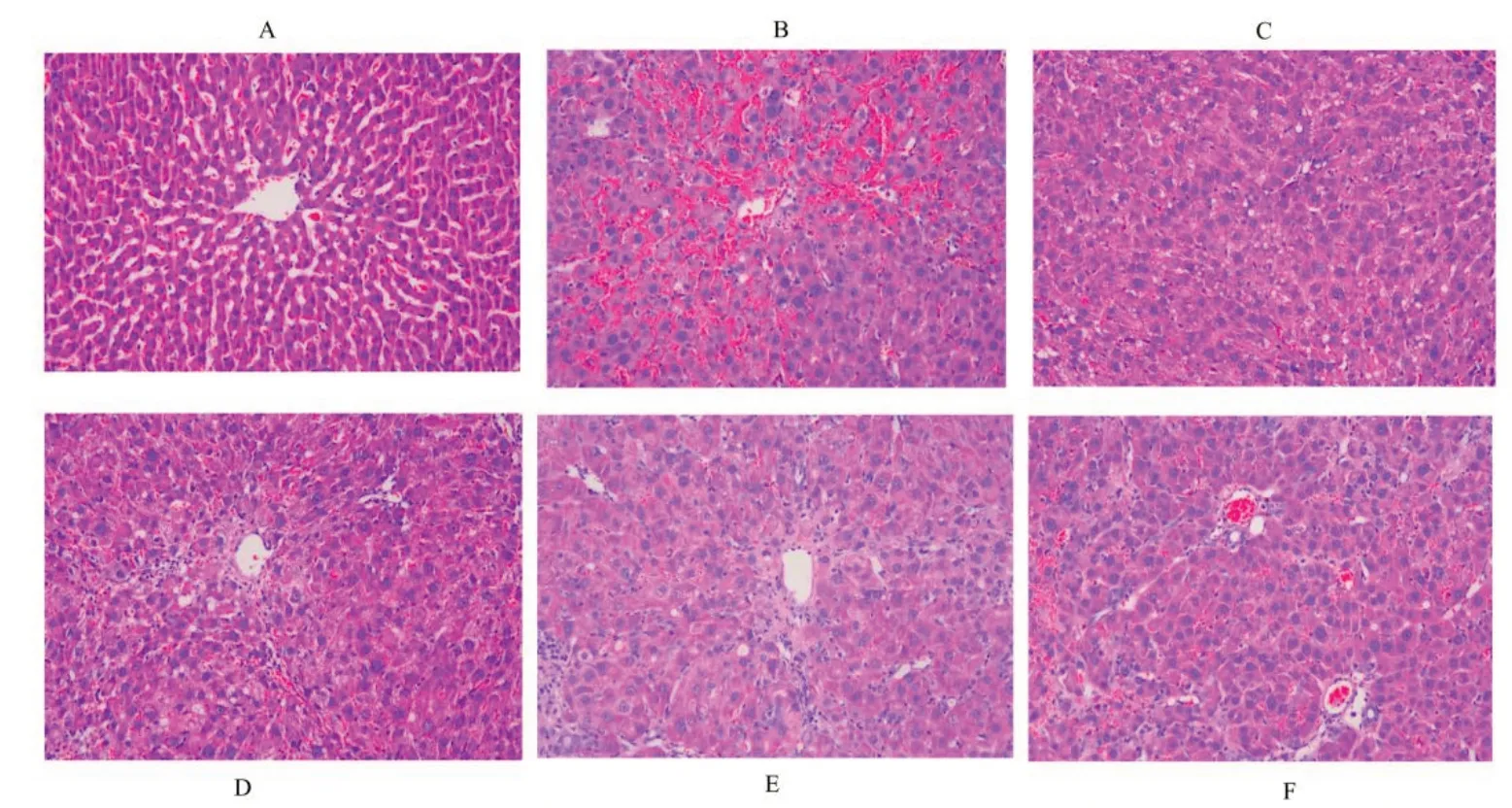
图1 各组大鼠肝脏HE染色(×200)
3.2.2 Masson 染色结果 正常组肝脏形态结构正常,未见有明显纤维组织增生及肝小叶形成;模型组可见大量增生性胶原纤维,肝小叶结构被严重破坏,假小叶形成;秋水仙碱组与三仁汤低、中、高剂量组中,可见纤维性增生较模型组有所减少,纤维间隔较模型组缩小,而疗效可见秋水仙碱组>三仁汤低剂量组>三仁汤中剂量组>三仁汤高剂量组。见图2。
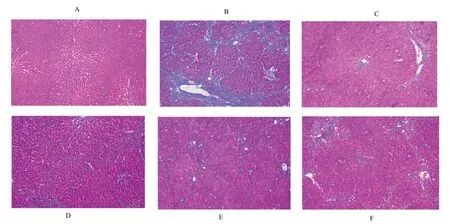
图2 大鼠肝组织Masson染色(×100)
3.3 三仁汤对大鼠血清IL-1β、IL-6、IL-10、TNFα、PDGF-BB的影响 与正常组比较,模型组IL-1β水平显著升高,具有统计学差异(P<0.05)。与模型组比较,秋水仙碱组及三仁汤低、中剂量组的IL-1β 水平明显降低,具有统计学差异(P<0.05)。与正常组比较,模型组IL-6 水平显著升高,具有统计学差异(P<0.05)。与模型组比较,秋水仙碱组及三仁汤低、中、高剂量组的IL-6水平显著降低,差异均具有统计学意义(P<0.05)。与正常组比较,模型组IL-10 水平显著降低,具有统计学差异(P<0.05);与模型组比较,三仁汤高剂量组的IL-10水平显著升高(P<0.05)。见表2。
表2 三仁汤对肝纤维化大鼠IL-1β、IL-6、IL-10水平的影响(pg/mL,± s)
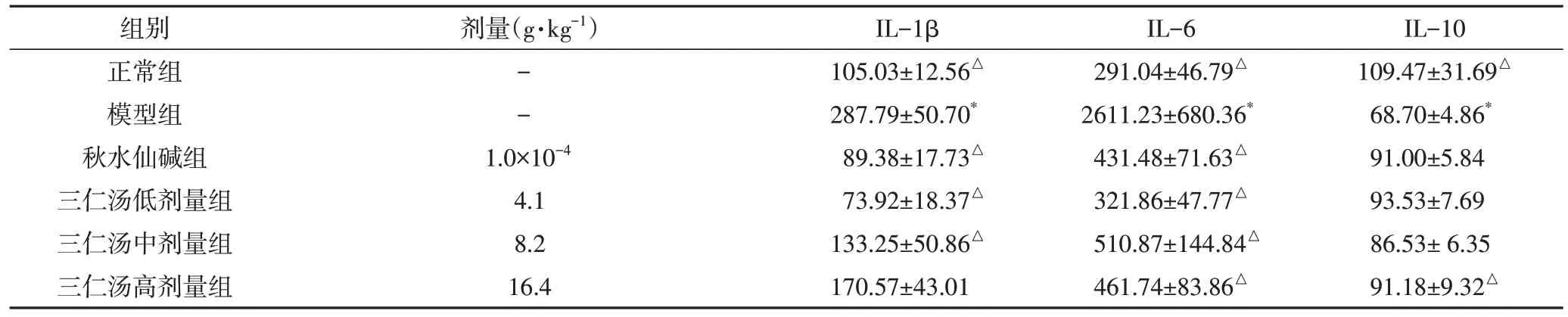
表2 三仁汤对肝纤维化大鼠IL-1β、IL-6、IL-10水平的影响(pg/mL,± s)
注:与正常组比较,*P<0.05;与模型组比较,△P<0.05
组别正常组模型组秋水仙碱组三仁汤低剂量组三仁汤中剂量组三仁汤高剂量组剂量(g·kg-1)--IL-10 109.47±31.69△68.70±4.86*91.00±5.84 93.53±7.69 86.53± 6.35 91.18±9.32△1.0×10-4 4.1 8.2 16.4 IL-1β 105.03±12.56△287.79±50.70*89.38±17.73△73.92±18.37△133.25±50.86△170.57±43.01 IL-6 291.04±46.79△2611.23±680.36*431.48±71.63△321.86±47.77△510.87±144.84△461.74±83.86△
与正常组比较,模型组的TNF-α、PDGF-BB 水平显著升高,具有统计学差异(P<0.001 或P<0.05)。与模型组比较,三仁汤低剂量组的TNF-α 水平显著降低,秋水仙碱组以及三仁汤低、中、高剂量组的PDGF-BB 水平亦显著降低,差异均有统计学意义(P<0.001 或P<0.01)。三仁汤低剂量组的TNF-α 水平以及三仁汤低、中、高剂量组的PDGF-BB水平均与正常组相当,差异无统计学意义(P>0.05)。见表3。
表3 三仁汤对肝纤维化大鼠TNF-α、PDGF水平的影响(pg/mL,± s)

表3 三仁汤对肝纤维化大鼠TNF-α、PDGF水平的影响(pg/mL,± s)
注:与正常组比较,*P<0.05,**P<0.01,***P<0.001;与模型组比较,△P<0.05,△△P<0.01,△△△P<0.001
PDGF-BB 4814.32±479.31△6208.82±382.29*3303.95±361.72*△△△4446.40±423.31△△4583.72±270.03△△4097.38±359.29△△△组别正常组模型组秋水仙碱组三仁汤低剂量组三仁汤中剂量组三仁汤高剂量组剂量(g·kg-1)--1.0×10-4 4.1 8.2 16.4 TNF-α 20.08±1.96△△△29.20±0.96***28.03±1.08**21.47±0.53△△25.64±1.69*31.85±2.23***
4 讨论
肝纤维化(hepatic fibrosis,HF)是肝病的一种常见的病理过程,是肝组织在受损后修复及愈合的过程中产生的,其表现为细胞外基质(ECM)的异常沉淀[10]。研究[11]表明,在纤维化过程中,不同免疫细胞和信号通路的激活,以及几种炎症介质的释放,驱动肝星状细胞(HSC)激活,引起细胞外基质(ECM)产生肌成纤维细胞,大量的ECM 积累会引起肝功能异常,如不及时干预最终可发展为肝硬化或肝癌。
血小板衍生生长因子(PDGF)由血小板、巨噬细胞、肌成纤维细胞和HSC 产生,是促进肝星状细胞活化最强有丝分裂的一种生长因子。在其几种亚型中,PDGF-BB 与HSC 活化关系最为密切。相关研究表明,慢性乙型病毒性肝炎患者血清中PDGF-BB 水平与疾病严重程度成正相关[12-14]。An S Y 等[15]研究发现,IL-6 和IL-1 是肝病中具有代表性的关键细胞因子,具有促炎和抗炎特性,其中IL-6 是与各种肝脏损伤相关的伤口愈合和组织再生过程中的主要调节因子,而IL-1细胞因子可激活肥大细胞(MCs)以分泌炎症介质。IL-1 刺激肝脏产生炎症反应,促进HSC 活化、增生,抑制ECM的降解,进一步启动和加速HF的发生、发展[16]。赵鹏等[17]报道,IL-1β、IL-6 和TNF-α在非酒精性脂肪性肝病的初期会加重肝脏的脂质聚积,过度的脂质聚积可通过脂毒性引发肝细胞损伤,从而加重肝脏中炎性细胞的激活与浸润,引发肝脏炎症,之后通过促进肝脏星状细胞的活化使疾病进一步发展为肝纤维化及肝硬化。Yao 等[18]研究得出,晚期纤维化患者IL-1β 和TNF-α 增加,并且IL-1β 还可以通过刺激人肝星形细胞(LX-2细胞)中结缔组织生长因子和PDGF的表达来诱导促纤维化级联反应。有研究指出,在急性炎症和伤口愈合的早期阶段,IL-10具有抗炎和抗纤维化作用,其可以通过自分泌或旁分泌机制抑制树突状细胞的抗原传递,抑制巨噬细胞活化和浸润到损伤部位的病理性改变,并抑制或者减少促炎介质的释放,从而达到对肝的保护作用[19,20]。亦有研究[21]发现IL-10 可以通过抑制细胞增殖,诱导细胞周期停滞,增加SA-β-Gal活性,增强衰老标志物蛋白p53 和p21 的表达来诱导活化HSC 的衰老,以减轻大鼠肝纤维化。
肝脏的慢性炎症反应可导致异常的伤口愈合反应,形成纤维瘢痕,破坏肝脏结构。肝纤维化在一些阶段是一个可逆的过程,去除纤维化反应因子有助于纤维化的消退[22]。去除致病因子时,临床和实验性肝纤维化会消退,这与消除这些活化的肌成纤维细胞和纤维瘢痕的再吸收有关[23]。因此,阻止或延缓肝纤维化的进一步发展,对临床防治肝硬化或肝癌具有重要意义。对于肝纤维化,西药治疗虽然可以清除炎症反应,有效降低胶原蛋白表达,调节人体细胞免疫分泌,减少HSC 的不断增生与激活,但作用靶点单一,难以同时多环节起效,而中药成分复杂,可多靶点起调控作用,在临床抗肝纤维化治疗中效果显著[24,25]。
肝纤维化是现代医学病理形态学概念,中医将其归属于“癥积”“胁痛”“瘀血”“鼓胀”等疾病范畴[26]。肝纤维化病位在肝,病因病机主要为湿热之邪入侵,蕴积肝胆,湿性胶着,缠绵难愈,导致肝胆疏泄不利,日久成瘀,继而发病[27,28]。文彬[29]等认为湿热内侵缠绵是导致肝纤维化形成的启动因子和关键病机之一。李鲜教授[30]提出痰瘀热毒凝结肝脏,日久而成肝纤维化者,可予三仁汤类方合下瘀血汤加减以清热祛湿化痰开其路,使痰湿消,瘀血散。吕文良教授[31]也提出在治疗慢性乙型肝炎时,应将清热利湿、祛邪解毒贯穿疾病治疗的始终。程志琴等[32]研究发现,加味三仁汤联合恩替卡韦治疗代偿期乙肝肝硬化患者疗效较好,可抑制肝纤维化和HBV-DNA 复制,提高患者免疫功能。赵玲等[33]认为应用化湿法治疗慢性乙型肝炎的机理包括3 个方面:首先,抑制病毒复制;其次,护肝、促进损伤的肝细胞恢复;最后,调节机体的免疫功能。综上可见,肝纤维化的防治当以疏肝理气化湿、健脾运气化湿之法调畅气机,气行则湿自化,瘀自散[34]。
本实验提示三仁汤可能主要通过下调IL-1β、IL-6、TNF-α、PDGF-BB,上调IL-10,有效改善肝脏的炎症反应,缓解肝损伤。观察大鼠肝重、肝体比后可见,三仁汤低、中、高剂量组及秋水仙碱组均较模型组得到不同程度的改善。并且根据以上实验观察,总体来说三仁汤低、中、高剂量组对于肝纤维化大鼠的病理形态及炎症水平均有一定的改善效果。考虑此次实验只进行了组织病理形态观察及ELISA定量分析,而中药成分复杂,可多靶点起调控作用,后续可在mRNA 及蛋白定性分析层面进一步观察三仁汤不同浓度之间对相应炎症指标水平影响的区别。
综上所述,三仁汤低、中、高剂量及秋水仙碱均可以减少成纤维细胞增殖,减少胶原纤维沉积,其可能主要通过降低IL-1β、IL-6、TNF-α、PDGF-BB 表达水平,并上调IL-10 表达水平,从而减少炎症反应,改善肝纤维化程度,在一定程度上可以延缓肝纤维化的进一步发展,但具体作用机制仍需要进一步全面系统的探析。
