长爪沙鼠不同感音神经性耳聋模型的建立及比较
2024-03-28宋丹丹桂飞汪海燕胡金池黄瑾杨磊
宋丹丹 桂飞 汪海燕 胡金池 黄瑾 杨磊


摘要:目的 利用不同的耳毒性藥物建立长爪沙鼠感音神经性耳聋模型,并对3种模型进行比较分析,为感音神经性耳聋的研究提供精准的动物模型。方法 选择长爪沙鼠,建立硫酸卡那霉素和呋塞米联用(KM+Fur)、新霉素(Neo)及哇巴因(Oua)3种耳毒性药物的感音神经性耳聋模型,通过听性脑干反应(ABR)和耳蜗组织形态学检测,比较分析不同耳毒性药物的损伤特点。结果 KM+Fur造模后,与对照组(14.00±1.80)相比,该组(71.00±5.26)长爪沙鼠的听力阈值显著上升,耳蜗HCs大量损伤,而SGNs无明显损伤;Neo造模后,与对照组相比,40 mmol·L-1 Neo仅影响沙鼠高频32 kHz时听力阈值(60.00±8.66),无明显的组织学改变;而100 mmol·L-1 Neo组的沙鼠各频率听力阈值均显著上升,且耳蜗HCs及SGNs均严重受损;Oua造模后,1 mmol·L-1 Oua 和10 mmol·L-1 Oua均可引起沙鼠各频率听力阈值显著上升,但损伤范围不同,10 mmol·L-1 Oua使HCs和SGNs均严重受损,而1 mmol·L-1 Oua仅造成耳蜗SGNs损伤。结论 利用KM+Fur可建立长爪沙鼠HCs特异性受损的感音神经性耳聋模型;40 mmol·L-1 Neo可建立高频区听功能损伤的感音神经性耳聋模型;利用100 mmol·L-1 Neo和10 mmol·L-1 Oua可以建立长爪沙鼠HCs和SGNs均受损的感音神经性耳聋模型;利用1 mmol·L-1 Oua可以建立长爪沙鼠耳蜗SGNs特异性受损的耳聋模型。
关键词:感音神经性耳聋;长爪沙鼠;动物模型;耳毒性药物
中图分类号:R764中图分类号文献标志码:A文献标识码
Establishment and comparison of sensorineural deafness models in Mongolian gerbils
SONG Dandan1, 2,GUI Fei2,WANG Haiyan1,HU Jinchi2,HUANG Jin2,YANG Lei1, 2*
(1 School of Public Health, Hangzhou Normal University,Hangzhou,Zhejiang 311121, China;
2 School of Medicine, Shihezi University,Shihezi, Xinjiang 832000, China)
Abstract: Objective Different ototoxic drugs were used to establish the model of sensorineural deafness in Mongolian gerbils, and the three models were compared to provide accurate animal models for the study of sensorineural deafness. Methods Mongolian gerbils model of sensorineural deafness was established by kanamycin sulfate and furosemide (KM+Fur), neomycin (Neo) and Ouabain (Oua), ABR auditory function and cochlear tissue morphological test were examined to compare and analyze the damage characteristics of different ototoxic drugs. Results After KM+Fur modeling, compared with the control group (14.00±1.80), the hearing threshold of Mongolian gerbils in this group (71.00±5.26) was significantly increased, and the cochlear HCs, while SGNs were not significantly damaged. After Neo modeling, 40 mmol·L-1 Neo only affected the hearing threshold (60.00±8.66) at high frequency 32 kHz, and had no obvious histological changes. n the 100 mmol·L-1 Neo group, the hearing thresholds of all frequencies were significantly increased, and the cochlear HCs and SGNs were severely damaged. After the modeling of Oua, 1 mmol·L-1 Oua and 10 mmol·L-1 Oua could significantly increase the hearing thresholds of all frequencies in gerbils, but the damage ranges were different. 10 mmol·L-1 Oua severely damaged HCs and SGNs, while 1 mmol·L-1 Oua only damaged cochlear SGNs. Conclusion KM+Fur can be used to establish sensorineural deafness model with specific damage of HCs in gerbils. 40 mmol·L-1 Neo can establish sensorineural deafness model with high frequency hearing impairment. Using 100 mmol·L-1 Neo and 10 mmol·L-1 Oua, the sensorineural hearing loss model of gerbils with impaired hair cells and spiral ganglion neurons was established. Deafness model with cochlear spiral ganglion neurons specific impairment of gerbils cochlea with 1 mmol·L-1 Oua was established
Key words: sensorineural deafness;Mongolian gerbil;animal model;ototoxic drugs
0 引言
耳聋是临床上最常见的致残性疾病之一,其中感音神经性听力损失占耳聋的绝大多数[1]。实验动物疾病模型是开展其各项基础和临床应用研究必不可少的实验工具,而选择并建立精准的耳聋实验模型对感音神经性耳聋的研究至关重要。
在各种感音神经性耳聋动物模型中,耳毒性药物所致的动物模型较噪声暴露、基因突变等造模更常用,且药物剂量可控,建立的模型更稳定[2]。药物诱导耳聋的方法有许多,例如新霉素(neomycin,Neo)或哇巴因(ouabain,Oua)的圆窗局部给药[3-4],以及硫酸卡那霉素(kanamycin sulfates, KM)、呋塞米(furosemide, Fur)的联用全身给药[5-6]等。不同药物的造模原理、给药方式及浓度等,所造成的损伤程度、损伤范围有较大差异。
关于长爪沙鼠在耳聋模型中的应用鲜见报道,本研究选择长爪沙鼠采用3种常用的耳毒性药物造模,包括一种全身给药方式(硫酸卡那霉素和呋塞米联用)的和两种局部给药方式(新霉素和哇巴因分别经圆窗给药),建立不同的急性感音神经性耳聋模型;通过观察长爪沙鼠的听功能,以及检测耳蜗毛细胞(hair cells, HCs)和螺旋神经节细胞(spiral ganglion neurons, SGNs)的组织形态学变化,比较分析不同耳毒性药物的损伤特点,为研究感音神经性耳聋提供精准的实验动物模型。
1 材料与方法
1.1 实验动物饲养
本实验选取70只2~3月龄健康的长爪沙鼠,雌雄各半。所有动物实验均符合实验动物福利伦理,饲养在杭州师范大学实验动物中心屏障系统隔离器中,环境温度20~26℃,相对湿度40%~70%,光照条件12/12h明暗交替,动物自由采食、饮水。使用许可证:SYXK(浙)2020-0026。
1.2 模型的建立
实验前ABR听功能检测显示其听力均正常,耳廓反应灵敏,外耳道通畅。剪脚趾标记,随机分为对照组、硫酸卡那霉素和呋塞米联用组(KM+Fur)、新霉素(Neo)40mmol·L-1和100mmol·L-1两组、哇巴因(Oua)1mmol·L-1和10mmol·L-1两组,每组10只。
本研究造模使用的3种耳毒性药物(KM+Fur、Neo和Oua)购自Sigma公司,分别采用全身给药和局部给药的方式,具体操作如下。
对于KM+Fur的全身给药,首先皮下注射KM(1000 mg·kg-1),30 min后腹腔注射Fur(500 mg·kg-1)。给药后观察动物状态,并放回笼内正常饲养。
对于Neo或Oua的经圆窗局部给药,先使用戊巴比妥钠(上海上药新亚药业有限公司),按动物体重进行麻醉,然后在耳背部剔除毛发并擦拭酒精。皮肤打开一个开口,钝性分离肌肉和脂肪组织,暴露听泡。接着,在听泡上打一个小孔并顺着开孔方向找到圆窗的位置。将药物缓慢滴注于圆窗膜上,每耳20μL,分4次给药,15 min·次-1,给药完成后,用明胶海绵填塞创口后缝合肌肉和皮肤,手术过程中置于37 ℃加热台上(苏金坛医疗器械厂)孵育,待苏醒后放回笼内饲养。
1.3 听功能检测
本实验使用听觉电生理工作站(美国TDT公司RZ6)来检测动物的听力功能。首先给动物注射戊巴比妥钠进行麻醉,并将其放置在保持体温的加热垫上。随后将记录电极固定在动物颅顶处,接地电极固定在对侧耳部乳突处下。外置耳声发射器置于待测耳一侧,距离外耳道约10 cm的位置。在检测电阻抗后,使用TDT RZ6系统软件进行听力阈值检测试验。通过click/tone burst 刺激,采用20次·秒-1的频率,扫描时间为10ms,滤波范围为100~3 000 Hz,叠加次数为1 024次,测量的频率依次为2 kHz、4 kHz、8 kHz、16 kHz和32 kHz。刺激声强从90 dBSPL开始逐渐递减,直到特征性的脑电波消失,记录该波对应的声音强度作为该动物的听力阈值(长爪沙鼠为Ⅱ波)。KM+Fur组动物使用click刺激检测听力阈值,Neo和Oua组动物使用tone burst刺激检测听力阈值。听力阈值检测在标准隔音室内完成以保证结果的准确性。
1.4 耳蜗样本的制备
实验结束后,安乐死各组长爪沙鼠,然后快速取出耳蜗。在解剖显微镜(德国卡尔蔡司公司)下,去除残留的肌肉和血液组织,并在蜗尖处钻孔,注入1~2 mL的4% pH 7.4多聚甲醛。将耳蜗组织样品放在4℃下固定过夜,随后使用0.5 mol·L-1 PH 7.0的EDTA-Na2常温脱钙3~4 d后,冲洗洁净的耳蜗组织,再经过15%、30%蔗糖中梯度脱水。将处理后的样品用OTC胶进行包埋,使用冰冻切片机(美国 Thermo 公司)将组织切成片厚12 μm的样本,再使用载玻片取片,置于-80℃冰箱进行保存,待检测。此外,取部分耳蜗组织,脱钙后,取出基底膜进行铺片。此样品用于免疫荧光检测。
1.5 免疫荧光染色
取出耳蜗切片样本,首先使用1×PBS清洗3次、15 min·次-1,然后使用10% 马血清+0.03% 皂苷进行封闭1h。随后加入购自Abcam公司的Myo7a和Tuj1/NF200一抗4℃ 冰箱放置过夜。次日,使用0.1% PBST清洗4次、 2 h·次-1。加入购自Invitrogen公司的山羊抗兔 Alex Fluro 488和山羊抗鼠 Alex Fluro 568二抗常温孵育2h,随后使用1×PBS清洗3次、15 min·次-1。最后用封片剂封片固定。
1.6 统计学分析
数据运用SPSS statistics 22及Graphpad prism软件分析处理,采用配对样本t检测,分析各组数据之间的差异,P<0.05为具有显著性差异,P<0.01為具有极显著性差异。
2 结果
2.1 硫酸卡那霉素和呋塞米联用(KM+Fur)对长爪沙鼠听功能的影响
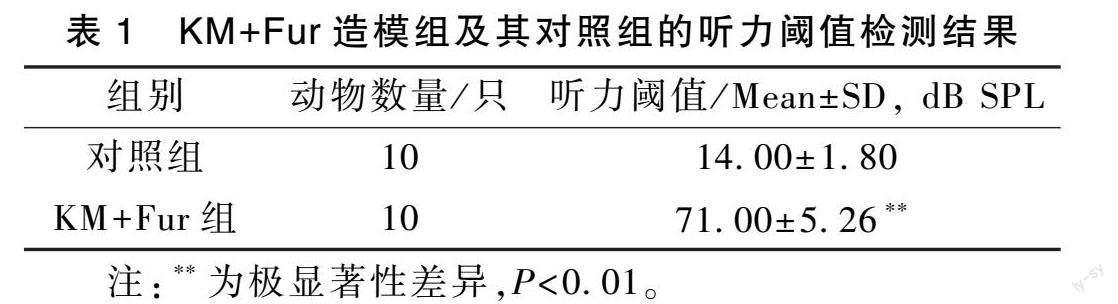
选用听功能正常的长爪沙鼠,利用KM+Fur造模2周后,ABR听功能检测结果显示,KM+Fur组听力阈值为71.00±5.26 dB SPL,较对照组(14.00±1.80 dB SPL)显著升高(P<0.01)(表1,图1)。
2.2 硫酸卡那霉素和呋塞米联用(KM+Fur)对长爪沙鼠组织形态学的影响
KM+Fur造模及其对照组的沙鼠听功能检测后,耳蜗组织免疫荧光结果显示:对照组HCs形态完整,包括一层内毛细胞(inner hair cells, IHC)和三层外毛细胞(outer hair cells, OHC);损伤组的长爪沙鼠耳蜗IHC和OHC均出现严重丢失,如图2绿色方框内所示,然而SGNs则几乎没有受损,如图2红色方框内所示。说明,KM+Fur可造成长爪沙鼠耳蜗HCs严重受损,从而导致听力阈值上升。
组织形态学检测结果,各组红色方框的局部放大图内为SGNs(Tuj1),各组绿色方框的局部放大图内为HCs(Myo7a)所在位置,包括一层IHC和三层OHC;白色箭头为损伤后残存的HCs,bar=50 μm;柱状图为对照组和KM+Fur组SGNs数量统计结果。图2 硫酸卡那霉素和呋塞米联用对长爪沙鼠组织形态学的影响
2.3 新霉素(Neo)对长爪沙鼠听功能的影响
选取听功能正常的长爪沙鼠,使用Neo造模2周,ABR听功能检测结果显示,与对照组相比,40mmol·L-1 Neo组仅在32 kHz时听力阈值显著上升,为 60.00±8.66 dB SPL(P<0.05);100mmol·L-1 Neo组听力阈值在2 kHz、4 kHz、8 kHz、16 kHz、32 kHz时均显著升高,依次为57.50±21.88、45.00±23.30、55.00±22.04、62.50±13.89、80.00±10.69(P<0.01)(图3,表2)。
2.4 新霉素(Neo)对长爪沙鼠组织形态学的影响
Neo造模组及对照组的沙鼠听功能检测结束,耳蜗组织形态学结果显示,与对照组相比,40mmol·L-1 Neo组耳蜗HCs、SGNs均未见明显损伤,仅高频区听力阈值显著升高。100mmol·L-1 Neo组耳蜗组织免疫荧光结果显示,IHC和OHC均出现一定程度的损伤,图4绿色方框所示;尽管SGNs数量没有明显变化,但出现明显的固缩变性,图4红色方框所示。
2.5 哇巴因(Oua)对长爪沙鼠的听功能的影响
选取听功能正常的长爪沙鼠,利用Oua造模2周后,ABR听功能检测结果显示,与对照组相比,1mmol·L-1 Oua 组在2、4、8、16、32 kHz各个频率下听力阈值均显著上升,依次为37.78±8.33、27.78±9.72、44.44±8.82、58.89±18.33、84.44±7.26;10mmol·L-1 Oua 组同样在2、4、8、16、32 kHz各个频率下听力阈值均显著上升,依次为33.33±10.33、26.67±5.16、50.00±0.00、70.00±8.94、90.00±0.00,(P<0.01);且高频区听力的损伤较1mmol·L-1 Oua组更为严重(表3,图5)。
组织形态学检测结果,各组红色方框的局部放大图内为SGNs(NF200),各组绿色方框的局部放大图内为HCs(Myo7a)所在位置,包括一层IHC和三层OHC,bar=50 μm;柱状图为对照组和Neo组SGNs数量统计结果。图4 不同浓度Neo造模对长爪沙鼠组织形态学的影响
2.6 哇巴因(Oua)对长爪沙鼠的组织形态学的影响
Oua造模组的听功能检测结束后,耳蜗组织免疫荧光结果显示,1mmol·L-1 Oua组耳蜗SGNs严重受损,而HCs几乎未见损伤,见图6。
为进一步确证HCs是否无明显损伤,取对照组和1mmol·L-1 Oua组基底膜进行免疫荧光检测,结果显示IHC和OHC均未见损伤,与耳蜗冰冻切片检测结果一致(图7)。
然而,10mmol·L-1 Oua组除SGNs出现严重损伤,图6白色箭头所指,IHC和OHC均出现一定程度的缺失,其中OHC损伤更为严重,如图6中绿色方框所示。
组织形态学检测结果,各组红色方框的局部放大图内为SGNs(NF200),各组绿色方框的局部放大图内为HCs(Myo7a)所在位置,包括一层IHC和三层OHC;白色箭头为残存的SGNs,bar=50 μm;柱状图为对照组和Oua组SGNs数量统计结果。
2.7 3种耳毒性药物建模的结果比较
从听功能的角度观察,3种耳毒性药物均可以造成各频率听力阈值显著升高,仅40mmol·L-1 Neo影响高频区的听功能。从组织形态学的角度观察,KM+Fur 特异性损伤HCs,而SGNs无明显损伤;1mmol·L-1 Oua特异性损伤SGNs,而HCs无明显损伤(表4)。
3 讨论
本研究选择长爪沙鼠,建立了KM+Fur、Neo和Oua 3种作用机制各异,给药方式不同的药物感音神经性耳聋模型,通过听功能检测、耳蜗毛细胞和螺旋神经节的观察,比较分析了各种模型各自的损伤特点,为感音神经性耳聋的研究提供了比较精准的感音神经性耳聋模型。
动物的选择在动物模型的建立中至关重要,针对感音神经性耳聋的研究,国内外实验动物模型主要集中大鼠、小鼠、豚鼠等啮齿类动物[2,5-6],而关于长爪沙鼠在耳聋模型中的研究鲜见报道。小鼠作为最常用的实验动物,由于个体较小,在耳蜗局部给药时,操作难度较大;豚鼠药物造模死亡率高;长爪沙鼠对于声音敏感度高,且听泡较大,便于局部给药,是耳聋研究的理想模式动物[7]。因此本研究选择长爪沙鼠建立感音神經性耳聋模型。
用于建立耳聋模型的耳毒性药物有很多,包括氨基糖苷类抗生素[8]、强心苷类药物[9]、卡铂[10]、顺铂[11]等。本研究根据作用机制和给药方式,选择3种常用的耳毒性药物(KM+Fur、Neo以及Oua)造模。
硫酸卡那霉素和新霉素是氨基糖苷类抗生素,由于其永久性听力损失的不良反应是,被广泛应用于建立感音神经性耳聋模型。研究表明硫酸卡那霉素的耳毒性主要针对耳蜗HCs,与呋塞米联用可以增强耳毒性[12-13],因此本研究选择KM+Fur,通过全身给药的方式建立感音神经性耳聋模型。
而全身给药的新霉素会产生很强的毒性作用[10]。故本研究是选择新霉素通过耳蜗圆窗给药进行造模。为更系统的比较分析不同浓度的Neo对听功能和组织形态学的影响,本研究分别选取40mmol·L-1 Neo和100mmol·L-1 Neo 2个浓度组。
哇巴因作为一种强心苷,被广泛用于建立耳蜗SGNs特异性损伤的动物模型[14]。为全面比较Oua对耳蜗受损程度的影响,实验中设置2个浓度组,分别为1mmol·L-1 Oua组和10mmol·L-1 Oua组,通过耳蜗圆窗给药进行造模。
3种模型的检测结果,综合比较发现:1000 mg·kg-1 KM和500 mg·kg-1 Fur联用特异性损伤HCs,且全身给药方式简单无创,为开展HCs损伤型感音神经性耳聋研究的首选;40mmol·L-1 Neo仅造成高频区的听功能异常,却无明显组织形态改变,故可用于高频区的听功能异常的感音神经性耳聋的研究;100mmol·L-1 Neo和10mmol·L-1 Oua可以造成HCs和SGNs均受损,可用于HCs和SGNs广泛损伤的感音神经性耳聋的研究;1mmol·L-1 Oua可以造成耳蜗SGNs特异性受损,为开展SGNs损伤型感音神经性耳聋研究的最佳选择。
针对不同的研究可选择合适的动物模型,为感音神经性耳聋的基础研究和临床应用提供精准的实验动物模型。
参考文献(References)
[1] SAGI V, STANKOVIC K M. Toward personalized diagnosis and therapy for hearing loss: insights from cochlear implants[J]. Otol Neurotol, 2022, 43(8):E903-E909.
[2] MA L, YI H J, YUAN F Q, et al. An efficient strategy for establishing a model of sensorineural deafness in rats[J]. Neural Regen Res, 2015, 10(10):1683-1689.
[3] SCHMIEDT R A, OKAMURA H O, LANG H, et al. Ouabain application to the round window of the gerbil cochlea: a model of auditory neuropathy and apoptosis[J]. J Assoc Res Otolaryngol, 2002, 3(3):223-233.
[4] ZHANG Q, WU Y, YU Y, et al. Tetrandrine prevents neomycin-induced ototoxicity by promoting steroid biosynthesis[J]. Front Bioeng Biotechnol, 2022, 10:876237.
[5] HUANG J, SUN X, WANG H, et al. Conditional overexpression of neuritin in supporting cells (SCs) mitigates hair cell (HC) damage and induces HC regeneration in the adult mouse cochlea after drug-induced ototoxicity[J]. Hear Res, 2022, 420:108515.
[6] CAMPBELL K C, MARTIN S M, MEECH R P, et al. D-methionine (D-met) significantly reduces kanamycin-induced ototoxicity in pigmented guinea pigs[J]. Int J Audiol 2016, 55(5):273-278.
[7] GLEICH O, SEMMLER P, STRUTZ J. Behavioral auditory thresholds and loss of ribbon synapses at inner hair cells in aged gerbils[J]. Exp Gerontol, 2016, 84:61-70.
[8] MURILLO C S, CONTRERAS J, CEDIEL R, et al. Comparison of different aminoglycoside antibiotic treatments to refine ototoxicity studies in adult mice[J]. Lab Anim 2010, 44(2):124-131.
[9] KURIHARA S, FUJIOKA M, HIRABAYASHI M,et al. Otic organoids containing spiral ganglion neuron-like cells derived from human-induced pluripotent stem cells as a model of drug-induced neuropathy[J]. Stem Cells Transl Med, 2022, 11(3):282-296.
[10] RYBAK L P. Neurochemistry of the peripheral and central auditory system after ototoxic drug exposure: implications for tinnitus[J]. Int Tinnitus J, 2005, 11(1):23-30.
[11] HE J, YIN S, WANG J, et al. Effectiveness of different approaches for establishing cisplatin-induced cochlear lesions in mice[J]. Acta Otolaryngol, 2009, 129(12):1359-1367.
[12] YAMANE H, NAKAI Y, KONISHI K. Furosemide-induced alteration of drug pathway to cochlea[J]. Acta Otolaryngol Suppl, 1988, 447:28-35.
[13] BRUMMETT R E, BROWN R T, HIMES D L. Quantitative relationships of the ototoxic interaction of kanamycin and ethacrynic acid[J]. Arch Otolaryngol, 1979, 105(5):240-246.
[14] FU Y, DING D, WEI L, et al. Ouabain-induced apoptosis in cochlear hair cells and spiral ganglion neurons in vitro[J]. Biomed Res Int, 2013,73:628064.(責任编辑:编辑唐慧)
