小麦条锈菌新菌系CYR34中 CDK5基因的克隆及生物信息学分析
2024-03-28蒋应磊罗超陈诗雯邵欣邹一萍陶飞薛应钰
蒋应磊 罗超 陈诗雯 邵欣 邹一萍 陶飞 薛应钰


摘 要 为探究细胞周期蛋白依赖性激酶(Cyclin-dependent kinase 5,CDK5)在小麦条锈菌(Puccinia striiformis f. sp. tritici)新菌系CYR34夏孢子萌发过程的毒性作用,以天水地区小麦条锈菌新菌系CYR34夏孢子标样为试材,通过RACE克隆CDK5基因并对其进行生物信息学分析,获得长度为706 bp,编码190个氨基酸的cDNA序列。蛋白质结构预测显示,其二级结构主要以α-螺旋为主,且具有典型的STKC激酶结构域。同源性分析显示,CDK5与小麦杆锈菌(Puccinia graminis f. sp. tritici)中的CDK5亲缘关系较近。蛋白质互作数据库预测分析发现,CDK5可以与磷酸核酮糖3-差异构酶、荚膜生物合成蛋白、鸟苷酸激酶、丝氨酸/苏氨酸特异性蛋白激酶、16S rRNA 蛋白以及肌苷-5′-单磷酸脱氢酶6个蛋白互作关系;基因时序表达发现在孢子萌发0~6 h时,基因的表达量持续下调,6 h后表现为上调,萌发10 h后为对照的1.2倍,萌发14 h后基因的表达量达趋于平台期,为对照的1.36倍。综上所述,推测细胞周期蛋白依赖性激酶CDK5在小麦条锈菌(CYR34)夏孢子萌发过程中参与了适应环境的信号调控。
关键词 小麦条锈菌; CDK5;基因克隆;生物信息学分析
小麦条锈病是由条形柄锈菌(Puccinia striiformis f. sp. tritici)引起,主要以气流传播的一种真菌性病害,是目前世界上温带地区最具破坏性的小麦病害之一[1]。在1950年,小麦条锈病的发生造成小麦生产损失达到6万t,而1990年和2002年小麦条锈病的发生更甚,造成的损失分别达到了180万t和130万t[2-3]。2020年,小麦条锈病在全国的发病面积为439.52万hm2,同比上年增加1.9倍,实际造成小麦减产2.49亿kg[4]。在中国,小麦条锈病几乎在所有小麦主产区都有过发生,一直都是中国西北、北部和西南部以及长江中下游地区小麦生产的潜在威胁[5-6]。2015年Beddow等[7]使用条锈病发生数据来建立概率蒙特卡罗模拟模型,来分析近几十年来该疾病地理传播的变化,结果显示自1960年以来,条锈病的发生传播显著增加,每年约547万t小麦因感染小麦条锈病而造成损失,相当于每年损失9.79亿美元,使之成为世界上小麦生产出口国最具威胁性的生物灾害。
小麦条锈病的发病“热点”主要集中在甘肃东南部和四川西北部,是小麦条锈病主要越夏区和多样性的发源地[4,8]。在甘肃陇南、天水地区,高山、半山、盆地的垂直海拔(1 100~2 716 m)差异较大,小麦的栽培又呈垂直分布,便产生了对条锈病生长扩展有利的局部小气候,当条件适宜时,小麦条锈病可以在所有产区爆发流行[9]。天水市小麦种植面积广,在高海拔地区,由于交叉栽培早熟冬麦与晚熟冬麦,使小麦条锈菌完整的生活史即可在当地顺利完成,更加有利于它的繁衍和变异[8,10]。刘博等[11]研究发现,小麦条锈菌CYR34小种出现的频率是10.56%,较2014年的频率升高了一倍,代替原本流行的生理小种,逐渐变成在甘肃省流行传播的首位生理小种,其流行程度和传播趋势逐渐加重。与先前报道的CYR32和CYR33这两种快速流行传播的生理小种对比,CYR34小种的毒性、致病性以及寄生能力都更强[12]。新的毒性小种的出现和种群数目的急剧革新,致使小麦条锈菌病原群体结构发生了转变,抗病小麦品种沦为感病品种,最终导致小麦条锈病的爆发和流行。
细胞周期蛋白依赖性激酶(Cyclin-dependent kinase 5,CDK5)是一种蛋白质激酶,在控制细胞分裂和调节转录应答多种胞外和胞内线索中发挥着重要作用,而来自CDK5/Pho85家族的周期蛋白依赖性激酶被认为在包括酵母和人类在内的多种生物体的形态变化中发挥某种功能[13-14]。CDK5不直接参与细胞周期的调节,主要通过磷酸化相应底物来发挥其生理学作用[15]。先前的研究表明,CDK5是一种受脯氨酸影响的蛋白激酶,大多数已知的CDK5底物是细胞骨架元件、信号分子或调节蛋白。CDK5主要与其伴侣分子P25结合,可以增加CDK5激酶稳定性导致CDK5持续激活,且在神经系统中最丰富,使得CDK5被一些神经学家在人类疾病中研究较多[16-17]。目前的研究中CDK5基因在植物真菌病害中仅有少量报道。Castillo等[18]以玉米黑穗病菌(Ustilago maydis)为研究对象,探讨CDK5/Pho85激酶在二型植物病原菌形态发生和毒力中的作用时,发现一个温度敏感的CDK5突变体在限制性温度下会引起细胞壁的形态缺陷,黑穗病菌持续的细胞极性和毒性依赖于CDK5/Pho85家族中一种必要的细胞周期依赖性激酶,并提出CDK5激酶可能在病原真菌感染过程中发挥了重要作用。截至目前,关于细胞周期蛋白依赖性激酶基因 CDK5在小麦条锈菌夏孢子萌发的相關研究尚未报道。
小麦条锈病菌群体的毒性和温敏性,正随着全球变暖的环境而发生变化。而根据目前的研究结果,推测CDK5基因参与了条锈菌的夏孢子的生长繁殖及适应环境等过程,且对条锈菌的毒性也有一定的影响。本文以条锈菌生理小种CYR34为材料,通过对CDK5基因的RACE克隆及生物信息学分析,研究该基因对环境的变化,探索条锈菌群体变异进化规律。
1 材料与方法
1.1 试验材料
1.1.1 供试病原菌 小麦条锈菌34号小种由甘肃省农科院贾秋珍老师馈赠,扩繁后收集新鲜夏孢子,备用。
1.1.2 供试药品及仪器 供试药品:TAE缓冲液,琼脂糖,β-巯基乙醇,无水乙醇,DEPC,无菌水,反转录试剂盒RevertAid First Strand cDNA Synthesis Kit(赛默飞世尔科技有限公司),MicroAmpTM EnduraPlateTM Optical 96-Well Fast Clear Reaction Plates with Barcode(Applied BiosystemsTM公司),MicroAmpTM Optical Adhesive Film(Applied BiosystemsTM公司),SMART○RRACE 5′/3′ Kit Components(北京宝日医生物技术有限公司)。
RNA提取试剂盒:E.Z.N.A.○RPlant RNA Kit(广州飞扬生物工程有限公司)。
供试仪器:实时荧光定量 PCR 仪(美国Thermo Fisher Scientific),水浴锅(北京 HW.SY11-KP1),超净工作台(AIRTECH),灭菌锅(上海申安LDZX-50KBS),漩涡震荡仪(北京USV-1),电热鼓风干燥箱(江苏DGG-9023A), 1.5 mL 离心管电泳仪(北京六一DYY-8C型),超微量分光光度计(德国IMPLEN公司的NanoPhotometer NP 80-Touch),-80 ℃超低温冰箱(北京DW-HL398),H1850R高速台式冷冻R离心机(湖南湘仪实验仪器开发有限公司),凝胶成像系统(UVITECESSENTIRL V6)。
1.2 研究方法
1.2.1 菌种的扩繁与保存 供试的小麦条锈菌是从天水地区分离纯化的CYR34,为恢复其孢子萌发的活性,选取感病品种为‘铭贤169,采用涂抹法将夏孢子接种到感病品种上进行扩繁,涂抹法所采用的夏孢子浓度为30 mg/L。接种后在湿度大于75%的黑暗条件下保湿24 h,次日放到人工气候箱培养,设置气候箱中的温度为15 ℃上下(不超过2 ℃),湿度为70%~85%,光照条件设置为一个循环16 h,光照度为9 000~11 500 lx[19]。大约10~12 d,待大量产孢后,收集备用。
1.2.2 条锈菌总RNA的提取 基于前期优化试验条件将夏孢子做5种处理(Ⅰ:萌发0 h的夏孢子样品;Ⅱ:萌发2 h的夏孢子样品;Ⅲ:萌发 6 h的夏孢子样品;Ⅳ:萌发10 h的夏孢子样品;Ⅴ:萌发14 h的夏孢子样品),之后用RNA提取试剂盒E.Z.N.A. ○RPlant RNA Kit(广州飞扬生物工程有限公司提供)对上述5个处理的夏孢子提取总RNA,将提取后的总RNA保存在-80 ℃的超低温冰箱。
1.2.3 cDNA的合成和RACE克隆 参照Thermo Scientific公司生产供应的cDNA合成试剂盒(RevertAid First Strand cDNA Synthesis Kit),根据其自带试剂说明书的使用方法,对 cDNA的第1链进行生物合成。以转录组测序组装后的EST序列为依据,设计CDK5的RACE引物,以小麦条锈菌(CYR34)萌发10 h的样本为模板进行克隆,RACE克隆反应体系及PCR反应条件按照说明书进行。
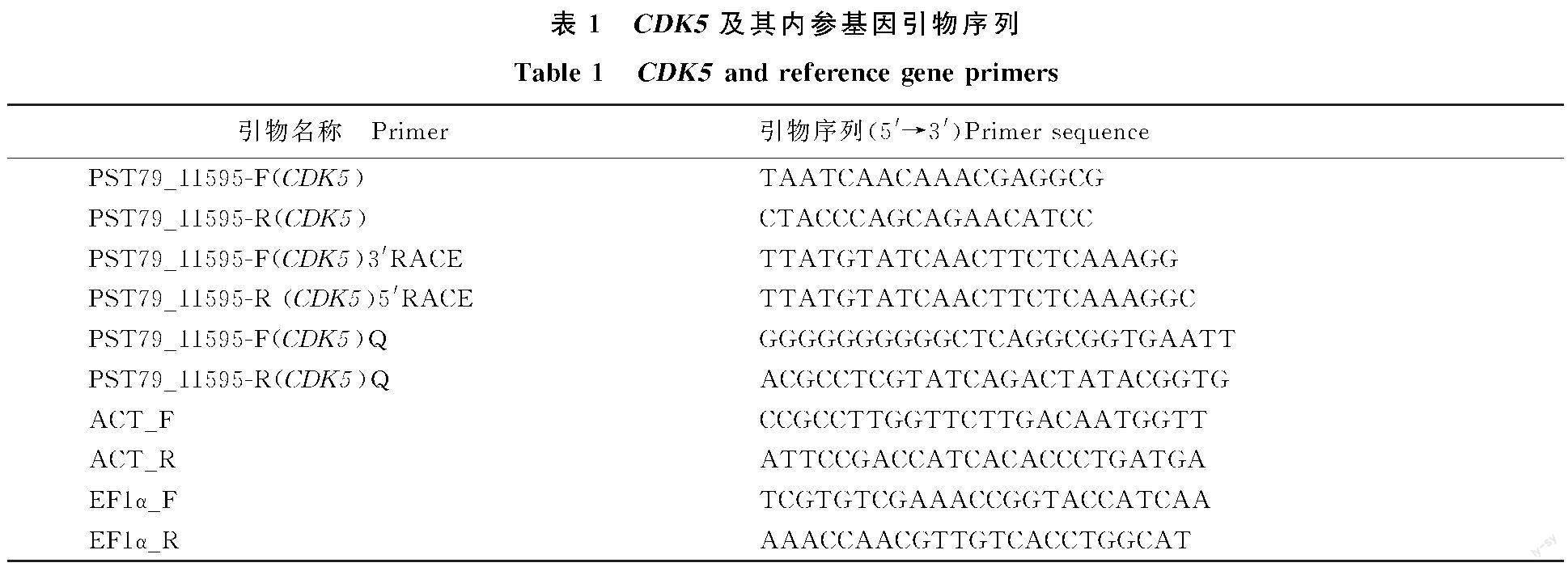
1.2.4 引物的设计与合成 根据Garnica等[20]提供的和孢子萌发有关的 CDK5基因序列,BLAST到小麦条锈菌Pst-78的基因组上,找到对应的基因序列(PST79_11595),通过Primer Premier 5对其进行特异性引物的设计(表1),之后委托北京擎科生物科技有限公司(西安分部)实现引物的合成工作。
1.2.5 系统发育树的构建 为明确CDK5的分类地位及进化情况,利用NCBA Blastn 进行序列比对,选择与其同源的核苷酸及氨基酸序列,采用邻接法(Neighbor joining methed, NJ),bootstrap重复检验次数设置为1 000,在MAGA 5.1 构建系统进化树。
1.2.6 qRT-PCR分析 qRT-PCR分析在iQTM5荧光定量PCR反应仪上进行,反应体系为20 μL:2×SYBR○R Green Pro Taq HS Premix(ROX plus) 10 μL、cDNA 1 μL、F-Primer 0.5 μL、R-Primer 0.5 μL和RNase free water 8 μL。
實时荧光定量PCR的反应条件为:Step 1:95 ℃,30 s;Step 2:95 ℃,5 s;Step 3:50~60 ℃,30 s;Step 4:将Step 2和Step 3循环35次;Step 5:反应结束后,进行数据分析。
数据收集来自3个生物学重复试验,每组至少3次技术重复,阴性对照为不加模板,并选取条锈菌延伸因子基因( EF1α)和肌动蛋白基因(ACT)作为内参基因,以矫正目的基因在小麦条锈菌萌发过程中的真实表达水平,采用2-ΔΔCt法计算目的基因的相对表达量。
1.2.7 生物信息学分析 通过EMBOSS(http://emboss.open-bio.org/wiki/Appdocs)对CDK5基因所编码蛋白质的氨基酸序列进行预测;通过ExPASy(http://web.expasy.org/protparam/)对CDK5基因所编码的氨基酸的类别、数量及其分子质量进行预测;通过SMART(http://smart.embl-heidelberg.de/#)对CDK5基因编码蛋白质的保守结构域进行预测; 通过蛋白互作网络数据库(http://string-db.org/)进行CDK5基因编码的蛋白进行互作预测。
1.2.8 数据分析 数据的处理以及图表制作使用Excel 2019统计软件完成,统计分析使用SAS v8.01完成。在对每一个处理间的差异进行显著性检验时,采用Duncan氏新复极差法检验其显著性。
2 结果与分析
2.1 CDK5基因的RACE克隆及生物信息学分析
2.1.1 CDK5基因的RACE克隆 以小麦条锈菌(CYR34)夏孢子萌发后10 h的样本为模板,提取总RNA后反转录为cDNA,进行CDK5基因的RACE扩增,最终获得cDNA序列的全长为706 bp(图1)。
2.1.2 CDK5编码的氨基酸的类别、数量及其相对分子质量 通过开放阅读框预测(ORF), CDK5 共编码190个氨基酸,蛋白质的分子质量为21.68 ku,等电点(PI)为9.24。其中亮氨酸(Leu)22个(11.60%)、精氨酸(Arg)16个 (8.40%)、缬氨酸(Val)13个(6.80%)和脯氨酸(Pro)12个(6.30%)等(图2)。
2.1.3 CDK5结构域分析 通过SMART结构域预测发现,该蛋白从第3位至287位区间含有典型的STKC激酶结构域,蛋白二级结构预测结果显示,主要以α-螺旋为主(图3)。
2.2 CDK5基因进化树分析
与Nr数据库进行比对之后,发现小麦杆锈菌(Puccinia graminis f. sp. tritici)中的CDK5基因(Gene Bank ID:XP 003321865.2)与本研究克隆的CDK5基因的相似度达到了99%。与紫色菌(Violaceomyces palustris)和红酵母(Rhodotorula diobovata)相比,亲缘关系更为接近的是小麦杆锈菌中的CDK5基因(图4)。
2.3 CDK5基因的蛋白互做网络分析
为了揭示CDK5基因编码蛋白之间的关系,采用蛋白质互作网络数据库(PPIs)进行预测分析。构建的网络有21个蛋白组成,CDK5编号为ESK66431.1,能够与磷酸核酮糖3-差异异构酶(Ribulose-phosphate 3-epimerase)、荚膜生物合成蛋白(Capsular biosynthesis protein)、鸟苷酸激酶(Guanylate kinase)、丝氨酸/苏氨酸特异性蛋白激酶(Serine/threonine-specific protein kinase)、16S rRNA 蛋白和肌苷-5′-单磷酸脱氢酶(Inosine-5′-monophosphate dehydrogenase)6个蛋白之间互作(图5)。
2.4 CDK5基因在CYR-34-8中的时序表达分析
以EF1α和ACT为双内参基因,萌发0 h的夏孢子样本作为对照,通过分析细胞周期蛋白依赖性激酶基因CDK5的时序表达发现,在孢子萌发0~6 h的样本中,基因的表达量表现出明显的下调,萌发6 h后的样品中基因表达量开始上升,萌发10 h后为对照的1.2倍,萌发14 h后基因的表达量达趋于平台期,为对照的1.36倍(图6)。
3 讨 论
随着全球气候变暖,小麦条锈菌耐高温性和毒性变异越显突出[21]。近几年在甘肃省小麦条锈菌群体研究中,CYR34是省内第一流行小种,它具有毒性谱宽、致病性强等特点,在众多文献报道中小麦主栽品种大多数对其已经“丧失”抗性[12,22-23]。
细胞周期蛋白依赖性激酶(CDKs)属于丝氨酸/苏氨酸激酶家族,其家族种类数目较多。CDKs于20世纪80年代在裂殖菌和芽殖酵母中被发现,其与细胞周期密切相关,通过与细胞周期蛋白相互作用,以磷酸化、去磷酸化、泛素化等方式促进细胞周期的运行[24],同时CDKs与癌症、神经退行性疾病等关系密切,因此在哺乳动物乃至人类中被广泛研究[14,25-26]。CDK5属于CDC2/CDK1家族的丝氨酸/苏氨酸激酶,其两侧拥有参与调解的催化结构域,由特定的辅助因子组成如p35和p39和细胞周期蛋白Ⅰ激活[27-29]。在微生物,一些真菌的新陈代谢过程中,都包含蛋白的磷酸化过程,且真菌侵染、繁殖以及信号传导与激酶也可能与磷酸酶存在一定的关联[30]。2015年,在烟草栽培品种红花大金元中细胞周期蛋白依赖性激酶NtCDK8基因成功克隆,该基因含有丝氨酸/苏氨酸蛋白激酶结构域,可以通过磷酸化下游蛋白中的丝氨酸/苏氨酸残基,将信号从胞外转向胞内[31]。本试验克隆获得的小麦条锈菌细胞周期蛋白依赖性激酶基因CDK5,具有典型的STKC激酶结构域,蛋白质互作网络数据库(PPI)预测分析发现,可以与荚膜生物合成蛋白、磷酸核酮糖3-差異构酶、肌苷-5′-单磷酸脱氢酶、丝氨酸/苏氨酸特异性蛋白激酶、鸟苷酸激酶以及16S rRNA 蛋白互作,推测该蛋白的功能实现可能是通过丝氨酸苏氨酸残基磷酸化,从而参与到对逆境的应答反应过程中。
CDK5基因可以与细胞周期蛋白D/E进行结合,并与哺乳动物CDK2和酵母CDC2有60%的序列同源性,该分子高度保守,在有丝分裂后神经元和胶质细胞中广泛存在,且基因的表达量较高,使得分子神经科学家对其产生兴趣,并对它的作用在大脑中枢神经系统的发展做了广泛研究[32-35]。水稻的CDK7基因不仅能够磷酸化水稻的CDKA,还可以磷酸化人类的CDK2,参与细胞周期的调控[36]。本研究中通过分析细胞周期蛋白依赖性激酶CDK5基因的时序表达发现,在孢子萌发0~6 h时,基因的表达量表现出明显下调,6 h后基因表达量有所回升,6~10 h回升较快,10 h后逐渐趋于稳定,14 h表达量达到本研究中的最大值,该基因对环境变化产生了应激反应,推断细胞周期蛋白依赖性激酶基因 CDK5可能参与了小麦条锈菌夏孢子萌发过程中对环境信号的调控。
本研究通过时序表达分析,发现该基因对环境变化产生了应激反应,推测细胞周期蛋白依赖性激酶基因 CDK5响应了夏孢子萌发过程中的信号调控,后续将进行基因功能研究,以便对小麦条锈病的发生和传播做到更加有效的预防和控制。
参考文献 Reference:
[1] WAN A M,CHEN X M,HE Z H.Wheat stripe rust in China[J].Australian Journal of Agricultural Research,2007(58):605-619.
[2] 李振岐,曾士迈.中国小麦锈病[M].北京:中国农业出版社,2002:4.
LI ZH Q,ZENG SH M.Wheat Stripe Rust in China[M].Beijing:China Agriculture Press,2002:4.
[3] 陈万权,康振生,马占鸿,等.中国小麦条锈病综合治理理论与实践[J].中国农业科学,2013,46(20):4254-4262.
CHEN W Q,KANG ZH SH,MA ZH H,et al.Integrated management of wheat stripe rust caused by Puccinia striiformis f.sp.tritici in China[J].Scientia Agricultura Sinica,2013,46(20):4254-4262.
[4] 劉万才,王保通,赵中华,等.我国小麦条锈病历次大流行的历史回顾与对策建议[J].中国植保导刊,2022,42(6):21-27.
LIU W C,WANG B T,ZHAO ZH H,et al.Historical review and countermeasures of wheat stripe rust epidemics in China[J].China Plant Protection,2022,42(6):21-27.
[5] 黄苗苗,陈万权,曹世勤,等.甘肃、青海地区小麦条锈菌监测及群体遗传多样性分析[J].中国农业科学,2020,53(18):3693-3706.
HUANG M M,CHEN W Q,CAO SH Q,et al.Surveillance and genetic diversity analysis of Puccinia striiformis f.sp .tritici in Gansu and Qinghai Provinces[J].Scientia Agricultura Sinica,2020,53(18):3693-3706.
[6] WANG H G,YANG X B,MA Z H.Long-distance spore transport of wheat stripe rust pathogen from Sichuan,Yunnan,and Guizhou in Southwestern China[J].Plant Disease,2010,94(7):873-880.
[7] BEDDOW J M,PARDEY P G CHAI Y,et al.Research investment implications of shifts in the global geography of wheat stripe rust[J].Nature Plants,2015,1(10):1-5.
[8] 康振生,王晓杰,赵 杰,等.小麦条锈菌致病性及其变异研究进展[J].中国农业科学,2015,48(17):158-172.
KANG ZH SH,WANG X J,ZHAO J,et al.Advances in research of pathogenicity and virulence variation of the wheat stripe rust fungus Puccinia striiformis f.sp.tritici[J].Scientia Agricultura Sinica,2015,48(17):158-172.
[9] 王吉庆,陆家兴,刘守俭,等.甘肃地区小麦条锈病菌越夏规律的初步研究[J].植物病理学报,1965,8(1):1-10.
WANG J Q,LU J X,LIU SH J,et al.Preliminary study on the over-summering pattern of wheat stripe rust fungus in Gansu area[J].Acta Phytopathologica Sinica,1965,8(1):1-10.
[10] [ZK(#]安菊棠.甘谷县小麦条锈病越夏区治理的示范模式[J]. 中国植保导刊,2007,27(5):20-21.
AN J T.Demonstration model for management of wheat stripe rust trans-summer zone in Gangu County[J].China Plant Protection,2007,27(5):20-21.
[11] 刘 博,刘太国,章振羽,等.中国小麦条锈菌条中34号的发现及其致病特性[J].植物病理学报,2017,47(5):681-687.
LIU B,LIU T G,ZHANG ZH Y,et al.Discovery and pathogenicity of CYR34,a new RACE of Puccinia striiformis f.sp .tritici in China[J].Acta Phytopathologica Sinica,2017,47(5):681-687.
[12] 贾秋珍,曹世勤,王晓明,等.2017-2018年甘肃省小麦条锈菌生理小种变异监测[J].植物保护,2021,47(2):214-218.
JIA Q ZH,CAO SH Q,WANG X M,et al.Monitoring the variation of physiological RACEs of Puccinia striiformis f.sp. tritici in Gansu province during 2017-2018[J].Plant Protection,2021,47(2):214-218.
[13] MALUMBRES M,BARBACID M.Cyclin-dependent kinases[J].Chemical Reviews,2014,15(6):122.
[14] DHAVAN R,TSAI L H.A decade of CDK5[J].Nature Reviews Molecular Cell Biology,2001,2(10):749-759.
[15] 康 平.TGF-β1调控CDK5表达在人肾系膜细胞细胞外基质沉积中的作用[D].石家庄:河北医科大学,2021.
KANG P.The role of TGF-βl in regulating CDK5 expression in human mesangial extracellular matrix deposition[D].Shijiazhuang:Hebei Medical University,2021.
[16] 杨 培,周 琥,王丽韫,等.胆碱能M受体调控细胞周期蛋白依赖性激酶5及其在敌敌畏诱导SH-SY5Y细胞毒性损伤中的作用[J].中国药理学与毒理学杂志,2020,34(3):179-187.
YANG P,ZHOU H,WANG L Y,et al.Acetyl cholinergic M receptor regulates cyclin dependent kinase 5 and plays pivotal role in DDVP induced cytotoxic injury in SH-SY5Y cells[J].Chinese Journal of Pharmacology and Toxicology,2020,34(3):179-187.
[17] DHALIWALIWALA F A,RAIADHYAKSHA M S.An unusual member of the CDK Family: CDK5[J].Cellular & Molecular Neurobiology,2008,28(3):351-369.
[18] CASTILLO L S,ALVAREZ T I,WEBER I,et al.Sustained cell polarity and virulence in the phytopathogenic fungus ustilago maydis depends on an essential cyclin-dependent kinase from the CDK5/Pho85 family[J].Journal of Cell Science,2007,120(9):1584-1595.
[19] 張永红,黄丽丽,康振生.小麦条锈菌CY32夏孢子萌发研究[J].菌物学报,2006,25(4):656-659.
ZHANG Y H,HUANG L L,KANG ZH SH.Study on germination condition of urediospores of Puccinia striiformis f.sp.tritici[j].Mycosystema,2006,25(4):656-659.
[20] GARNICA D P,UPADHYAYA N M,DODDS P N, et al.Strategies for wheat stripe rust pathogenicity identified by transcriptome sequencing[J]. Public Library of Science One,2013,8(6):e67150.
[21] TAO F,HU Y S,SUC,et al.Revealing differentially expressed genes and identifying effector proteins of Puccinia striiformis f.sp. tritici in response to high-temperature seedling plant resistance of wheat based on transcriptome sequencing[J].mSphere,2020,5(3):e00096-20.
[22] 刘 琦,马泽宇,曾明昊,等.新疆新源县小麦条锈菌生理小种鉴定[J].麦类作物学报,2022,42(1):36-41.
LIU Q,MA Z Y,ZENG M H,et al.Identification of Puccinia striiformis f.sp.tritici physiologica races in Xinyuan County,Xinjiang[J].Journal of Triticeae Crops,2022,42(1):36-41.
[23] 黄 亮,刘太国,刘 博,等.我国197份小麦核心种质资源对小麦条锈菌新小种CYR34的抗性评价[J].植物保护,2019,45(1):148-154.
HUANG L,LIU T G,LIU B,et al.Resistance evaluation of 197 Chinese wheat core germplasms to a new stripe rust RACE,CYR34[J].Plant Protection,2019,45(1):148-154.
[24] 吴向伟.烟草细胞周期蛋白依赖性激酶NtCDK8基因的克隆及功能分析[D].重庆:西南大学,2015.
WU X W.Cloning and functional analysis of cyclin-dependent protein kinases,NtCDK8 from Nicotiana tobacco[D].Chongqing:Southwest University,2015.
[25] HUANG D,PATRECK G,MOFFAT J, et al.MammalianCDK5 is a functional homolog of the budding yeast Pho85 cyclin-dependent protein kinase[J].Proceedings of the National Academy of Sciences of the United States of America,1999,96(25):14445-14450.
[26] BHARDWAJ V K,DAS P,PUROHIT R.Identification and comparison of plant-derived scaffolds as selective CDK5 inhibitors against standard molecules:Insights from umbrella sampling simulations [J].Journal of Molecular Liquids,2022,348:118015-118024.
[27] DAMU T,JEFFERY Y,KI-YOUNG L,et al.An isoform of the neuronal cyclin-dependent kinase 5 (CDK5) activator [J].Journal of Biological Chemistry,1995,270(45),26897-26903.
[28] LI H T,IVANA D,VERNE S C J,et al.P35 is a neural-specific regulatory subunit of cyclin-dependent kinase 5[J].Nature,1994,371(29):419-423.
[29] BRINKKOETTER P T,OLIVIER P,WU J S, et al.Cyclin I activates CDK5 and regulates the expression of Bcl-2 and Bcl-XL in postmitotic mouse cells[J].The Journal of Clinical Investigation,2009,119(10),3089-3101.
[30] DICKMAN M B,YARDEN O.Serine/threonine protein kinases and phosphatases in filamentous fungi[J].Fungal Genetics and Biology,1999,26(2):99-117.
[31] NURSE P,BISSETT Y.Gene required in G1 for commitment to cell cycle and in G2 for control of mitosis in fission yeast[J].Nature,1981,292(5823):558-560.
[32] HELLMICH M R,PANT H C,WADA E,et al.Neuronal cdc2-like kinase:a cdc2-related protein kinase with predominantly neuronal expression[J].Proceedings of the National Academy of Sciences of the United States of America,1992,89(22):10867-10871.
[33] MEYERSON M,ENDERS G H,WU C L,et al.A family of human Cdc2-related protein kinases[J].The Embo Journal,1992,11(8):2909-2917.
[34] PAGLINI G,CACERES A.The role of the CDK5-p35 kinase in neuronal development[J].European Journal of Biochemistry,2001,268(6):1528-1533.
[35] SMITH D S,GREERP L,TASI L H.CDK5 on the brain[J].Cell Growth & Differentiation:the Molecular Biology Journal of the American Association for Cancer Research,2001,12(6):277-283.
[36] 宋 健.水稻細胞周期关键调节基因的全基因组分析及Orysa;DEL1功能的初步鉴定[D].山东泰安:山东农业大学,2008.
SONG J.Genome-wide analysis of core cell cycle genes and function identification of Orysa;DEL1 in Rice[D].Taian:Shandong:Shandong Agricultural University,2008.
Cloning and Bioinformatics Analysis ofCDK5 Gene from
a New Wheat Stripe Rust Strain CYR34
Abstract In this study,we explored the toxic effect of cyclin-dependent kinase 5 (CDK5) on the germination of urediospores from the newly idencified CYR34 rust strain in Tianshui.TheCDK5 gene was cloned ussing RACE (Rapid Amplifiction of cDNA Ends) and analyzed through bioinformatics tools.We successfully obtained a 706 bp cDNA sequence capable of encoding 190 amino acid.The structural prediction of protein showed a predominant α spiral secondary structure,with a characteristic STKC kinase domain.The homolology analysis demonstrated that CDK5 shared a closer relationship with the CDK5 found in Puccinia graminis f.sp. tritici.Moreover,based on the prediction and the analysis of CDK5 protein interaction network using PPIs database,CDK5 was shown to interact with six proteins,including ribose phosphate-3 isomerase,capsule biosynthetic protein,guanylate kinase,serine/threonine-specific protein kinase,16S rRNA protein and inosine-5′-monophosphate dehydrogenase.Furthermore,the gene expression analysis indicated thatCDK5 expression was initially down-regulated during 0-6 hours post germination (hpg) of urediospores,followed by an up-regulated after 6 hpg,reaching a peak at 14 hpg,where was 1.36 times higher than the control.This suggests that CDK5 may paly a role in the regulating environmental signals during the germination of CYR34 urediospores.
Key words Puccinia striiformis f.sp.tritici;CDK5; Gene clone; Bioinformatics analysis
