尖孢镰刀菌侵染枸杞根系的转录组分析
2024-03-28张生懂李捷冯丽丹孙涛张煦李永晖
张生懂 李捷 冯丽丹 孙涛 张煦 李永晖


摘 要 由尖孢镰刀菌引起的根腐病是枸杞种植中的主要病害之一,为探究尖孢镰刀菌侵染枸杞的分子致病机制,并挖掘其关键致病基因,通过尖孢镰刀菌侵染‘宁杞1号枸杞根系,于侵染第7天刮取菌样进行转录组测序分析。结果表明,与纯培养菌株相比,在侵染第7天的尖孢镰刀菌中共发现了1 892个显著差异表达基因,其中上调表达基因1 242个,下调表达基因650个;GO富集分析表明,分子功能分类的跨膜转运蛋白和ATP酶活性以及生物学过程分类的跨膜转运可能在尖孢镰刀菌致病过程中发挥了重要作用;KEGG富集分析表明,鞘脂代谢、过氧化物酶体和ABC转运蛋白是尖孢镰刀菌侵染过程的主要代谢途径。此外,通过对比分析编码碳水化合物酶与植物-病原互作相关基因在尖孢镰刀菌侵染前后的表达量,筛选到10个关键致病候选基因。
关键词 转录组;尖孢镰刀菌;枸杞;差异表达基因;富集分析
枸杞(Lycium barbarum L.)是西北地区一类重要的药食同源型经济作物,其在促进西北地区的经济发展中发挥着举足轻重的作用。但近年来由尖孢镰刀菌为主要病原菌引起的土传真菌性病害——根腐病的广泛传播,造成盛果期枸杞植株的大量死亡[1]。相关研究表明,枸杞根腐病的发病率会随枸杞种植年限的延长而逐年加重,严重时发病率可达50%,给枸杞的种植和生产带来严重的经济损失[2]。加上根腐病的土壤传播性质,以目前的技术手段,很难通过施用杀菌剂对其产生有效防治[3]。
高通量测序技术精确度高,成本较低,已广泛应用于病原和寄主分子互作机制的研究以及功能基因的挖掘[4]。Thatcher等[5]对侵染苜蓿(Medicago sativa L.)的尖孢镰刀菌(Fusarium oxysporum)进行转录组测序分析,初步筛选到10个与致病相关的基因;舒新月等[6]对不同侵染时间点的稻粒黑粉病菌(Tilletia horrida)进行转录组分析,初步解析了稻粒黑粉病菌的致病分子机制;Ding等[7]和丁兆建等[8]通过转录组测序分析发现,MAPK信号通路激酶基因FoBck1、 FoMKK2和FoSlt2可以调控尖孢镰刀菌古巴专化型(Fusarium oxysporum f.sp.cubense)的生理特性和致病性,并在此基础上,对尖孢镰刀菌古巴专化型野生型菌株和FoSlt2敲除突变体菌株进行比较转录组分析,证实基因FoSlt2在调控尖孢镰刀菌古巴专化型的生长发育、细胞壁完整性和致病性方面发挥着重要作用;梁丽琴等[9]也通过转录组分析发现,敲除Argonaute1基因后的尖孢镰刀菌致病相关基因显著下调表达。
目前,对于尖孢镰刀菌在其他植株,如绿豆(Vigna radiata L.)[10]、香蕉(Musa nana Lour.)[11]和苜蓿[5]等方面的研究较多,但在枸杞中的致病性研究较少。因此,为了初步解析尖孢镰刀菌侵染枸杞的分子致病机制,本研究对侵染‘宁杞1号根系7 d的尖孢镰刀菌进行取样,以PDA培养基培养7 d菌株作为对照进行转录组测序分析,并筛选出尖孢镰刀菌在侵染过程中的关键致病基因,为后续功能基因的验证奠定基础。
1 材料与方法
1.1 试验材料
尖孢镰刀菌菌株由甘肃农业大学林木生理生化实验室分离并保存;枸杞根部组织采集自甘肃农业大学经济林实训基地大田栽种的‘宁杞1号植株。
1.2 试验方法
1.2.1 样品制备 将尖孢镰刀菌菌株于PDA固体培养基上活化后,用消毒后的打孔器挑取菌饼于新的PDA固体培养基中,于26 ℃恒温箱培养7 d后,刮取培养基表面的菌丝制成孢子悬浮液。将采集到的根组织用蒸馏水冲洗干净,以消毒后的针刺对枸杞根组织间隔1 cm进行扎孔处理,为尖孢镰刀菌提供侵染途径。将处理后的根组织置于配置好的孢子悬浮液中静置2 min后取出,于培养皿中26 ℃恒温培养,為保持根组织活性,每隔2 d于无菌操作台中向培养皿加入适量无菌水。由前期预试验可知,在尖孢镰刀菌侵染枸杞第7天可取够转录组测序所需样本量,同时PDA培养基上纯培养的菌丝也可长满培养皿。因此,于尖孢镰刀菌侵染第7天刮取枸杞根组织表面的菌丝作为处理组(T),同时以PDA培养基上培养7 d的菌丝作为对照组(CK),各组3个生物学重复,用于后续RNA提取。
1.2.2 样品RNA提取 采用Tri-zol法提取6个 RNA 样品,利用Nanodrop 2 000对所提RNA的浓度和纯度进行检测,以1.0%变性琼脂糖凝胶电泳检测RNA 完整性,并保存于超低温冰箱备用。
1.2.3 转录组测序分析 利用高通量测序平台(Illumina Hiseq 2 500)进行转录组测序,以PDA培养基上培养7 d菌株测序作为参考基因组,使用SOAP2软件将测序得到的过滤后读段(Clean reads)比对到参考基因组。
1.2.4 差异表达分析 使用R程序中的DESeq2(version1.18.0)程序包进行差异表达分析,P-value的计算模型为负二项分布,初步以P-value< 0.0001 & |log2(Fold Change)| > 2作为筛选标准进行差异表达基因的筛选,并根据基因的表达量绘制表达模式聚类热图。
1.2.5 GO和KEGG富集分析 GO和KEGG富集的P-value经过Bonferroni校正后,以 FDR<0.05为显著富集。使用R程序中的GOseq程序包对差异表达基因进行GO富集分析;KEGG富集分析使用KOBAS 3.0软件,并分别选取在GO和KEGGG中富集最为显著的20个条目(term)和通路(pathway)绘制富集分析图。
1.2.6 关键致病基因的筛选 根据“1.2.4”筛选到的差异表达基因绘制可以直观显示全部基因在两组样本间差异倍数(Fold Change)值分布情况的火山图,进一步限定阈值,筛选极显著差异表达的基因,并剔除少于两个注释信息的基因。在此基础上,对与病原菌致病性密切相关的碳水化合物活性酶以及植物-病原互作相关基因进行筛选并分析。
1.2.7 实时荧光定量PCR分析 利用筛选到的候选致病基因,使用 ABI 7 500 实时系统进行荧光定量 PCR (qRT-PCR) 验证 RNA-seq 的结果。以actin作为内参基因,试验对每个样品进行3个生物学重复,使用软件Oligo 7.0设计引物(表1),采用2-ΔΔCt法进行数据分析并作图。
2 结果与分析
2.1 尖孢镰刀菌侵染枸杞根系的测序数据分析
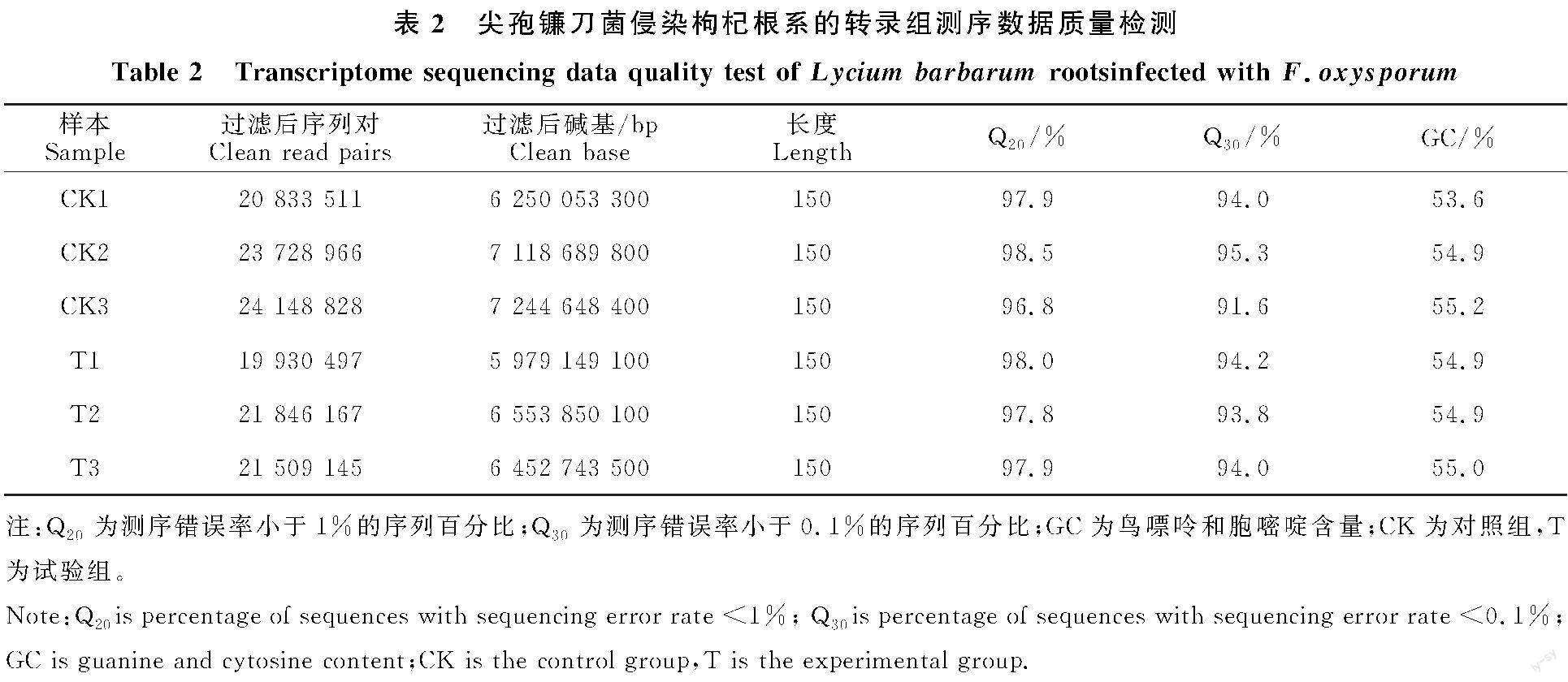
6个样本的转录组测序共获得131 997 114条Clean reads,去掉接头、含N的序列和低质量的reads后,每个样本产生约 6.5 Gb Clean bases;在参考基因组上的平均比对率约达70%,Q20为96.8%~98.5%,Q30为91.6%~95.3%,GC含量为53.6%~55.2%(表2)。根据测序的Clean reads和比对到参考基因组的数据,可进行后续数据分析。
2.2 尖孢镰刀菌侵染枸杞根系前后的差异性分析
2.2.1 差异表达分析 在P-value<0.000 1 & |log2(Fold Change)| >2的筛选阈值下总共筛选到1 892个差异表达基因(differentially expressed genes,DEGs),包括1 242个上调表达和650个下调表达的基因,表明尖孢镰刀菌在侵染后的差异表达基因主要表现为显著上调表达。
通过表达模式聚类热图(图1)可知,CK和T两组样本间聚类明显分离,且两组样本间显示相同颜色的基因相对较少,初步说明尖孢镰刀菌在侵染枸杞前后的基因表达存在明显差异。
2.2.2 GO富集分析 对筛选到的1 892个DEGs进行GO富集分析发现,这些DEGs被富集到生物学过程(biological process)、细胞组成(cellular componment)和分子功能(molecular function)3个GO分类中。由GO富集柱状图(图2)可以看出,在生物学过程分类中,DEGs主要富集在跨膜转运过程相关条目中,如金属离子的跨膜转运等过程;在细胞组成分类中,DEGs在细胞膜及质膜等相关条目富集最为显著;在分子功能分类中,DEGs则主要富集在跨膜转运蛋白及ATP酶活性相关条目中。
2.2.3 KEGG富集分析 对DEGs进行Pathway显著性分析发现,在尖孢镰刀菌侵染过程中,鞘脂代谢(sphingolipid metabolism)、过氧化物酶体(Peroxisome)和ABC转运蛋白(ABC transporters)等是最主要的代谢途径,其P-value均小于0.000 1,推测以上代谢途径很可能参与了尖孢镰刀菌对枸杞的致病过程(图3)。
2.3 关键致病基因的筛选
通过火山图可以发现,大部分高表达的基因主要分布于-lg P-value>10 & |log2(Fold Change)|>5的范圍内,因此进一步设定筛选阈值为-lg P-value>10 & |log2(Fold Change)|>5对1 892个显著DEGs进行筛选,最终共筛选到283个极显著DEGs,包括166个上调表达和117个下调表达的DEGs(图4)。通过NR数据库、GO数据库、KO数据库、KEGG数据库、KOG数据库和Swiss-prot数据库对筛选到的极显著DEGs进行注释,并剔除少于两个注释结果的DEGs,最终得到180个极显著表达且有两个及以上注释结果的DEGs。
2.3.1 碳水化合物活性酶相关DEGs 通过分析180个极显著DEGs的注释信息,发现47个DEGs与碳水化合物活性酶相关,包括编码MFS转运蛋白、丝氨酸/苏氨酸蛋白激酶以及细胞壁降解酶相关的基因。其中,编码β-木糖酶(beta-xylosidase)的基因 NECHADRAFT_48184、编码丝氨酸/苏氨酸蛋白激酶(serine/threonine-protein kinase)的基因NECHADRAFT_52370、编码果胶酸裂解酶(pectate lyase)的基因NECHADRAFT_8181和NECHADRAFT_122787以及编码MFS转运蛋白(MFS transporter)的基因NECHADRAFT_45233在尖孢镰刀菌侵染7 d后显著上调表达(图5)。相关研究表明,丝氨酸/苏氨酸蛋白激酶和MFS转运蛋白在病原真菌侵染宿主植物过程中发挥致病性作用,而β-木糖酶和果胶酸裂解酶均为细胞壁降解酶类,是致病菌侵染宿主植物细胞壁的关键酶[12-13]。因此,推测NECHADRAFT_48184、NECHADRAFT_52370、NECHADRAFT_8181、 NECHADRAFT_122787和NECHADRAFT_45233参与了尖孢镰刀菌的致病机制。
2.3.2 植物-病原互作相关DEGs 从180个DEGs中共筛选到25个上调表达的植物-病原互作相关DEGs,包括编码角质酶、自噬相关蛋白、甲基转移酶和转运型ATP酶等相关酶的基因。其中,编码Na+/K+转运P型ATP酶(Na+/K+ P-type transporting ATPase)的基因 NECHADRAFT_65962和 NECHADRAFT_62632、编码Ca2+转运P型ATP酶(Ca2+P-type transporting ATPase)的基因 NECHADRAFT_100814、编码AAA+型ATP酶(AAA+-type ATPase)的基因NECHADRAFT_1988和编码角质酶(chitinase)的基因 NECHADRAFT_122567在尖孢镰刀菌侵染前后变化尤为显著(图6)。研究表明,转运型ATP酶在致病菌致病过程中可以为细胞输入许多新陈代谢所需的物质并输出毒物[14],因此推测基因NECHADRAFT_65962、 NECHADRAFT_62632、 NECHADRAFT_100814和NECHADRAFT_1988可能在致病过程中发挥了重要作用。另外,角质酶作为突破寄主植物角质层的工具酶,也参与了真菌的致病性过程,其编码基因 NECHADRAFT_122567也是尖孢镰刀菌成功侵染的关键基因。
2.4 实时定量PCR 分析
为了验证 RNA-seq 数据的可靠性,对筛选到的10个关键致病候选基因进行qRT-PCR验证,并将其结果与RNA-seq结果进行相关性分析(图7)。结果表明,10个关键致病候选基因转录得到的FPKM值与qRT-PCR得到的基因相对表达量的变化趋势基本一致,两者的相关系数达 0.882 5,说明对转录组测序结果的分析具有可 靠性。
3 讨 论
近年来,素有“植物癌症”之称的根腐病逐渐成为制约枸杞种植的重要因素之一,其发病率一般可达15%~65%[15]。而目前主要依赖于化学药剂对枸杞根腐病的防治,不仅对环境和人体不利,而且因其土传性质,很难达到有效防治[16]。解析根腐病主要致病菌尖孢镰刀菌的分子致病机[CM(21]制,是制定对其进行有效防治策略的根本前提。
为初步阐明尖孢镰刀菌的分子致病机制,本研究对尖孢镰刀菌侵染第7天的DEGs进行富集分析,并筛选10个与致病性密切相关的候选基因。为了确保测序数据的可靠性,通过qRT-PCR对10个候选致病基因的表达量进行验证,结果显示,转录组测序的数据和qRT-PCR得到的数据表达趋势高度一致,表明转录组测序的数据可以作为解析尖孢镰刀菌致病机制的依据。
KEGG富集分析表明,DEGs在鞘脂代谢、过氧化物酶体和ABC转运蛋白等代谢途径显著富集。其中,鞘脂代谢途径不仅参与多种重要的信号转导过程,还与病原真菌的致病性密切相关[17]。本研究中共发现17个与鞘脂代谢途径相关的DEGs,其中在尖孢镰刀菌侵染前后表达差异最为显著的基因 NECHADRAFT_53688和 NECHADRAFT_78539分别通过调控能影响病原真菌生长发育和致病力的葡萄糖基神经酰胺(glucosylceramide,GlcCer)和半乳糖基神经酰胺(galactosylceramide,GalCer)的合成,从而对鞘脂代谢产生影响 [18-21]。研究表明,沉默调控GlcCer合成相关基因的禾谷镰孢菌(Fusarium graminearum)突变体菌株,虽仍可侵染宿主植物,但致病力明显减弱[22]; PdGcs1是编码柑橘绿霉菌(Penicillium digitatum) GlcCer合成的关键基因,缺失该基因会导致柑橘绿霉菌菌丝生长缓慢,孢子萌发延迟,且毒力显著减弱[23]。过氧化物酶体也在真菌致病过程中发挥着重要作用,缺失过氧化物酶体 PEX6基因的炭疽病菌(Colletotrichum acutatum),致病力明显下降,导致侵染宿主植物失败[24];敲除过氧化物酶体基因Mgpex6Delta的稻瘟病菌(Magnaporthe oryzae)突变体菌株,不能形成具有侵染能力的附着孢,从而导致病原菌的致病性丧失[25]。除此之外,通过对小麦叶锈病菌(Puccinia triticina)ABC转运蛋白的功能验证发现,沉默小麦叶锈病菌体内ABC转运蛋白相关基因,会导致小麦叶锈病菌致病力显著降低,并且抑制病原菌的发育,证明ABC转运蛋白在致病菌侵染过程中发挥毒力作用[26]。基于以上观点,本研究进一步推测鞘脂代谢、过氧化物酶体和ABC转运蛋白等代谢途径在尖孢镰刀菌侵染枸杞过程中发挥了极其重要的作用。
此外,为了进一步筛选出尖孢镰刀菌在侵染过程中的关键致病基因,本研究对在真菌侵染过程中发挥致病作用的碳水化合物活性酶和植物—病原互作相关的DEGs进行解析。在对碳水化合物活性酶相关DEGs进行分析时发现,除细胞壁降解酶相关DEGs变化显著外,MFS转运蛋白和丝氨酸/苏氨酸蛋白激酶相关DEGs也被诱导显著差异表达。其中,细胞壁降解酶是病原菌成功侵染宿主植物的关键致病因子,植物病原菌通过分泌细胞壁降解酶降解宿主植物的细胞壁成功进入植物体内,从而对植物产生致病性,Zheng等[27]研究表明,水稻纹枯病菌(Rhizoctonia solani)侵染宿主期间,大量细胞壁降解酶被诱导表达。MFS是真核生物和原核生物体内两个最大的膜转运蛋白超家族之一,在植物病原菌中,MFS转运蛋白可通过参与植物毒素的分泌,从而对植物产生致病性。敲除灰霉病菌(Botrytis cinerea) BcMfs1、小麦叶枯菌(Mycosphaerella graminicola) MgMfs1和炭疽病菌(Colletotrichum acutatum) ChMfs1等真菌体内编码MFS转运蛋白的基因后,其突变体菌株均表现为分生孢子减少,致病力降低[12,28-29]。同时,有研究发现,敲除编码丝氨酸/苏氨酸蛋白激酶 MoSch9基因后的稻瘟病菌突变体菌株,生长速率、产孢量、致病力以及在寄主植物体内的扩展能力均显著降低,且有性生殖能力丧失[30];Liu等[31]也发现缺失编码丝氨酸/苏氨酸蛋白激酶 MgATG1基因的稻瘟病菌突变体菌株,丧失侵染水稻和小麦的能力,以上研究均表明丝氨酸/苏氨酸蛋白激酶在植物病原菌侵染宿主植物过程中发挥了致病性作用。在本研究中,编码细胞壁降解酶的基因NECHADRAFT_48184、NECHADRAFT_8181、NECHADRAFT_122787和编码丝氨酸/苏氨酸蛋白激酶的基因NECHADRAFT_52370以及编码MFS转运蛋白的基因NECHADRAFT_45233均被诱导显著上调表达,因此推测以上基因是尖孢镰刀菌侵染枸杞的关键致病基因。
在对植物—病原互作相关DEGs进行分析时发现,Na+/K+转运P型ATP酶编码基因NECHADRAFT_65962和NECHADRAFT_62632、Ca2+转运P型ATP酶编码基因NECHADRAFT_100814等一些编码P型ATP酶的基因在尖孢镰刀菌侵染前后表达差异显著。相关研究表明,P型ATP酶是一类可以被ATP驱动发生磷酸化的阳离子泵,包括Na+、K+和Ca2+转运ATP酶,普遍存在于各种生物体中,参与生物体许多重要的代谢过程。在植物病原菌中,P型ATP酶家族基因不仅参与离子运输、细胞信号转导等功能,部分P型ATP酶还与病菌的生长发育以及致病性密切相关[14]。相关研究在稻瘟病菌中发现了 MgAPT2和 PDE1兩个与致病性密切相关的P型ATP酶基因,其中 MgAPT2是稻瘟病菌侵染过程中分泌作用所必需的基因,缺少该基因的突变体菌株表现为多种胞外酶分泌受阻,影响附着胞的形成,而 PDE1基因则主要调控致病菌的生长发育和致病性[32-33];蔡志英[34]利用基因敲除与互补技术,证实了Ca2+转运P型ATP酶基因 CgATPase是橡胶树胶孢炭疽病菌(Colletotrichum gloeosporioides)的一个致病基因,该基因不仅影响菌株穿透橡胶树叶片表皮组织的能力,还可调控菌株生长速度、产孢量以及孢子大小。此外,编码角质酶的基因NECHADRAFT_122567也在尖孢镰刀菌侵染前后显著差异表达,角质酶在植物病原菌侵染宿主植物过程中发挥重要作用,是突破植物角质层的主要工具酶,相关研究表明,缺失编码角质酶基因的突变体菌株致病力减弱或无致病力,而恢复缺失的角质酶编码基因后,菌株恢复致病力[35]。结合上述相关研究推测,编码P型ATP酶的基因NECHADRAFT_65962、NECHADRAFT_62632、NECHADRAFT_100814和编码角质酶的基因NECHADRAFT_122567可能也是尖孢镰刀菌成功侵染寄主的关键因子。
除此之外,本研究通过火山图发现,在上调和下调表达的DEGs中分别有两个表达差异异常显著的基因,其中上调表达的基因 NECHADRAFT_92084和 NECHADRAFT_51989主要调控ABC转运蛋白的活性,而下调表达的基因 NECHADRAFT_64597和 NECHADRAFT_39397则主要调控磷酸酶的活性。ABC转运蛋白在真菌致病过程中发挥了重要作用在上文已经得到论证,因此,本研究推测,调控ABC转运蛋白活性的基因 NECHADRAFT_92084和 NECHADRAFT_51989极有可能也是尖孢镰刀菌成功侵染枸杞的关键致病基因。而磷酸酶是一类广泛存在于除高等植物外几乎所有生物体内的非特异性磷酸单酯酶,主要参与催化生物体内的水解反应[36]。有研究表明,磷酸酶在真菌的生长发育、分生孢子的形成和对寄主的致病性方面发挥着重要作用,通过敲除稻瘟病菌体内编码磷酸酶的基因发现,与野生型菌株相比,突变体菌株生长缓慢,且分生孢子的致病力减弱[37];除参与病原菌的致病性过程外,磷酸酶还参与病原菌对氧化胁迫的响应,研究发现,在氧化胁迫下,柑橘褐斑病菌编码磷酸酶的基因表达量显著下降[38]。在本研究中,编码磷酸酶的基因 NECHADRAFT_64597和 NECHAD-RAFT_39397在尖孢镰刀菌侵染后显著下调表达,推测可能是由于枸杞为了抵御尖孢镰刀菌的侵染,产生大量活性氧,导致编码磷酸酶的基因表达受到了抑制,但其具体的作用机理以及基因 NECHADRAFT_64597和 NECHADRAFT_39397是否为尖孢镰刀菌侵染枸杞的关键致病基因还需要进一步研究和验证。
4 结 论
本研究通过转录组测序分析,解析尖孢镰刀菌在侵染枸杞前后的基因表达差异,初步阐明ABC转运蛋白、过氧化物酶体以及鞘脂代谢是尖孢镰刀菌侵染枸杞过程中的关键代谢途径。此外,对细胞壁降解酶和植物—病原互作相关DEGs进行解析,最终筛选到10个与尖孢镰刀菌致病性密切相关的致病候选基因,为后续关键致病基因的功能验证奠定了理论基础。
参考文献 Reference:
[1] 李 捷,冯丽丹,王有科,等.枸杞接种尖孢镰孢菌后抗氧化酶类活性的变化[J].草原与草坪,2015,35(6):77-82.
LI J,FENG L D,WANG Y K,et al.The change of antioxidant enzymes of Lycium infected by Fusarium oxysporum[J].Grassland and Turf,2015,35(6):77-82.
[2] 陈思杰,杜 娟,张 涛.宁夏枸杞根腐病病原研究[J].农业科学研究,2021,42(4):7-11.
CHEN S J,DU J,ZHANG T.Studies on the pathogen of root rot of Lycium barbarum in Ningxia[J]. Journal of Agricultural Sciences,2021,42(4):7-11.
[3] 刘戈辉,韩泽刚,孙士超,等.转 GhB301基因棉花响应枯萎病菌侵染的转录组分析[J].核农学报,2021,35(12):2733-2745.
LIU G H,HAN Z G,SUN SH CH,et al.Transcriptome analysis of GhB301 transgenic cotton response to Fusarium wilt infection[J]. Journal of Nuclear Agricultural Sciences,2021,35(12):2733-2745.
[4] WANG Z,GERSTEIN M,SNYDER M.RNA - seq:a revolutionary tool for transcriptomics[J]. Nature Reviews Genetics,2010,10(10):57-63.
[5] THATCHER L F,WILLIAMS A H,GARY G,et al.Transcriptome analysis of the fungal pathogen Fusarium oxysporum f.sp.Medicaginis during colonization of resistant and susceptible Medicago truncatula hosts identifies differential pathogenicity profiles and novel candidate effectors [J]. BMC Genomics,2016,17(1):860-879.
[6] 舒新月,江 波,馬 丽,等.不同侵染时间点稻粒黑粉病菌的转录组分析[J].草业学报,2020,29(9):190-202.
SHU X Y,JIANG B,MA L,et al.Transcriptome analysis of Tilletia horrida at different infection time points[J].Acta Prataculturae Sinica,2020,29(9):190-202.
[7] DING Z J,LI M H,SUN F,et al.Mitogen-activated protein kinases are associated with the regulation of physiological traits and virulence in Fusarium oxysporum f.sp.cubense[J]. PloS One,2015,10(4):122634-122658.
[8] 丁兆建,吴小霞,孙君梅,等.尖孢镰刀菌古巴专化型MAPK FoSlt2敲除突变体的转录组分析[J].菌物学报,2019,38(7):1090-1098.
DING ZH J,WU X X,SUN J M,et al.Transcriptome analysis of the MAPK FoSlt2 deletion mutant of Fusariu moxysporum f.sp.cubense[J].Mycosystema,2019,38(7):1090-1098.
[9] 梁丽琴,杜海燕,段江燕,等. Argonaute1敲除前后尖孢镰刀菌转录组分析比较[J].植物病理学报,2019,49(5):621-631.
LIANG L Q,DU H Y,DUAN J Y,et al.Transcriptome analysis of Fusarium oxysporum before and after Argonaute1 knock-out[J].Acta Phytopathologica Sinica,2019,49(5):621-631.
[10] [ZK(#]CHANG Y J,SUN F F,SUN S L,et al.Transcriptome analysis of resistance to Fusarium wilt in Mung Bean (Vigna radiataL.) [J]. Frontiers in Plant Science,2021,12(6):679629-679629.
[11] 李敏慧,苑曼琳,姜子德,等.香蕉枯萎病菌致病机理研究进展[J].果树学报,2019,36(6):803-811.
LI M H,YUAN M L,JIANG Z D,et al.Research progress in pathogenic mechanism of Fusarium oxysporum f.sp.cubense[J].Journal of Fruit Science,2019,36(6):803-811.
[12] LIU L P,YAN Y Q,HUANG J B,et al.A novel MFS transporter gene ChMfs1 is important for hyphal morphology,conidiation,and pathogenicity in Colletotrichum higginsanum[J]. Frontiers in Microbiology,2017,8(10):1953-1964.
[13] SKAMNIOTI P,GURR S J.Cutinase and hydrophobin interplay:a herald for pathogenesis[J]. Plant Signaling & Behavior,2008,3(4):248-250.
[14] 彭 陈.稻瘟菌P型ATP酶的基因家族分析及其基因 MoCTA1、 MoCTA3的研究[D].合肥:安徽农业大学,2012.
PENG CH.The analysis of P-ATPase gene family and the research ofMoCTA1, MoCTA3 in the Rice Blast Fungus Magnaporthe oryzae[D].Hefei:Anhui Agricultural University,2012.
[15] WANG Y,YANG X M,TENG Z T,et al.Prevention and control of wolfberry root rot[J]. China Fruit & Vegetable,2018,38(3):43-46.
[16] 陳 伟,何 静,多甜甜,等.几种杀菌剂对枸杞根腐病菌的室内毒力测定[J].甘肃农业大学学报,2017,52(1):109-113.
CHEN W,HE J,DUO T T,et al.Toxicity test on several fungicides against Chinese wolfberry root rot in vitro[J]. Journal of Gansu Agricultural University,2017,52(1):109-113.
[17] 单婷婷,陈晓梅,郭顺星,等.鞘脂在植物-真菌互作中的分子调控机制研究进展[J].植物学报,2019,54(3):396-404.
SHAN T T,CHEN X M,GUO SH X,et al.Advances in molecular regulation of sphingolipids in plant-fungus interactions[J].Chinese Bulletin of Botany,2019,54(3):396-404.
[18] 刘润华,江文波,余迪求.植物鞘脂的结构、代谢途径及其功能[J].植物学报,2009,44(5):619-628.
LIU R H,JIANG W B,YU D Q.Structure,metabolic pathway and function of sphingolipids in plants[J]. Chinese Bulletin of Botany,2009,44(5):619-628.
[19] ELIANA B,GUILHERME L S,LAURO S.Structural analysis of fungal cerebrosides[J]. Frontiers in Microbiology,2011,2(12):239-250.
[20] CHEN M,MARKHAM J E,CAHOON E B.Sphingolipid Delta 8 unsaturation is important for glucosylceramide biosynthesis and low-temperature performance in Arabidopsis [J]. The Plant Journal,2012,69(5):769-781.
[21] LINA L,ALINE X.S.S,HELN O,et al.Membrane engineering of S.cerevisiae targeting sphingolipid metabolism[J]. Scientific Reports,2017,7(1):41868-41878.
[22] RAMAMOORTHY V,CAHOON E B,LI J,et al.Glucosylceramide synthase is essential for alfalfa defensin-mediated growth inhibition but not for pathogenicity of Fusarium graminearum[J]. Molecular Microbiology,2007,66(3):771-786.
[23] ZHU C G,WANG M S,WANG W L,et al.Glucosylceramides are required for mycelial growth and full virulence in Penicillium digitatum [J]. Biochemical and Biophysical Research Communications,2014,455(3/4):165-171.
[24] KIMURA A,TAKANO Y,FURUKAWA I,et al.Peroxisomal metabolic function is required for appressorium-mediated plant infection by Colletotrichum lagenarium[J]. The Plant Cell,2001,13(8):1945-1958.
[25] MARILOU R P,NAWEED I.N Q.Host invasion during rice-blast disease requires carnitine-dependent transport of peroxisomal acetyl-CoA[J]. Molecular Microbiology,2006,61(1):61-75.
[26] 韋 杰,张 悦,齐 悦,等.小麦叶锈菌ABC转运蛋白的功能验证[C]//中国植物病理学会2019年学术年会论文集.北京:中国农业科学技术出版社,2019:220.
WEI J,ZHANG Y,QI Y,et al.Functional validation of the ABC transporter of Puccinia tritica[C]//Proceedings of the Annual Meeting of Chinese Society for Plant Pathology 2019.Beijing:China Agricultural Science and Technology Press,2019:220.
[27] ZHENG A P,LIN R M,ZHANG D H,et al.The evolution and pathogenic mechanisms of the rice sheath blight pathogen[J]. Nature Communications,2013,4(1):1424-1434.
[28] HAYASHI K,SCHOONBEEK H J.Bcmfs1,a novel major facilitator superfamily transporter from Botrytis cinerea,provides tolerance towards the natural toxic compounds camptothecin and cercosporin and towards fungicides[J]. Applied and Environmental Microbiology,2002,68(10):4996-5004.
[29] RAMIN R,MAARTEN A D.MgMfs1,a major facilitator superfamily transporter from the fungal wheat pathogen Mycosphaerella graminicola,is a strong protectant against natural toxic compounds and fungicides[J]. Fungal Genetics and Biology,2007,44(5):378-388.
[30] 孔祥一.稻瘟病菌丝氨酸苏氨酸蛋白激酶MoSch9的功能研究[D].南京:南京农业大学,2017.
KONG X Y.Functional analysis of serine/threonine kinase MoSch9 in Magnaporthe oryzae[D].Nanjing:Nanjing Agricultural University,2017.
[31] LIU X H,LU J P,ZHANG L,et al.Involvement of a Magnaporthe grisea serine/threonine kinase gene, MgATG1,in appressorium turgor and pathogenesis[J]. Eukaryotic Cell,2007,6(6):997-1005.
[32] MARTIN J G,CHRISTOPHER R T,GAVIN E W,et al.A P-type ATPase required for rice blast disease and induction of host resistance[J]. Nature,2006,440(7083):535-539.
[33] BALHADERE P V,TALBOT N J. PDE1 encodes a P-type ATPase involved in appressorium-mediated plant infection by the rice blast fungus Magnaporthe grisea[J]. The Plant Cell,2001,13(9):1987-2004.
[34] 蔡志英.橡膠树胶孢炭疽菌突变体库的构建及其CgATPase基因功能分析[D].海口:海南大学,2013.
CAI Z Y.Generating a mutation library by ATMT and analyzing functions of CgATPase of Colletotrichum gloeosporioides of Hevea brasiliensis[D].Haikou:Hainan University,2013.
[35] 高必达,陈 捷.生理植物病理学[M].北京:科学出版社,2006:26-27.
GAO B D,CHEN J.Physiological Plant Pathology[M].Beijing:Science Press,2006:26-27.
[36] BERMUDEZ O,PAGES G,GIMOND C.The dual-specificity MAP kinase phosphatases:critical roles in development and cancer[J]. American Journal of Physiology Cell Physiology,2010,299(2):189-202.
[37] L W W,KONG X W,ZHOU C Y,et al.Pdel,encoding a low-affinity cAMP phosphodiesterase,regulates conidiation and pathogenesis in Alternaria alternata tangerine pathotype[J]. Frontiers in Microbiology,2020,11(7):597545-597557.
[38] 吕韦玮.柑橘褐斑病菌AaYvh1基因生物学功能初步研究[D]重庆:西南大学,2021.
LV W W.Preliminary studies on the function ofAaYvh1 gene in Alternaria alternata tangerine pathotype[D].Chongqing:Southwest University,2021.
Transcriptome Analysis of Fusarium oxysporum Infected Roots of Lycium barbarum
Abstract Root rot caused by Fusarium oxysporum is major disease affecting the cultivation of Lycium barbarum.We infected the roots of L.barbarum ‘Ningqi No.1 with F.oxysporum and analyzed the bacterial samples on the 7th day of infection using transcriptome sequencing.The aim was to investigate the molecular pathogenic mechanism of F.oxysporum infection in L.barbarum and identify its key pathogenic genes.Our findings revealed that,compared with pure culture strains,F.oxysporum showed 1 892 significantly differentially expressed genes on the 7th day of infection,including 1 242 up-regulated genes and 650 down-regulated genes; GO enrichment analysis indicated that transmembrane transporter and ATPase activity classified as molecular function and transmembrane transport classified as biological process might play an important role in the pathogenesis of F.oxysporum; KEGG enrichment analysis showed that sphingolipid metabolism,peroxisome and ABC transporters were the main metabolic pathways during F.oxysporum infection.Furthemore,we identified 10 key pathogenic candidate genes by comparing the the expression levels of genes encoding carbohydrases and plant-pathogen interactions before and after F.oxysporum infection.Overall,this study provides a theoretical foundation for the elucidation of the molecular pathogenic mechanism of F.oxysporum.
Key words Transcriptome; Fusarium oxysporum; Lycium barbarum; Differentially expressed genes; Enrichment analysis
