政策暖风催化 创新药进入加速发展期
2024-03-28张桔
张桔

今年创新药发展首次被写入《政府工作报告》。政策东风正为创新药大发展打开方便之门,市场亦对此抱有非常大的期待,创新药有望迎来戴维斯双击。
创新药行业涵盖的细分领域众多,对此查理投资的李一丁对本刊表示:“DAC、ADC、抗体、蛋白质降解、RNA干扰以及异体细胞疗法等,都是未来国内炙手可热的研发方向。”从病种看,除肿瘤,减重、阿尔茨海默病、脱发以及特应性皮炎等也已成为创新药领域的热门病种。
一位不愿具名的行业公司董秘表示:“近几年,创新药行业即将迎来历史发展的新高。仿制药企业正在进行转型升级。以恒瑞、正大天晴等为代表的国内医药龙头企业经过多年的积累已转型成功,还有如信达、康方、百济等新生代创新药企业已经成为行业的龙头。未来在政策持续影响下,会有更多企业由仿制药向自主原创新药转型升级。产业端也将与研究所、高校等科研机构更加紧密地合作,提供资金、人才等方面支持,加速成果转化,会有更多的创新药实现产业落地,带动我国从仿制药大国转型创新药,迈入新的发展阶段。”
对此,亚虹医药董秘杨明远向本刊强调:“在国内医保控费的大局之下,如何在创新药的价格和价值之间寻找平衡,一直是促进创新药产业高质量发展的关键所在。目前,政策方向已经明了,但细则仍待明确。但政策释放出大力支持开放、创新的信号,对创新药行业无疑是利好。”他进一步分析。
肿瘤药创新药“实至名归”ADC赛道或迎景气爆发
[2023年国产1类新药的获批具体名单包括了艾诺米替片、氢溴酸氘瑞米德韦片等。这显示了中国在创新药物研发尤其是抗肿瘤、罕见病等领域的突破。]
春节前的农历2月28日,富国基金新发了一只医药主题公募,该基金拟任经理赵伟明确地表示重点关注创新药投资机会,尤其是ADC及自免领域创新药出海机遇。实际在公募明星医药基金经理中,葛兰、金笑非等多位名将均长期力挺创新药(ADC为抗体偶联药物)。
在春节后一场公开路演中,赵伟表示:“站在全球角度看ADC、基因治疗、CAR-T、MRA等研发领域,我国都处在比较高的水平和起点,特别是ADC已跻身世界第一梯队,有望成为医药投资主线之一。我国的ADC在研发特异性以及工程师红利上体现出非常明显的趋势,现在很多海外企业在引进国内的ADC。同时,ADC正成为二线肿瘤治疗中重要的方法,特别是肺癌和乳腺癌。同时它和免疫治疗的联用可以在少数病种上往一线领域去治疗。”
2023年发生在中国ADC领域的出海合作颇为抢镜:据医药魔方数据,2023年中国公司就ADC产品至少达成了11项license-out合作,涉及至少12款产品,其中有7项合作的总金额超过了10亿美元。规模最大的一笔发生在2023年12月,百利天恒研发的双抗ADC(BL-B01D1),以8亿美元的首付款與最高达84亿美元的潜在总交易额独家授权给百时美施贵宝(BMS)。
生物医药ETF(512290)基金经理梁杏介绍:“随着ADC技术的成熟,ADC作为一类高效靶向化疗,正在显示出与IO联用的潜力。ADC通过特定的连接子将具有细胞毒性的药物连接到单克隆抗体上。ADC药物能够利用抗体与靶细胞的特异性结合,将细胞毒性药物精确地递送到肿瘤细胞内,从而实现高效、低毒的肿瘤治疗。从现在的临床数据来看,IO+ADC有望成为未来5—10年肿瘤免疫的主线。现有的IO疗法中,近一半方案可能从IO+化疗升级为IO+ADC,相关适应症市场有望实现100%-200%扩容。随着中国ADC进入世界第一梯队,未来中国公司有望在IO+ADC浪潮中占据重要地位,实现国际化价值。”不过需要注意的是,曾几何时双抗与ADC是两条互不交叉的平行线,但如今两者之间已不再那样泾渭分明。
鹏华明星医药基金经理金笑非就看好双抗:“从临床需求来看,目前全球获批上市了14款双抗药物,而国产双抗药物仅有某H股上市公司的PD-1/CTLA-4双抗获批上市,国内研发的空白亟待填补。从获批适应症上看,目前这14款已上市药物适应症以血液瘤居多,但近年来,针对实体瘤适应症的双抗,层出不穷,表现积极,已初步展现出了较大的临床优势与市场潜力,成长天花板较高。”
“从市场销售端看,双抗药物商业化前景广阔,比如罗氏开发的Hemlibra(艾美赛珠单抗),2023年实现销售额达41.47亿瑞士法郎,同比增长16%,是近20年来FDA批准的首个用于治疗A型血友病的新药,销售强劲有望成为双抗中的药王。最后从研发竞争程度看,可布局的靶点非常多,预计不会形成激烈内卷的格局。无论是从技术可行性、临床需求、适应症丰富程度,还是商业化前景来看,双抗都是一个未来可期的领域。”他进一步强调。
在分食ADC大蛋糕时,医药类上市公司非常积极,恒瑞医药一马当先。今年1月和2月,公司先后公告收到FDA的认证函,注射用SHR-A2009获得FDA授予快速通道资格和注射用SHR-A1912获得FDA授予FTD,前者是恒瑞自主研发的一款以HER3为靶点的ADC药物,后者为靶向CD79b的ADC药物。
几乎同一时间段,科创板上市公司迈威生物—U公告,公司在研品种9MW2821获FDA授予“快速通道认定”,用于治疗晚期、复发或转移性食管鳞癌。9MW2821为靶向Nectin-4的定点偶联ADC新药。
除外,我国布局ADC赛道的代表性企业还包括荣昌生物、科伦博泰、翰森制药等,而2021年开启我国原创ADC产品先河的维迪西妥单抗就是出自荣昌生物之手。
ADC的火热也折射出肿瘤治疗领域的持续景气。
对此,在回复本刊时,科创板上市公司亚虹医药高级副总裁曹少华也介绍,早期肿瘤发展到晚期肿瘤是一个逐步恶化的过程。如果将肿瘤患者群体比作一个“漏斗”,最上方是早期肿瘤,随着疾病进展的恶化,往下则是末期的肿瘤患者。实际上,“漏斗”上方的患者也需要获得很好的治疗,但目前在国内,这部分患者往往容易被忽视,存在着较大未被满足的治疗需求。
表1 部分ADC 行业上市公司相关情况一览
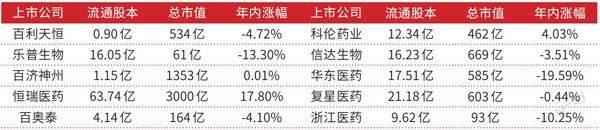
数据来源:Wind。数据截至:3月14日
她进一步举例分析,以宫颈高级别鳞状上皮内病变(HSIL)为例,这是一种高级别的宫颈癌前病变,约有25%的HSIL可能在10年内进展为浸润性宫颈癌。目前该疾病的标准治疗方式是手术,但对于很多育龄妇女患者来说,基于对生育能力的考虑,她们往往不愿意接受手术。然而,迄今为止,全球范围内该领域尚未有无创的非手术治疗产品上市。亚虹用于非手术治疗的希维她(APL-1702),采用光动力原理,通过高能量的红光杀死肿瘤细胞。这个药械一体化的产品,III期临床试验已达到主要研究终点,目前这也是惟一一个在HSIL这个适应症上做出阳性结果的临床研究。APL-1702有望成为全球首创,中国首发的无创治疗宫颈癌前病变的光动力创新疗法,相信有潜力填补国内宫颈癌前病变领域的治疗空白,打破该领域此前无无创的非手术治疗方式的窘境。
减重领域热度持续国企追赶礼来、诺和诺德
[2023年减重药爆红,也为此前专注于糖尿病治疗的药物推开了另一扇门。GLP-1类药物一步步登上“减肥神药”宝座,热度依旧未减。]
春节后的第一周,中外资本市场见证了两家医药公司股价的惊人翻倍,分别是中国的来凯医药和美国的维京治疗(Viking Therapeutics)。
来凯医药的股价翻倍之旅始于一则关于其新药LAE102的公告。LAE102是一种针对ActRIIA的单克隆抗体,原本用于治疗肿瘤,但在肥胖小鼠模型中,LAE102与GLP-1的联合疗法显示出协同增效作用,有效加大减脂效果,同时避免肌肉流失。国家药监局的药品审评中心已受理了LAE102的新药临床试验申请,这一进展被视为公司在治疗成人肥胖领域的新突破。
维京治疗的股价翻倍则源于其减肥药VK2735的积极临床试验数据。VK2735是一种双重激动剂,针对GLP-1和GIP受体,用于治疗肥胖症和糖尿病。在二期临床双盲实验中,VK2735达到了主要终点和所有次要终点,显示出显著的减重效果。
试验结果显示,VK2735在13周的试验期间内,对于肥胖(BMI超过30)和超重(BMI大于27)但存在至少一项与体重问题相关合并症的成年人,显示出显著的减重效果。用药剂量最大的15mg组别效果最好,平均减肥14.6公斤,其中有88%的受试患者减重比例超过10%。即使是用药剂量最小的2.5mg组,也平均减掉9.2公斤的体重,而安慰剂组同期体重只下降1.8公斤。
这一结果不仅震动了“减肥药双雄”诺和诺德和礼来,也使得维京治疗成为潜在的收购标的,市场对其未来的发展充满了期待。
“减肥领域前途最明显,肥胖和糖尿病是全球范围内的公共卫生问题。”回复本刊时,查理投资的李一丁说,“目前美国减重药的渗透率是12:1。对于能够提供有效治疗手段的医药公司,市场也愿意给予高估值。”
李一丁给出一组对比数字,预计到2030年,全球减重药物市场规模有望增至540亿美元,其中2024至2030年的复合年增长率(CAGR)为35%。预计到2025年,全球GLP-1市场规模达283亿美元。对比看,预计到2030年,中国减重药物市场规模有望达到149亿元人民币。预计到2025年,中国GLP-1市场规模达156亿元人民币。
而在展望减肥药领域的变化时,李一丁谈道:“当前创新药中最内卷的领域莫过于非酒精性脂肪性肝炎,目前已经有多种机制被验证成功了,而且最重要的GLP-1也已经被证明可以明显改善非酒精性脂肪性肝炎的纤维化,随着减肥的患者越来越多,这个市场明显要进入内卷的竞争。”
当然在国内公司中围绕着减重领域的也不全是利好。本刊注意到,节后派格生物转战港股重启IPO,不过其押宝减肥药赛道6年亏损接近10亿。资料显示,派格生物的核心产品PB-119是一款自主研发、接近商业化阶段的长效GLP-1受体激动剂,主要用于T2DM及肥胖症的一线治疗。公司预计最早于2024年第四季度获得NDA批准并于2025年在中国商业化推出该款产品。而它或许是国内参与这一领域竞争众多企业的一面镜子。
对此,梁杏强调:“目前GLP-1市场仍被诺和诺德和礼来两大霸主垄断,但国内药企对减肥市场的争夺依然愈演愈烈。华东医药、万邦医药、信达生物、恒瑞医药、天视珍生物、甘李药业、爱美客等多家国内药企都在积极布局减肥药市场。例如,华东医药已经在减肥药领域取得了重要进展,其申报的司美格鲁肽注射液临床试验申请已经获得批準。国内原料药市场也开始了竞争,包括上市公司诺泰生物在内,目前国内已有3家公司提交司美格鲁肽原料药上市申请,预计后续仍有企业将申请。”
持有类似观点的还有鹏扬基金:“司美格鲁肽核心专利在2026年到期,目前国内主要仿制药厂家均有所布局,2026年就能看到多个司美仿制药的上市销售,2026年之后很快可能司美格鲁肽就会被集采。而GLP-1创新药里,目前国内布局单靶或双靶GLP-1的厂家在大几十家,进入临床2期及以后的管线也不下10个,未来国内可能会看到一个极度竞争内卷的GLP-1减重市场。”
书面回复本刊时,国内某创新药企业的一位中高层坦言:“在一、二级资本市场大幅缩水情况下,很多新创型医药公司,包括已经进入资本市场的头部公司面临现金流紧张甚至枯竭、新融资又没有着落,陷入难以为继的境地。一些公司不得不裁人员、砍管线、卖青苗,也就促进了中国创新药的出海。”
他也举了一个创新药出海失败的例子:“天境生物2023年9月被艾伯维通知终止双方关于相关CD47抗体的许可和合作协议。2020年9月,天境生物与艾伯维达成CD47抗体海外授权合作时,这笔交易潜在总金額接近30亿美元。公司出海失败主要原因还是CD47靶点的成效性及开发难度,CD47是近年来最受关注的靶点之一,但该靶点还未有药物获批上市。”
不过他也强调,该公司的出海虽然受挫,但仍然是国内创新药出海的先驱,想要通过对外授权获得国外药企的青睐,核心仍然是坚持自主创新,针对未满足的临床需求和创新靶点做差异化的研发,国内药企不应因部分失败案例而放弃出海。实际在后疫情时代,海外创新药交易热度明显升温,中国药企敢于走出国门也是实力的体现。根据财新的统计,去年中国创新药实现全面净出口,披露的对外授权交易总额突破450亿美元,今年1月就突破百亿美元。
在这样的大背景下,跨国药企来中国买药的新潮流有望在龙年更为流行,当然这背后得益于政策利好的升温。
医药创新资金价值最大化是关键学习海外先进经验或着重三点
[某种意义上说创新药是勇敢者的游戏,因为其最终获得的艰辛成功必然伴随着质疑、失败、入不敷出等艰难阶段。]
根据生物医药ETF(512290)基金经理梁杏团队的介绍:“创新药从研发到上市的整个过程涉及多个阶段,包括临床前研究、临床试验、药品审批等。每个阶段的投入都因药物的类型、研发难度、市场需求等因素而有所不同。一般来说,创新药研发的临床前研究阶段需要5到6年,花费约为1.5亿美元。临床试验阶段分为I期、II期和III期,分别需要1到2年、2到3年和3到4年,对应的投入大致为800万美元至2.5亿美元、2000万美元至3.5亿美元和3000万美元至5亿美元。最后,药品审批阶段可能需要1到2年,花费约为1亿美元。此外,药品上市后还需要进行上市监测。”
“整体创新药研发到落地的费用区间为2亿-12亿美元,以上数据仅作为一般参考,并不能代表所有创新药的研发投入。对于任何一家制药公司或学术机构,候选药物在临床前阶段经过严格优化后,推进到I期临床是一项巨大的成就。然而进入临床阶段后,将有90%的候选药物会在I、II、III期临床试验或药物批准过程中失败。考虑到上市失败的药物,均摊到每个产品的实际研发费用会更高。”她具体列举了一组海外的数字,“以白细胞介素-2(IL-2)为例,Nektar的IL-2曾经被寄予厚望,公司股价曾突破100美元(目前0.6美元左右),股价大幅回落的主要原因在于IL-2在肿瘤上的III期临床失败,而失败的原因就在于因药物副作用而无法提升产品剂量,从而导致产品疗效未能体现。”
销售收入方面,梁杏用一个假设案例呈现回报。假设创新药产品X在上市后,年销售收入达到5亿美元,并保持5年专利保护期内的独家销售权。净利润扣除生产成本、销售费用、税费等后,假设年净利润为销售收入的30%,即1.5亿美元/年。在5年的专利保护期内,总销售收入为25亿美元,在5年专利期后的5年按照销售额每年10%的速率递减,上市后十年销售总收入42.5亿美元,总净利润为12.75亿美元。
建信基金明星医药基金经理潘龙玲强调:“其实单个成功产品的回报率非常可观,血液肿瘤经典药物伊布替尼,上市前总研发成本3.28亿美元,艾伯维报表(艾伯维拥有美国地区权利)2015—2023年累计净收入却达到323亿美元,强生报表(强生拥有美国以外地区权利)2014—2022年累计净收入达到223亿美元,总体实现了较高的投入产出比。”
财通资管基金经理易小金解释:“新药研发具有双十定律,也就是说一款全球新药(FIC)的问世,往往要花费10年时间,投入至少10亿美元,周期长、风险大。确实创新药的研发具有很大风险,越靠近临床后期试错成本越大。据BIO统计,2011-2020这10年期间,药物开发项目从1期临床到获得美国FDA批准上市的成功率平均为7.9%,所需要的时间平均为10.5年。
同时在消费端,患者支付的药费不仅包含了成功上市药物的成本,还有背后失败品高昂的试错成本,以及满足企业的盈利需求。一款创新药的盈利窗口往往不到10年,在度过专利保护期之后仿制药也将入场,会极大拉低药品利润率。经过研发阶段,因为成本、审批仍会刷掉一部分产品。真正从研发走到上市的创新药,差不多只有10%不到。因此,创新药是一个高投入、高风险也应该高回报的模型。”
“创新药公司研发费用高无法避免,但是资金毕竟是有限的,如何根据实际情况循序渐进和合理使用将资金价值最大化是关键。所以核心并不是一定要降低研发费用,而是如何高效使用研发费用,使得投入产出比最大化。从研发费用使用角度来说,研发费用的高低并不是评判一家公司好坏的标准,还应根据产品实际情况(比如适应症大小、创新程度、公司定位)等多个角度去考虑。”他进一步解释。
梁杏举了一个国内龙头公司例子,恒瑞医药2019年12月获批的注射用甲苯磺酸瑞马唑仑是一种短效的GABAa受体激动剂,用于常规胃镜检查的镇静,是1类创新药。研发费用在恒瑞产品种中最低,仅7135万人民币。据药融云数据,注射用甲苯磺酸瑞马唑仑上市首年——2020年销售额便达2637万元,2021年H1销售额达6383万元,仅一年半便覆盖研发费用。
李一丁也强调应辩证看待创新药高费用:“药企如果拥有一个明星药物,那么在早期这个药物可以为药企带来高昂的回报,一旦其面临专利悬崖,这个药物的销售额就会变成一个‘天坑。药企若是没有新药物来填补这一天坑,业绩不可避免出现下滑。也正因此,药企需要提前应对,投入高额的研发费用,避免滑铁卢的出现。”
他举的例子是国际巨头默沙东:“其打出了非常规组合拳。2023年,其营业收入为601亿美元,但研发费用达到了305亿美元,占比超过50%。看似极高的费用率,原因并不难解释,默沙东拥有极大的增长焦虑。目前,K药仍是公司的核心收入来源。2023年,K药收入达到250亿美元,占总收入的比重达到41%。然而,一個残酷的现实是,K药的专利将于2028年到期。在此之前,默沙东管线中能够媲美K药的潜力选手,并没有出现。2023年,公司收入规模第二大的是HPV疫苗,为88.86亿美元。事实上,HPV疫苗放量也进入尾声阶段。目前,其核心增量来自中国女性市场。明年国产9价HPV疫苗或将面世,这会极大冲击默沙东的市场份额。去年10月,默沙东以220亿美元的总价打包拿下了第一三共的HER3-DXd、I-DXd、R-DXd三款ADC药物权益。完成对Prometheus的并购,总额达到108亿美元。通过该笔收购,默沙东囊括了Prometheus的TL1A抗体PRA023,在IBD领域卡住了身位。”
此外,目前国内的创新药发展或冷热不均,本文此前列举的赛道似乎快马加鞭,但是在罕见病领域似较为落后。“目前国内能够让公司盈利的大部分还是肿瘤药物,和代谢类疾病等针对大量人群的药物。罕见病药物主要还是依赖进口,2020年全球罕见病药物市场规模为1351亿美元,中国罕见病药物市场规模为13亿美元。悬殊的差距,体现了罕见病药物在中国市场的乏力,包含了市场对于国内支付环境难以支持罕见病药物放量的悲观预期。罕见病患者规模不大,用药基数有限,研发成本高昂,导致罕见病药价往往不菲。海外由于有医保、商保的全面覆盖,因此罕见病药物往往能够快速放量。不过,国内支付环境相对较弱,对于药企而言似乎难以赚取超额利润。”查理投资强调。
对于逐渐进入正轨的中国创新药产业来说,潘龙玲建议学习海外三点经验:
一是海外的创新药拥有商业化保险支付支持,允许创新药物自主定价以及每年进行一定幅度的涨价,因此拥有更大的创新药市场及一批活跃的创新药公司。我国创新药支付目前则以国家医保为主,商业保险参与度较低,市场潜力有较大提升空间。
二是海外创新药同质化竞争少,有效竞争和协同更多,审评审批体系高效,审评机构专业度高,审评审批要求高。海外市场鼓励优效和差异化,简单的“Me too”类药物开发公司难以获得融资,在审批上难度也较大。
三是海外创新药公司估值体系历史悠久,一级市场及二级市场定价相对合理,公司可以合理估值获得融资或者被并购的机会,从而继续推动产品开发。我国创新药公司目前数量不多,估值体系尚未成熟稳定,并购环境尚未成熟。因此融资波动较大,并购较少。
至于在当前产业大发展环境下应该向国外学习哪些经验,有业内人士指出应该学习我们的近邻日本。她对比分析指出:“政策环境端,为降低医保负担,日本政府20世纪70年代开启了医保控费。1988年启动药物全面集采,日本集采后医药行业发展经历了仿制药积累期、集采阵痛期、创新药红利期、创新药出海期四个阶段。日本政府为减少集采对于药企创新性的打击,在1980—1990年期间出台多项鼓励创新政策,如加快创新药审批、延长创新药专利期等,对药企创新激励效果显著。我国政府对于实质性创新药扶持力度日益加大,这与当年日本政府十分相似。在集采与鼓励实质性创新药的双重加持下,我国优质的创新型本土药企如果能持续做出Me-Better甚至Best in Class的优质创新药,极有可能和武田制药、安斯泰来、第一三共等一样走上TOP跨国制药企业之路。”
“随着我国创新药研发投入增加,创新药技术发展,已有多家公司通过授权等方式将产品推向海外市场,真正具有创新性的药品有望实现国际化价值。”她进一步强调。
(文中个股仅为举例分析,不做买卖推荐。)
